Вакцина против ВГБК и Миксоматоза — инструкция
» О кролиководстве » Лекарства для кроликов » Вакцина против ВГБК и Миксоматоза — инструкция
Миксоматоз и ВГБК (вирусная геморрагическая болезнь кроликов) – опасные заболевания, которые плохо поддаются лечению и нередко приводят к гибели животных.
Основными средствами, направленным на борьбу с этими болезнями, являются профилактические прививки. Для данной цели применяется ассоциированная вакцина против миксоматоза и ВГБК. Она представляет собой комплексный препарат, который, в отличие от других вакцин, обеспечивает защиту сразу от обоих заболеваний.
Ассоциированную вакцину производят из штамма B-87 ВГБК и штамма B-82 вируса миксомы. Сухую пористую массу расфасовывают во флаконы емкостью 10-20 см3, рассчитанные на 5-120 иммунизирующих доз.
При внутрикожном, подкожном и внутримышечном введении вакцина не вредит здоровью кроликов. В результате ее использования напряженный иммунитет формируется на третий день после прививки, его минимальная продолжительность составляет 12 месяцев.
Необходимо знать, что вакцинации подлежат только здоровые животные. Кроме того, ветеринары советуют перед введением вакцины вывести глистов. Когда препарат попадает в организм больного кроля, животное может погибнуть.
Нужно ли прививать кроликов вообще?
Прививать кроликов или нет – личное дело каждого. Но поскольку у кролей низкий иммунитет, и избежать заражения практически невозможно, лучше будет провести вакцинацию. Своевременное введение вакцины – единственный способ предотвратить развитие болезни.
Когда прививать кроликов?
Первый раз кроликов прививают, когда их возраст составляет 45 дней, при этом вес животных должен быть не менее 500 грамм.
Вакцинацию применяют в благополучных, угрожаемых и неблагополучных по Миксоматозу и ВГБК хозяйствах. В благополучных и угрожаемых хозяйствах иммунизацию проводят однократно, ревакцинацию – через каждые 9 месяцев. Крольчихам прививку делают в любой период беременности.
 Через 3 месяца после первого введения препарата выполняется ревакцинация молодняка, все последующие вакцинации – через каждых полгода.
Через 3 месяца после первого введения препарата выполняется ревакцинация молодняка, все последующие вакцинации – через каждых полгода.Как разводить вакцину (дозировка)?
Желательно, чтобы прививку делал ветеринарный врач, но при отсутствии такой возможности ввести препарат можно самостоятельно. Перед использованием сухую вакцину растворяют в стерильном физиологическом растворе или дистиллированной воде (0.5 см3 раствора на 1 дозу вакцины), тщательно перемешивают, после чего однократно вводят во внутреннюю поверхность бедра в объеме 0.5 см3 (подкожно или внутримышечно). При внутрикожном введении на 1 дозу вакцины берут 0.2 см3 растворителя, кролику вводят 0.2 см3 препарата в ухо или подхвостовое зеркало.
Место инъекции протирают 70%-ым медицинским спиртом, шприцы и иглы перед использованием кипятят на протяжении 15-20 минут, после использования – в течение 30 минут.
 Перед его применением головку инъектора в сборе, запасные сопла, мандрены и плунжер тщательно обрабатывают 70%-ым спиртом или кипятят в дистиллированной воде на протяжении 15-20 минут. После сборки прокачка инъектора производится с использованием ватного тампона, смоченного спиртом, в него также производится 2-3 пробных «выстрела». Сопло инъектора после каждого введения вакцины на несколько секунд погружают в спирт. После проведения вакцинации кроликам создают благоприятные условия содержания, и наблюдают за ними в течение 21 дня. Вывозить в другие хозяйства животных можно через 3-4 недели после введения препарата.
Перед его применением головку инъектора в сборе, запасные сопла, мандрены и плунжер тщательно обрабатывают 70%-ым спиртом или кипятят в дистиллированной воде на протяжении 15-20 минут. После сборки прокачка инъектора производится с использованием ватного тампона, смоченного спиртом, в него также производится 2-3 пробных «выстрела». Сопло инъектора после каждого введения вакцины на несколько секунд погружают в спирт. После проведения вакцинации кроликам создают благоприятные условия содержания, и наблюдают за ними в течение 21 дня. Вывозить в другие хозяйства животных можно через 3-4 недели после введения препарата. Противопоказания к применению ассоциированной вакцины против миксоматоза и ВГБК.
Противопоказания для использования препарата не выявлены.
Побочные действия.
Поскольку ассоциированная вакцина не обладает лечебными свойствами, кроли, которые были привиты в инкубационный период заболевания, могут погибнуть.
Условия хранения препарата.
Вакцину хранят 18 месяцев (после первого отбора – 7 суток) в защищенном от света и влаги месте при температуре 2-8 °С. Если нарушена целостность флакона или в нем содержатся плесень, посторонние примеси, хлопья, которые не разбиваются при встряхивании, препарат не применяют. Отбракованную и разведенную, но не использованную в течение четырех часов, вакцину обеззараживают путем кипячения на протяжении 20 минут.
Если нарушена целостность флакона или в нем содержатся плесень, посторонние примеси, хлопья, которые не разбиваются при встряхивании, препарат не применяют. Отбракованную и разведенную, но не использованную в течение четырех часов, вакцину обеззараживают путем кипячения на протяжении 20 минут.
Всегда ли удается избежать болезни?
К сожалению, положительного эффекта от вакцинации удается достичь не всегда. Иногда это происходит из-за ошибки владельца животных, который не позаботился о поддержании иммунитета кролей на высоком уровне. Также на развитие болезни может повлиять несвоевременное введение препарата, то есть прививка, сделанная после заражения кролика.
Можно ли вакцинировать маленьких кроликов?
Существует мнение, что маленьким кроликам нельзя вводить вакцину. На самом деле ее обязательно нужно применять, начиная с 45-дневного возраста, поскольку это единственный метод предотвращения заражения. К тому же, у крольчат более крепкая иммунная система, чем у взрослых кроликов, что позволяет выработать стойкий иммунитет к возбудителям миксоматоза и ВГБК.
На самом деле ее обязательно нужно применять, начиная с 45-дневного возраста, поскольку это единственный метод предотвращения заражения. К тому же, у крольчат более крепкая иммунная система, чем у взрослых кроликов, что позволяет выработать стойкий иммунитет к возбудителям миксоматоза и ВГБК.
Не следует приобретать ассоциированную вакцину у подпольных фирм, неизвестных лиц или с рук, поскольку такой препарат может не подействовать. Ее нужно покупать только в хорошо зарекомендовавших себя ветаптеках, где препараты хранятся с соблюдением всех норм и правил. Дома вакцину также нужно держать с соблюдением условий ее хранения – только в холодильнике.
Не рекомендуется использовать вскрытые флаконы с вакциной, запрещено применять препарат, срок годности которого истек. От таких средств необходимо избавиться, предварительно их прокипятив.
Если в организме животного на момент введения вакцины присутствовали кокцидии или глисты, и профилактика для их устранения не была проведена, препарат может оказаться неэффективным.
К упаковке с вакциной прилагается инструкция, в которой содержится информация по использованию препарата. В инструкции указано, как нужно правильно прививать кроликов, ее обязательно нужно соблюдать. Только при таком порядке действий удастся достичь желаемого эффекта с минимальным риском для животных.
Положительный результат отсутствует, если:
- во время вакцинации кролики были в ослабленном состоянии, страдали от глистной инвазии или инфекции;
- присутствовала чрезмерная атака возбудителя заболевания, и выработанный иммунитет не смог с ней справиться;
- была использована просроченная вакцина или нарушена схема прививок;
- на момент проведения процедуры кролики уже были заражены.
Преимущества комплексной прививки для кроликов:
Ассоциированная вакцина для кроликов: цена, описание, доставка по России
Описание
Вакцина представляет собой пористую сухую массу от бледно-розового до светло-коричневого цвета.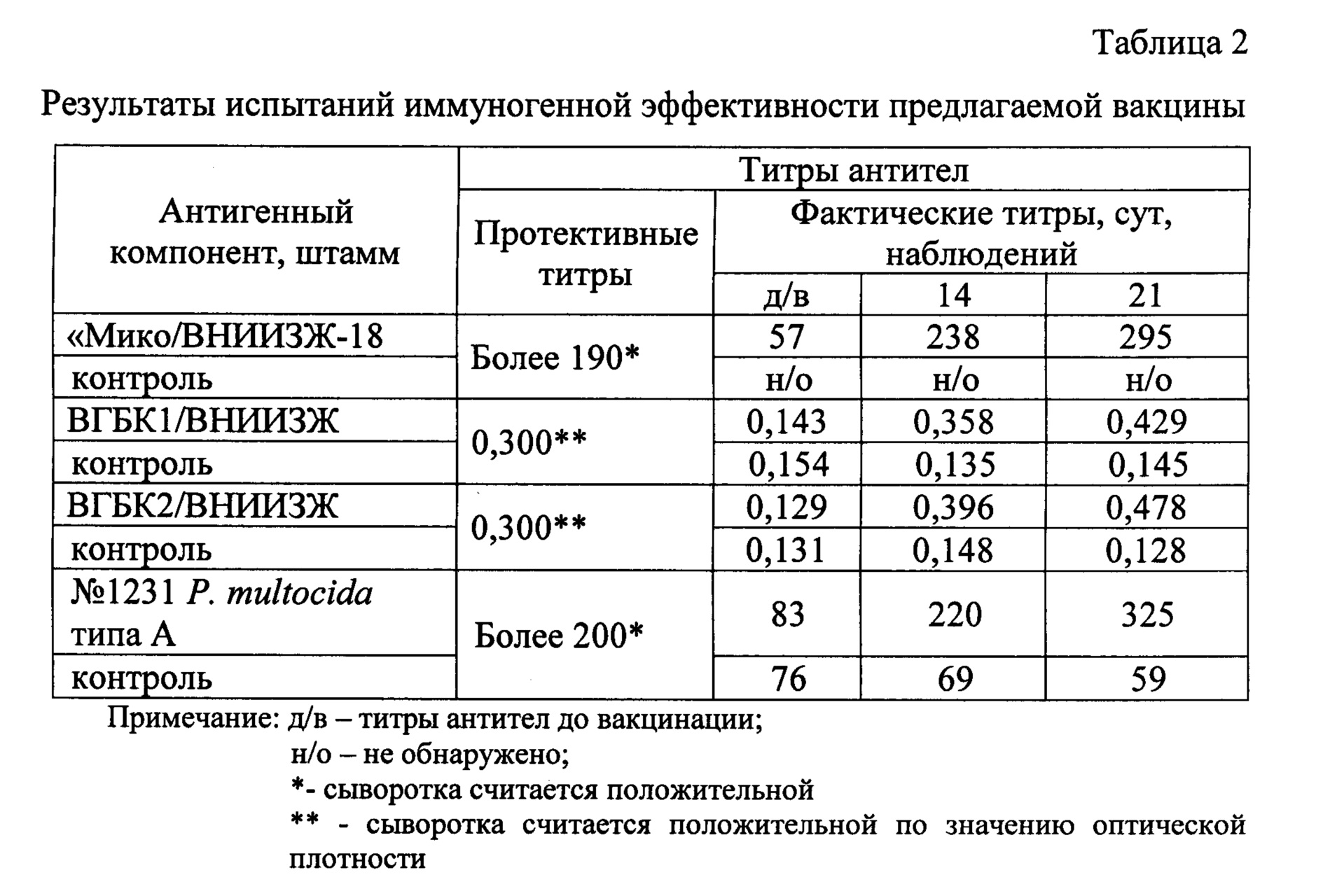
Состав
Вакцину ассоциированную против миксоматоза и вирусной геморрагической болезни кроликов изготавливают из штамма В-82 вируса миксомы кроликов и штамма В-87 вируса геморрагической болезни кроликов.
Форма выпуска
Расфасовывают по 0,5 , 1 , 2 см3 в стерильные ампулы вместимостью 2 , 3 , 5 , 6 см3.
4 , 6 см3 во флаконы емкостью 10 и 20 см3 , содержащие 5-120 иммунизирующих доз.
Флаконы закрывают пробками и закатывают алюминиевыми колпачками, а ампулы запаивают. На флакон (ампулу) с вакциной наклеивают этикетку или наносят несмываемой краской маркировку с указанием: краткого наименования организации – изготовителя, краткого названия биопрепарата (вакцина против миксоматоза и ВГБК сухая), номера серии, номера контроля, даты изготовления, количества доз и срока годности. Флаконы (ампулы) с вакциной упаковывают в картонные коробки с перегородками, обеспечивающими неподвижность и целостность флаконов и (ампул). На каждую коробку наклеивают этикетку с указанием : ведомства и наименования предприятия – изготовителя, его товарного знака, наименования биопрепарата, номера серии, номера контроля, даты изготовления ( месяц, год ), срока годности, количества флаконов ( ампул ) в коробке, количества доз во флаконе (ампуле) , условий хранения , обозначения настоящих ТУ и надпись «Для животных». В каждую коробку вкладывают наставление по применению вакцины.
В каждую коробку вкладывают наставление по применению вакцины.
Показания к применению
Профилактика миксоматоза и ВГБК кроликов.
Биологические свойства
Вакцина безвредна для кроликов при внутримышечном, подкожном или внутрикожном введении. Применение вакцины согласно наставлению обеспечивает формирование напряженного иммунитета с 3-го дня после прививки, продолжительностью не менее 12-месяцев.
Дозы и способ применения
Вакцину применяют внутримышечно, подкожно, внутрикожно для иммунизации здоровых кроликов в благополучных, угрожаемых и неблагополучных по миксоматозу и ВГБК пунктах.
В благополучных и угрожаемых пунктах кроликов иммунизируют однократно, начиная с 1,5-месячного возраста. Крольчих вакцинируют в любой период беременности.
В неблагополучных пунктах по миксоматозу и ВГБК клинически здоровых кроликов и крольчат с 45- дневного возраста подвергают вакцинации. Молодняк через 3 месяца ревакцинируют.
Больных животных вакцинировать запрещается.
- Для внутримышечного и подкожного введения вакцину во флаконах (ампулах) растворяют из расчета на 1 дозу 0,5 см3 растворителя и вводят 0,5 см3 в область бедра.
- Для внутрикожной инъекции вакцину во флаконах (ампулах) растворяют из расчета на 1 дозу 0,2 см3 растворителя и вводят 0,2 см3 в подхвостовое зеркало или ухо.
Перед вакцинацией шприцы и иглы стерилизуют кипячением в течение 15-20 минут. Место введения вакцины дезинфицируют 70% спиртом. Каждого кролика прививают отдельной иглой. За привитым животным ведут наблюдение в течение 20 суток. Для внутрикожных прививок рекомендуется пользоваться безигольным инъектором. Техническое обслуживание инъектора проводят согласно правилам, изложенным в паспорте. Перед началом работы головку инъектора в сборе, плунжер, мандрены и запасные сопла подвергают стерилизации кипячением в дистиллированной воде в течение 15-20 минут или обрабатывают 70% спиртом. После сборки прокачку ннъектора и 2-3 пробных «выстрела» осуществляют в ватный тампон, смоченный 70% спиртом. После каждой инъекции вакцины сопло безигольного инъектора обрабатывают погружением его на 1-3 секунды в 70 процентный спирт.
После каждой инъекции вакцины сопло безигольного инъектора обрабатывают погружением его на 1-3 секунды в 70 процентный спирт.
Условия хранения
Вакцина пригодна для применения в течение 18 месяцев с даты изготовления при условии хранения ее в сухом и темном месте при температуре +2-8 С.
Флаконы (ампулы) с вакциной, содержащие плесень, постороннюю примесь, не разбившиеся при встряхивании хлопья, а также с нарушением укупорки и целостности бракуют. Выбракованную сухую вакцину, а также разведенную, но неиспользованную в течение 4 часов, обеззараживают кипячением в течение 20 минут.
Ассоциированная вакцина для кроликов от миксоматоза и ВГБК
Ассоциированная вакцина против миксоматоза и ВГБК представляет собой комплексную защиту животных от опасных инфекций. Эти заболевания при игнорировании профилактических мероприятий поражают всё поголовье и очень плохо поддаются лечению, вызывая большой процент падежа. Введение препарата обеспечивает кроликов иммунитетом, сохраняющимся в продолжение 12 месяцев.
Ассоциированная вакцина против миксоматоза
Описание вакцины
Ассоциированная вакцина вводится внутрикожным, внутримышечным способом или под кожу согласно инструкции производителя. Формирование иммунитета к введенным штаммам инфекции занимает 3 суток.
Справка. Вакцина против миксоматоза и геморрагической болезни производится на базе вируса В-87 (геморрагическое заболевание) и вируса типа В-82, вызывающего миксоматоз. Реализуется вакцина в сухом виде: пористое вещество во флаконах объемом от 10 до 20 куб.см. Количество препарата рассчитано на вакцинацию 5-120 животных.
Перед введением вакцины кролик должен быть осмотрен ветеринаром (или самим заводчиком при наличии опыта выявления больных животных). Вакцинация особей с явными признаками заболевания запрещена, так как это создает чрезмерную нагрузку на иммунитет и может вызвать гибель животного.
Нужно ли вакцинировать кроликов и когда это делать?
Вакцинация кроликов – единственный эффективный способ обезопасить животных от целого ряда серьёзных заболеваний. В график прививок для декоративных и промышленных пород входят профилактические мероприятия против миксоматоза, ВГБК, листериоза, пастереллеза, паратифа и сальмонеллеза. Также при домашнем выращивании ветеринары настоятельно рекомендуют делать всем животным прививки от бешенства. Конечно, заводчик вправе не следовать этим назначениям, но, как показывает опыт, такие эксперименты заканчиваются очень печально. Препарат, вводимый животным в качестве вакцины, не вредит зверьку и направлен исключительно на выработку защитных антител.
Первые прививки можно ставить молодняку уже по достижении 45-дневного возраста. Вес кролика на момент вакцинации должен превышать 0,5 кг. Ревакцинация осуществляется в зависимости от эпидемиологического благополучия: в хозяйствах с неблагополучным окружением ревакцинацию проводят через 90 дней, а в дальнейшем – каждые полгода.
Ревакцинация кролика
Инструкция по применению и дозировка
Прививка от миксоматоза и ВГБК должна вводиться ветеринаром. В исключительных случаях, когда нет возможности организовать профессиональный осмотр, заводчик может выполнить инъекции самостоятельно. Порядок применения вакцины:
- Сухой препарат разбавляют аптечным физраствором из расчета 0,5 куб.см. на 1 дозу. Физраствор можно заменить дистиллированной водой.
- Готовый препарат тщательно перемешивается во флаконе путем встряхивания.
- Дозу препарата вводят под кожу или внутримышечно во внутреннюю поверхность бедра.
Важно! При введении препарата подкожным способом на 1 дозу сухого препарата берут 0,2 куб.см. растворителя.
Перед инъекцией место введения иглы протирают спиртовым раствором. Для вакцинации можно использовать одноразовые или многоразовые шприцы. Во втором случае шприцы кипятят на протяжении 30 минут до и после применения.
Во втором случае шприцы кипятят на протяжении 30 минут до и после применения.
После прививки кроликам должно быть организовано тщательное наблюдение. Вывозить животных за пределы хозяйства запрещается на протяжении 3 недель после вакцинации.
Противопоказания и побочные действия
Препарат не имеет противопоказаний к введению за исключением наличия явных признаков заболевания. Побочные действия могут наблюдаться при вакцинации в инкубационный период заболевания. Тяжесть симптомов обусловлена возбудителем инфекции и иммунитетом животного, от недомогания до гибели.
Условия хранения
Препарат может храниться на протяжении 18 месяцев. Температура хранения должна находиться в пределах 2-8°С. Место хранения должно быть защищено от воздействия прямых солнечных лучей. При выявлении посторонних примесей, плесени, хлопьев во флаконе препарата вакцину не используют и отбраковывают. Для ее обеззараживания применяют кипячение в течение 20 минут. Открытый флакон может храниться на протяжении 7 дней.
Хранение вакцины
Всегда ли помогает вакцинация?
Вакцинация кроликов от миксоматоза и геморрагической болезни обеспечивает 100-процентную защиту при условии соблюдения рекомендованных сроков первого введения препарата и ревакцинации.
Внимание! Исключение составляют случаи, когда возбудитель инфекции попал в организм до введения прививки.
Для достижения оптимального результата и закрепления иммунитета рекомендуется перед вакцинацией дать кроликам противоглистные препараты. Также отсутствие положительного результата после вакцинации может быть связано со следующими состояниями:
- слабый иммунитет;
- повышенная активность возбудителей, подавляющая иммунитет животного;
- заражение инфекцией или глистное поражение.
Можно ли вакцинировать маленьких крольчат?
Вакцинировать молодняк нужно обязательно, во избежание массового падежа. До 1,5-месячного возраста крольчат защищает материнский иммунитет, а после отсаживания от самки кролики должны быть привиты согласно рекомендациям ветеринара. Для получения напряженного иммунитета покупают вакцины у проверенных поставщиков. Нельзя использовать флаконы с поврежденными крышками и нарушенными условиями хранения.
Для получения напряженного иммунитета покупают вакцины у проверенных поставщиков. Нельзя использовать флаконы с поврежденными крышками и нарушенными условиями хранения.
Преимущества применения ассоциированной вакцины – оптимизация прививочной процедуры и соблюдения графика вакцинации, снижение стоимости профилактики болезней. При использовании таких препаратов отмечается минимальный риск возникновения нежелательных реакций, а также наблюдается повышенный уровень защиты от наиболее распространенных инфекционных заболеваний кроликов.
Вакцина ассоциированная против миксоматоза и ВГБК
Что из себя представляет миксоматоз и ВГБК я уже писала и если вы читали, то знаете, что это весьма опасные заболевания.
 Они плохо поддаются лечению. Все усилия по лечению часто не дают положительного результата и нередко все заканчивается гибелью животных.
Они плохо поддаются лечению. Все усилия по лечению часто не дают положительного результата и нередко все заканчивается гибелью животных.Главными средствами в борьбе с этими болезнями являются профилактические прививки. Для этой цели применяется ассоциированная вакцина против миксоматоза и ВГБК, которая представляет собой комплексный препарат и в отличие от других вакцин обеспечивает защиту от двух заболеваний сразу.
Ассоциированная вакцина изготавливается из штамма В-87 ВГБК и штамма в-82 вируса миксомы. Сухая, пористая масса расфасовывается во флакончики емкостью 10-20 см³,рассчитанные от 5 до 100 доз.
При подкожном, внутрикожном и внутримышечном введении вакцина здоровью кроликов не вредит. В результате ее применения на третий день после прививки формируется напряженный иммунитет. Вакцина действует в течении 12 месяцев.
Внимание: вакцинировать следует только здоровых животных!!!
Ветеринары также советуют перед введением вакцины проглистогонить кроликов.
При попадании препарата в организм больного кролика – животное может погибнуть.
Нужно ли прививать кроликов
Прививать кроликов или не прививать – это конечно дело личное каждого кроликовода. Но у кроликов низкий иммунитет ,а значит избежать заражения вряд ли получится. Значит, единственный способ предупредить развитие болезни – своевременное введение вакцины.
Когда надо прививать кроликов
Первый раз кроликам прививки делают в 1,5 месячном возрасте (вес животного при этом должен быть не меньше 0,5 кг).
Вакцинацию проводят в неблагоприятных, угрожаемых и благополучных по миксоматозу и ВГБК хозяйствах. В благополучных и угрожаемых хозяйствах иммунизацию проводят однократно. Ревакцинацию – с периодичностью каждые 9 месяцев. Сукрольных крольчих прививают в любой период беременности.А вот кормящих крольчих — прививать не надо.
В неблагополучных хозяйствах вакцинируют и здоровых кроликов, и 1,5 месячных крольчат. После первого введения препарата через три месяца проводят ревакцинацию молодняка. Все последующие вакцинации -регулярно 1 раз в шесть месяцев.
После первого введения препарата через три месяца проводят ревакцинацию молодняка. Все последующие вакцинации -регулярно 1 раз в шесть месяцев.
Дозировка – как разводить вакцину
Безусловно, прививка, сделанная ветеринарным врачом, дает больше шансов на успех, но если такой возможности нет, то препарат можно ввести и самому. Сухую вакцину непосредственно перед применением надо растворить стерильным физиологическим раствором (натрия хлорид) или дистиллированной водой (0,5 см³ раствора на 1 дозу препарата), хорошо взболтать и однократно ввести во внутреннюю поверхность бедра в объеме 0,5 см³ (внутримышечно или подкожно). Для инъекций лучше использовать одноразовые шприцы, а место инъекции протирать 70% — ым медицинским спиртом. Одним шприцом можно привить несколько кроликов. После проведения вакцинации животным создают хорошие условия содержания и наблюдают за ними на протяжении 21 дня. Вывозить животных на выставки и другие хозяйства можно не раньше 3-4-х недель после проведения вакцинации.
Для использования препарата никаких противопоказаний не выявлено.
В связи с тем, что ассоциированная вакцина лечебными свойствами не обладает ,то кролики ,привитые в инкубационный период заболевания могут погибнуть.
Хранение препарата
Срок хранения вакцины – 18 месяцев (после 1-ого отбора – 7 дней) при t 2-6°С в недоступном для света и влаги месте. При нарушении целостности флакона или обнаружении в нем плесени, посторонних примесей, хлопьев ,которые не разбиваются при встряхивании препарат не стоит использовать.
Всегда ли можно избежать болезни
Положительного эффекта от вакцины, к сожалению, не всегда удается достичь. Зачастую причиной тому ошибки хозяев животных, которые не заботятся о поддержании иммунитета своих подопечных на высоком уровне. Несвоевременная вакцинация также может повлиять на развитие болезни, т.е. прививка, сделанная уже после заражения кролика. Человек, решивший разводить кроликов должен создать им хорошие условия проживания, правильный уход и сбалансированное кормление, а также вовремя проводить профилактические мероприятия. Не соблюдая эти правила заражение животных можно допустить еще до проведения вакцинации.
Не соблюдая эти правила заражение животных можно допустить еще до проведения вакцинации.
Можно ли вакцинировать маленьких крольчат
Есть такое мнение: маленьким крольчатам вводить вакцину нельзя. Это в корне неверное мнение. Ее обязательно нужно применять и начинать надо с 45-дневного возраста. Иммунная система у крольчат более крепкая, чем у взрослых кроликов, благодаря чему у них вырабатывается стойкий иммунитет к возбудителям миксоматоза и ВГБК.
Приобретать ассоциированную вакцину у неизвестных лиц и подпольных фирм не стоит, так как препарат такой может только вред нанести.За вакциной лучше обращаться в хорошо зарекомендовавшие себя ветаптеки. Там препараты хранятся соблюдая условия ее хранения – в холодильнике.
Использовать вскрытые флаконы с вакциной – не рекомендуется. Препарат с истекшим сроком годности запрещен к применению. Если на момент введения вакцины в организме присутствовали кокцидии или глисты и для их устранения не была проведена профилактика, то препарат не будет эффективным. Вакцина выпускается с инструкцией, где содержится информация по применению препарата, как нужно правильно прививать кроликов. Инструкцию следует соблюдать неукоснительно. Только так можно достичь желаемого результата без риска для животных.
Вакцина выпускается с инструкцией, где содержится информация по применению препарата, как нужно правильно прививать кроликов. Инструкцию следует соблюдать неукоснительно. Только так можно достичь желаемого результата без риска для животных.
Положительного результата не будет,если:
· во время вакцинации кролики были в ослабленном состоянии, страдали от глистной инвазии или инфекции;
· присутствовала чрезмерная атака возбудителя заболевания, и выработанный иммунитет не смог с ней справиться;
· была использована просроченная вакцина или нарушена схема прививок;
· на момент проведения процедуры кролики уже были заражены.
Преимущества комплексной прививки для кроликов:
· снижение затрат;· оптимизация процесса вакцинации;
· минимальный риск развития осложнений;
повышенный уровень защиты от самых распространенных болезней.
Новую вакцину от вирусных болезней кроликов выпустят на рынок в 2022 году
Ассоциированную вакцину против миксоматоза, пастереллеза и вирусной геморрагической болезни кроликов (ВГБК) 1-го и 2-го типов разработали в научном учреждении Россельхознадзора – Федеральном центре охраны здоровья животных (ФГБУ «ВНИИЗЖ»).
Текст: Юлия МакееваНовая вакцина прошла все доклинические испытания, по их результатам показала себя как безопасный и эффективный препарат, рассказала «Ветеринарии и жизни» Наталья Мороз, заведующая лабораторией профилактики болезней птиц ФГБУ «ВНИИЗЖ».
Испытания проходили на базе вивария ФГБУ «ВНИИЗЖ», три серии экспериментальной вакцины протестировали на группах кроликов от 20 до 60 голов.
-
«В 2021 году планируется провести клинические испытания этой вакцины в производственных (полевых) условиях и оформить регистрационное досье. На рынок собираются выпустить препарат в 2022 году», – сообщила Наталья Мороз.

Она подчеркнула, что подобного иммунобиологического препарата на отечественном фармрынке нет.
- «Ассоциированной вакцины против миксоматоза, пастереллеза и ВГБК 1-го и 2-го серотипа в России не зарегистрировано, несмотря на то что эти болезни являются для кроликов особо опасными, высококонтагиозными, приводящими к гибели большого числа поголовья и экономическому ущербу», – рассказала Наталья Мороз.
Эксперт обратила внимание, что в 2018 году в Тверской и Московской областях был выявлен новый серотип вирусной геморрагической болезни кроликов – ВГБК2 (RHDV2, или RHDVb).
- «ВГБК2 отличается от прежнего варианта вируса тем, что он преодолел видовой барьер и поражает не только кроликов, но и зайцев. Этот вирус опасен для кроликов, вакцинированных против «классического» возбудителя RHDV и RHDVа, – пояснила Наталья Мороз. – В настоящее время зарегистрированных вакцин против данного серотипа ВГБК2 на территории России нет, поэтому разработка ассоциированной вакцины против вирусных болезней кроликов, включающей в свой состав компонент ВГБК2, является актуальнейшей задачей».

ФГБУ "ВНИИЗЖ" / Фото: Александр Плонский / "ВиЖ"
Также нет в России и официально зарегистрированных вакцин против пастереллеза кроликов. «Формолвакцина против пастереллеза кроликов Армавирской биофабрики снята с регистрации. Вакцина «Раббивак-Р» «БиАгро» регистрацию не прошла. Pasorin OI Bioveta (Чехия) продается на Украине, но не зарегистрирована в ТС», – рассказала эксперт.
Поэтому сейчас кролиководы вынуждены применять вакцины против пастереллеза крупного рогатого скота, жвачных животных и свиней, пояснила Наталья Мороз.
Подпишитесь на нас в Telegram, чтобы читать новости сразу, как только они появляются на сайте.
Подпишитесь на нас в ЯНДЕКС.НОВОСТИ и в Telegram , чтобы читать новости сразу, как только они появляются на сайте.
Ассоциированная вакц-а п/миксоматоза и ВГБК (100 доз)
ИНСТРУКЦИЯ
по применению вакцины от миксоматоза и вирусной геморрагической болезни кроликов
СОСТАВ И ФОРМА ВЫПУСКА
Вакцину ассоциированную против миксоматоза и вирусной геморрагической болезни кроликов изготавливают из штамма В-82 вируса миксомы кроликов и штамма В-87 вируса геморрагической болезни кроликов. Вакцина представляет собой пористую сухую массу от бледно-розового до светло-коричневого цвета. Вакцину расфасовывают по 0,5 , 1 , 2 см3 в стерильные ампулы вместимостью 2 , 3 , 5 , 6 см3 , 4 , 6 см3 во флаконы емкостью 10 и 20 см3 , содержащие 5 – 120 иммунизирующих доз. Флаконы закрывают пробками и закатывают алюминиевыми колпачками, а ампулы запаивают. На флакон (ампулу) с вакциной наклеивают этикетку или наносят несмываемой краской маркировку с указанием: краткого наименования организации – изготовителя, краткого названия биопрепарата (вакцина против миксоматоза и ВГБК сухая), номера серии, номера контроля, даты изготовления, количества доз и срока годности. Флаконы (ампулой) с вакциной упаковывают в картонные коробки с перегородками, обеспечивающими неподвижность и целостность флаконов и (ампул). На каждую коробку наклеивают этикетку с указанием : ведомства и наименования предприятия – изготовителя, его товарного знака, наименования биопрепарата, номера серии, номера контроля, даты изготовления ( месяц, год ), срока годности, количества флаконов ( ампул ) в коробке, количества доз во флаконе (ампуле) , условий хранения , обозначения настоящих ТУ и надпись «Для животных». В каждую коробку вкладывают наставление по применению вакцины.
Флаконы (ампулой) с вакциной упаковывают в картонные коробки с перегородками, обеспечивающими неподвижность и целостность флаконов и (ампул). На каждую коробку наклеивают этикетку с указанием : ведомства и наименования предприятия – изготовителя, его товарного знака, наименования биопрепарата, номера серии, номера контроля, даты изготовления ( месяц, год ), срока годности, количества флаконов ( ампул ) в коробке, количества доз во флаконе (ампуле) , условий хранения , обозначения настоящих ТУ и надпись «Для животных». В каждую коробку вкладывают наставление по применению вакцины.
ПОКАЗАНИЯ
Профилактика миксоматоза и ВГБК кроликов.
БИОЛОГИЧЕСКИЕ СВОЙСТВА
Вакцина безвредна для кроликов при внутримышечном, подкожном или внутрикожном введении. Применение вакцины согласно наставлению обеспечивает формирование напряженного иммунитета с 3-го дня после прививки, продолжительностью не менее 12-месяцев.
ДОЗЫ И СПОСОБ ПРИМЕНЕНИЯ
Вакцину применяют внутримышечно, подкожно, внутрикожно для иммунизации здоровых кроликов в благополучных, угрожаемых и неблагополучных по миксоматозу и ВГБК пунктах. В благополучных и угрожаемых пунктах кроликов иммунизируют однократно, начиная с 1,5-месячного возраста. Крольчих вакцинируют в любой период беременности. В неблагополучных пунктах по миксоматозу и ВГБК клинически здоровых кроликов и крольчат с 45- дневного возраста подвергают вакцинации. Молодняк через 3 месяца ревакцинируют. Больных животных вакцинировать запрещается. Для внутримышечного и подкожного введения вакцину во флаконах (ампулах) растворяют из расчета на 1 дозу 0,5 см3 растворителя и вводят 0,5 см3 в область бедра. Для внутрикожной инъекции вакцину во флаконах (ампулах) растворяют из расчета на 1 дозу 0,2 см3 растворителя и вводят 0,2 см3 в подхвостовое зеркало или ухо. Перед вакцинацией шприцы и иглы стерилизуют кипячением в течение 15-20 минут. Место введения вакцины дезинфицируют 70% спиртом. Каждого кролика прививают отдельной иглой. За привитым животным ведут наблюдение в течение 20 суток. Для внутрикожных прививок рекомендуется пользоваться безигольным инъектором. Техническое обслуживание инъектора проводят согласно правилам, изложенным в паспорте.
В благополучных и угрожаемых пунктах кроликов иммунизируют однократно, начиная с 1,5-месячного возраста. Крольчих вакцинируют в любой период беременности. В неблагополучных пунктах по миксоматозу и ВГБК клинически здоровых кроликов и крольчат с 45- дневного возраста подвергают вакцинации. Молодняк через 3 месяца ревакцинируют. Больных животных вакцинировать запрещается. Для внутримышечного и подкожного введения вакцину во флаконах (ампулах) растворяют из расчета на 1 дозу 0,5 см3 растворителя и вводят 0,5 см3 в область бедра. Для внутрикожной инъекции вакцину во флаконах (ампулах) растворяют из расчета на 1 дозу 0,2 см3 растворителя и вводят 0,2 см3 в подхвостовое зеркало или ухо. Перед вакцинацией шприцы и иглы стерилизуют кипячением в течение 15-20 минут. Место введения вакцины дезинфицируют 70% спиртом. Каждого кролика прививают отдельной иглой. За привитым животным ведут наблюдение в течение 20 суток. Для внутрикожных прививок рекомендуется пользоваться безигольным инъектором. Техническое обслуживание инъектора проводят согласно правилам, изложенным в паспорте. Перед началом работы головку инъектора в сборе, плунжер, мандрены и запасные сопла подвергают стерилизации кипячением в дистиллированной воде в течение 15-20 минут или обрабатывают 70% спиртом. После сборки прокачку ннъектора и 2-3 пробных «выстрела» осуществляют в ватный тампон, смоченный 70% спиртом. После каждой инъекции вакцины сопло безигольного инъектора обрабатывают погружением его на 1-3 секунды в 70 процентный спирт.
Перед началом работы головку инъектора в сборе, плунжер, мандрены и запасные сопла подвергают стерилизации кипячением в дистиллированной воде в течение 15-20 минут или обрабатывают 70% спиртом. После сборки прокачку ннъектора и 2-3 пробных «выстрела» осуществляют в ватный тампон, смоченный 70% спиртом. После каждой инъекции вакцины сопло безигольного инъектора обрабатывают погружением его на 1-3 секунды в 70 процентный спирт.
УСЛОВИЯ ХРАНЕНИЯ
Вакцина пригодна для применения в течение 18 месяцев с даты изготовления при условии хранения ее в сухом и темном месте при температуре +2-8 С. Флаконы (ампулы) с вакциной, содержащие плесень, постороннюю примесь, не разбившиеся при встряхивании хлопья, а также с нарушением укупорки и целостности бракуют. Выбракованную сухую вакцину, а также разведенную, но неиспользованную в течение 4 часов, обеззараживают кипячением в течение 20 минут.
Вакцинация кроликов в Иваново | Верный Друг
Вместе с собаками и кошками необходимо вакцинировать и кроликов. В клинике “Верный друг” сделают прививку вашему питомцу против миксоматоза кроликов и вирусной геморрагической болезни кроликов.
В клинике “Верный друг” сделают прививку вашему питомцу против миксоматоза кроликов и вирусной геморрагической болезни кроликов.
Несмотря на то, что многие кролики в настоящее время содержатся исключительно в домашних условиях и на прогулке не бывают, заражение возможно. Мы уже не говорим про кроликов, которые бывают на природе и вакцинация которых является обязательной мерой перед выездом на природу!
Источником возбудителей вирусных заболеваний может быть человек или насекомые. Так, например, человек может на одежде, обуви занести в дом вирус геморрагической болезни кроликов, а заражение миксоматозом может произойти при укусах комаров, вшей и других насекомых.
Перед покупкой второго кролика необходимо провести вакцинацию уже живущего у вас питомца.
Вакцинация —
самая лучшая профилактика вирусных болезней
Самый лучший вариант — посещение ветеринарной клиники, где специалист по болезням кроликов проведет тщательный осмотр вашего животного и сделает необходимую прививку. Кроме того, ветеринар будет наблюдать за животным непосредственно во время проведения процедуры. В случае каких-либо отрицательных реакций на вакцинацию врач сможет вовремя помочь кролику, чего не сможет сделать сам владелец в домашних условиях.В нашей клинике применяют ассоциированную вакцину для кроликов которая помогает сформировать иммунитете против 2 вирусных заболеваний: миксоматоза и вирусной геморрагической болезни. Это наиболее опасные для кроликов болезни, приводящей к большой смертности. Лекарств против этих заболеваний нет, поэтому профилактика в виде вакцинации крайне важна!
Кроме того, ветеринар будет наблюдать за животным непосредственно во время проведения процедуры. В случае каких-либо отрицательных реакций на вакцинацию врач сможет вовремя помочь кролику, чего не сможет сделать сам владелец в домашних условиях.В нашей клинике применяют ассоциированную вакцину для кроликов которая помогает сформировать иммунитете против 2 вирусных заболеваний: миксоматоза и вирусной геморрагической болезни. Это наиболее опасные для кроликов болезни, приводящей к большой смертности. Лекарств против этих заболеваний нет, поэтому профилактика в виде вакцинации крайне важна!
| Наименование вакцины | Полная стоимость (без паспорта) | Против каких болезней | Что входит в стоимость |
|---|---|---|---|
| вакцина для кроликов ассоциированная | 300 | миксоматоз, вирусная геморрагическая болезнь кроликов | только препарат (10 доз/ампула) |
| вакцина раббивак B | 53 | миксоматоз кроликов | только препарат (10 доз/ампула) |
| вакцина раббивак V | 74 | вирусной геморрагической болезни кроликов | только препарат (10 доз/ампула) |
Условия проведения вакцинации
Процедуру проводят только здоровым кроликам, начиная с 1,5 месячного возраста и достижения массы 500 гр. Молодняк через 3 месяца ревакцинируют. Данные меры обеспечивают формирование иммунитета, начиная с 3-го дня после прививки и продолжительностью не менее 12 месяцев. Таким образом, необходимо проводить ревакцинацию по истечению 12 месяцев, т.е. через год после последней прививки. Пропускать сроки вакцинации и ревакцинации нельзя.
Молодняк через 3 месяца ревакцинируют. Данные меры обеспечивают формирование иммунитета, начиная с 3-го дня после прививки и продолжительностью не менее 12 месяцев. Таким образом, необходимо проводить ревакцинацию по истечению 12 месяцев, т.е. через год после последней прививки. Пропускать сроки вакцинации и ревакцинации нельзя.
После вакцинации кроликов нельзя купать, чтобы не простудить на фоне переохлаждения, держать в тепле, не создавать стрессовых ситуаций (смена корма, содержания, перевозки и др.). В случае опасений за здоровье питомца необходимо сразу же обратиться к ветеринарному врачу.
⋆ Использование вакцинации кроликов от миксоматоза и HBV ⋆ 🌼Farmer
Комплексные вакцинации кроликов от миксоматоза и HBV являются эффективным средством сохранения домашнего скота от гибели.
Содержание
- Фармакология ассоциированной вакцинации
- Действие Нобивак Миксо
- Фармакология Лапимун Гемикс
- Дозы вакцинации
- Живая ассоциированная вакцина
- Нобивак Миксо
- Лапимун Гемик кролики от миксоматоза и HBV
Фармакология ассоциированной вакцинации
Вакцина против миксоматоза и вирусной геморроидальной болезни кроликов доступна в одном из двух возможных штаммов:
- B82 миксоматозный вирусный патоген кролика,
- B87 возбудитель вирусной геморроидальной инфекции.
 .
.
Внешне выглядит как сухая пористая смесь, цвет которой варьируется от светло-розового до светло-коричневого.
Вакцина живая для кроликов от миксоматоза и HBV фасуется в стерильные герметичные ампульные контейнеры с объемом активного вещества 0,5–2 мл либо в стеклянные герметичные флаконы объемом 4–6 мл действующего вещества.
При покупке сухой вакцины против миксоматоза и HBV особое внимание следует обращать на наличие этикетки с названием производителя, серией и названиями контроля, датой упаковки, количественными данными о содержащихся дозах и сроке годности.
Количественный показатель содержащихся иммунизирующих доз зависит от формы выпуска в резервуаре с вакциной для миксоматоза и вирусной геморрагической болезни кроликов и может колебаться от 5 до 120.
Живая сухая вакцина может использоваться внутримышечно, подкожно или внутрикожно. вызывает устойчивую резистентность с третьего дня после вакцинации, активно действуя в течение всего календарного года.

Действие Нобивак Миксо
Вакцина Нобивак против миксоматоза и ВГВ - набор из сухой лиофилизированной смеси светло-розового оттенка с прилагаемым растворителем для изготовления инъекционного раствора во флаконе.Он сделан из клеточной линии, инфицированной миксоматозной вирусной инфекцией, с сконструированными кодирующими генами кролика GB. Помимо вирусных штаммов, в состав препарата входят: стабилизаторы
- , в том числе сорбитол 25 мг, гидролизат желатина 12,5 мг, гидролизат казеина 12,5 мг, натрия дигидрат
- - 0,065 мг.
Стерильный фосфатно-буферный разбавитель, входящий в набор для вакцинации, согласно инструкции, представляет собой смесь дигидрата натрия (0.31 мг), дигидрофосфат калия (0,21 мг) и вода (1 мл).
При растворении Нобивак Миксо не выпадает в осадок и не чешется, он хорошо растворяется в однородной прозрачной жидкости.
Выпуск Нобивак Миксо организован в виде 1 или 50 иммунизирующих доз в стекле или пластике, упакованных по 5-10 шт.

При вакцинации Нобивак Миксо иммунитет против последствий вирусных инфекций миксоматоза и формы ВГВ вводится через трехнедельный период, обеспечивая действие действующего вещества в течение всего календарного года.
Фармакология Лапимун Гемикс
Украинская вакцина против миксоматоза кроликов и HBVK Лапимун Гемикс - лекарство, включающее два основных компонента:
- Источник инактивированного возбудителя вирусной геморрагической инфекции кроликов представлен в виде суспензии со штаммом BG04. , служащий растворителем, носитель
- миксоматозного вируса представлен в виде лиофилизатного штамма МАВ РК-1 320.
Лекарство Лапимун помещено во флакон объемом 10 мл, что составляет 50 иммунизирующих доз.
Вакцина развивает устойчивую резистентность через 1-2 недели после инъекции и остается активной до 10 месяцев.
Устойчивость кроликов к геморрагическим инфекциям и миксоматозу вырабатывается не позднее, чем через две недели после вакцинации Лапимуна Гемикс.

Среди противопоказаний к применению препарата в инструкции есть предупреждения: при применении препарата кроликам следует избегать вакцинации за неделю до родов, чтобы избежать стресса у кроликов и связанных с ним механических абортов.
Дозировки вакцины
В зависимости от типа вакцины, вакцинируемой кроликов против миксоматоза и ВГБК, инструкция к препарату устанавливает ее дозировку.
Живая ассоциированная вакцина
Вакцина кроликов от миксоматоза и ассоциированного ВГБК применима для профилактики среди здоровых людей. Причем в регионах, благоприятных для инфекций, вакцинация проводится однократно, с полуторамесячного возраста кроликов. В неблагополучных районах, где введены карантинные меры против миксоматоза и HBV, кроликов вакцинируют, а затем через три месяца после первичной вакцинации проводят повторную вакцинацию молодых особей.
Порядок дозирования препарата зависит от способа введения:
- для внутримышечного и подкожного введения, сухая смесь разводится в пропорции 1 дозировка 0,5 мл раствора и вводится приготовленная вакцина в объеме 0,5 мл.
 в области бедра
в области бедра - для внутрикожного введения препарата 1 дозу препарата разводят 0,2 мл раствора и готовую вакцину объемом 0,2 мл вводят в ушную раковину или в область подрыва. .li>
При использовании соответствующей вакцины рекомендуется ревакцинация через 9 месяцев.
Нобивак Миксо
Нобивак вакцины кроликов от миксоматоза и ВГВ. Домашние питомцы к моменту процедуры должны достичь возраста 5 недель, декоративные карликовые породы также прививаются. Вакцину от болезни необходимо развести в соотношении 1: 1, вакцинировать 1 мл подкожно. Чтобы раки не заболели, препарат следует ревакцинировать не реже одного раза в календарный год.
Лапимун Гемикс
Вакцина живая для кроликов Лапимун гемикс в виде профилактического средства от заболевания подходит кроликам возрастной категории 10 недель. В регионах с благоприятной эпидемиологической ситуацией его вводят однократно с 10-недельного возраста при существующей угрозе заражения с последующей ревакцинацией по достижении 4-месячного возраста.
 К моменту первой вакцинации животное должно набрать вес не менее 0,5 кг. При меньших показателях вакцинация кроликов от миксоматоза и HBV откладывается, это делается при наборе необходимой массы.Для однократной вакцинации кроликов от миксоматоза и HBVC дозировка составляет 1,0 мл действующего вещества, полученного путем смешивания суспензии и лиофилизата.
К моменту первой вакцинации животное должно набрать вес не менее 0,5 кг. При меньших показателях вакцинация кроликов от миксоматоза и HBV откладывается, это делается при наборе необходимой массы.Для однократной вакцинации кроликов от миксоматоза и HBVC дозировка составляет 1,0 мл действующего вещества, полученного путем смешивания суспензии и лиофилизата.Путь инъекции: подкожно в область за лопаткой. Вакцину Лапимун Хемикс повторяют через 8 месяцев.
При проведении вакцинации необходимо соблюдать график, вакцинация проводится вовремя, так как нарушение календаря прививок часто приводит к снижению эффективности препарата в профилактике заболеваний.Перед вакцинацией кроликов в течение 2 недель все животные проходят обязательную дегельминтизацию. Проведение мер по дегельминтизации возможно также через 2 недели после введения одного из вышеперечисленных препаратов.
вакцина против миксоматоза и vgbk для кроликов подготовка вакцины
вакцинация кроликов как вакцинировать кроликов от миксоматоза и HBVC
вакцинация кроликов против миксоматоза и вакцины против HBV Rabbivak
вакцинация вакцинация и особые инструкции для животных наблюдается не менее 20 дней.

Причем в качестве возможных допустимых последствий могут быть:
- небольшие увеличения лимфатических узлов, исчезающие через 3 дня,
- небольшая припухлость в месте инъекции, которая исчезает через 1-2 недели.
При применении вакцины против миксоматоза и HBV у кроликов побочных эффектов и осложнений не было. Следует учитывать, что они не должны появляться при соблюдении рекомендаций, изложенных в инструкции к вакциносодержащим препаратам.
Симптоматические меры иногда требуются людям, склонным к гиперчувствительности.
Контейнеры с сухой вакциной для кроликов от миксоматоза и HBVC с прошедшим сроком годности и без маркировки не используются. То же касается и изменяющих цвет смесей, жидкостей с вкраплениями примесей, лекарств, которые не используются через 3-4 часа после вскрытия.
В процессе инъекции соблюдаются правила личной гигиены при работе с лекарствами.
По общим правилам срок годности активного препарата для вакцинации 2 года, растворитель может храниться 4 года в стекле и 2 года в пластике.
 Лекарства хранят в сухих местах с температурой 2-25 ° С, солнечные лучи не должны попадать в складские помещения. Другой момент - следовать инструкции по вакцине против миксоматоза и HBV для кроликов, без которой невозможно добиться успеха и предотвратить заболевание. И в любом случае перед вакцинацией животного нужно посоветоваться с ветеринаром, а то и доверить ему столь важное дело.
Лекарства хранят в сухих местах с температурой 2-25 ° С, солнечные лучи не должны попадать в складские помещения. Другой момент - следовать инструкции по вакцине против миксоматоза и HBV для кроликов, без которой невозможно добиться успеха и предотвратить заболевание. И в любом случае перед вакцинацией животного нужно посоветоваться с ветеринаром, а то и доверить ему столь важное дело.Миксоматоз - обзор | Темы ScienceDirect
Раздел 7.3 Вирусы группы I: двухцепочечная ДНК
Что это за ловушка? Где были спрятаны его зубы?
Филип Ларкин, из его стихотворения «Миксоматоз»Группа I, дцДНК
Herpesvirales
Herpesviridae
Вирус простого герпеса
- 003 9152-Barr типа Тип вируса
Вирус герпеса ветряной оспы
Herpesvirus simiae
Вирус герпеса человека
Вирус герпеса человека
- 0003
- Без оболочки
Adenoviridae
Адеонвирусы человека от A до G
Papillomaviridae
Вирус папилломы человека
Polyomav3 полиомавирус
Полиомавирус JC
Вирус обезьяны
Нуклеоцитоплазматические вирусы большой ДНК (вирусы NCLDV)
Poxviridae
Poxviridae
- 9pox2 Вирус Poxviridae 9pox6
Вирус оспы обезьян
Вирус коровьей оспы
Вирус оспы оспы
Вирус малой натуральной оспы
Парапоксвирус
Yatapoxvirus
Tanapoxvirus
Вирус опухоли обезьяны Yaba
Mimiviridae
Mimivirus
Мимивирус Acanthamoeba polyphaga
Группа II, оцДНК
Группа III, дцРНК
Группа IV (+) оцРНК
ОцРНК группы V (-)
ОцРНК группы V (-)
Группа VII, dsDNA-RT
Все вирусы группы I имеют геном двухцепочечной ДНК.
 Помимо этого свойства, эти вирусы сильно различаются. У некоторых видов есть конверты; другие нет. Некоторые виды имеют кольцевые геномы; другие имеют линейные геномы. Размер вирусного генома может различаться в 50 раз у разных видов группы. Диапазон хозяев охватывает диапазон живых организмов. Бактерии, археи, эукариоты инфицированы тем или иным вирусом I группы. Группа была разделена на подклассы на основе общих морфологических свойств, шесть из этих подклассов содержат патогены человека: Adenoviridae, Herpesviridae, Poxviridae, Papillomaviridae, Polyomaviridae и Mimiviridae.
Помимо этого свойства, эти вирусы сильно различаются. У некоторых видов есть конверты; другие нет. Некоторые виды имеют кольцевые геномы; другие имеют линейные геномы. Размер вирусного генома может различаться в 50 раз у разных видов группы. Диапазон хозяев охватывает диапазон живых организмов. Бактерии, археи, эукариоты инфицированы тем или иным вирусом I группы. Группа была разделена на подклассы на основе общих морфологических свойств, шесть из этих подклассов содержат патогены человека: Adenoviridae, Herpesviridae, Poxviridae, Papillomaviridae, Polyomaviridae и Mimiviridae.Большинство ДНК-трансформирующих вирусов (т.е. ДНК-вирусов, вызывающих рак) относятся к группе I: полиомавирусы, аденовирусы, папилломавирусы и вирусы герпеса (включая вирус Эпштейна-Барра). Исключение составляет вирус гепатита В, который относится к VIII группе. В отличие от ретровирусов (группа VI), которые содержат гены, гомологичные онкогенам, вызывающим рак, ДНК-трансформирующие вирусы не содержат онкогенов.
 Вирусы, трансформирующие ДНК группы I, по-видимому, вызывают рак через механизм, связанный с их способностью вызывать репликацию в их клетках-хозяевах [Глоссарий вирусов гепатита].
Вирусы, трансформирующие ДНК группы I, по-видимому, вызывают рак через механизм, связанный с их способностью вызывать репликацию в их клетках-хозяевах [Глоссарий вирусов гепатита].Группа I, дцДНК
Herpesvirales
Herpesviridae
Вирус Эпштейна-Барра
Вирус простого герпеса
типаHerpesvirus simiae
Тип вируса герпеса человека
Тип вируса герпеса человека
Тип вируса герпеса человека
Цитомегаловирус вируса
9034 Члены группы вирусов герпеса
 После латентной фазы вирусы могут ускорить литическую фазу, проявляющуюся как клиническое заболевание. Рецидивирующее заболевание может клинически отличаться от первоначальной инфекции (например,g., ветряная оспа, начальная инфекция вируса ветряной оспы, спустя десятилетия сменяется опоясывающим лишаем). Некоторые из вирусов герпеса представляют собой ДНК-трансформирующие вирусы.
После латентной фазы вирусы могут ускорить литическую фазу, проявляющуюся как клиническое заболевание. Рецидивирующее заболевание может клинически отличаться от первоначальной инфекции (например,g., ветряная оспа, начальная инфекция вируса ветряной оспы, спустя десятилетия сменяется опоясывающим лишаем). Некоторые из вирусов герпеса представляют собой ДНК-трансформирующие вирусы.К человеческим герпесвирусам относятся: вирус Эпштейна-Барра, вирусы простого герпеса, вирус ветряной оспы и вирусы герпеса человека 6, 7 и 8, а также цитомегаловирус.
Вирус Эпштейна-Барра поражает почти всех взрослых. Его стойкость делает его одним из наиболее распространенных патогенов человека. Он проявляется остро как мононуклеоз, фарингит, сопровождающийся лимфоцитозом (увеличение лимфоцитов в периферической крови) с морфологическими изменениями в инфицированных лимфоцитах.Возможны спленомегалия и гепатомегалия. Общие симптомы заболевания, особенно утомляемость, могут длиться месяцами или дольше, а в некоторых случаях мононуклеоз повторяется.
 Вирус Эпштейна-Барра представляет собой ДНК-трансформирующий вирус и вызывает несколько видов рака, включая лимфому Ходжкина, лимфому Беркитта, карциному носоглотки и лимфому центральной нервной системы. Предполагается роль вируса в нескольких аутоиммунных заболеваниях.
Вирус Эпштейна-Барра представляет собой ДНК-трансформирующий вирус и вызывает несколько видов рака, включая лимфому Ходжкина, лимфому Беркитта, карциному носоглотки и лимфому центральной нервной системы. Предполагается роль вируса в нескольких аутоиммунных заболеваниях.Простой герпес 1 типа вызывает герпес, а простой герпес 2 типа вызывает генитальный герпес.Оба заболевания могут рецидивировать после первоначального заражения.
Как уже упоминалось, вирус ветряной оспы вызывает ветряную оспу при первом заражении и опоясывающий лишай, также известный как опоясывающий лишай, при реактивации.
Herpesvirus simiae, также известный как вирус B, заражает макак, не вызывая тяжелых заболеваний. В редких случаях люди могут заразиться этим вирусом из обезьяньего резервуара. Инфекция человека обычно приводит к тяжелой энцефалопатии.
Вирусы герпеса человека типа 6 (HHV6) и типа 7 (HHV7) продуцируют экзантему subitum, также известную как roseola infantum и как шестое заболевание.
 Читателям не следует путать шестую болезнь с пятой. Пятое заболевание, также известное как инфекционная эритема и болезнь ударов по лицу, вызывается парвовирусом B19. Эти заболевания получили свое название от исторической диагностической дилеммы, с которой столкнулись педиатры, которые регулярно сталкивались с шестью клиническими синдромами детской сыпи. Четыре сыпи в детстве имели известную этиологию. Пятая и шестая высыпания, вызванные еще не идентифицированными организмами, назывались «пятая болезнь» и «шестая болезнь».Впоследствии вирусные причины этих двух заболеваний были обнаружены, но числовые названия остались.
Читателям не следует путать шестую болезнь с пятой. Пятое заболевание, также известное как инфекционная эритема и болезнь ударов по лицу, вызывается парвовирусом B19. Эти заболевания получили свое название от исторической диагностической дилеммы, с которой столкнулись педиатры, которые регулярно сталкивались с шестью клиническими синдромами детской сыпи. Четыре сыпи в детстве имели известную этиологию. Пятая и шестая высыпания, вызванные еще не идентифицированными организмами, назывались «пятая болезнь» и «шестая болезнь».Впоследствии вирусные причины этих двух заболеваний были обнаружены, но числовые названия остались.Вирус герпеса человека 8 типа (HHV8) - это ДНК-трансформирующий вирус, который может вызывать саркому Капоши, первичную лимфому с выпотом и некоторые формы болезни Кастлемана. Саркома Капоши - это рак, характеризующийся очаговым разрастанием мелких кровеносных сосудов, чаще всего возникающим в коже. У пациентов с ослабленным иммунитетом (например, реципиенты трансплантата), которые являются носителями латентного вируса HHV8, может развиться саркома Капоши в течение нескольких месяцев после иммуносупрессии.
 Интересно, что если остановить иммуносупрессию, саркома Капоши может регрессировать [49]. Предполагается, что для раннего роста опухоли необходима устойчивая репликация вируса.
Интересно, что если остановить иммуносупрессию, саркома Капоши может регрессировать [49]. Предполагается, что для раннего роста опухоли необходима устойчивая репликация вируса.Цитомегаловирус поражает около половины населения земного шара, при этом большинство людей не страдают от каких-либо побочных эффектов. После заражения вирус обычно сохраняется на всю жизнь человека. В меньшинстве случаев, особенно среди лиц с ослабленным иммунитетом (например, реципиенты трансплантатов органов и пациенты со СПИДом) и новорожденных, вирус может вызывать тяжелое неврологическое заболевание.Заболевание известно как болезнь цитомегальных телец включения, и, как следует из названия, цитоплазматические и ядерные тельца включения характеризуют активно инфицированные клетки. Когда вирус передается трансплацентарно от матери, инфицированной во время беременности, новорожденный может пострадать в результате развития мозга и других органов (рис. 7.1).
Рис. 7.1. Цитомегаловирусная инфекция легкого.
(Источник, изображение общественного достояния, предоставленное Центром США по контролю и профилактике заболеваний Библиотекой изображений общественного здравоохранения.) В центре изображения вверху находится инфицированный пневмоцит с сильно увеличенным ядром. Основная часть ядра занята плотным включением, иногда называемым тельцом Каудри, содержащим вирусные нуклеокапсиды.Вокруг включения - чистая зона. Такие ядерные включения, наблюдаемые у всех видов вирусов герпеса, инфицирующих людей, долгое время служили важным ключом к диагностике и патогенезу вирусных заболеваний.
В центре изображения вверху находится инфицированный пневмоцит с сильно увеличенным ядром. Основная часть ядра занята плотным включением, иногда называемым тельцом Каудри, содержащим вирусные нуклеокапсиды.Вокруг включения - чистая зона. Такие ядерные включения, наблюдаемые у всех видов вирусов герпеса, инфицирующих людей, долгое время служили важным ключом к диагностике и патогенезу вирусных заболеваний.Группа I, dsDNA
Без оболочки
Без оболочки
- e Человеческие адеонвирусы от A до G
Papillomaviridae
Вирус папилломы человека
Polyomaviridae
BK polyomavirus
BK polyomavirus
- polyomaviridae
- вируса polyomaviridae4 вируса JS4 вируса JS
которых существует 57 типов, с различными клиническими синдромами, связанными с конкретными подтипами вируса.
 Большинство аденовирусных заболеваний клинически проявляются как респираторное заболевание, конъюнктивит (то есть вирусный конъюнктивит) или гастроэнтерит. Клинически инфекции могут проявляться в виде тонзиллита (имитирующего стрептококковое воспаление горла), фарингита (крупа), среднего отита, пневмонии, менингоэнцефалита и геморрагического цистита. Аденовирусы обычно распространяются аэрозольными каплями и особенно стабильны во внешней среде.
Большинство аденовирусных заболеваний клинически проявляются как респираторное заболевание, конъюнктивит (то есть вирусный конъюнктивит) или гастроэнтерит. Клинически инфекции могут проявляться в виде тонзиллита (имитирующего стрептококковое воспаление горла), фарингита (крупа), среднего отита, пневмонии, менингоэнцефалита и геморрагического цистита. Аденовирусы обычно распространяются аэрозольными каплями и особенно стабильны во внешней среде.Вирусы папилломы человека вызывают кожные бородавки, бородавки гортани и остроконечные кондиломы.Бородавки - это доброкачественные опухоли, состоящие из пролиферирующих плоских клеток. В некоторых случаях эти бородавки, вызванные вирусом папилломы человека, прогрессируют в инвазивные плоскоклеточные карциномы (рис. 7.2).
Рис. 7.2. Койлоцитоз. Скопление плоских эпителиальных клеток слева - это нормальные плоские клетки, выстилающие шейку матки. Группа из трех клеток справа - это клетки плоского эпителия, демонстрирующие койлоцитоз, цитопатический эффект, вызванный инфекцией вируса папилломы человека.
(Источник, Википедия, из общедоступного изображения, предоставленного Euthman.) Обратите внимание на то, что ядра увеличены и кажутся примерно в 2-3 раза больше нормальных ядер (слева).Каждое ядро (правое скопление) окружает аномальная зона бледной цитоплазмы, типичная для койлоцитоза. За бледной зоной находится более тонкая зона нормальной цитоплазмы, простирающаяся до клеточной мембраны.
Обратите внимание на то, что ядра увеличены и кажутся примерно в 2-3 раза больше нормальных ядер (слева).Каждое ядро (правое скопление) окружает аномальная зона бледной цитоплазмы, типичная для койлоцитоза. За бледной зоной находится более тонкая зона нормальной цитоплазмы, простирающаяся до клеточной мембраны.Класс Polyomaviridae содержит несколько вирусов, поражающих людей: полиомавирус BK, полиомавирус JC и вирус обезьяны 40.
Полиомавирус BK редко вызывает заболевание у инфицированных пациентов, и большинство людей являются носителями скрытого вируса.После иммуносупрессии латентный период может перейти в литическую инфекцию, вызывая клиническую нефропатию.
Полиомавирус JC постоянно поражает большинство людей, но не вызывает заболевания у здоровых людей. В редких случаях у пациентов с ослабленным иммунитетом полиомавирус JC может вызывать прогрессирующую мультифокальную лейкоэнцефалопатию.
 Вирус нацелен на производящие миелин олигодендроциты в головном мозге, вызывая области демиелинизации и некроза.
Вирус нацелен на производящие миелин олигодендроциты в головном мозге, вызывая области демиелинизации и некроза.Вирус обезьяны 40 (SV40) заражает обезьян и людей, но в настоящее время нет доказательств, подтверждающих его роль в заболевании человека.
Группа I, дцДНК
Неназначенный
Нуклеоцитоплазматические вирусы большой ДНК (вирусы NCLDV)
Poxviridae
- 9poxvirus 9poxviridae
- 9poxvirus
Вирус оспы обезьян
Вирус коровьей оспы
Вирус оспы оспы
Вирус малой натуральной оспы
Парапоксвирус
Ятапоксвирус
Танапоксвирус
Вирус опухоли обезьяны Яба
Яба
Члены класса ортопоксвирусов вызывают заболевания se характеризуется гнойничками на коже и лимфаденопатией.

Вирус оспы отличается чрезвычайно узким кругом хозяев: только люди. Вирус поражает кожу и слизистую оболочку верхних дыхательных путей, вызывая гнойнички, мокнутие и сыпь. На слизистой оболочке дыхательных путей сыпь мешает дыханию. Если болезнь переходит в геморрагический характер, прогноз ухудшается. Считается, что оспа убила около 300 миллионов человек в 20-м веке до того, как эффективная вакцина стала широко доступной. Оспа считается величайшим убийцей в истории человечества.Его уровень смертности составлял 30–35%, что значительно ниже, чем у некоторых геморрагических вирусов (например, от вируса Эбола, группа V, уровень смертности составляет почти 90%). Несомненно, смертность росла, потому что болезнь легко передавалась через аэрозоли, фомиты, физиологические жидкости или прямой контакт с пациентами с сыпью.
В настоящее время оспа считается единственной инфекцией людей, которая была объявлена «искорененной». Следует отметить, что существует несколько закрытых обществ, для которых статус оспы среди населения неизвестен (например,г.
 , Северная Корея). Помимо замечательного успеха вакцинации, искоренение оспы, несомненно, стало возможным, потому что натуральная оспа не является резервуаром для животных. В настоящее время вакцинация обычно не проводится и предназначена в первую очередь в качестве меры борьбы с терроризмом для персонала, входящего в зону, где существует угроза биологического оружия.
, Северная Корея). Помимо замечательного успеха вакцинации, искоренение оспы, несомненно, стало возможным, потому что натуральная оспа не является резервуаром для животных. В настоящее время вакцинация обычно не проводится и предназначена в первую очередь в качестве меры борьбы с терроризмом для персонала, входящего в зону, где существует угроза биологического оружия.Variola minor - это вирус, тесно связанный с Variola major, вызывающий более легкое заболевание. Эти болезни известны под разными названиями, включая аластрим, хлопковую оспу, молочную оспу, белую оспу и кубинский зуд.Считается, что инфекция Variola minor вызывает перекрестную устойчивость к Variola Major (и наоборот).
Вирус осповакцины - это выращенный в лаборатории поксвирус малоизвестного происхождения, который не совсем соответствует известным вирусам, находящимся за пределами лаборатории или клиники (т.е. не совсем коровьей оспы, не совсем натуральной оспы). Известно, что вакцинация вирусом осповакцины в редких случаях вызывает множество клинических заболеваний, начиная от коровьей оспы (локализованные пустулезные высыпания) и заканчивая генерализованной коровьей оспой, прогрессирующей осповакцинией, гангренозной осповакциной и некрозной осповакциной.
 К другим состояниям, связанным с вакцинацией, относятся вакцинальная экзема и поствакциниальный энцефалит).
К другим состояниям, связанным с вакцинацией, относятся вакцинальная экзема и поствакциниальный энцефалит).Вакцинация против оспы, помимо искоренения величайшего убийцы человечества, могла иметь до сих пор непризнанную ценность для общественного здравоохранения. Количество известных в настоящее время патогенных организмов, их вариантных подтипов, их способность мутировать и появление новых патогенных микроорганизмов делают невозможным разработку вакцины для каждого организма, инфицирующего людей. Следовательно, специалисты по вакцинам ищут вакцины, которые обеспечивают иммунитет, частичный или полный, против нескольких различных патогенов или нескольких вариантов одного патогена [50].Интересным достижением в этой области является то, что вакцина против оспы может обеспечивать ограниченную защиту от инфекции ВИЧ (вируса иммунодефицита человека). Оба вируса усиливают свою инфекционность за счет использования рецептора CCR5 на поверхности лейкоцитов. Этот общий способ заражения может способствовать перекрестной защите от ВИЧ, которая, по всей видимости, исходит от противооспенной вакцины.
 Было высказано предположение, что появление ВИЧ в 1980-х годах могло быть частично результатом прекращения вакцинации против оспы в конце 1970-х годов [51].
Было высказано предположение, что появление ВИЧ в 1980-х годах могло быть частично результатом прекращения вакцинации против оспы в конце 1970-х годов [51].Оспа буйволов, коровья оспа и оспа обезьян вызывают болезни в резервуарах для животных и редко заражают людей. Заражение человека происходит в результате тесного контакта с инфицированными животными и проявляется во многом как оспа, но в более легкой форме.
Члены класса Parapoxvirus заражают позвоночных, особенно овец, коз, крупный рогатый скот и красных белок. Вирус Orf вызывает заболевание овец и коз «болезненность во рту» или «чесотка во рту». Люди, хотя и редко заражаются, могут иметь болезненные язвы на руках. Аналогичное заболевание может возникнуть у людей, которые обрабатывают вымя коров, инфицированных клубеньковым вирусом Милкера.
Класс Molluscipoxvirus содержит один вид, заразный для человека, вирус Molluscum contagiosum. Контагиозный моллюск - это высыпание из бородавчатых кожных поражений, которые легко диагностируются при гистологическом исследовании по характерным клеточным включениям (так называемые тельца моллюска).
 Нет известных резервуаров для животных. Инфекция передается от человека к человеку. Лечение не всегда необходимо, поскольку отдельные поражения регрессируют в течение двух месяцев. Однако автоинокуляция вируса может вызвать новые поражения кожи, что продлит болезнь.
Нет известных резервуаров для животных. Инфекция передается от человека к человеку. Лечение не всегда необходимо, поскольку отдельные поражения регрессируют в течение двух месяцев. Однако автоинокуляция вируса может вызвать новые поражения кожи, что продлит болезнь.Члены класса Yatapoxvirus заражают приматов в экваториальной Африке. Инфекции могут передаваться людям через насекомых-переносчиков. Поксвирус Tana вызывает язвенную кожную инфекцию с лихорадкой и лимфаденопатией у инфицированных людей (то есть как легкая форма оспы). Вирус опухоли обезьяны Яба вызывает гистиоцитомы у обезьян. Гистиоцитомы - это пролиферативные поражения фиброзной ткани, которые дают опухолевидные узелки. Эти вирусно-индуцированные гистиоцитомы у обезьян быстро растут после заражения, а затем регрессируют в течение следующего месяца [52].Вирус опухоли обезьяны Яба и вирус Яба-подобной болезни, как и все представители класса Yatapoxvirus, считаются потенциальными патогенами человека.
Группа I, дцДНК
Не назначено
Нуклеоцитоплазматические вирусы большой ДНК (вирусы NCLDV)
Mimiviridae
Mimiviridae
Mimiviridae
Mimiviridae в 1992 году занимает нишу, которая, кажется, охватывает биологическую пропасть, отделяющую живые организмы от вирусов.
 Члены класса Mimiviridae сложны, крупнее некоторых бактерий, с огромными геномами (по вирусным стандартам), превышающими миллион пар оснований и кодирующими более 1000 белков. Большой размер и сложность Class Mimiviridae иллюстрируют преимущество генома двухцепочечной ДНК. ДНК гораздо более химически стабильна, чем РНК, и может точно реплицироваться, даже если ее длина превышает миллиард пар оснований. Геном двухцепочечной ДНК можно защитить ферментами репарации ДНК и внешними модификациями структуры ДНК.Класс Megaviridae - это недавно описанный (октябрь 2011 г.) класс вирусов, родственный классу Mimiviridae, но более крупный [45].
Члены класса Mimiviridae сложны, крупнее некоторых бактерий, с огромными геномами (по вирусным стандартам), превышающими миллион пар оснований и кодирующими более 1000 белков. Большой размер и сложность Class Mimiviridae иллюстрируют преимущество генома двухцепочечной ДНК. ДНК гораздо более химически стабильна, чем РНК, и может точно реплицироваться, даже если ее длина превышает миллиард пар оснований. Геном двухцепочечной ДНК можно защитить ферментами репарации ДНК и внешними модификациями структуры ДНК.Класс Megaviridae - это недавно описанный (октябрь 2011 г.) класс вирусов, родственный классу Mimiviridae, но более крупный [45].Как отмечалось ранее, жизнь мимивируса не сильно отличается от жизни облигатных внутриклеточных бактерий (например, риккетсий). Открытие класса Mimiviridae вдохновляет биологов пересмотреть «неживой» статус, приписываемый вирусам, и вынуждает систематиков изучить место вирусов в филогенетическом развитии прокариотических и эукариотических организмов.

Мимивирус Acanthamoeba polyphaga является возможным патогеном человека. У некоторых пациентов с пневмонией обнаружены антитела против вируса [53].
Хотя вирус миксомы не является патогеном человека, представляется целесообразным включить некоторое упоминание об этом представителе класса Poxviridae из-за той роли, которую люди сыграли в его истории. Вирус миксомы вызывает у кроликов смертельную болезнь - миксоматоз. Заболевание характеризуется быстрым появлением кожных опухолей (миксом), за которыми следует тяжелый конъюнктивит, системные симптомы и фульминантная пневмония.Смерть обычно наступает через 2-14 дней после заражения. В 1952 году французский вирусолог, надеясь сократить популяцию кроликов в своем частном имении, привил нескольким кроликам вирус миксомы. Результаты оказались намного лучше, чем он ожидал. В течение двух лет 90% популяции кроликов во Франции скончались от миксоматоза.
Европейские кролики, завезенные в Австралию в 19 веке, одичали и размножались.
 К 1950 году популяция кроликов в Австралии составляла около 3 миллиардов. Воспользовавшись вирусом миксомы как решением проблемы перенаселения кроликов, австралийцы запустили программу инокуляции вируса миксомы.Менее чем за 10 лет популяция австралийских кроликов сократилась на 95% [54]. Погибло около 3 миллиардов кроликов, что очень близко к числу людей, живших на планете в середине 1950-х годов. Эту чуму на кроликах развязал комитет людей, решивший, что следует использовать смертельный кроличий вирус в качестве биологического оружия. Не комментируя моральные последствия усилий по искоренению животных, стоит отметить, что кролики - не единственные млекопитающие, которые могут быть истреблены патогенным вирусом.Люди должны быть внимательны.
К 1950 году популяция кроликов в Австралии составляла около 3 миллиардов. Воспользовавшись вирусом миксомы как решением проблемы перенаселения кроликов, австралийцы запустили программу инокуляции вируса миксомы.Менее чем за 10 лет популяция австралийских кроликов сократилась на 95% [54]. Погибло около 3 миллиардов кроликов, что очень близко к числу людей, живших на планете в середине 1950-х годов. Эту чуму на кроликах развязал комитет людей, решивший, что следует использовать смертельный кроличий вирус в качестве биологического оружия. Не комментируя моральные последствия усилий по искоренению животных, стоит отметить, что кролики - не единственные млекопитающие, которые могут быть истреблены патогенным вирусом.Люди должны быть внимательны.Инфекционные роды
Виды Adenoviridae
- -
Линия . Вирусы дцДНК, стадия без РНК: Adenoviridae: Мастаденовирус: неклассифицированные Аденовирусы человека: Human adenovirus sp.

- -
Инфекция . Аденовирусы человека (вызывают инфекции дыхательных путей, фарингитные и легочные, а также конъюнктивальные, гастроэнтеритические или бактериемические инфекции)
Аденовирус человека A, типы 12, 18, 31
Аденовирус человека B, типы 3, 7 , 11, 14, 16, 21, 34-35, 50, 55
Аденовирус человека C, типы 1, 2, 5-6, 57
Аденовирус человека D, типы 8-10, 13, 15 , 17, 19-20, 22, 23-30,
32-33, 36-39, 42-49, 51, 53-54, 56
Аденовирус человека E, тип 4
Аденовирус человека F, типы 40-41
Аденовирус человека G, тип 52
Herpesviridae
- -
Линия .Вирусы дцДНК, стадия без РНК: Herpesvirales: Herpesviridae: Gammaherpesvirinae: Лимфокриптовирус: Человеческий гаммагерпесвирус 4 (вирус Эпштейна-Барра)
- -
Инфекция .
 Вирус Эпштейна-Барра (включая инфекции, такие как мононуклеоз, и новообразования, такие как лимфома Ходжкина, лимфома Беркитта, карцинома носоглотки и лимфома центральной нервной системы, а также различные аутоиммунные заболевания)
Вирус Эпштейна-Барра (включая инфекции, такие как мононуклеоз, и новообразования, такие как лимфома Ходжкина, лимфома Беркитта, карцинома носоглотки и лимфома центральной нервной системы, а также различные аутоиммунные заболевания)- -
- 20619 Инфекция.Простой герпес 1 типа (герпес)
- -
Инфекция . Простой герпес 2 типа (генитальный герпес)
- -
Инфекция . Вирус герпеса ветряной оспы (ветряная оспа при первой инфекции, опоясывающий лишай или опоясывающий лишай при повторной активации)
- -
Инфекция . Вирус герпеса simiae, также известный как вирус B (энцефалопатия)
- -
Инфекция .Вирус герпеса человека 6 типа, HHV6 (exanthem subitum, roseola infantum, шестое заболевание)
- -
Инфекция . Вирус герпеса человека 7 типа, HHV7 (exanthem subitum, roseola infantum, шестое заболевание; предполагаемая, но спорная причина розового питириаза)
- -
Инфекция .
 Вирус герпеса человека 8 типа, HHV8 (саркома Капоши, первичная выпотная лимфома, болезнь Кастлемана)
Вирус герпеса человека 8 типа, HHV8 (саркома Капоши, первичная выпотная лимфома, болезнь Кастлемана)- -
Инфекция .Цитомегаловирус, также известный как вирус герпеса человека 5 (болезнь цитомегальных телец включения)
Ортопоксвирус
- -
Линия . Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Orthopoxvirus: вирус натуральной оспы
- -
Инфекция . Variola major (натуральная оспа)
- -
Инфекция . Variola minor (аластрим, хлопковая оспа, молочная оспа, белая оспа и кубинский зуд)
- -
Линия .Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Orthopoxvirus: вирус осповакцины
- -
Инфекция . Вирус осповакцины (коровьей оспы, генерализованной коровьей оспы, прогрессирующей осповакцины, гангренозной осповакцины, некроза осповакцины, вакцинационной экземы, поствакциниального энцефалита)
- -
Линия .
 Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Orthopoxvirus: Вирус осповакцины: вирус оспы буйволов
Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Orthopoxvirus: Вирус осповакцины: вирус оспы буйволов- -
Инфекция .Buffalopoxvirus (Buffalopox)
- -
Происхождение . Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Orthopoxvirus: Monkeypox virus
- -
Инфекция . Вирус оспы обезьян (Monkeypox)
- -
Происхождение . Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Orthopoxvirus: Cowpox virus
- -
Инфекция .Вирус коровьей оспы (Cowpox)
Molluscipoxvirus
- -
Линия . Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Molluscipoxvirus: Molluscum contagiosum virus
- -
Инфекция . Вирус контагиозного моллюска (Molluscum contagiosum)
Парапоксвирус
- -
Линия .
 Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Parapoxvirus
Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Parapoxvirus- -
Инфекция .Вирус узелков Милкера (узлы Милкера)
- -
Происхождение . Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Parapoxvirus: Orf virus
- -
Инфекция . Вирус Orf (Orf, также известный как контагиозная эктима)
Yatapoxvirus
- -
Lineage . Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Yatapoxvirus: Tanapox virus
- -
Инфекция .Вирус танапокса (легкая инфекция кожи с образованием ямок) [52]
- -
Линия . Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Yatapoxvirus: вирус опухоли обезьяны Yaba
- -
Инфекция . Вирус опухоли обезьяны Yaba (регрессирующая гистиоцитома) [52]
Papillomaviridae
- -
Линия .
 Вирусы дцДНК, без стадии РНК: Papillomaviridae
Вирусы дцДНК, без стадии РНК: Papillomaviridae- -
Инфекция .Вирус папилломы человека (бородавки, остроконечные кондиломы, папилломы гортани, плоскоклеточный рак)
Polyomaviridae
- -
Линия . Вирусы дцДНК, без стадии РНК: Polyomaviridae
- -
Инфекция . Полиомавирус ВК или вирус ВК (нефропатия у лиц с ослабленным иммунитетом)
- -
Инфекция . Полиомавирус JC или вирус JC (прогрессирующая мультифокальная лейкоэнцефалопатия у лиц с ослабленным иммунитетом)
- -
Инфекция .Вирус обезьяны 40 или вирус SV40 (весьма спорная потенциальная причина рака человека)
Mimiviridae:
- -
Линия . Вирусы дцДНК, без стадии РНК: Mimiviridae: Mimivirus
- -
Инфекция .
 Мимивирус Acanthamoeba polyphaga (пневмония)
Мимивирус Acanthamoeba polyphaga (пневмония)
Широкое применение кроликов в качестве модели болезней человека
- 1.
Пастер, Л. Методика для предотвращения наступления смерти. Comptes rendus Hebd. Des. séances De. l’Académie Des. Sci. 101 , 765–774 (1885).
Google Scholar
- 2.
Pinheiro, A. et al. Молекулярные основы генетического разнообразия и эволюции локуса гена вариабельной области тяжелой цепи иммуноглобулина (IGHV) у лепорид. Иммуногенетика 63 , 397–408 (2011).
CAS PubMed PubMed Central Google Scholar
- 3.
Pinheiro, A. et al. Обзор иммунной системы зайцеобразных и ее генетического разнообразия. Иммуногенетика 68 , 83–107 (2016).
CAS PubMed Google Scholar
- 4.
Маг, Р. Г., Пинейро, А., Лемос де Матос, А.
 и Эстевес, П. Дж. Иммунная система зайцеобразных. В: М. Дж. Х. Рэтклифф (ред.). Энциклопедия иммунобиологии. Том. 1, (515–525. Elsevier, Амстердам, Голландия, 2016).
и Эстевес, П. Дж. Иммунная система зайцеобразных. В: М. Дж. Х. Рэтклифф (ред.). Энциклопедия иммунобиологии. Том. 1, (515–525. Elsevier, Амстердам, Голландия, 2016).Google Scholar
- 5.
Буркхолдер, Т. Х., Линтон, Г. Ф. Р., Хойт, Дж. И Янг, Р. Кролик как экспериментальная модель. В: М. А. Суков, К. А. Стивенс, Р. П. Уилсон (ред.). Лабораторный кролик, морская свинка, хомяк и другие грызуны. с. 529–560. (Academic Press, Кембридж, Массачусетс, США, 2012).
Google Scholar
- 6.
Муллейн, К. и Уильямс, М.Модели астмы на животных: повторение или перезагрузка? Biochem. Pharmacol. 87 , 131–139 (2014).
CAS PubMed Google Scholar
- 7.
Уэбб Д. Р. Животные модели болезней человека: воспаление. Biochem. Pharmacol. 87 , 121–130 (2014).
CAS PubMed Google Scholar
- 8.

Граур, Д., Дюре, Л. и Гуи, М.Филогенетическое положение отряда зайцеобразных (кролики, зайцы и союзники). Nature 379 , 333–335 (1996).
CAS PubMed Google Scholar
- 9.
Neves, F. et al. Генетическая характеристика интерлейкинов (IL-1альфа, IL-1beta, IL-2, IL-4, IL-8, IL-10, IL-12A, IL-12B, IL-15 и IL-18) с соответствующими биологическими ролями в зайцеобразные. Врожденный иммунитет. 21 , 787–801 (2015).
CAS PubMed PubMed Central Google Scholar
- 10.
Perkins, H.D., van Leeuwen, B.H., Hardy, C.M. и Kerr, P.J. Полные последовательности кДНК IL-2, IL-4, IL-6 И IL-10 европейского кролика ( Oryctolagus cuniculus ). Цитокин 12 , 555–565 (2000).
CAS PubMed Google Scholar
- 11.
James, J. et al. Принудительная экспрессия тяжелой цепи альфа-миозина в желудочке кролика приводит к кардиопротекции в кардиомиопатических условиях.
 Тираж 111 , 2339–2346 (2005).
Тираж 111 , 2339–2346 (2005).CAS PubMed PubMed Central Google Scholar
- 12.
Zschaler, J., Schlorke, D. & Arnhold, J. Различия в врожденном иммунном ответе между человеком и мышью. Crit. Rev. Immunol. 34 , 433–454 (2014).
CAS PubMed Google Scholar
- 13.
Вентилятор, Дж.и другие. Модели кроликов для изучения атеросклероза человека: от патофизиологических механизмов к трансляционной медицине. Pharmacol. Ther. 146 , 104–119 (2015).
CAS PubMed Google Scholar
- 14.
Tian, J. et al. Новая модель атеросклероза у кроликов с использованием повреждения стенок артерий, вызванного хлоридом железа, по оценке оптической когерентной томографии, а также внутрисосудистого ультразвукового исследования и гистологии. J. Biomed. Biotechnol.
 2014 , 121867 (2012).
2014 , 121867 (2012).Google Scholar
- 15.
Хименес-Гарсия, А. и др. Повреждение кишечной стенки при простой кишечной непроходимости у кроликов: иммуномодуляторная роль соматостатина. Гепатогастроэнтерология 51 , 1030–1036 (2004).
PubMed Google Scholar
- 16.
Fischer, B., Chavatte-Palmer, P., Viebahn, C., Наваррете Сантос, А. и Дюрантон, В. Кролик как репродуктивная модель для здоровья человека. Репродукция 144 , 1–10 (2012).
CAS PubMed Google Scholar
- 17.
Маг, Р. Г. и Рай, Г. Модель системной красной волчанки на кроликах, полезная для исследований нейропсихиатрической СКВ. В: Х. Алмоаллин (ред.). Системная красная волчанка. с. 201–217. (InTech –Open Access Publisher, Риека, Хорватия, 2012 г.).
Google Scholar
- 18.

Desando, G. et al. Внутрисуставная доставка стромальных клеток, полученных из жировой ткани, снижает прогрессирование остеоартрита на экспериментальной модели кролика. Arthritis Res. Ther. 15 , R22 (2013).
CAS PubMed PubMed Central Google Scholar
- 19.
Канг, С. Дж., Гроссниклаус, Х. Э. Кроличья модель ретинобластомы. J. Biomed. Biotechnol. 2011 , 394730 (2011).
PubMed Google Scholar
- 20.
Вудрафф-Пак, Д. С., Агелан, А., Дель Валле, Л. Кроличья модель болезни Альцгеймера: действительна на нейропатологическом, когнитивном и терапевтическом уровнях. J. Alzheimers Dis. 11 , 371–383 (2007).
CAS PubMed Google Scholar
- 21.
Rhee, K. J. et al. Положительный отбор репертуара периферических В-клеток в лимфоидной ткани, ассоциированной с кишечником. J. Exp. Med. 201 , 55–62 (2005).
CAS PubMed PubMed Central Google Scholar
- 22.
Маг, Р. Г., Лэннинг, Д. и Найт, К. Л. Развитие репертуара В-клеток и антител у кроликов: потребность в лимфоидных тканях, ассоциированных с кишечником. Dev. Комп. Иммунол. 30 , 137–153 (2006).
CAS PubMed Google Scholar
- 23.
Бернетт, Р. К., Хэнли, В. К., Чжай, С. К. и Найт, К. Л. Семейство генов тяжелой цепи IgA у кроликов: клонирование и анализ последовательности 13 С альфа-генов. EMBO J. 8 , 4041–4047 (1989).
CAS PubMed PubMed Central Google Scholar
- 24.
Аби-Рэчед, Л., Дориги, К., Норман, П.J., Yawata, M. и Parham, P. Эпизоды естественного отбора сформировали взаимодействия IgA-Fc с FcalphaRI и бактериальными белками-ловушками. J. Immunol. 178 , 7943–7954 (2007).
CAS PubMed Google Scholar
- 25.
Пиньейро, А., Вуф, Дж. М., Аби-Рэчед, Л., Пархэм, П. и Эстевес, П. Дж. Вычислительный анализ эволюционной гонки вооружений между иммунитетом млекопитающих, опосредованным иммуноглобулином А, и его подрывом бактериальными патогенами . PLoS ONE 8 , e73934 (2013).
CAS PubMed PubMed Central Google Scholar
- 26.
Дикс, Э. Д. и Китинг, Г. М. Кроличий антитимоцитарный глобулин (тимоглобулин): обзор его использования в профилактике и лечении острого отторжения почечного аллотрансплантата. Наркотики 69 , 1483–1512 (2009).
CAS PubMed Google Scholar
- 27.
Flisikowska, T. et al. Эффективное разрушение гена иммуноглобулина и целенаправленная замена у кролика с помощью нуклеаз цинкового пальца. PLoS ONE 6 , e21045 (2011).
CAS PubMed PubMed Central Google Scholar
- 28.
Вебер, Дж., Пенг, Х. и Рейдер, С. От репертуаров кроличьих антител до кроличьих моноклональных антител. Exp. Мол. Med. 49 , e305 (2017).
CAS PubMed PubMed Central Google Scholar
- 29.
Zhang, Y. F. и Ho, M. Гуманизация кроличьих моноклональных антител путем пересадки комбинированных областей, определяющих комплементарность Kabat / IMGT / Paratome: обоснование и примеры. МАБ 9 , 419–429 (2017).
CAS PubMed PubMed Central Google Scholar
- 30.
Куммерфельдт, К. Э. Раксибакумаб: потенциальная роль в лечении легочной формы сибирской язвы. Заражение. Устойчивость к наркотикам. 7 , 101–109 (2014).
PubMed PubMed Central Google Scholar
- 31.
Greig, S. L. Obiltoxaximab: первое глобальное одобрение. Наркотики 76 , 823–830 (2016).
CAS PubMed Google Scholar
- 32.
Carmo, C., Esteves, PJ, Ferrand, N. & van der Loo, W. Генетическая изменчивость хемокинового рецептора CCR5 у лепорид: изменение во 2-м внеклеточном домене путем преобразования гена с CCR2 в Oryctolagus , но не видов Sylvilagus и Lepus . Иммуногенетика 58 , 494–501 (2006).
CAS PubMed Google Scholar
- 33.
Abrantes, J. et al. Общее необычное генетическое изменение хемокинового рецептора типа 5 между Oryctolagus , Bunolagus и Pentalagus . Консерв. Genet 12 , 325–330 (2011).
CAS Google Scholar
- 34.
Lau, G., Labrecque, J., Metz, M., Vaz, R. & Fricker, S.P. Специфичность к ингибитору CCR5 обеспечивается ролью одного аминокислотного остатка ROLE OF ILE198. J. Biol. Chem. 290 , 11041–11051 (2015).
CAS PubMed PubMed Central Google Scholar
- 35.
Proost, P. et al. Посттрансляционные модификации влияют на активность хемотаксических белков моноцитов человека MCP-1 и MCP-2: идентификация MCP-2 (6–76) как природного ингибитора хемокинов. J. Immunol. 160 , 4034–4041 (1998).
CAS PubMed Google Scholar
- 36.
van der Loo, W., Afonso, S., de Matos, AL, Abrantes, J. & Esteves, PJ Псевдогенизация гена хемокина MCP 2 / CCL8 у европейского кролика (род Oryctolagus ), но не у видов Cottontail Rabbit ( Sylvilagus ) и Hare ( Lepus ). BMC Genet. 13 , 72 (2012).
PubMed PubMed Central Google Scholar
- 37.
van der Loo, W. et al. Адаптивная потеря гена? Отслеживание псевдогенизации хемокина Rabbit CCL8 . J. Mol. Эволюция 83 , 12–25 (2016).
Google Scholar
- 38.
Абрантес, Дж., Ван дер Лоо, В., Ле Пенду, Дж. И Эстевес, П. Дж. Геморрагическая болезнь кроликов (RHD) и вирус геморрагической болезни кроликов (RHDV): обзор. Вет. Res. 43 , 12 (2012).
PubMed PubMed Central Google Scholar
- 39.
Керр, П. Дж. Миксоматоз в Австралии и Европе: модель возникающих инфекционных заболеваний. Антивирь. Res. 93 , 387–415 (2012).
CAS PubMed Google Scholar
- 40.
Kerr, P.J. et al. Вирус миксомы и лепорипоксвирусы: эволюционная парадигма. Вирусы 7 , 1020–1061 (2015).
PubMed PubMed Central Google Scholar
- 41.
Le Gall-Reculé, G. et al. Обнаружение нового варианта вируса геморрагической болезни кроликов во Франции. Вет. Рек. 168 , 137–138 (2011).
PubMed Google Scholar
- 42.
Lopes, A. M. et al. Полный геномный анализ нового варианта вируса геморрагической болезни кроликов (RHDVb) выявил множественные события рекомбинации. J. Gen. Virol. 96 , 1309–1319 (2015).
CAS PubMed Google Scholar
- 43.
Chan, W. M. et al. Вирусы миксомы и осповакцины по-разному связываются с лейкоцитами человека. J. Virol. 87 , 4445–4460 (2013).
CAS PubMed PubMed Central Google Scholar
- 44.
Чан В. М. и Макфадден Г. Онколитические поксвирусы. Annu Rev. Virol. 1 , 119–141 (2014).
PubMed PubMed Central Google Scholar
- 45.
Lilly, C. L. et al. Онколитическая виротерапия ex-vivo с использованием вируса миксомы усиливает множественные аллогенные лейкоциты трансплантата костного мозга для усиления трансплантата по сравнению с опухолью. Мол. Ther. 4 , 31–40 (2017).
CAS Google Scholar
- 46.
Ruvoën-Clouet, N., Ganière, J.P., André-Fontaine, G., Blanchard, D. & Le Pendu, J. Связывание вируса геморрагической болезни кроликов с антигенами семейства гистокрови ABH. J. Virol. 74 , 11950–11954 (2000).
PubMed PubMed Central Google Scholar
- 47.
Ahmed, S. M. et al. Глобальная распространенность норовируса в случаях гастроэнтерита: систематический обзор и метаанализ. Lancet Infect.Дис. 14 , 725–730 (2014).
PubMed Google Scholar
- 48.
Тан, М. и Цзян, X. Антигены гисто-группы крови: общий никч для норовируса и ротавируса. Эксперт. Rev. Mol. Med. 16 , e5 (2014).
PubMed Google Scholar
- 49.
Ruvöen-Clouet, N., Belliot, G. & Le Pendu, J. Норовирусы и группы гистокрови: влияние генетических полиморфизмов общих хозяев на передачу и эволюцию вирусов. Rev. Med. Virol. 23 , 355–366 (2013).
PubMed Google Scholar
- 50.
Ле Пенду, Дж., Нистром, К. и Рувоэн-Клуэ, Н. Коэволюция патогена и хозяина и взаимодействия гликанов. Curr. Opin. Virol. 7 , 88–94 (2014).
PubMed Google Scholar
- 51.
Nyström, K. et al. Антигены гисто-группы крови действуют как факторы прикрепления вирусной инфекции геморрагической болезни кроликов в зависимости от штамма вируса. PLoS Pathog. 7 , e1002188 (2011).
PubMed PubMed Central Google Scholar
- 52.
Tuñón, M. J., Alvarez, M., Culebras, J. M. & González-Gallego, J. Обзор животных моделей для исследования патогенеза и терапевтических стратегий при острой печеночной недостаточности. World J. Gastroenterol. 15 , 3086–3098 (2009).
PubMed PubMed Central Google Scholar
- 53.
Vallejo, D. et al. Аутофагический ответ при геморрагической болезни кроликов, животная модель вирусно-индуцированной фульминантной печеночной недостаточности. Вет. Res. 45 , 15 (2014).
PubMed PubMed Central Google Scholar
- 54.
Tuñón, M. J. et al. Кардиотропин-1 способствует высокой выживаемости кроликов с летальным фульминантным гепатитом вирусного происхождения. J. Virol. 85 , 13124–13132 (2011).
PubMed PubMed Central Google Scholar
- 55.
Booth, L. et al. AR-12 подавляет множественные шапероны, одновременно стимулируя образование аутофагосом, коллективно предотвращая репликацию вируса. J. Cell Physiol. 231 , 2286–2302 (2016).
CAS PubMed PubMed Central Google Scholar
- 56.
Сан-Мигель, Б., Альварес, М., Culebras, J. M., González-Gallego, J. & Tuñón, M. J. N-ацетил-цистеин защищает печень от апоптотической гибели в животной модели молниеносной печеночной недостаточности. Апоптоз 11 , 1945–1957 (2006).
CAS PubMed Google Scholar
- 57.
Crespo, I. et al. Мелатонин предотвращает снижение активности антиоксидантных ферментов и активирует передачу сигналов фактора 2, связанного с ядерным эритроидом 2, в животной модели молниеносной печеночной недостаточности вирусного происхождения. J. Pineal Res. 49 , 193–200 (2010).
CAS PubMed Google Scholar
- 58.
Crespo, I. et al. Мелатонин подавляет сигнальный путь сфингозинкиназа 1 / сфингозин-1-фосфат у кроликов с молниеносным гепатитом вирусного происхождения. J. Pineal Res. 61 , 168–176 (2016).
CAS PubMed Google Scholar
- 59.
Le Gall-Reculé, G. et al. Появление нового лаговируса, связанного с вирусом геморрагической болезни кроликов. Вет. Res. 44 , 81 (2013).
PubMed PubMed Central Google Scholar
- 60.
Николс, Х. Дж. И Хью, У. Х. Демонстрация Spirochaeta pallida в спинномозговой жидкости. JAMA 60 , 108–110 (1913).
Google Scholar
- 61.
Магнусон, Х. Дж., Игл, Х. и Флейшман, Р. Минимальный инфекционный инокулят Spirochaeta pallida (штамм Николса) и рассмотрение скорости его размножения in vivo. Am. J. Syph. 32 , 1–18 (1948).
CAS PubMed Google Scholar
- 62.
Тернер Т. Б. и Холландер Д. Х. Биология трепонематозов. . (Всемирная организация здравоохранения, Женева, Швейцария, 1957 г.).
Google Scholar
- 63.
Селл, С. и Норрис, С. Дж. Биология, патология и иммунология сифилиса. Внутр. Rev. Exp. Патол. 24 , 203–276 (1983).
CAS PubMed Google Scholar
- 64.
Lithgow, K. V. et al. Определенный кандидат в вакцину от сифилиса подавляет распространение Treponema pallidum подвидов pallidum. Нат. Commun. 8 , 14273 (2017).
CAS PubMed PubMed Central Google Scholar
- 65.
Фитцджеральд Т. Дж. Экспериментальный врожденный сифилис у кроликов. Банка. J. Microbiol. 31 , 757–762 (1985).
CAS PubMed Google Scholar
- 66.
Фроберг, М. К., Фицджеральд, Т. Дж., Гамильтон, Т. Р., Гамильтон, Б.& Зараби, М. Патология врожденного сифилиса у кроликов. Заражение. Иммун. 61 , 4743–4749 (1993).
CAS PubMed PubMed Central Google Scholar
- 67.
Тантало, Л.С., Люкхарт, С.А. и Марра, С.М. Treponema pallidum Штамм-специфические различия в нейроинвазии и клиническом фенотипе на модели кролика. J. Infect. Дис. 191 , 75–80 (2005).
PubMed Google Scholar
- 68.
Schell, R.F., LeFrock, J.L., Chan, J.K., Bagasra, O. Модель сифилитической инфекции на хомяке LSH. Заражение. Иммун. 28 , 909–913 (1980).
CAS PubMed PubMed Central Google Scholar
- 69.
Wicher, K., Miller, J. N., Urquhart, A. W. & Wicher, V. Treponema pallidum -иммобилизирующие антитела при экспериментальном сифилисе морских свинок. Заражение. Иммун. 57 , 2900–2902 (1989).
CAS PubMed PubMed Central Google Scholar
- 70.
Gueft, B. & Rosahn, P. D. Экспериментальный сифилис мышей, критический обзор литературы. Am. J. Syph. 32 , 59–88 (1948).
CAS PubMed Google Scholar
- 71.
Giacani, L. et al. Антигенная изменчивость Treponema pallidum: разнообразие последовательностей TprK накапливается в ответ на иммунное давление во время экспериментального сифилиса. J. Immunol. 184 , 3822–3829 (2010).
CAS PubMed PubMed Central Google Scholar
- 72.
Molini, B.J. et al. Устойчивость к макролидам Treponema pallidum коррелирует с мутациями 23S рДНК в недавно выделенных клинических штаммах. Секс. Трансм. Дис. 43 , 579–583 (2016).
CAS PubMed PubMed Central Google Scholar
- 73.
Кэмерон К. Э. и Люкхарт С. А. Текущее состояние разработки вакцины от сифилиса: необходимость, проблемы, перспективы. Вакцина 32 , 1602–1609 (2014).
PubMed Google Scholar
- 74.
Koch, R. Die aetiologie der tuberkulose. Berl. Клин. Wochenschr. 19 , 221–230 (1882).
Google Scholar
- 75.
Лурье, М.B. Устойчивость к туберкулезу: экспериментальные исследования естественных и приобретенных защитных механизмов. (издательство Гарвардского университета, Кембридж, Массачусетс, США, 1964).
Google Scholar
- 76.
Mendez, S. et al. Восприимчивость к туберкулезу: состав туберкулезных гранулем у Thorbecke и аутбредных новозеландских белых кроликов. Вет. Иммунол. Immunopathol. 122 , 167–174 (2008).
CAS PubMed Google Scholar
- 77.
Каплан Г., Ценова Л. Туберкулез легких у кролика. В: Ф. Дж. Леонг, В. Дартуа, Т. Дик (ред.). Цветной атлас сравнительной гистопатологии туберкулеза легких. с. 107–130. (CRC Press, Бока-Ратон, Флорида, США, 2010 г.).
Google Scholar
- 78.
Флинн, Дж. Л., Ценова, Л., Иззо, А. и Каплан, Г. Экспериментальные модели туберкулеза на животных. В: С. Х. Э. Кауфманн, У. Дж. Бриттон (редакторы). Справочник по туберкулезу. с. 389–426. (Wiley-VCH Verlag GmbH & Co, Вайнхайм, Германия, 2008 г.).
Google Scholar
- 79.
Manabe, Y.C. et al. Аэрозольная кроличья модель латентного туберкулеза, реактивации и воспалительного синдрома восстановления иммунитета. Туберкулез 88 , 187–196 (2008).
CAS PubMed Google Scholar
- 80.
Liu, X. et al. Создание кроличьей модели туберкулеза позвоночника с использованием штамма Mycobacterium tuberculosis h47Rv. Jpn. J. Infect. Дис. 68 , 89–97 (2015).
PubMed Google Scholar
- 81.
Суббиан С., Каракусис П. и Каплан Г. Кроличья модель микобактериальных заболеваний. В: Х. Мукундан, М. А. Чемберс, Р. В. Уотерс, М. Х. Ларсен (ред.). Туберкулез, проказа и микобактериальные болезни человека и животных: многочисленные хозяева микобактерий. с. 402–418. (CABI, Оксфордшир, Великобритания, 2015 г.).
Google Scholar
- 82.
Ценова Л. и др. Вакцинация БЦЖ обеспечивает слабую защиту от вызванного M. tuberculosis HN878 заболевания центральной нервной системы. Вакцина 25 , 5126–5132 (2007).
CAS PubMed Google Scholar
- 83.
Данненберг, А. Дж. Кроличья модель туберкулеза. В: Б. Р. Блум (ред.). Туберкулез: патогенез, защита и борьба. с. 149–156. (ASM Press, Вашингтон, округ Колумбия, США, 1994).
Google Scholar
- 84.
Хелке К. Л., Манковски Дж. Л. и Манабе Ю. С. Модели кавитации на животных при туберкулезе легких. Туберкулез 86 , 337–348 (2006).
PubMed Google Scholar
- 85.
Via, L.E. et al. Туберкулезные гранулемы гипоксичны у морских свинок, кроликов и нечеловеческих приматов. Заражение. Иммун. 76 , 2333–2340 (2008).
CAS PubMed PubMed Central Google Scholar
- 86.
Manabe, Y.C. et al. Различные штаммы Mycobacterium tuberculosis вызывают различные спектры заболеваний в модели туберкулеза на кроликах. Заражение. Иммун. 71 , 6004–6011 (2003).
CAS PubMed PubMed Central Google Scholar
- 87.
Via, L.E. et al. Динамика инфекции и ответ на химиотерапию в модели туберкулеза на кролике с использованием позитронно-эмиссионной томографии [(1) (8) F] 2-фтор-дезокси-D-глюкозы и компьютерной томографии. Антимикробный. Агенты Chemother. 56 , 4391–4402 (2012).
CAS PubMed PubMed Central Google Scholar
- 88.
Kjellsson, M.C. et al. Фармакокинетическая оценка проникновения противотуберкулезных агентов в легочные поражения кроликов. Антимикробный. Агенты Chemother. 56 , 446–457 (2012).
CAS PubMed PubMed Central Google Scholar
- 89.
Лю П., Цзян, Х., Ли, С., Лин, З. и Цзян, Дж. Определение концентрации и распределения противотуберкулезного лекарственного средства из микросфер с замедленным высвобождением в позвонках модели спинального туберкулеза у кроликов. J. Orthop. Res. 35 , 200–208 (2017).
CAS PubMed Google Scholar
- 90.
Prideaux, B. et al. Связь между стерилизующей активностью и распространением лекарств при туберкулезе. Нат. Med. 21 , 1223–1227 (2015).
CAS PubMed PubMed Central Google Scholar
- 91.
Zumla, A. et al. Терапия инфекционных заболеваний, направленная на хозяина: текущее состояние, недавние успехи и перспективы на будущее. Lancet Infect. Дис. 16 , e47 – e63 (2016).
PubMed Google Scholar
- 92.
Суббиан, С.и другие. Ингибирование фосфодиэстеразы-4 в сочетании с лечением изониазидом кроликов с туберкулезом легких снижает активацию макрофагов и патологию легких. Am. J. Pathol. 179 , 289–301 (2011).
CAS PubMed PubMed Central Google Scholar
- 93.
Datta, M. et al. Лечение антисосудистым фактором роста эндотелия нормализует сосудистую сеть туберкулезной гранулемы и улучшает доставку малых молекул. Proc. Natl Acad. Sci. США 112 , 1827–1832 (2015).
CAS PubMed Google Scholar
- 94.
Данненберг, А. М. Младший. Перспективы клинических и доклинических испытаний новых противотуберкулезных вакцин. Clin. Microbiol. Ред. 23 , 781–794 (2010).
PubMed PubMed Central Google Scholar
- 95.
Converse, P.J. et al. Легочный туберкулез крупного рогатого скота у кроликов: бактериальная вирулентность, эффекты ингаляционных доз, чувствительность к туберкулину и иммунотерапия Mycobacterium vaccae. Clin. Диаг. Лаборатория. Иммунол. 5 , 871–881 (1998).
CAS PubMed PubMed Central Google Scholar
- 96.
Breitburd, F. et al. Иммунизация вирусоподобными частицами из вируса папилломы кролика (CRPV) может защитить от экспериментальной инфекции CRPV. J. Virol. 69 , 3959–3963 (1995).
CAS PubMed PubMed Central Google Scholar
- 97.
Кристенсен, Н. Д. Модельная система вируса папилломы кролика (CRPV) для тестирования противовирусных и иммунотерапевтических стратегий. Антивирь. Chem. Chemother. 16 , 355–362 (2005).
CAS PubMed Google Scholar
- 98.
Ху, Дж., Кладель, Н. М., Балог, К., Баджон, Л. и Кристенсен, Н. Д. Влияние генетических изменений на геном CRPV и их применение для изучения патогенеза in vivo. Вирусология 358 , 384–390 (2007).
CAS PubMed Google Scholar
- 99.
Maglennon, G. A., McIntosh, P. & Doorbar, J. Устойчивость вирусной ДНК в базальном слое эпителия предлагает модель латентного периода папилломавируса после иммунной регрессии. Вирусология 414 , 153–163 (2011).
CAS PubMed PubMed Central Google Scholar
- 100.
Hu, J. et al. Модель HLA-A2.1-трансгенного кролика для изучения иммунитета к папилломавирусной инфекции. J. Immunol. 177 , 8037–8045 (2006).
CAS PubMed Google Scholar
- 101.
Биениас, П. Д. и Каллен, Б.R. Множественные блоки репликации вируса иммунодефицита человека 1 типа в клетках грызунов. J. Virol. 74 , 9868–9877 (2000).
CAS PubMed PubMed Central Google Scholar
- 102.
Коэн, Дж. Построение модели СПИДа на мелких животных, блок за блоком. Наука 293 , 1034–1036 (2001).
CAS PubMed Google Scholar
- 103.
Keppler, O.T. et al. Прогресс в создании модели трансгенных крыс CD4 / CCR5 человека для заражения de novo вирусом иммунодефицита человека типа 1. J. Exp. Med. 195 , 719–736 (2002).
CAS PubMed PubMed Central Google Scholar
- 104.
Michel, N. et al. Экспрессия человеческого циклина Т1 улучшает специфическое для Т-клеток ограничение транскрипции ВИЧ у трансгенных крыс, но этого недостаточно для распространения инфекции прототипных штаммов ВИЧ-1 R5 ex vivo. Ретровирология 6 , 2 (2009).
PubMed PubMed Central Google Scholar
- 105.
Кутино-Могуэл Т. и Фассати А. Фенотипический рецессивный пост-входной блок в клетках кролика, который приводит к аберрантному перемещению ВИЧ-1. Трафик 7 , 978–992 (2006).
CAS PubMed PubMed Central Google Scholar
- 106.
Schaller, T., Hue, S. & Towers, G.J. Активный белок TRIM5 у кроликов указывает на общего противовирусного предка белков TRIM5 млекопитающих. J. Virol. 81 , 11713–11721 (2007).
CAS PubMed PubMed Central Google Scholar
- 107.
Терво, Х. М. и Кепплер, О. Т. Высокая естественная проницаемость первичных клеток кролика для ВИЧ-1 с дефектом вирионной инфекционности в макрофагах в качестве конечного репликационного барьера. J. Virol. 84 , 12300–12314 (2010).
CAS PubMed PubMed Central Google Scholar
- 108.
Goffinet, C. et al. Антагонизм CD317 к ВИЧ-1 является видоспецифичным и включает Vpu-опосредованную протеасомную деградацию фактора рестрикции. Клеточный микроб-хозяин 5 , 285–297 (2009).
CAS PubMed Google Scholar
- 109.
Ikeda, T. et al. Антиретровирусная активность дезаминазы APOBEC1 мелких видов животных. Nucleic Acids Res. 36 , 6859–6871 (2008).
CAS PubMed PubMed Central Google Scholar
- 110.
Zhang, J. X., Diehl, G. E. & Littman, D. R. Снятие прединтеграционного ингибирования и характеристика дополнительных блоков репликации ВИЧ в первичных Т-клетках мыши. PLoS ONE 3 , e2035 (2008 г.).
PubMed PubMed Central Google Scholar
- 111.
Speck, R.F. et al. Клетки кролика, экспрессирующие человеческий CD4 и человеческий CCR5, обладают высокой проницаемостью для инфицирования вирусом иммунодефицита человека типа 1. J. Virol. 72 , 5728–5734 (1998).
CAS PubMed PubMed Central Google Scholar
- 112.
Guo, R. et al. Получение и оценка кроликов и коз, нокаутированных по миостатину, с использованием системы CRISPR / Cas9. Sci. Отчет 6 , 29855 (2016).
CAS PubMed PubMed Central Google Scholar
- 113.
Yang, D. et al. Идентификация и характеристика кроличьей ROSA26 для нокаута и стабильной экспрессии репортерного гена. Sci. Отчет 6 , 25161 (2016).
CAS PubMed PubMed Central Google Scholar
- 114.
Torrents de la Peña, A. et al. Иммуногенность у кроликов тримеров SOSIP из клад A, B и C, вводимых индивидуально, последовательно или в комбинациях. J. Virol. 92 , JVI.01957–17 (2018).
Google Scholar
- 115.
Sanders, R. W. et al. ВАКЦИНЫ от ВИЧ-1. Нейтрализующие антитела к ВИЧ-1, индуцированные нативными тримерами оболочки. Наука 349 , aac4223 (2015).
PubMed PubMed Central Google Scholar
- 116.
Beddows, S. et al. Сравнительное исследование иммуногенности на кроликах дисульфид-стабилизированного, протеолитически расщепленного, растворимого тримерного вируса иммунодефицита человека типа 1gp140, тримерного дефектного по расщеплению gp140 и мономерного gp120. Вирусология 360 , 329–340 (2007).
CAS PubMed Google Scholar
- 117.
Zhang, P. F. et al. Нейтрализующие антитела против ВИЧ-1 с широкой перекрестной реакцией, индуцированные иммунизацией gp140. Proc. Natl Acad. Sci. США. 104 , 10193–10198 (2007).
CAS PubMed Google Scholar
- 118.
Dong, M. et al. Индукция первичных перекрестно-реактивных антител, нейтрализующих вирус иммунодефицита человека типа 1, у мелких животных с использованием системы экспрессии in vivo, полученной из альфавируса. J. Virol. 77 , 3119–3130 (2003).
CAS PubMed PubMed Central Google Scholar
- 119.
Kulp, D. W. et al. Конструирование на основе структуры нативных тримеров оболочки ВИЧ-1 для подавления ненейтрализующих эпитопов и устранения связывания CD4. Нат. Commun. 8 , 1655 (2017).
PubMed PubMed Central Google Scholar
- 120.
Ло, М., Кардосо, Р. М., Уилсон, И. А. и Бертон, Д. Р. Антигенное и иммуногенное исследование антигенов gp120 с привитыми проксимальной мембраной внешней областью с помощью стратегии иммунизации первичным белком ДНК. J. Virol. 81 , 4272–4285 (2007).
CAS PubMed PubMed Central Google Scholar
- 121.
Richmond, J. F. L. et al. Скрининг гликопротеинов Env ВИЧ-1 на способность повышать нейтрализующие антитела с использованием иммунизации ДНК и усиления рекомбинантным вирусом осповакцины. Вирусология 230 , 265–274 (1997).
CAS PubMed Google Scholar
- 122.
Lu, S. et al. Иммуногенность ДНК-вакцин, экспрессирующих гликопротеин оболочки вируса иммунодефицита человека типа 1 с делециями в областях V1 / 2 и V3 и без них. AIDS Res. Гм. Ретровир. 14 , 151–155 (1998).
CAS PubMed Google Scholar
- 123.
Wang, S. et al. Повышенная иммуногенность белка gp120 в сочетании с праймингом рекомбинантной ДНК для создания антител, которые нейтрализуют первичный изолят JR-FL вируса иммунодефицита человека 1 типа. J. Virol. 79 , 7933–7937 (2005).
CAS PubMed PubMed Central Google Scholar
- 124.
Vaine, M. et al. Улучшенная индукция антител против ключевых нейтрализующих эпитопов с помощью буст-вакцинации первичным белком gp120 вируса иммунодефицита человека типа 1 по сравнению с вакцинацией только белком gp120. J. Virol. 82 , 7369–7378 (2008).
CAS PubMed PubMed Central Google Scholar
- 125.
Vaine, M., Wang, S., Hackett, A., Arthos, J. & Lu, S. Ответы антител, вызванные гомологичной или гетерологичной первичной буст-вакцинацией ДНК и белком, различаются по функциональной активности и авидности. Вакцина 28 , 2999–3007 (2010).
CAS PubMed PubMed Central Google Scholar
- 126.
Vaine, M. et al. Два близкородственных антигена Env от одного и того же пациента вызывали разные спектры нейтрализующих антител против гетерологичных изолятов ВИЧ-1. J. Virol. 85 , 4927–4936 (2011).
CAS PubMed PubMed Central Google Scholar
- 127.
Chen, Y. et al. Новая платформа кроличьих моноклональных антител для анализа разнообразного репертуара эпитопов антител для создания иммуногена Env ВИЧ-1. J. Virol. 87 , 10232–10243 (2013).
CAS PubMed PubMed Central Google Scholar
- 128.
Pan, R. et al. Кроличьи моноклональные антитела против ВИЧ-1, полученные в результате иммунизации, могут имитировать способы связывания антигена антител, полученных от людей, инфицированных ВИЧ-1. J. Virol. 87 , 10221–10231 (2013).
CAS PubMed PubMed Central Google Scholar
- 129.
Pan, R. et al. Структурный анализ нового кроличьего моноклонального антитела R53, нацеленного на эпитоп в области C4 gp120 ВИЧ-1, критической для связывания рецептора и корецептора. Emerg. Microb. Заразить. 4 , e44 (2015).
CAS Google Scholar
- 130.
Лю С., Ван С. и Лу С. ДНК-иммунизация как технологическая платформа для индукции моноклональных антител. Emerg. Microb. Заразить. 5 , e33 (2016).
CAS Google Scholar
- 131.
Srivastava, R. et al. Бессимптомные эпитопы человека, идентифицированные из тегументного белка вируса простого герпеса vp13 / 14 (ul47), преимущественно вызывают полифункциональные эффекторные клетки памяти cd44high cd62llow cd8 + tem и защищают гуманизированных трансгенных мышей hla-a * 02: 01 от инфекции глазного герпеса. J. Virol. 91 , e01793–16 (2017).
CAS PubMed PubMed Central Google Scholar
- 132.
Srivastava, R. et al. CXCL10 / CXCR3-зависимая мобилизация hsv-специфических клеток cd8 + tem и cd8 + trm в инфицированных тканях обеспечивает эффективную защиту от рецидивирующей герпетической инфекции и заболевания. J. Virol. 91 , e00278–17 (2017).
PubMed PubMed Central Google Scholar
- 133.
Несберн, А. Б. и Бен Мохамед, Л. Дань уважения профессору Стивену Л. Векслеру (1948-2016): человеку и ученому. Curr. Eye Res. 42 , 161–162 (2017).
PubMed Google Scholar
- 134.
Налбандян А. и др. Активация инфламмасомы NLRP3 связана с валозин-содержащей белковой миопатией. Воспаление 40 , 21–41 (2017).
CAS PubMed PubMed Central Google Scholar
- 135.
Хан, А.А. и др. Увеличение числа и функции ВПГ-1-специфичных CD8 + эффекторных Т-клеток памяти и резидентных Т-клеток памяти в латентно инфицированных ганглиях тройничного нерва снижает рецидивирующую инфекцию и заболевание глазным герпесом. J. Immunol. 199 , 186–203 (2017).
CAS PubMed PubMed Central Google Scholar
- 136.
Dasgupta, G. & BenMohamed, L. Мышей, а не людей: насколько надежны животные модели для оценки кандидатов на иммунотерапевтические вакцины на основе CD8 (+) - Т-клеточных эпитопов герпеса? Вакцина 29 , 5824–5836 (2011).
CAS PubMed PubMed Central Google Scholar
- 137.
Chentoufi, A. A. et al. Новая модель трансгенного кролика HLA (HLA-A * 0201) для доклинической оценки вакцин против глазного герпеса на основе CD8 + Т-клеточного эпитопа человека. J. Immunol. 184 , 2561–2571 (2010).
CAS PubMed PubMed Central Google Scholar
- 138.
Srivastava, R. et al. Ген транскрипта, ассоциированного с латентным периодом вируса простого герпеса, связан с более широким репертуаром вирус-специфических истощенных CD8 + Т-клеток, удерживаемых в ганглиях тройничного нерва латентно инфицированных трансгенных кроликов hla. J. Virol. 90 , 3913–3928 (2016).
CAS PubMed PubMed Central Google Scholar
- 139.
Perng, G.C. et al. Большое количество реактивированного вируса в слезах предшествует рецидивирующему стромальному кератиту герпеса у стрессированных кроликов, латентно инфицированных вирусом простого герпеса. Curr. Eye Res. 41 , 284–291 (2016).
CAS PubMed Google Scholar
- 140.
Jester, J. V. et al. Конфокальный микроскопический анализ модели глаза кролика с высокой частотой рецидивирующего стромального кератита герпеса. Роговица 35 , 81–88 (2016).
PubMed PubMed Central Google Scholar
- 141.
Шривастава, Р.и другие. Бессимптомные Т-клеточные эпитопы CD8 вируса простого герпеса типа 1 защищают от глазного герпеса в модели «гуманизированного» трансгенного кролика HLA. IOVS 194 , 2232–2248 (2015).
CAS Google Scholar
- 142.
Srivastava, R. et al. Вакцина на основе бессимптомных CD8 + Т-клеточных эпитопов человека вируса простого герпеса типа 1 защищает от глазного герпеса на «гуманизированной» HLA-трансгенной модели кролика. Инвест.Офтальмол. Vis. Sci. 56 , 4013–4028 (2015).
CAS PubMed PubMed Central Google Scholar
- 143.
Хан А.А. и др. Терапевтическая иммунизация смесью "бессимптомных" эпитопов CD8 + Т-клеток человека, полученных из гликопротеина D вируса простого герпеса 1, снижает спонтанное выделение глаз у латентно инфицированных трансгенных кроликов HLA: связь с низкой частотой локальных PD-1 + TIM-3 + CD8 + исчерпана Т-клетки. J. Virol. 89 , 6619–6632 (2015).
CAS PubMed PubMed Central Google Scholar
Потенциальный атипичный случай геморрагической болезни кролика у карликового кролика.
Геморрагическая болезнь кроликов (ГБК) - очень заразное инфекционное заболевание европейских диких и домашних кроликов. Вирус геморрагической болезни кроликов (RHDV, GI.1) появился в 1986 году в Европе и быстро распространился по всему миру. Со временем было обнаружено несколько генотипов RHDV, но в 2010 году появился новый вирус (RHDV2 / RHDVb, GI.2) возникли и постепенно заменили предыдущие штаммы RHDV из-за отсутствия перекрестного иммунитета между RHDV и RHDV2. RHDV2 имеет высокую частоту мутаций, как и другие каливирусы, и рекомбинирует со штаммами RHDV и непатогенного калицивируса (GI.4), обеспечивая непрерывное появление новых полевых штаммов. Хотя это представляет угрозу для уже находящихся под угрозой исчезновения европейских видов кроликов, доступные вакцины против RHDV2 и соблюдение мер биобезопасности, похоже, контролируют инфекцию в кролиководстве. Домашние кролики, особенно при содержании в помещении, считаются подверженными более низкому риску инфекций. хотя RHDV2 и вирус миксомы (MYXV) представляют собой постоянную угрозу из-за передачи через насекомых.Поэтому вакцинация против этих вирусов рекомендуется каждые 6 месяцев (миксоматоз) или ежегодно (геморрагическая болезнь кроликов). Комбинированная иммунизация против миксоматоза и RHDV с помощью коммерчески доступной бивалентной вакцины с антигеном RHDV широко используется (Nobivac Myxo-RHD, MSD, Кенилворт, Нью-Джерси, США). Однако эта вакцина не обеспечивает должной защиты от RHDV2, поэтому необходимо обновить протокол клинической вакцинации кроликов. Здесь мы сообщаем о клиническом случае гепатита и нарушения свертывания крови у домашнего кролика, который был вакцинирован коммерчески доступной бивалентной вакциной против RHDV и после смерти дал положительный результат на RHDV2.У животного развилось затяжное и атипичное заболевание, совместимое с RHD. Вирус был идентифицирован как рекомбинантный штамм RHDV2 со структурной основой RHDV2 (GI.2) и неструктурными генами непатогенных штаммов A1 (RCV-A1, GI.4). Хотя подтверждение этиологического агента было сделано только после смерти, клинические признаки и аналитические данные очень наводили на мысль о RHD.Список литературы
PubMed
Оценка безопасности рекомбинантного вируса миксомы-RHDV, индуцирующего горизонтальную трансмиссивную защиту от миксоматоза и геморрагической болезни кроликов
рисков введения вакцины в разнообразном диапазоне
ситуаций, которые могут возникнуть, если рекомбинантный вирус
используется для крупномасштабных ® иммунизация кроликов в полевых условиях.
Что касается дозировки вакцины и возможности случайного введения
передозировки, результаты
продемонстрировали безопасность вакцины даже при 100-кратной передозировке
(10
6
БОЕ) (рис.1, таблица). 2).
Оценка воздействия вакцины на
кроликов с ослабленным иммунитетомкроликов считалась актуальной, учитывая заболеваемость
индивидуумов с ослабленным иммунитетом из-за
инфекций, вызванных экологическими или генетическими причинами.По этой причине
мы исследовали эффект введения вакцины
на кроликах, получавших преднизолон, мощный иммунный супрессор
. Это лечение вызывает истощение контуров эозинофилов и мононуклеарных клеток, вызывая
сильного снижения Т-клеточного ответа с незначительным воздействием только на
на функцию В-клеток [29]. Это обычно используемая процедура
для оценки безопасности ветеринарных вакцин
[30 - 32].Результаты показали, что кролики, получавшие преднизолон
, проявляли симптомы, аналогичные симптомам
, наблюдаемым у контрольных кроликов (фиг. 2, таблица 3). Единственное замечательное наблюдение
состояло в том, что кролики
с подавленным иммунитетом демонстрировали тонкую тенденцию к задержке разрешения локальных поражений: 16 ± 18 точек на дюйм против 15 точек на дюйм (рис. 2).
Еще одним важным аспектом, который рассматривался, было влияние инфицирования вирусом
6918VP60-T2 на репродуктивную функцию. Результаты
показали, что инокуляция рекомбинантного вируса
не изменила параметры репродукции, и ни один из кроликов
, рожденных от вакцинированных самок, не показал клинических признаков, связанных с миксоматозом-
(Таблица 4).В заключение, полученные общие результаты
демонстрируют заметное отсутствие
побочных эффектов, связанных с рекомбинантным вирусом,
независимо от дозы, пути или стадии жизненного анамнеза людей
человек (т.е. новорожденные, молодые, беременная или иммунизированная
без компромиссов).
Наконец, была проанализирована биологическая стабильность рекомбинантного вируса
. Выделение в окружающую среду рекомбинантного вируса 6918VP60-T2
потребовало бы определенного количества последовательных пассажей в его естественном хозяине, даже
, когда эта возможность, казалось, ограничивалась только двумя последовательными пассажами
в лабораторных условиях [25]. ].
Если будет тенденция к эволюции вируса до вирулентного состояния
, серийное проникновение на кроликах приведет к такому развитию вируса
. Соответственно, биологическая стабильность
6918VP60-T2 была изучена путем проведения 10 серийных пассажей вируса
на кроликах, и полученные результаты
(рис. 3, таблица 5) указали на то, что рекомбинантный вирус сохранился в основном. те же биологические характеристики
через ходы.Таким образом, ослабленный характер
6918VP60-T2 кажется стабильным признаком. С другой стороны, генетический анализ показал, что ген VP60
оставался стабильно интегрированным в геном MV после серийного пассажа
у кроликов, что согласуется с опубликованными до
результатами, полученными после 15 серийных пассажей.
шалфея вируса 6918VP60-T2 в монослоях клеток RK-13
[25].
На основе результатов, ранее опубликованных
[24,25] и представленных в этой статье, а также экспериментальных данных
, касающихся дальнейшей безопасности и проблем e-
(будут опубликованы в другом месте), рекомбинированный -
nant 6918VP60-T2 прошел процедуру обязательной оценки риска
в отношении выпуска
генетически модифицированных организмов.Ограниченное испытание
®eld, санкционированное компетентным органом Испании
®, находится в процессе. Это испытание будет оценивать эффективность
и безопасность вакцины в контролируемых условиях в полевых условиях с точки зрения ее использования в крупномасштабной программе
для борьбы с миксоматозом и RHD
среди диких животных. популяции кроликов.
Благодарности
Эта работа была поддержана соглашением между
Фондом
Ân para el Estudio y Defensa de la Nat-
uraleza y la Caza (FEDENCA) и Национальным институтом
de Investigacio
Ân y Tecnologõ
Âa Agraria y Ali-
mentaria '' (INIA).
Ссылки
[1] Мерфи, Ф.А., Фоке, С.М., Бишоп, DHL, Габриал, С.А.,
Джарвис, А.В., Мартелли, Г.П., Мейо, Массачусетс, М.А., Саммерс, Мэриленд, вирус
таксономия: classi® катион и номенклатура вирусов. Шестой отчет Международного комитета по таксономии
вирусов
. Arch. Virol. 1995; 10 (Приложение): 586 с. Вена,
Springer-Verlag.
[2] Феннер Ф., Росс Дж. Миксоматоз. В: Thompson HV, King CM,
редакторы.Европейский кролик. История и биология успешного колонизатора
. Оксфорд: Издательство Оксфордского университета, 1994. стр.
205 ± 40.
[3] Керр П.Дж., Best SM. Вирус миксомы у кроликов. Rev Sci Tech O
Int Epiz 1998; 17: 256 ± 68.
[4] Феннер Ф, Woodroofe GM. Защита лабораторных кроликов
от миксоматоза путем вакцинации вирусом брома. Aust J
exp Biol Med Sci 1954; 32: 653.
[5] Saurat P, Gilbert Y, Ganie
Áre JP.Etude d'une souche de virus
myxomateux modi®e. Rev Med Vet 1978; 129: 415 ± 51.
[6] Лю SJ, Xue HP, Pu BQ, Qian SH. Новое вирусное заболевание в раб-
бит. Anim Husb Vet Med 1984; 16: 253 ± 5.
[7] Morise JP, Le Gall G, Boilleot E. Гепатит вирусного происхождения у
leporidae: введение и этиологические гипотезы. Ред. Sci
Tech O Int Epiz 1991; 10: 283 ± 95.
[8] Олингер В.Ф., Тиль Х.Дж. Геморрагическая болезнь кроликов (RHD):
характеристика возбудителя калицивируса.Vet Res
1993; 24: 103 ± 16.
[9] Вильяфуэрте Р., Кальвете С., Бланко Дж. К., Люсьентес Дж. Заболеваемость
вирусных геморрагических заболевания в популяциях диких кроликов в Испании.
Mammalia 1995; 59: 651 ± 9.
[10] Чейзи Д. Геморрагическая болезнь кроликов: новое бедствие
Oryctolagus cuniculus. Lab Anim 1997; 31: 33 ± 44.
[11] Маршандо С., Шанталь Дж., Портеджуа И., Барро С., Шаваль Ю.
Воздействие вирусной геморрагической болезни на дикую популяцию
европейских кроликов во Франции.Дж. Уайлдл Дис 1998; 34: 429 ± 35.
[12] Муце Дж., Кук Б., Александр П. Первоначальное воздействие геморрагической болезни кроликов
на популяции европейских кроликов в Южной
Австралии. Дж. Уайлдл Дис 1998; 34: 221 ± 7.
J.M. Torres et al. / Вакцина 19 (2001) 174 ± 182 181
Вакцины | Бесплатный полнотекстовый | Кодируемый вирусом миксомы белок диапазона хозяев M029: Многофункциональный антагонист, нацеленный на множественные антивирусные пути хозяина и врожденные иммунные пути
Индуцированная IFN дцРНК-зависимая протеинкиназа (PKR) является важным компонентом врожденного иммунитета хозяина против вирусной инфекции, репликации и распространения.PKR - серин-треониновая киназа, состоящая из двух N-концевых дцРНК-BD и С-концевого киназного домена [65]. Было показано, что обработанные IFN и инфицированные VACV клетки обладают блоком трансляции вирусных и клеточных мРНК [66,67]. Этот блок в синтезе белка был связан с продукцией дцРНК VACV и последующей активацией PKR [68,69,70]. Помимо вирусной дцРНК, PKR также активируется из-за различных клеточных стрессов [71]. В присутствии адекватного стимула активация PKR и аутофосфорилирование приводит к фосфорилированию альфа-субъединицы фактора инициации трансляции 2 эукариот (eIF2α), что в конечном итоге активирует отключение глобального синтеза белка и индукцию апоптоза [72].Среди многих других клеточных функций PKR также играет роль в передаче сигналов и контроле транскрипции через путь IκB / NF-κB [73,74]. Многие патогены, включая вирусы, кодируют белки, которые напрямую взаимодействуют с PKR или различными аспектами сигнального пути PKR, чтобы остановить этот процесс [75,76,77]. Белки E3, кодируемые поксвирусом, не только секвестрируют дцРНК, но также ингибируют PKR путем прямого взаимодействия, что приводит к образованию гетеродимеров [63,69] (Рисунок 2). Тот факт, что PKR является ключевой мишенью для белков-ортологов E3, подтверждается наблюдениями, что дефект репликации E3L-нокаут-вирусов может быть устранен с использованием клеточных линий со сниженной экспрессией PKR или без нее [78].Это было показано на множественных поксвирусах, лишенных экспрессии ортологов E3 [47,48,78]. Отсутствие PKR восстанавливало вирусный поздний синтез белка и образование потомства вируса в клеточных линиях, где мутантные поксвирусы E3L не могли реплицироваться. Например, нокдаун или нокаут PKR восстанавливали репликацию MYXV в линиях клеток человека в отсутствие M029 [47]. Аналогичные результаты были получены и для вируса ECTVΔE3L [48]. Для ингибирования PKR необходимы как N-, так и C-концевые домены белка E3 [63].Хотя предыдущие исследования показали, что ингибирование PKR и взаимодействие с dsRNA тесно связаны, подробные исследования мутаций E3 показали, что эти две функции белка E3 могут быть разделены [64]. В случае MYXV-M029 и MPXV-F3, где отсутствует полный или частичный N-концевой домен E3, исследования делеций и мутаций в этих белках могут дополнительно пролить свет на роль домена дцРНК и соседних последовательностей в ингибировании PKR. Поскольку PKR является ключевой мишенью ортологов белка E3, способность ингибировать PKR различных видов часто определяет клеточный тропизм поксвирусов in vitro [79,80].Ингибирование PKR также имеет решающее значение для регуляции IFN типа I и провоспалительных цитокинов, участвующих в активации врожденных иммунных ответов [30,81]. Что касается VACV, то на клетках A549 человека было продемонстрировано, что нокаут как путей PKR, так и RNase L полностью спасает репликацию мутантного вируса E3, предполагая, что оба этих пути успешно ингибируются VACV [82]. In vivo, мыши C57BL / 6 с единичным нокаутом по PKR и РНКазе L показали более быстрое и усиленное заболевание, даже при более низкой дозе WT-VACV и более высокой дозе вируса VACVΔE3L [46].Эти результаты еще раз подтвердили, что PKR и РНКаза L являются ключевой мишенью для репликации и патогенеза поксвируса. Помимо E3, ортологи белка K3, кодируемого поксвирусом (M156 в MYXV), гомолог eIF2α, действуют как псевдосубстрат для PKR, чтобы ингибировать активацию PKR [83].Вакцины на основе вирусоподобных частиц для вирусных инфекций животных
ВведениеВакцинация считается наиболее экономически эффективным способом борьбы с патогенами и предотвращения заболеваний как в области медицины, так и в ветеринарии. В настоящее время большинство лицензированных вакцин для животных представляют собой живые аттенуированные или убитые вакцины, разработанные с использованием обычных технологий.Тем не менее, новые субъединичные вакцины все больше укрепляются в ветеринарной вакцинологии, и среди них вирусоподобные частицы (VLP) представляют собой один из наиболее привлекательных подходов1 благодаря своим внутренним иммуногенным свойствам, а также высокому профилю безопасности, отмеченному несколькими обзоры появились за последние десять лет.1–13
Вакцины на основе вирусоподобных частицVLP-вакцины сочетают в себе многие преимущества цельновирусных вакцин и рекомбинантных субъединичных вакцин, объединяя ключевые особенности, которые лежат в основе их иммуногенности, безопасности и защитного потенциала ( Инжир.1): (а) дисперсный и многовалентный характер, (б) четко определенная геометрия и замечательная однородность с повторяющимися и упорядоченными поверхностными структурами, (в) сохранение нативной антигенной конформации, (г) безопасность, поскольку они абсолютно неинфекционны и не реплицирующиеся кандидаты, (e) более высокая стабильность, чем растворимые антигены в экстремальных условиях окружающей среды, (f) применимость в качестве векторов для презентации чужеродных антигенов, лигандов или лекарств, (g) соответствие требованиям Дифференциации инфицированных от вакцинированных животных (DIVA) - проблемы соблюдения.
VLPs представляют собой супрамолекулярные группы с четко определенной геометрией, обычно икосаэдры или стержневидные структуры, с диаметрами в диапазоне 25–100 нм14, которые имитируют общую структуру нативных вирионов. Эти белковые клетки основаны на естественной внутренней способности многих типов структурных вирусных субъединиц, часто основных белков в капсиде или оболочке, спонтанно самоорганизовываться в VLP при экспрессии с использованием рекомбинантных систем экспрессии.13 Они состоят из нескольких копий одной или больше вирусных белков и обычно антигенно неотличимы от инфекционных вирусов или субвирусных частиц.1
Многовалентный дисплей и высокоупорядоченная структура VLP составляют патоген-ассоциированные мотивы молекулярного паттерна (PAMP). Поскольку эти мотивы, в общем и целом, уникальны для микробных антигенов, иммунная система млекопитающих эволюционировала, чтобы энергично реагировать на такое расположение антигенов. PAMP запускают механизмы восприятия врожденного иммунитета3 и могут распознаваться Toll-подобными рецепторами (TLR), а также другими рецепторами распознавания образов (PRR), которые присутствуют в клетках-хозяевах. Кроме того, из-за их очень повторяющейся поверхности было показано, что VLP вызывают сильные В-клеточные ответы, эффективно сшивая связанные с мембраной молекулы иммуноглобулина, которые составляют рецептор В-клеток.15 Стимуляция В-клеток VLP в некоторых случаях бывает достаточно сильной, чтобы вызвать независимую от Т-клеток индукцию антител IgM. Следовательно, есть примеры VLP, действующих как независимые от Т-клеток B-клеточные антигены.16-19 Кроме того, PAMP могут также стимулировать захват антигена антигенпрезентирующими клетками (APC) и последующую презентацию антигенов клеткам адаптивного иммунного ответа. Помимо свойства PAMP, их характер и размеры в виде частиц влекут за собой VLP, но не их белковые субъединицы, которые могут эффективно поглощаться APC, в частности дендритными клетками (DC).Поглощение антигенов APC зависит от различных свойств, включая размер, форму, поверхностный заряд и т. Д., И размер антигена является ключевым фактором. APC способны поглощать антигены с размерами, подобными патогену (от 20 нм до 3 мкм) 5,20, и было продемонстрировано, что DC оптимально поглощают антигены с диаметром приблизительно 40 нм 21,22 только в пределах диапазона размеров VLP. Тот факт, что VLP обладают общими подходящими характеристиками для их захвата DC и последующего процессинга и представления путями MHC-II и MHC-I (кросс-презентация), привел к описанию VLP как «самоадъювантных» систем доставки иммуногена.9,10,23,24 Однако это утверждение следует смягчить тем фактом, что некоторые вакцины-кандидаты на основе VLP требуют составления с мощными адъювантами для того, чтобы вызывать эффективные иммунные ответы, что указывает на относительную способность различных типов VLP вызывать различные На ветви иммунного ответа влияет ряд факторов, которые являются специфическими для VLP.25,26
В целом, VLPs, как было показано, стимулируют сильные B-клеточные иммунные ответы и могут быть высокоэффективными при стимуляции пролиферации CD4 + T-клеток. ответы и ответы цитотоксических Т-лимфоцитов (CTL) 27–30 - фундаментальная цель любой вакцины.Иммунная система имеет несколько механизмов для надежного ответа на вирусные частицы 10,31, которые могут использоваться вакцинами на основе VLP. На практике это означает, что более низкие дозы антигена по сравнению с мономерными антигенными вакцинами достаточны для того, чтобы вызвать подобный защитный ответ. Это соображение особенно важно в случае ветеринарных вакцин, где стоимость вакцины должна быть сопоставлена со стоимостью вакцинированного животного.
С точки зрения безопасности тот факт, что в VLP отсутствуют какие-либо вирусные нуклеиновые кислоты, полностью устраняет любые риски, связанные с процессами репликации, инсерции, реверсии, рекомбинации или повторной сортировки вирусов.Вакцины на основе VLP могут быть получены без необходимости размножения патогенных вирусов с использованием различных систем экспрессии.32,33 Следовательно, возникают проблемы безопасности, связанные с производством и введением цельновирусной вакцины, связанные с утечкой вируса из производственных объектов, появлением реверсивных мутантов или эффекты у лиц с ослабленным иммунитетом устраняются.1
Как сообщалось ранее, 11 VLP были произведены для широкого ряда таксономически и структурно различных вирусов, которые инфицируют людей и других животных, 3,34–37, а также вирусы растений.38-40 К ним относятся вирусы, которые имеют один белок капсида, несколько белков капсида, а также вирусы с липидными оболочками и без них, что указывает на то, что способность к развитию VLP, по-видимому, не ограничивается каким-либо типом семейства вирусов или сложностью вирусов. вирусная частица. VLP, полученные из вирусов с липидной оболочкой, таких как вирус гриппа, иногда называют виросомами и состоят из однослойных липосом, несущих белки вирусной оболочки.41
В дополнение к их пригодности в качестве вакцины против гомологичного вируса, из которого они происходят. полученные VLP могут также использоваться в качестве платформ для индукции иммунных ответов против выбранных антигенов, дальнейшего усиления и расширения их потенциального использования как в качестве профилактических, так и терапевтических вакцин.Слабый иммунный ответ многих растворимых антигенов можно преодолеть, сделав их очень повторяющимися в одной частице. Это может быть достигнуто путем включения антигенных эпитопов в VLP путем генетического слияния (химерные VLP) или путем конъюгирования антигенов с VLP.
Развитие методов инженерии рекомбинантной ДНК в сочетании с огромным количеством информации о вирусной структуре с высоким разрешением облегчило возможность сознательной модификации VLP, так что они могут функционировать по существу как молекулярные каркасы для презентации генетически встроенных чужеродных антигенов.VLP, полученные из двух- и одноцепочечных ДНК и РНК вирусов, охватывающих 14 различных семейств вирусов, были успешно использованы для производства химерных VLP. 10,35,42
Альтернативный подход для отображения антигенов на поверхности VLP. представляет собой использование модульных систем, в которых нативные VLP и антиген-мишень синтезируются отдельно, а затем конъюгируются in vitro ковалентно или нековалентно, связывая антиген с поверхностью предварительно собранных VLP.43 Методы конъюгации основаны на присутствии адресуемые фрагменты на поверхности VLP.При необходимости, VLP могут быть сконструированы таким образом, чтобы они содержали полезные сайты прикрепления на поверхности частиц.44,45 Преимущество этого подхода состоит в том, что размер и структура рекомбинантных антигенов-мишеней не ограничиваются требованиями для правильного сворачивания VLP. мономеры и сборка частиц. Химическая конъюгация позволяет прикреплять к VLP различные типы целевых антигенов: короткие линейные пептиды, циклические пептиды, полноразмерные белки или небелковые мишени, такие как гликаны или маленькие гаптены.46 Более того, способность VLP самопроизвольно собираться позволяет их разбирать и собирать in vitro, процесс, который позволяет включать другой диапазон молекул в частицы VLP. Например, стимуляторы врожденного иммунитета, такие как лиганды TLR, могут быть упакованы в VLP. Таким образом, совместная доставка антигенов и активаторов врожденного иммунитета к DC делает возможным последующую индукцию эффективных Т-клеточных ответов 47, тем самым направляя адаптивный иммунный ответ соответствующей величины, качества и специфичности.
Другое исследование выявило недавний интерес к разработке VLP из вирусов животных в качестве эффективной системы доставки лекарств.48 Противораковое лекарственное средство доксорубицин (DOX) было ковалентно конъюгировано с VLP на основе ротавируса (DVLP), продуцируемыми в системе экспрессии белка Escherichia coli. DVLP были дополнительно связаны с лактобионовой кислотой (LA), лигандом нацеливания на клетки, который содержит галактозу (DVLPLA), и было исследовано внутриклеточное поглощение различными клетками. Zhao et al. продемонстрировали высвобождение DOX в клетках с разной кинетикой и более низкую токсичность этой системы по сравнению со свободным DOX.48
VLP не только могут действовать как переносчики антигенов, полученных от микробных патогенов (профилактические вакцины), но они также успешно используются для представления аутоантигенов иммунной системе, преодолевая толерантность к В-клеткам, тем самым открывая путь для развития терапевтических вакцин против хронических заболеваний, таких как артрит или болезнь Альцгеймера, и рака.1
Наконец, тот факт, что VLP не содержат неструктурных вирусных белков, делает их совместимыми со стратегиями DIVA, если структурные белки, составляющие VLP, не используются в качестве маркера.Это представляет собой важный потенциал для использования вакцин на основе VLP против подлежащих регистрации болезней домашнего скота. Применение технологии DIVA обеспечивает совместимость между программами эпиднадзора и вакцинации, что позволяет вакцинации играть важную роль в борьбе с этими заболеваниями.
В настоящее время вакцины против болезней человека на основе VLP находятся на различных стадиях разработки, включая доклиническую оценку для вывода на рынок. Вакцины против гепатита В (Рекомбивакс® и Энгерикс®) и вируса папилломы человека (Гардасил® и Церварикс®) имеют коммерческую лицензию.35,49,50 Вакцины, находящиеся в клинической разработке, включают вакцины того типа, в которых VLP сама представляет собой антиген-мишень, и вакцины, в которых VLP используются для представления чужеродных антигенов иммунной системе10,31,35,42,51 Прогрессия. были созданы при разработке вакцин на основе VLP против вируса гепатита С, Эбола, вируса Ласса, хантавиуса, Марбурга, коронавируса SARS и вируса Чикунгунья2,3,28,52–55
Кандидатные вирусоподобные вакцины на основе частиц для болезней животных Животные вирусоподобные частицы в качестве иммуногенов вакцины Вирусы свиней и ParvoviridaeВ ветеринарии, хотя несколько вакцин-кандидатов находятся в процессе изучения (Таблица 1), только вакцина на основе вируса цирковируса свиней типа 2 (PCV2) на основе VLP Porcilis PCV® (производства Intervet International). , Нидерланды), является лицензированным и коммерчески доступным.56 PCV2, член семейства Circoviridae, связан с мультисистемным синдромом истощения после отъема, заболеванием свиней, характеризующимся истощением, потерей веса, респираторным расстройством и диареей, которое оказывает серьезное экономическое влияние на производство.57 Иммуноген Porcilis PCV® представляет собой VLP, образованный капсидным белком ORF2 PCV2, полученным с использованием системы экспрессии бакуловируса. Вакцина безопасна, обладает высокой иммуногенностью и эффективна против инфекции ЦВС-2. Было показано, что он индуцирует гуморальный, клеточно-опосредованный иммунитет и защиту от заболеваний, связанных с цирковирусом свиней, в полевых условиях после одной внутримышечной дозы.58 Более того, он индуцирует широкую иммунную защиту против разных генотипов (1 и 2) и различных географических изолятов.59,60 Для того же вируса была лицензирована другая подобная экспрессируемая бакуловирусная субъединичная вакцина, Ingelvac® CircoFLEX (Boehringer Ingelheim, Германия). 61 Это также основано на экспрессии капсидного белка ORF2, но нет информации о том, собирается ли рекомбинантный белок в VLP.
Другие вирусы свиней были исследованы как кандидаты для разработки вакцин на основе VLP.Одним из первых изученных вирусов был парвовирус свиней (PPV), высокоинфекционный вирус, вызывающий репродуктивную недостаточность у свиней. PPV-VLP (белок VP2) тестировали на различных моделях животных, которым вводили однократную внутримышечную иммунизацию в сочетании с различными адъювантами. Доза в микрограммах была высокоиммуногенной, очень эффективной в предотвращении трансплацентарной передачи вируса, а свинки были защищены от репродуктивной недостаточности, вызванной PPV.62 Таким образом, было показано, что Parvoriridae является подходящим семейством вирусов для создания вакцин на основе VLP.Действительно, парвовирус собак (CPV) (белок VP2), парвовирус мускусной утки (DPV) (белки VPs), парвовирус гуся (GPV) (белки VPs) и VLP вируса энтерита норок (MEV) (белок VP2) также были изучены в качестве кандидатов на вакцины. . В недавнем предварительном исследовании на гусях, GPV-VLP, вводимые однократно подкожно, показали более высокие титры нейтрализующих антител по сравнению с инактивированным и ослабленным вирусом in vivo.63 Аналогичным образом, предыдущее исследование на утках также показало продукцию специфических DPV-антител после DPV. -VLP-иммунизация и уровни нейтрализующих антител соответствовали уровням, наблюдаемым у утят, инокулированных коммерческой инактивированной вакциной.64 Также было показано, что MEV-VLP вызывают более высокий ответ антител после ревакцинации по сравнению с коммерческой традиционной вакциной; Интересно, что норки были защищены от вирусного заражения и не выделяли MEV с фекалиями.65 Кроме того, в двух исследованиях использовались рекомбинантные CPV-VLP в стратегии прайм-бустинга с адъювантом. Оба протестированных VLP были способны вырабатывать нейтрализующие антитела, достаточные для защиты всех иммунизированных собак от вирусного заражения.66,67
Зоонозные вирусыВирус гриппа - это зооноз, который остается одной из основных угроз для здоровья человека и включает широкий спектр видов животных, в основном птиц, свиней и лошадей.VLP гриппа (FLU-VLP) собираются в клетках-продуцентах, инфицированных рекомбинантным бакуловирусом, и высвобождаются в культуральную среду, имитируя процесс почкования вируса. Они представляют собой VLP, которые включают вирусные гликопротеины (гемаглютинин и нейраминидазу) на поверхности, и обычно другие вирусные структурные белки, такие как матричный белок M1 и белок ионного канала M2.68 Эти FLU-VLPs продемонстрировали способность обеспечивать защитный иммунитет через интраназальный или внутримышечный путь в отсутствие адъювантов6 и были исчерпывающе рассмотрены в.4,6,7,69 FLU-VLP, созданные с использованием системы экспрессии бакуловируса, сейчас проходят клинические испытания на людях70 (NCT01072799, NCT01014806, NCT00
- 2 и NCT00519389) [июнь 2012 г., ClinicalTrials.gov, Служба Национального института здоровья США, http: / /clinicaltrials.gov/] [июнь 2012 г., Novavax, Исследования и разработки, Клинические испытания, www.novavax.com/go.cfm?do=Page.Viewπd=81]. 71 Кроме того, недавнее исследование показало, что пандемия h2N1 ( 2009) VLP являются иммуногенными и обеспечивают защитный иммунитет свиньям.72
Другие вакцины-кандидаты на основе VLP, полученные против важного зоонозного агента, получены из вируса лихорадки долины Рифт (RVFV), члена семейства Bunyaviridae.RVFV передается несколькими видами комаров и имеет широкий спектр восприимчивых животных-хозяев.73 Интересно, что RVFV-VLP (N, GN, GC), продуцируемые в клетках млекопитающих, были способны вызывать высокие титры нейтрализующих антител и защищать мышей от летального заражения. , устранение репликации вируса.74
ReoviridaeРотавирусы (RV) являются частью семейства Reoviridae. Эти вирусы широко распространены среди новорожденных многих видов млекопитающих, вызывая тяжелую дегидратирующую диарею. 75 RV-VLP, экспрессирующие основные структурные вирусные белки (VP: 2, 4, 6, 7), оценивались на предмет их эффективности с использованием различных моделей животных, таких как мышей, 76 кроликов, 77 гнотобиотических поросят78 и коров.79 При парентеральном пути было доказано, что RV-VLP обеспечивают гомологичную защиту у кроликов77 и гетерологичную защиту у мышей.76 Кроме того, было показано, что гомологичные и гетерологичные VLP являются иммуногенными у мышей, где сообщалось о различных уровнях защиты в зависимости от дозы, путь или совместное введение с адъювантами. 80
Другие вакцины-кандидаты на основе VLP из этого семейства - это вакцины, полученные из вируса блютанга (BTV). БТ - трансмиссивное заболевание жвачных животных, вызывающее кровоизлияния и язвы в ротовой полости и верхних отделах желудочно-кишечного тракта.81 Иммуногенность BTV-VLP, полученных из системы экспрессии бакуловируса, разработанной для одновременной экспрессии всех четырех основных структурных белков (VP2, VP3, VP5 и VP7), недавно была рассмотрена в сравнении с другими вакцинами-кандидатами BTV. 82 BTV- VLP вводили в присутствии различных адъювантов овцам, позвоночным животным-хозяевам, чувствительным к вирусу. Результаты показали, что эти мультипротеиновые VLP в сочетании с подходящим адъювантом вызывают иммунный ответ, который защищает от заражения инфекционным вирусом.83 Комбинации различных белков внешнего капсида вызвали более высокие титры нейтрализующих антител по сравнению с одним белком VP2.84 Кроме того, недавнее исследование показало, что внешний капсид необходим для полной защиты, в то время как географическое происхождение ВКЛО не было критическим для разработка серотип-специфической вакцины.85
ПапилломавирусыПапилломавирусы важны не только для здоровья человека, но и в ветеринарии. Действительно, у лошадей, ослов и крупного рогатого скота могут развиваться локальные кожные опухоли, называемые саркоидами86, а у собак - папилломы полости рта.Недавнее исследование показало, что внутримышечная вакцинация лошадей L1-VLP вируса папилломы крупного рогатого скота (BPV-1) приводит к длительному антителому ответу против вируса. Титры нейтрализации были индуцированы на уровнях, которые коррелируют с защитой как у экспериментальных животных, так и у человека.87 Об индукции защитного иммунного ответа ранее также сообщалось у крупного рогатого скота (обзор см. В ссылке 88), кроликов (вирус папилломы кроликового хвоста, CRPV) 89 и собак. (собачий оральный папилломавирус) .90
CaliciviridaeНаконец, еще одно важное семейство вирусов, из которых были созданы VLP, - это Caliciviridae.Калицивирусы включают важные патогены человека и животных, классифицированные по разным родам. Норовирусы являются основной причиной гастроэнтерита у людей во всем мире, а также были описаны у видов домашнего скота, что вызывает опасения относительно их зоонозного потенциала.91–93 Возбудителем является вирус геморрагической болезни кроликов (RHDV), прототип штамма рода Lagovirus. острой и очень заразной болезни кроликов, которая уничтожила популяции диких и домашних кроликов во всем мире.94–96 В пределах рода Vesivirus калицивирус кошек (FCV) вызывает респираторные заболевания у кошек. За последние 10 лет были спорадические сообщения о высоковирулентных вспышках FCV у кошек.97 Сообщалось о рекомбинантных VLP, полученных из единственного капсидного белка (VP1) калицивирусов, принадлежащих к разным родам, которые были разработаны в качестве вакцин-кандидатов. VLP, полученные из норовирусов человека, использовались для индукции системных иммунных ответов и иммунных ответов слизистых оболочек у мышей и оцениваются в клинических испытаниях на людях.98 VLP, происходящие из норовируса, также использовались для иммунизации телят и свиней, обе вызывали частичную защиту от заражения вирусом. 99,100 Лучшие результаты были получены с вакцинами-кандидатами на основе VLP для RHDV. RHDV-VLP с адъювантом вводили кроликам однократно в разные дни перед смертельным заражением. Такая иммунизация была способна защитить кроликов от вирулентного заражения в условиях, используемых для тестирования коммерческих вакцин во Франции. Антитела, специфичные к капсидному белку RHDV, можно было обнаружить уже через 5 дней после вакцинации, и титры постепенно увеличивались в течение 15-дневного периода.101 Другие авторы также сообщили о полной защите кроликов от летального заражения RHDV, индуцированного RHDV-VLP. 102–104. Аналогичным образом, FCV-VLP тестировались на кроликах, которых дважды иммунизировали VLP и адъювантом. Поддающийся измерению ответ нейтрализующих антител был обнаружен после первой иммунизации, который усилился после повторной иммунизации. Титры нейтрализующих антител оставались высокими в течение 3 месяцев, а сыворотки проявляли нейтрализующую активность против всех проанализированных штаммов FCV.105
PicornaviridaeВирусы из семейства Picornaviridae разделяют общую стратегию репликации и самосборку зрелых капсидных белков в VLP.Эти свойства были продемонстрированы для нескольких пикорнавирусов, включая вирус ринита А лошадей (ERAV), вирус ящура (ящур) и вирус энцефаломиокардита свиней (EMCV). Эти VLP были созданы путем совместной экспрессии вирусных белков (полипротеина P1, неструктурного белка 2A и протеазы 3C) с использованием различных систем экспрессии: ERAV-VLP были созданы с использованием вектора экспрессии млекопитающих, тогда как другие VLP были созданы с использованием системы экспрессии бакуловируса. ERAV - респираторный патоген лошадей, который может вызывать острое респираторное заболевание с лихорадкой или субклиническую инфекцию.106 ERAV-VLP тестировали внутримышечно на мышах с тремя дозами с последующей бустер-инъекцией ERAV, инактивированным УФ-излучением. Животные, иммунизированные VLP, показали значительные титры вирус-нейтрализующих антител, а также индукцию ответа памяти на нейтрализующий эпитоп.107 Ящур вызывает экономически важное заболевание, поражающее свиней, крупный рогатый скот и другой парнокопытный скот. Ящур-VLP были протестированы на морских свинках. Животных дважды иммунизировали VLP и адъювантом. Как специфические антитела к вирусу ящура, так и нейтрализующие антитела были получены у животных, иммунизированных VLP, но их уровни были ниже, чем уровни, индуцированные обычной коммерческой вакциной.108 Вероятно, плохие результаты, полученные с этими и другими VLP-вирусом ящура, были связаны с их известной низкой стабильностью, что, как известно, затрудняет их получение, как правило, с ограниченными урожаями.109,110 EMCV вызывает миокардит у свиней до отъема и серьезную репродуктивную недостаточность у свиноматок111,112 ; EMCV-VLP тестировали на естественном хозяине, инокулированном один или два раза с использованием адъюванта. Иммунизация вызвала уровни нейтрализующих антител, аналогичные тем, которые были получены после введения коммерческой вакцины.В этом исследовании стратегия первичной бустерной иммунизации была более эффективной, чем иммунизация однократной дозой, в стимулировании выработки и поддержания нейтрализующих антител.113
Вирусы домашней птицыПтицеводство также является другой ветеринарной областью, которая ищет безопасные, иммуногенные, защитные и менее дорогие вакцины; следовательно, экономически важные вирусы птиц рассматривались как потенциальные мишени для разработки субъединичных вакцин. Вирус анемии цыплят (CAV) принадлежит к семейству Circoviridae и вызывает анемию и иммунодефицит у только что вылупившихся цыплят с серьезными экономическими потерями.114 Белки VP1 и VP2 CAV, экспрессируемые в клетках насекомых, использовали для иммунизации цыплят.115 Иммунизация этими белками была способна вызвать нейтрализующие антитела, и было показано, что потомство иммунизированной курицы защищено от заражения CAV непосредственно после вылупления.115 случае образование CAV-VLP предполагалось, но не подтверждалось.
Другое важное заболевание, поражающее цыплят, вызывается вирусом инфекционной бурсальной болезни (IBDV), вирусом Birnaviridae, который вызывает иммуносупрессию за счет разрушения незрелых B-лимфоцитов в бурсе Фабрициуса.116 Различные частицы IBDV (VP2, VPX и PP), полученные из полипротеина, подвергнутого дифференцированному процессингу, были протестированы на курице с использованием одной дозы. Результаты показали, что все IBDV-VLP были эффективны в отношении индукции гуморальных ответов, но не все вызывали одинаковую способность нейтрализовать вирус. Они обеспечили защиту всем вакцинированным цыплятам, как и коммерческая вакцина. Не наблюдалось явного эффекта от дозы вакцинного антигена.117
Недавно было сообщено об интересном кандидате на вакцину на основе VLP для домашней птицы.71 VLP, образованные структурными белками (NP, M, F, HN) вируса болезни Ньюкасла (NDV), парамиксовируса с птичьей оболочкой, вызывающего респираторное и / или нервное заболевание, были протестированы на мышиной модели в сравнении с инактивированным ультрафиолетом цельным вирусом. вирусная вакцина. VLP продемонстрировали свою эффективность в качестве иммуногенов. Уровни специфических антител, охарактеризованные с помощью ELISA, а также титры нейтрализующих антител, полученные в результате иммунизации NDV-VLP, были такими же высокими или даже выше, чем уровни, полученные в результате иммунизации инактивированной цельновирусной вакциной с использованием сопоставимых количеств антигена.Более того, NDV-VLP стимулировали Т-клеточные ответы на уровнях, немного превышающих уровни, стимулируемые традиционной вакциной.118 Еще одним важным открытием было то, что NDV-VLP также можно использовать в качестве платформ для представления пептидных последовательностей от других патогенов-мишеней, но эта тема будет прокомментировать в следующем разделе.
Вирусы рыбВирусные болезни рыб также важны в ветеринарии, поскольку они создают серьезные проблемы для рыбоводства и рынка морепродуктов, оказывая большое экономическое влияние.Вирус нервного некроза (NNV) из семейства Nodaviridae вызывает энцефалопатию и ретинопатию у многих видов рыб.119 VLP, полученные из единственного капсидного белка вирусов, принадлежащих к роду Betanodavirus, были созданы в качестве кандидатов на вакцины для различных видов рыб. Два исследования показали, что эти VLP способны вызывать нейтрализующие антитела против NNV, и было показано, что ответы зависят от дозы.120,121 Кроме того, Thiery et al. может продемонстрировать, что вакцинация NNV-VLP способна защитить рыбу от смертельного заражения и уменьшить распространение вируса.120
Вирусоподобные частицы как платформы для доставки чужеродного антигенаКак указывалось ранее, VLP также можно использовать в качестве платформ для мультимерного отображения чужеродных антигенов, которые могут быть включены в VLP либо путем генетического слияния, либо путем химической конъюгации. В таких случаях VLP служат как каркасами для представления антигенов, происходящих от других патогенов, в подходящей повторяющейся конфигурации, так и адъювантами для усиления иммунного ответа. В идеале лежащие в основе иммуногенные «вирусные отпечатки пальцев» VLP сообщаются прикрепленным антигенам, что делает их такими же мощными иммуногенами, как и сами VLP.В этом разделе мы рассмотрим VLP, полученные из вирусов человека или животных, используемых в качестве векторов вакцины для презентации антигенов вирусов, вызывающих болезни животных (обобщенные в таблице 2).
HepadnaviridaeОдним из первых VLP, использованных в качестве вектора для отображения чужеродных вирусных антигенов, был вирус гепатита B (HBV), который принадлежит к семейству Hepadnaviridae и является возбудителем серьезного заболевания (цирроза и / или рака печени. ) в людях. Нейтрализующий эпитоп, полученный из белка VP1 вируса ящура, был слит с коровым белком антигена HBV (HBcAg).Полученные химерные VLP вызвали вирус-нейтрализующие антитела против ящура и вызвали более сильный иммунный ответ, чем соответствующий пептид вируса ящура, у иммунизированных морских свинок. Кроме того, химерные VLP были почти такими же иммуногенными, как и инактивированные частицы вируса ящура, а морские свинки, иммунизированные VLP, были полностью защищены от заражения вирусом ящура.122 В нескольких других исследованиях сообщалось о создании химерных VLP, полученных из HBcAg, включающих антигенные эпитопы вируса ящура в качестве кандидатов в вакцины. , используя разные подходы.Бисли и др. продуцировали химерные VLP с использованием дрожжевой системы экспрессии, 123 в то время как Jin et al. использовали систему, основанную на временной экспрессии плазмид ДНК в культурах клеток HeLa.124 Результаты, полученные в этих исследованиях, демонстрируют потенциальную полезность этой стратегии вакцины против ящура. VLP на основе HBcAg также использовали для экспрессии различных эпитопов (пептиды, ограниченные MHC-I или MHC-II) вируса лимфоцитарного хориоменингита (LCMV), вируса, переносимого грызунами. Это исследование было проведено с целью выяснить, могут ли ранее существовавшие VLP-специфические антитела влиять на специфические цитотоксические Т-клеточные и Th-клеточные ответы или на индукцию защитного ответа у мышей.125 В этой модели на презентацию антигена существенно не влияло ни in vitro, ни in vivo присутствие антител против каркаса VLP, и защитный иммунитет мог быть установлен у животных, вакцинированных носителем. Таким образом, Руэдл и др. 125 открыли новую перспективу в отношении векторов VLP и классической концепции, согласно которой предыдущая иммунизация или материнские антитела ухудшают индукцию защитных иммунных ответов при вакцинации.126 Действительно, также в ветеринарии вмешательство колостральных антител было описан у вакцинированных животных.127 Однако результаты, представленные Ruedl et al. предполагают, что существовавшие ранее VLP-специфические антитела вряд ли будут ограничивающим фактором для Т-клеточных вакцин на основе VLP, хотя для полного прояснения этого аспекта необходимо провести дальнейшие исследования на ветеринарных животных. Также Storni et al. использовали HBcAg, экспрессирующий эпитоп LCMV, чтобы исследовать активацию APC для примирования ответов CTL после вакцинации VLP.128 В этой модели они продемонстрировали, что только VLP неэффективны для индукции ответов CTL и не могут обеспечивать эффективную защиту от вирусного заражения, но они стали очень мощными. при применении вместе с другим веществом, активирующим АПК (например,g., анти-CD40-антитела или CpG).
Недавнее дополнительное подтверждение того, что HBV является многообещающим средством доставки, было опубликовано Wang et al., 129 с использованием VLP HBc, содержащих пять мимотопов IBDV. В этом исследовании цыплят иммунизировали внутримышечно четырьмя дозами VLP HBc-5EPIS, и иммунизация без адъюванта обеспечивала защиту от заражения вирулентным штаммом IBDV.
PolyomaviridaeVLP, происходящие от членов семейства Polyomaviridae, также могут быть разработаны в качестве вакцинных векторов.Полиомавирусы (PyV) разных видов использовались для отображения вирусных эпитопов или опухолевых антигенов. PyV-VLP хомяка, включающие эпитоп GP33 CTL, полученный из LCMV130, показали, что они вызывают специфические защитные ответы CTL памяти in vivo без адъюванта.131 Более того, агрессивный рост опухолей, экспрессирующих GP33, значительно задерживается у этих мышей in vivo. Аналогичным образом мышиные PyV-VLP, отображающие весь человеческий простатоспецифический антиген (PSA), использовали для иммунотерапии в модельной системе мышей.Эрикссон и др. продемонстрировали, что PSA-MPy-VLP, нагруженные на DC в присутствии CpG, защищают мышей от роста опухоли, тогда как химерные VLP сами по себе или без адъюванта защищают мышей лишь незначительно.132 Загрузка VLP на DC открывает новую перспективу в вакцинации на основе VLP. . Он снижает ответ анти-VLP-антител, что благоприятно для первичной буст-терапии.132
ParvoviridaeVLP, происходящие от парвовируса, также использовались в качестве каркаса для презентации чужеродного антигена. Седлик и др.генерировали рекомбинантные PPV-VLP, включающие эпитоп CD8 + CTL из нуклеопротеина LCMV. Этот эпитоп сливали с N-концом капсидного белка VP2 PPV, и полученные химерные VLP анализировали на их иммуногенность на мышах. Одна внутрибрюшинная иммунизация всего лишь 10 мкг PPV-LCMV-VLP была способна вызвать полную защиту мышей от летального заражения LCMV за счет индукции вирус-специфичных MHC-I-ограниченных CD8 + CTL. Защита не требовала функции CD4 + T-хелперов, адъюванта, и сильный ответ ЦТЛ in vivo, индуцированный химерными VLP, сохранялся в течение месяцев после иммунизации.133 PPV-VLP также использовались для отображения иммунореактивных эпитопов, полученных из нуклеопротеина PCV2, вызывая сильные ответы антител у мышей в отсутствие какого-либо адъюванта.134
CaliciviridaeЕще одна многообещающая система VLP, удобная для отображения чужеродных антигенов, основана на RHDV-VLP. . Наша группа определила три сайта, подходящие для встраивания гетерологичных иммуногенных эпитопов в капсидный белок RHDV.96,135,136 Мы создали рекомбинантные химерные RHDV-VLP, включающие ограниченный MHC-I CD8 + Т-клеточный эпитоп SIINFEKL, полученный из куриного овальбумина (OVA).Чужеродный эпитоп вставляли в два разных места (на N-конце и в предполагаемой открытой петле вирусного капсидного белка), и соответствующие химерные VLP тестировали на их иммуногенность на мышиной модели. Результаты in vitro показали, что RHDV-VLP активировали DC, и они были способны обрабатывать и представлять чужеродный эпитоп для специфического распознавания CD8 + дозозависимым образом. In vivo, в отсутствие адъюванта, эти химерные RHDV-VLP были способны стимулировать специфическое прайминг клеток, продуцирующих IFN-γ, и мощный CTL-ответ, в основном, когда чужеродный эпитоп был вставлен на N-конец капсидного белка RHDV.Мыши, дважды иммунизированные химерными RHDV-VLP, были способны контролировать инфекцию, вызванную рекомбинантным вирусом осповакцины, экспрессирующим OVA в органах-мишенях.136 Сходные результаты были получены другой группой, использующей RHDV-VLP, демонстрирующие тот же эпитоп, полученный из OVA, включенный путем химического конъюгации. 137 В этом исследовании конъюгированные RHDV-VLP вводили с адъювантом (CpG) и тестировали на противоопухолевый ответ на мышиной модели. Полученные результаты показали, что вакцинация конъюгированными VLP приводила к значительному снижению роста опухоли.137 Химерные RHDV-VLP также оказались эффективными вакцинными векторами для иммунизации свиней, вызывая как сильные гуморальные, так и клеточные ответы против вставленного чужеродного эпитопа, полученного из ящура.138 Еще одним сообщенным использованием химерных RHDV-VLP было использование вектора для переноса генов. Химерные RHDV-VLP, несущие ДНК-связывающие последовательности, полученные из вируса папилломы человека, были способны упаковывать плазмидную ДНК и, таким образом, переносить гены в клетки животных (Cos-7), открывая путь для альтернативного метода переноса генов.139
ParamyxoviridaeКак упоминалось в предыдущем разделе, NDV-VLP (VLP, которые содержат вирусные белки M, NP, F и HN) также могут быть использованы для отображения пептидных последовательностей, полученных из патогенов-мишеней, которые включены путем генетического слияния на концевые концы. белка NP или к С-концу гликопротеина HN.71 Что еще более важно, NDV-VLPs можно использовать для представления полных эктодоменов гликопротеинов из других вирусов. Гликопротеины NDV собираются в VLP благодаря специфическим взаимодействиям цитоплазматического (CT) и трансмембранного (TM) доменов гликопротеина с коровыми белками вируса.Включение эктодомена чужеродного гликопротеина в VLP-NDV может быть достигнуто путем создания гена химерного белка, состоящего из последовательностей, кодирующих эктодомен чужеродного белка, слитых с последовательностями, кодирующими домены TM и CT соответствующего гликопротеина NDV. Используя этот подход, полные эктодомены вируса G Nipah, вируса гриппа и респираторно-синцитиального вируса (RSV) были успешно вставлены в NDV-VLP.71 Интересный результат заключался в том, что иммунизация NDV-VLP, содержащая эктодомен G-белка RSV, обеспечивала полную защита от репликации RSV в легких после интраназального заражения живым вирусом в мышиной системе.140 Кроме того, этот подход позволяет включать в препарат одной частицы эктодомены, полученные от двух разных вирусов, 71 повышая возможность использования NDV-VLP в качестве единой вакцины против двух разных патогенов. Например, сборка белка HN NDV и белка HA гриппа в одну VLP может быть использована для защиты цыплят как от птичьего гриппа, так и от NDV, хотя о такой двухвалентной вакцине еще не сообщалось.
Проблемы при разработке вакцины на основе вирусоподобных частицVLP используются в качестве вакцин с конца 1980-х годов.141 Несмотря на эту долгую историю, на сегодняшний день только несколько вакцин на основе VLP коммерциализируются во всем мире. Несколько других вакцин-кандидатов на основе VLP проходят клинические испытания, но многие другие до сих пор ограничиваются мелкомасштабными фундаментальными исследованиями, несмотря на накопленные доказательства потенциала VLP как мощных иммуногенов для многих вирусных заболеваний человека и животных. Эта ограниченная в настоящее время применимость частично связана с некоторыми техническими и практическими проблемами, связанными с процессом крупномасштабного производства VLP.
Хотя VLP были произведены для широкого спектра вирусов, очевидно, что не все они одинаково подходят для разработки вакцин. Даже если доказательство концепции было продемонстрировано при поддержке убедительных доклинических данных, продукт-кандидат на основе VLP не может быть разработан в качестве вакцины для широкого использования, если его производственный процесс не является масштабируемым или рентабельным142. полученные путем сборки одного белка, обычно могут быть произведены в больших количествах и высокого качества, в то время как структурно сложные VLP в некоторых случаях создают трудности для крупномасштабного производства.51,56,143 Кроме того, из-за свойств, присущих липидной оболочке, получение VLP с оболочкой технически более сложно.51 Однако прогресс налицо, и ожидается, что в ближайшем будущем интеграция инструментов оптимизации процесса (т. Е. , молекулярная биология, генная инженерия и системная биология), преодолеет некоторые из текущих ограничений, влияющих на крупномасштабное производство нескольких типов VLP.144
VLP могут быть продуцированы в различных системах экспрессии, включая бактериальные, дрожжевые, клетки млекопитающих или растения. .51,145–147 Однако наиболее популярным выбором является экспрессия в клетках насекомых с использованием технологии рекомбинантных бакуловирусов.32,34 Эта система экспрессии имеет много преимуществ для продукции VLP (последние обзоры см. 33, 51, 56, 143, 148). Большие количества правильно уложенных рекомбинантных белков могут быть получены с помощью посттрансляционных модификаций, подобных эукариотам. Хотя дрожжевые и бактериальные клетки могут достигать сходных урожаев, сложность VLP, продуцируемых системой экспрессии бакуловируса, значительно выше (VLPs, образованные максимум из пяти белков).Дополнительным преимуществом является то, что бакуловирусы имеют ограниченный круг хозяев (а именно насекомых) и, следовательно, безопасны для позвоночных. Клетки насекомых, используемые в системе экспрессии бакуловирусов, происходят от чешуекрылых насекомых, и их относительно легко выращивать. Они могут расти в бессывороточной среде, и культуры можно легко масштабировать. Дизайн рекомбинантных бакуловирусов прост и быстр, что обеспечивает высокую универсальность этой системы экспрессии. Это очень важно при производстве вакцин против вирусов, поверхностные белки которых быстро мутируют (например,g., вирус гриппа A), что является фундаментальным требованием для своевременной борьбы с потенциальными пандемиями. Тем не менее, эта система экспрессии имеет важные недостатки. Одним из основных ограничений является значительное совместное производство инфекционных бакуловирусных частиц, которые трудно отделить от VLP. Частицы бакуловируса могут влиять на иммуногенность вакцин на основе VLP.149 Кроме того, потенциальное загрязнение препаратов VLP инфекционными рекомбинантными бакуловирусами вызывает экологические проблемы.По этой причине иммуногены на основе VLP, продуцируемые в системе экспрессии бакуловируса, должны подвергаться либо химической инактивации для устранения инфекционности бакуловируса, которая может ухудшить качество продуцируемых VLPs150, либо нескольким последующим этапам обработки биосепарации, которые могут увеличить конечные производственные затраты.56 В этом отношении недавно было сообщено о многообещающем новом подходе, который может значительно упростить последующую обработку биофармацевтических препаратов, продуцируемых в клетках насекомых.151 Новая стратегия основана на использовании рекомбинантных бакуловирусов, лишенных гена vp80, который необходим для образования вируса, но имеет не влияет на экспрессию чужеродных генов.Делеция транскомплемментируется в линии клеток трансгенных насекомых, используемой для создания бакуловирусного посевного материала, и полученные дефектные бакуловирусы затем могут использоваться для получения больших количеств рекомбинантных белков без загрязнения вирионов.
Вышеупомянутые проблемы в течение некоторого времени препятствовали разработке вакцин, производимых на платформе для производства клеток насекомых. Тем не менее, разрешение на рынок двух вакцин для ветеринарного применения (Porcilis® Pesti и Bayonac® CSF против вируса классической чумы свиней) в 2000 г., 152, а затем коммерческое лицензирование вакцины на основе VLP Cervarix® для использования человеком в 2007 г. , стали критически важными вехами для принятия регуляторными органами технологии клеток насекомых при производстве вакцин.В настоящее время было показано, что эта технология отвечает экономическим требованиям для производства современных вакцин для больших популяций, и в настоящее время является доминирующей платформой для производства ветеринарных вакцин, 56, таким образом, открывая путь к лицензированию многих других вакцин на основе VLP для использование животных.
Что касается использования VLP в качестве платформ для отображения чужеродных эпитопов, обе стратегии, генерация химерных VLP посредством генетического слияния и химическая конъюгация антигенов с VLP имеют некоторые ограничения.Для того чтобы эффективно индуцировать ответные реакции антител с высоким титром, целевые антигены должны отображаться на поверхности VLP в иммунодоминантных областях с высокой плотностью. Следовательно, одним из ключевых моментов для создания химерных VLPs является выбор подходящих сайтов вставки, которые должны присутствовать на поверхности VLP и не должны мешать фолдингу и сборке белков. Однако создание химерных VLP в значительной степени эмпирически; почти невозможно предсказать, будут ли отдельные пептиды совместимы со сборкой VLP или вставки будут иммуногенными.Другое важное ограничение химерного подхода состоит в том, что размер и природа эпитопов, которые могут быть вставлены в VLP, в частности в их иммунодоминантные области, ограничены. VLP, содержащие пептиды длиной более 20 аминокислот, часто не могут собраться. Относительно большие вставки были успешно включены в VLP, 153–155, но это скорее исключение, чем правило. Эти ограничения размера ограничивают количество эпитопов, на которые могут быть нацелены отдельные химерные VLP.Напротив, гибкость альтернативного подхода, основанного на химической конъюгации целевых антигенов с ранее собранными нативными VLP, дает существенные преимущества, хотя это зависит от доступности адресуемых остатков как на VLP, так и на целевом антигене. С другой стороны, с производственной точки зрения, подход генетического слияния может иметь преимущества по сравнению с химической конъюгацией, поскольку химерные VLP могут быть получены и очищены с использованием тех же хорошо зарекомендовавших себя методов, которые используются для очистки немодифицированных родительских VLP, тогда как процесс производства конъюгированных VLP. влечет за собой дополнительные проблемы, а методы контроля качества неизбежно становятся более сложными.
Стратегии отображения чужеродных эпитопов VLP обычно позволяют нацеливаться только на эпитопы ограниченного размера. Поскольку патогены обычно подвергаются антигенным изменениям в ответ на давление иммунной системы хозяина, вакцины, основанные на VLP, отображающих чужеродные эпитопы, будут эффективны только против высококонсервативных B- или T-клеточных эпитопов. Следовательно, VLP, по-видимому, лучше всего подходят для нацеливания на высококонсервативные антигены. Примером такой подходящей мишени является внеклеточный домен из 23 аминокислот белка M2 вируса гриппа A, который является высококонсервативным среди вирусных штаммов и, как было показано, индуцирует защиту мышей от летального заражения при введении в виде пептида. включены в VLP, происходящие от HBV.43,156
Как указывалось в предыдущих разделах, относительная способность различных типов VLP индуцировать различные ветви иммунного ответа зависит от ряда факторов, специфичных для VLP. Поэтому маловероятно, что одна платформа VLP будет соответствовать всем желаемым требованиям. Однако продолжение параллельной разработки нескольких платформ VLP гарантирует, что отдельные вакцины можно будет соответствующим образом адаптировать к типу иммунного ответа, необходимого в каждом случае.
ВыводыVLP привлекательны в качестве кандидатов на вакцины, потому что присущие им свойства (т.е. мультимерные антигены, структура частиц, неинфекция) подходят для индукции безопасных и эффективных гуморальных и клеточных иммунных ответов. Тот факт, что вакцины на основе VLP могут соответствовать требованиям DIVA, делает их еще более привлекательными для разработки вакцин в ветеринарии. В настоящее время наблюдается четкая тенденция к созданию VLP в качестве мощного инструмента для разработки вакцин.На рынке вакцин для человека пять уже основаны на VLP: три для HBV и два для HPV, в то время как в ветеринарии недавно была лицензирована вакцина на основе VLP против PCV2. Несколько вакцин-кандидатов VLP, предназначенных для лечения болезней человека и животных, в настоящее время находятся на поздних стадиях оценки.
- polyomaviridae
- 9pox2 Вирус Poxviridae 9pox6



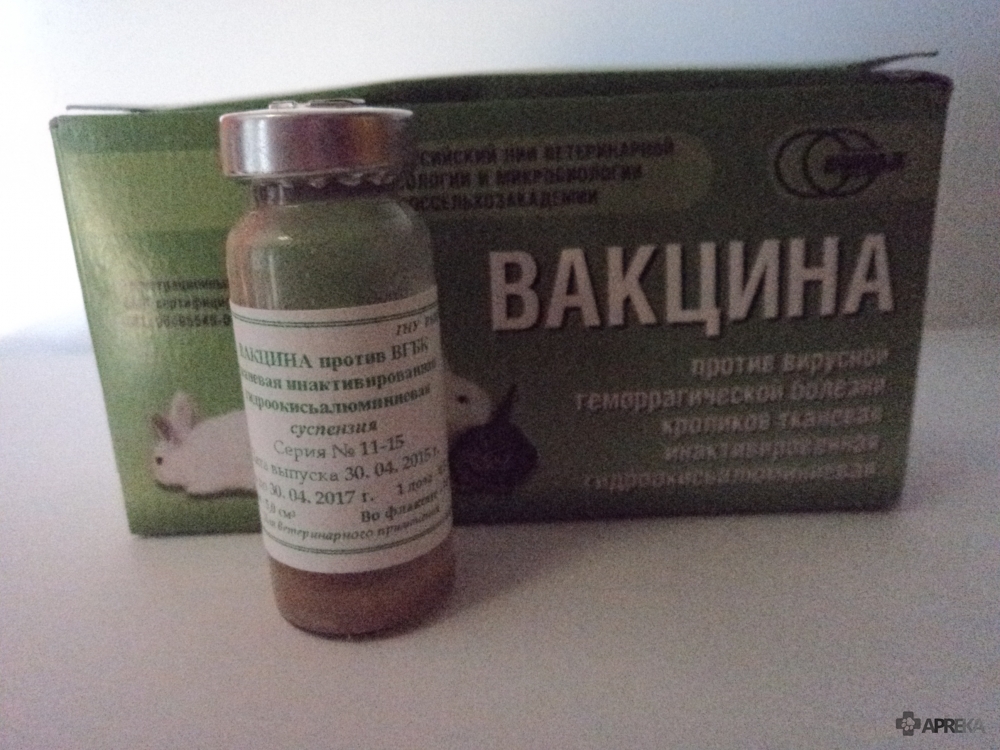
 .
.


 в области бедра
в области бедра К моменту первой вакцинации животное должно набрать вес не менее 0,5 кг. При меньших показателях вакцинация кроликов от миксоматоза и HBV откладывается, это делается при наборе необходимой массы.Для однократной вакцинации кроликов от миксоматоза и HBVC дозировка составляет 1,0 мл действующего вещества, полученного путем смешивания суспензии и лиофилизата.
К моменту первой вакцинации животное должно набрать вес не менее 0,5 кг. При меньших показателях вакцинация кроликов от миксоматоза и HBV откладывается, это делается при наборе необходимой массы.Для однократной вакцинации кроликов от миксоматоза и HBVC дозировка составляет 1,0 мл действующего вещества, полученного путем смешивания суспензии и лиофилизата.
 Лекарства хранят в сухих местах с температурой 2-25 ° С, солнечные лучи не должны попадать в складские помещения. Другой момент - следовать инструкции по вакцине против миксоматоза и HBV для кроликов, без которой невозможно добиться успеха и предотвратить заболевание. И в любом случае перед вакцинацией животного нужно посоветоваться с ветеринаром, а то и доверить ему столь важное дело.
Лекарства хранят в сухих местах с температурой 2-25 ° С, солнечные лучи не должны попадать в складские помещения. Другой момент - следовать инструкции по вакцине против миксоматоза и HBV для кроликов, без которой невозможно добиться успеха и предотвратить заболевание. И в любом случае перед вакцинацией животного нужно посоветоваться с ветеринаром, а то и доверить ему столь важное дело. Помимо этого свойства, эти вирусы сильно различаются. У некоторых видов есть конверты; другие нет. Некоторые виды имеют кольцевые геномы; другие имеют линейные геномы. Размер вирусного генома может различаться в 50 раз у разных видов группы. Диапазон хозяев охватывает диапазон живых организмов. Бактерии, археи, эукариоты инфицированы тем или иным вирусом I группы. Группа была разделена на подклассы на основе общих морфологических свойств, шесть из этих подклассов содержат патогены человека: Adenoviridae, Herpesviridae, Poxviridae, Papillomaviridae, Polyomaviridae и Mimiviridae.
Помимо этого свойства, эти вирусы сильно различаются. У некоторых видов есть конверты; другие нет. Некоторые виды имеют кольцевые геномы; другие имеют линейные геномы. Размер вирусного генома может различаться в 50 раз у разных видов группы. Диапазон хозяев охватывает диапазон живых организмов. Бактерии, археи, эукариоты инфицированы тем или иным вирусом I группы. Группа была разделена на подклассы на основе общих морфологических свойств, шесть из этих подклассов содержат патогены человека: Adenoviridae, Herpesviridae, Poxviridae, Papillomaviridae, Polyomaviridae и Mimiviridae.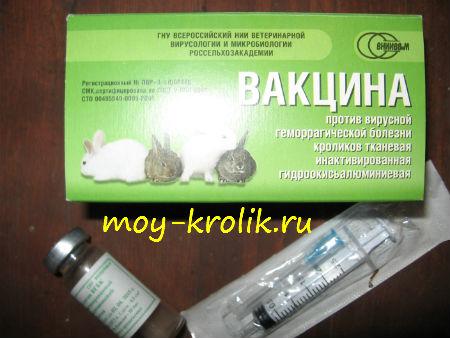 Вирусы, трансформирующие ДНК группы I, по-видимому, вызывают рак через механизм, связанный с их способностью вызывать репликацию в их клетках-хозяевах [Глоссарий вирусов гепатита].
Вирусы, трансформирующие ДНК группы I, по-видимому, вызывают рак через механизм, связанный с их способностью вызывать репликацию в их клетках-хозяевах [Глоссарий вирусов гепатита]. После латентной фазы вирусы могут ускорить литическую фазу, проявляющуюся как клиническое заболевание. Рецидивирующее заболевание может клинически отличаться от первоначальной инфекции (например,g., ветряная оспа, начальная инфекция вируса ветряной оспы, спустя десятилетия сменяется опоясывающим лишаем). Некоторые из вирусов герпеса представляют собой ДНК-трансформирующие вирусы.
После латентной фазы вирусы могут ускорить литическую фазу, проявляющуюся как клиническое заболевание. Рецидивирующее заболевание может клинически отличаться от первоначальной инфекции (например,g., ветряная оспа, начальная инфекция вируса ветряной оспы, спустя десятилетия сменяется опоясывающим лишаем). Некоторые из вирусов герпеса представляют собой ДНК-трансформирующие вирусы.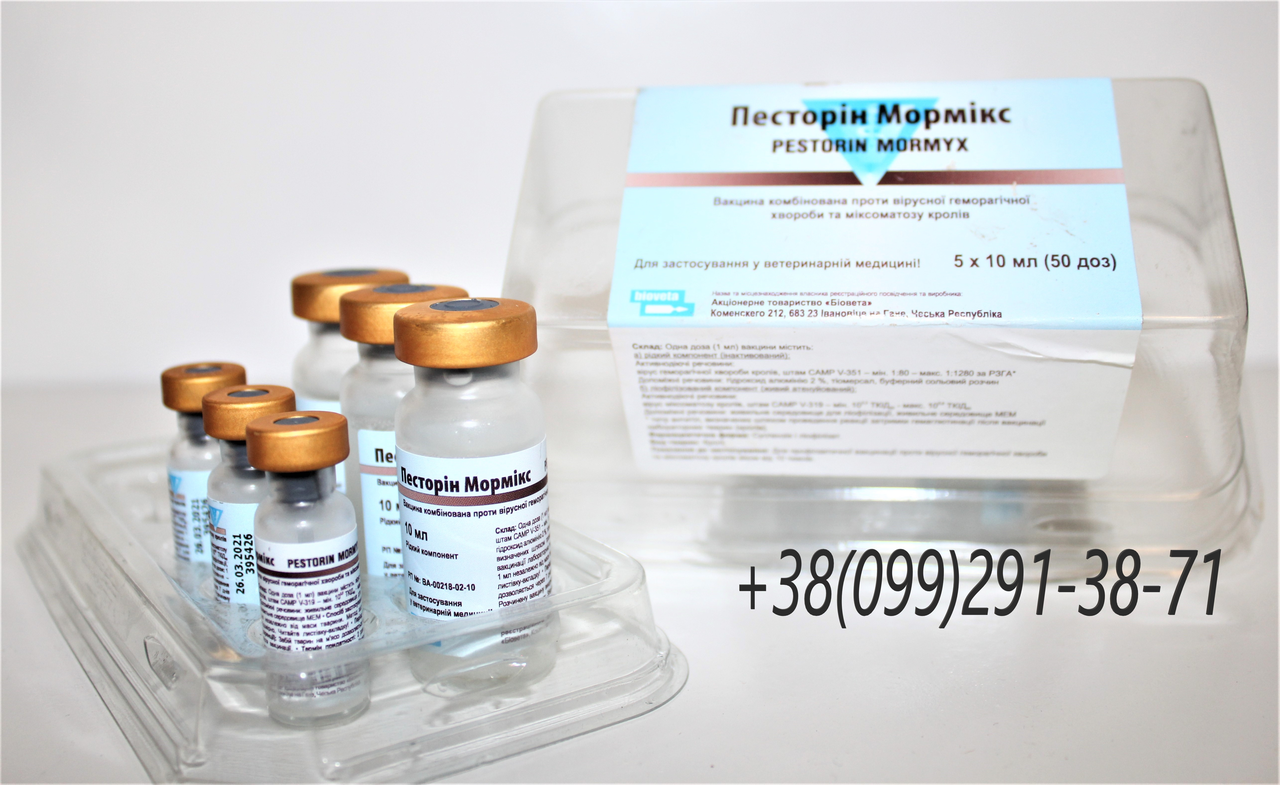 Вирус Эпштейна-Барра представляет собой ДНК-трансформирующий вирус и вызывает несколько видов рака, включая лимфому Ходжкина, лимфому Беркитта, карциному носоглотки и лимфому центральной нервной системы. Предполагается роль вируса в нескольких аутоиммунных заболеваниях.
Вирус Эпштейна-Барра представляет собой ДНК-трансформирующий вирус и вызывает несколько видов рака, включая лимфому Ходжкина, лимфому Беркитта, карциному носоглотки и лимфому центральной нервной системы. Предполагается роль вируса в нескольких аутоиммунных заболеваниях. Читателям не следует путать шестую болезнь с пятой. Пятое заболевание, также известное как инфекционная эритема и болезнь ударов по лицу, вызывается парвовирусом B19. Эти заболевания получили свое название от исторической диагностической дилеммы, с которой столкнулись педиатры, которые регулярно сталкивались с шестью клиническими синдромами детской сыпи. Четыре сыпи в детстве имели известную этиологию. Пятая и шестая высыпания, вызванные еще не идентифицированными организмами, назывались «пятая болезнь» и «шестая болезнь».Впоследствии вирусные причины этих двух заболеваний были обнаружены, но числовые названия остались.
Читателям не следует путать шестую болезнь с пятой. Пятое заболевание, также известное как инфекционная эритема и болезнь ударов по лицу, вызывается парвовирусом B19. Эти заболевания получили свое название от исторической диагностической дилеммы, с которой столкнулись педиатры, которые регулярно сталкивались с шестью клиническими синдромами детской сыпи. Четыре сыпи в детстве имели известную этиологию. Пятая и шестая высыпания, вызванные еще не идентифицированными организмами, назывались «пятая болезнь» и «шестая болезнь».Впоследствии вирусные причины этих двух заболеваний были обнаружены, но числовые названия остались. В центре изображения вверху находится инфицированный пневмоцит с сильно увеличенным ядром. Основная часть ядра занята плотным включением, иногда называемым тельцом Каудри, содержащим вирусные нуклеокапсиды.Вокруг включения - чистая зона. Такие ядерные включения, наблюдаемые у всех видов вирусов герпеса, инфицирующих людей, долгое время служили важным ключом к диагностике и патогенезу вирусных заболеваний.
В центре изображения вверху находится инфицированный пневмоцит с сильно увеличенным ядром. Основная часть ядра занята плотным включением, иногда называемым тельцом Каудри, содержащим вирусные нуклеокапсиды.Вокруг включения - чистая зона. Такие ядерные включения, наблюдаемые у всех видов вирусов герпеса, инфицирующих людей, долгое время служили важным ключом к диагностике и патогенезу вирусных заболеваний.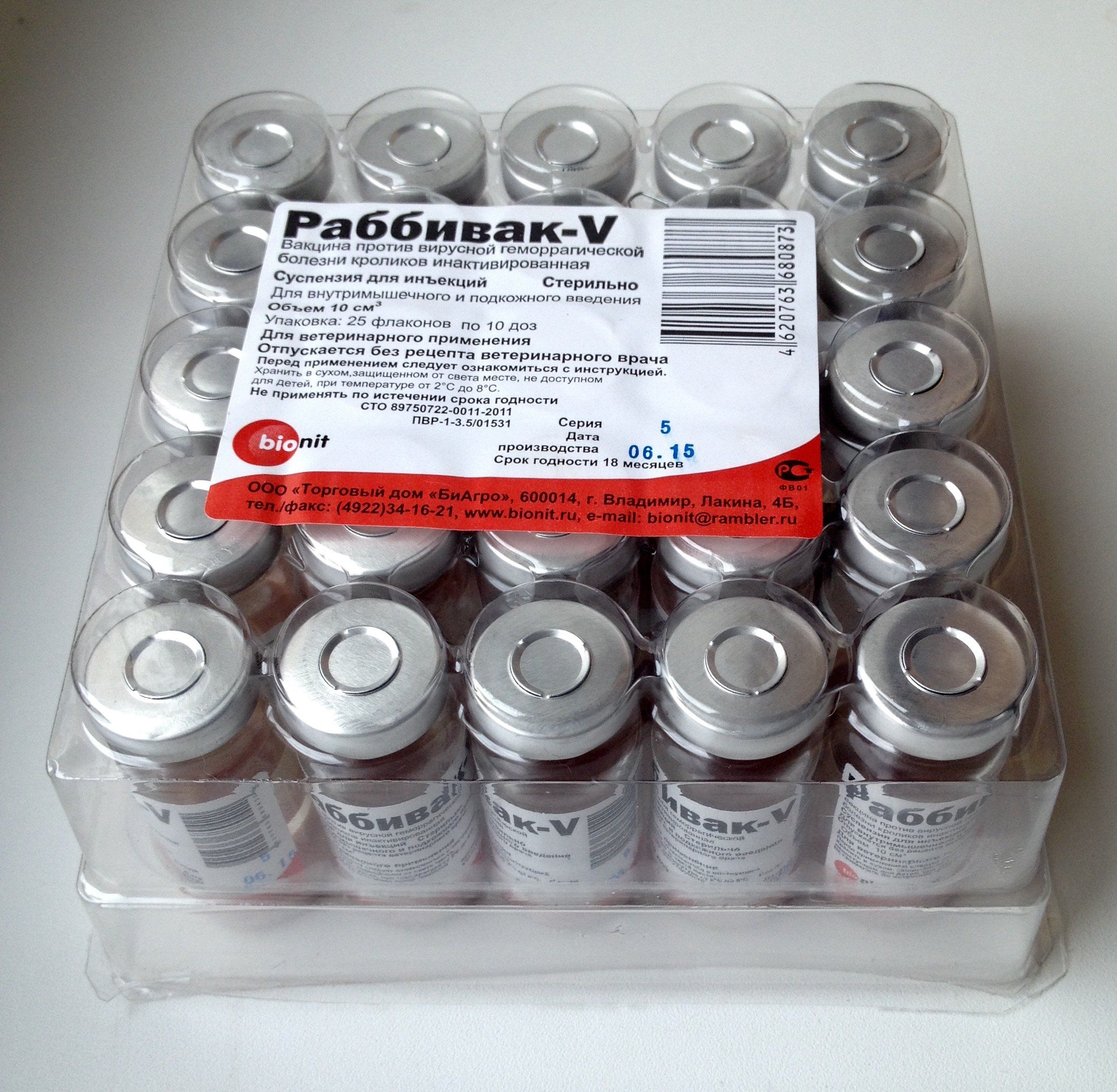 Большинство аденовирусных заболеваний клинически проявляются как респираторное заболевание, конъюнктивит (то есть вирусный конъюнктивит) или гастроэнтерит. Клинически инфекции могут проявляться в виде тонзиллита (имитирующего стрептококковое воспаление горла), фарингита (крупа), среднего отита, пневмонии, менингоэнцефалита и геморрагического цистита. Аденовирусы обычно распространяются аэрозольными каплями и особенно стабильны во внешней среде.
Большинство аденовирусных заболеваний клинически проявляются как респираторное заболевание, конъюнктивит (то есть вирусный конъюнктивит) или гастроэнтерит. Клинически инфекции могут проявляться в виде тонзиллита (имитирующего стрептококковое воспаление горла), фарингита (крупа), среднего отита, пневмонии, менингоэнцефалита и геморрагического цистита. Аденовирусы обычно распространяются аэрозольными каплями и особенно стабильны во внешней среде. Вирус нацелен на производящие миелин олигодендроциты в головном мозге, вызывая области демиелинизации и некроза.
Вирус нацелен на производящие миелин олигодендроциты в головном мозге, вызывая области демиелинизации и некроза.
 , Северная Корея). Помимо замечательного успеха вакцинации, искоренение оспы, несомненно, стало возможным, потому что натуральная оспа не является резервуаром для животных. В настоящее время вакцинация обычно не проводится и предназначена в первую очередь в качестве меры борьбы с терроризмом для персонала, входящего в зону, где существует угроза биологического оружия.
, Северная Корея). Помимо замечательного успеха вакцинации, искоренение оспы, несомненно, стало возможным, потому что натуральная оспа не является резервуаром для животных. В настоящее время вакцинация обычно не проводится и предназначена в первую очередь в качестве меры борьбы с терроризмом для персонала, входящего в зону, где существует угроза биологического оружия. К другим состояниям, связанным с вакцинацией, относятся вакцинальная экзема и поствакциниальный энцефалит).
К другим состояниям, связанным с вакцинацией, относятся вакцинальная экзема и поствакциниальный энцефалит). Было высказано предположение, что появление ВИЧ в 1980-х годах могло быть частично результатом прекращения вакцинации против оспы в конце 1970-х годов [51].
Было высказано предположение, что появление ВИЧ в 1980-х годах могло быть частично результатом прекращения вакцинации против оспы в конце 1970-х годов [51]. Нет известных резервуаров для животных. Инфекция передается от человека к человеку. Лечение не всегда необходимо, поскольку отдельные поражения регрессируют в течение двух месяцев. Однако автоинокуляция вируса может вызвать новые поражения кожи, что продлит болезнь.
Нет известных резервуаров для животных. Инфекция передается от человека к человеку. Лечение не всегда необходимо, поскольку отдельные поражения регрессируют в течение двух месяцев. Однако автоинокуляция вируса может вызвать новые поражения кожи, что продлит болезнь. Члены класса Mimiviridae сложны, крупнее некоторых бактерий, с огромными геномами (по вирусным стандартам), превышающими миллион пар оснований и кодирующими более 1000 белков. Большой размер и сложность Class Mimiviridae иллюстрируют преимущество генома двухцепочечной ДНК. ДНК гораздо более химически стабильна, чем РНК, и может точно реплицироваться, даже если ее длина превышает миллиард пар оснований. Геном двухцепочечной ДНК можно защитить ферментами репарации ДНК и внешними модификациями структуры ДНК.Класс Megaviridae - это недавно описанный (октябрь 2011 г.) класс вирусов, родственный классу Mimiviridae, но более крупный [45].
Члены класса Mimiviridae сложны, крупнее некоторых бактерий, с огромными геномами (по вирусным стандартам), превышающими миллион пар оснований и кодирующими более 1000 белков. Большой размер и сложность Class Mimiviridae иллюстрируют преимущество генома двухцепочечной ДНК. ДНК гораздо более химически стабильна, чем РНК, и может точно реплицироваться, даже если ее длина превышает миллиард пар оснований. Геном двухцепочечной ДНК можно защитить ферментами репарации ДНК и внешними модификациями структуры ДНК.Класс Megaviridae - это недавно описанный (октябрь 2011 г.) класс вирусов, родственный классу Mimiviridae, но более крупный [45].
 К 1950 году популяция кроликов в Австралии составляла около 3 миллиардов. Воспользовавшись вирусом миксомы как решением проблемы перенаселения кроликов, австралийцы запустили программу инокуляции вируса миксомы.Менее чем за 10 лет популяция австралийских кроликов сократилась на 95% [54]. Погибло около 3 миллиардов кроликов, что очень близко к числу людей, живших на планете в середине 1950-х годов. Эту чуму на кроликах развязал комитет людей, решивший, что следует использовать смертельный кроличий вирус в качестве биологического оружия. Не комментируя моральные последствия усилий по искоренению животных, стоит отметить, что кролики - не единственные млекопитающие, которые могут быть истреблены патогенным вирусом.Люди должны быть внимательны.
К 1950 году популяция кроликов в Австралии составляла около 3 миллиардов. Воспользовавшись вирусом миксомы как решением проблемы перенаселения кроликов, австралийцы запустили программу инокуляции вируса миксомы.Менее чем за 10 лет популяция австралийских кроликов сократилась на 95% [54]. Погибло около 3 миллиардов кроликов, что очень близко к числу людей, живших на планете в середине 1950-х годов. Эту чуму на кроликах развязал комитет людей, решивший, что следует использовать смертельный кроличий вирус в качестве биологического оружия. Не комментируя моральные последствия усилий по искоренению животных, стоит отметить, что кролики - не единственные млекопитающие, которые могут быть истреблены патогенным вирусом.Люди должны быть внимательны.
 Вирус Эпштейна-Барра (включая инфекции, такие как мононуклеоз, и новообразования, такие как лимфома Ходжкина, лимфома Беркитта, карцинома носоглотки и лимфома центральной нервной системы, а также различные аутоиммунные заболевания)
Вирус Эпштейна-Барра (включая инфекции, такие как мононуклеоз, и новообразования, такие как лимфома Ходжкина, лимфома Беркитта, карцинома носоглотки и лимфома центральной нервной системы, а также различные аутоиммунные заболевания) Вирус герпеса человека 8 типа, HHV8 (саркома Капоши, первичная выпотная лимфома, болезнь Кастлемана)
Вирус герпеса человека 8 типа, HHV8 (саркома Капоши, первичная выпотная лимфома, болезнь Кастлемана) Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Orthopoxvirus: Вирус осповакцины: вирус оспы буйволов
Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Orthopoxvirus: Вирус осповакцины: вирус оспы буйволов Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Parapoxvirus
Вирусы дцДНК, без стадии РНК: Poxviridae: Chordopoxvirinae: Parapoxvirus Вирусы дцДНК, без стадии РНК: Papillomaviridae
Вирусы дцДНК, без стадии РНК: Papillomaviridae Мимивирус Acanthamoeba polyphaga (пневмония)
Мимивирус Acanthamoeba polyphaga (пневмония) и Эстевес, П. Дж. Иммунная система зайцеобразных. В: М. Дж. Х. Рэтклифф (ред.). Энциклопедия иммунобиологии. Том. 1, (515–525. Elsevier, Амстердам, Голландия, 2016).
и Эстевес, П. Дж. Иммунная система зайцеобразных. В: М. Дж. Х. Рэтклифф (ред.). Энциклопедия иммунобиологии. Том. 1, (515–525. Elsevier, Амстердам, Голландия, 2016).
 Тираж 111 , 2339–2346 (2005).
Тираж 111 , 2339–2346 (2005).