Сапролегниоз (дерматомикоз) у рыбок - причины, симптомы, лечение
Причины возникновения дерматомикоза у рыбок
Сапролегниоз (дерматомикоз) – микозная болезнь пресноводных рыб, характеризующаяся поражением кожи, плавников и жаберного аппарата условно патогенными грибами.
Возбудителем сапролегниоза являются низшие грибы (фикомицеты) из рода Сапролегния. Они имеют разветвляющиеся гифы, лишенные перегородок, которые, разрастаясь, сплетаются и образуют мицелий гриба. Гифы окружены оболочкой и заполнены протоплазмой, содержащей многочисленные ядра. Часть гифа расширена и образует спорангий, в котором находятся зооспоры. После созревания спор спорангий разрывается, и зооспоры рассеиваются во внешней среде. Размножение сапролегниевых грибов может происходить и половым путем. Половые органы представлены артеридиями и оогониями. После слияния ядер яйцеклетки и антеридия образуется оплодотворенная клетка, которая вскоре покрывается двойной оболочкой и превращается в ооспору. При благоприятных условиях ооспора прорастает и образует новый гиф.
При благоприятных условиях ооспора прорастает и образует новый гиф.
Возбудитель сапролегниоза для человека не опасен.
Почему рыбки болеют сапролегниозом
К появлению и распространению сапролегниоза предрасполагают голодание рыб, плохой газовый режим и солевой состав воды, травмирование при ловле и перевозке. Сапролегниоз часто является сопутствующей болезнью при различных инфекционных и инвазионных болезнях (аэромонозах, псевдомонозах, бранхиомикозе и др.). Он поражает рыб в любое время года, если в водоеме сложились подходящие для этого условия. При оптимальных условиях содержания и полноценного кормления рыбы не болеют сапролегниозом даже при наличии в аквариуме возбудителей болезни.
Симптомы дерматомикоза у рыбок
В начальной стадии болезни на коже, плавниках или жабрах появляются белые тонкие нити, перпендикулярно отходящие от поверхности тела рыбы. Через несколько дней на местах поселения гриба виден ватообразный налет, состоящий из переплетённых гифов. С возрастом гифы гриба внедряются в межтканевые и межклеточные пространства поврежденных тканей кожи, мышц и жабр. При этом гриб и, возможно, сопутствующие ему бактерии разрушают живую ткань, вызывая ее омертвление. Гифы гриба, развиваясь, проникают во внутренние органы, что приводит к общему микотоксикозу.
С возрастом гифы гриба внедряются в межтканевые и межклеточные пространства поврежденных тканей кожи, мышц и жабр. При этом гриб и, возможно, сопутствующие ему бактерии разрушают живую ткань, вызывая ее омертвление. Гифы гриба, развиваясь, проникают во внутренние органы, что приводит к общему микотоксикозу.
Разрастаясь на поверхности тела больных рыб, возбудитель сапролегниоза образует мощно развитый пушистый или ватообразный мицелий белого или желтого цвета.
Диагностика и лечение дерматомикоза рыбок
Диагноз ставят на основании данных анамнеза, клинических признаков и лабораторных методов исследования.
Для лечения больных сапролегниозом рыб применяют ванны из 5%-ного раствора поваренной соли при экспозиции 5 минут, метиленовую синь в дозе 50 мг/л при экспозиции 12—16 часов, а также малахитовую зелень в концентрации 1:200000 в течение одного часа.
Как защитить своих рыбок от сапролегниозома
Профилактика и меры борьбы с сапролегниозом основаны на своевременном и тщательном выполнении всего комплекса ветеринарно-санитарных, рыбоводных и биотехнических мероприятий, направленных на создание в аквариумах и бассейнах оптимальных зоогигиенических условий, оптимального газового режима и солевого состава воды в них. Кроме того, необходимо обеспечивать полноценное кормление рыб.
Кроме того, необходимо обеспечивать полноценное кормление рыб.
Живородные садки, аквариумы и другие небольшие емкости, в которых находились больные рыбы, очищают от грязи и подвергают профилактической дезинфекции негашенной или хлорной известью. Рыбоводный инвентарь и оборудование, бывшие в контакте с больной рыбой, дезинфицируют.
[Болезни рыбок] Сапролегниоз (Сапролегния, Дерматомикоз)
Грибок Сапролегния
Возбудитель
Грибы Achilla, Aphanomyces, Saprolegnia. В зависимости от условий окраска грибка может быть белой и слабо-жёлтой. Имеют разветвляющиеся и неразветвляющиеся нитеобразные гифы, лишённые перегородок, толщина которых достигает 75 мкм. Гифы окружены оболочкой и заполнены протоплазмой, которая содержит большое количество ядер. Терминальная часть гифа расширина и образует оболочки с зооспорами. При созревании спор оболочка разрывается, и зооспоры выбрасываются во внешнюю среду. Эти грибы могут размножаться и половым путём.
Видео. Споры грибка:
Споры грибка:
Симптомы и патогенез
Заболевание развивается при содержании рыб в слишком холодной воде. Происходит поражение кожи, плавников, жабр, икры (прежде всего неоплодотворённой). Как правило, грибки действуют совместно с возбудителями других инфекционных и инвазионных заболеваний. Они постоянно присутствуют в воде аквариума, и как только рыба ослабевает или получает механические повреждения, паразитируют на ней. Вначале мицелий грибка умерщвляет клетки эпителия, а затем проникает глубже, в соединительную ткань, мышцы и даже внутренние органы, которые грибок постепенно омертвляет. На коже, плавниках, глазах и жабрах у заболевшей рыбы появляются тонкие грязно-белые нити, которые, быстро разрастаясь, через несколько дней образуют ватообразный налёт. Плавники укорачиваются, склеиваются и разрушаются, могут отвалиться.
Больная рыбка
Диагноз
Заболевание диагностируется на основе клинических и патологоанатомических признаков болезни.
Патологоанатомические изменения
Гифы грибка, разрастаясь, образуют ватообразный налёт на теле, жабрах, во рту и даже в носу, причём они проникают внутрь тела и разрушают его мускулатуру и внутренние органы.
Лечение
Аквариум с больными рыбами дезинфицируют 3 — 5 %-ным раствором марганцовокислого калия. Больных рыб пересаживают в чистую «старую» воду, предварительно удалив налёт на теле и обработав язвы ваткой, смоченной в растворе пенициллина (500000 ЕД на 1 кубический сантиметр новокаина).
Препараты для внесения в аквариумную воду:
— 500000 ЕД бициллина-5 на 100 литров воды, вносить на ночь 6 — 7 суток подряд при температуре воды 24 — 26 градусов;
Ванны:
— 1 мг колларгола на 10 литров воды, выдержка 20 минут;
— 500 г поваренной соли на 10 литров воды, выдержка 5 минут;
— 500 мг метиленовой сини на 10 литров воды, выдержка 12 часов;
— 50 мг малахитового зелёного на 10 литров воды, выдержка 1 час.
Можно также проводить озонирование аквариума (при объёме 50 литров — 25 — 30 минут, 100 литров — 40 — 50 минут).
Препараты для лечения икры:
— 0,1 г атебрина на 15 литров воды;
— 500000 ЕД спермасама на 100 литров воды.
Профилактика и рекомендации
Необходимо постоянно соблюдать оптимальный температурный режим, чистоту, плотность посадки. Рыб следует кормить разнообразным и полноценным кормом. Производителей не рекомендуется кормить трубочником. В нерестовик рекомендуется вносить 1 каплю на 10 литров воды 5 %-ного раствора йода. Это предотвращает поражение оплодотворённой икры грибками.
В нерестовик рекомендуется вносить 1 каплю на 10 литров воды 5 %-ного раствора йода. Это предотвращает поражение оплодотворённой икры грибками.
Грибковые инфекции аквариумных рыбок - диагностика заболевания и лечение.
Грибковые инфекции - Диагностика и лечение
Грибковые инфекции - Дерматомикоз (сапролегниоз, ахлиоз), Бранхиомикоз, Плистифороз, Ихтиоспоридиоз).
Грибковые инфекции относятся к наиболее распространённым и опасным заболеваниям аквариумных рыб,
вызываемых патогенными организмами.
Грибки и их споры всегда присутствуют в аквариумной воде и помогают в поддержании гигиены,
разлагая различные продукты жизнидеятельности рыб(экскременты, несъеденный корм).
Наилучшими условиями размножения грибков являются низкая температура и плохой уход за аквариумом.
Такие факторы, как стресс, переохолождение, старость,
плохое питание, могут ослабить
рыб и сделать их более уязвимыми перед грибковой атакой.
Среди патогенных для рыб грибков можно выделить три различных инфекционных вида:
- Наружные микозы.
- Бранхиомикозы.
- Системные микозы.
1. Наружные микозы или внешние микозы ( сапролегниоз, ахлиоз )
Причины: /> Поражают исключительно поверхность тела рыб в местах ран,
ссадин или язв ( появившихся в следствии бактериальных ифекций).
Наружные поражения ( "ватная болезнь","мох" ) связаны с группой несовершенных грибов - Achlia, Aphanomyces, Saprolegnia и др., относящихся к классу фикомицетов.
Эти виды "водяной плесени" можно рассматривать, как вторичных паразитов,
поселяющихся в основном на мёртвых, некротизированных, раненых или воспалённых тканях.
Внешние микозы легко заметить по налёту на коже, глазах, плавниках и у рта рыбы, который состоит из белых грибных нитей и похож на кусочки ваты ( гифы гриба). Если болезнь не начать лечить сразу, то с возрастом гифы внедряются в ткани рыбы (мышцы, жабры), разрушая их. В дальнейшем они проникают во внутренние органы рыбы.
На начальной стадии внешние микозы лечатся легко, с помощью фунгицидных ( антигрибковых ) препаратов. Если плохие условия в аквариуме будут сохранятся, то скорее всего болезнь появится снова, а неоднократное применение фунгицидов может вызвать у рыб химическое отравление.
В случае поражения грибками особей, больных каким-либо другим заболеванием, следует для начала избавить её от этой патологии, а плесневелые налёты на теле и плавниках аккуратно удалить ватным тампоном.
 Возможно, при излечении рыбки от основной болезни, грибки уйдут сами собой.
В противном случае лечение грибкового заболевания будет неэффективным и будет только приводить к приглушению процесса,
но поскольку основное заболевание не вылечено, то и грибок не ликвидируется.
Если грибок поселился на рыбке самостоятельно в результате повреждения кожного покрова, то вылечить его можно достаточно быстро.
В этих целях больную рыбку сажают в отдельный аквариум, в котором разведен оксалат малахитовой зелени из расчёта 0,04 мг/л. Одного часа достаточно для того,
чтобы убить все грибки. Кроме того, в начале заболевания может быть эффективной ванна из 5%-го солевого раствора в течение пяти минут и длительная ванна из метиленового синего,
из расчёта 50г/л в течение 12-16 часов.
Возможно, при излечении рыбки от основной болезни, грибки уйдут сами собой.
В противном случае лечение грибкового заболевания будет неэффективным и будет только приводить к приглушению процесса,
но поскольку основное заболевание не вылечено, то и грибок не ликвидируется.
Если грибок поселился на рыбке самостоятельно в результате повреждения кожного покрова, то вылечить его можно достаточно быстро.
В этих целях больную рыбку сажают в отдельный аквариум, в котором разведен оксалат малахитовой зелени из расчёта 0,04 мг/л. Одного часа достаточно для того,
чтобы убить все грибки. Кроме того, в начале заболевания может быть эффективной ванна из 5%-го солевого раствора в течение пяти минут и длительная ванна из метиленового синего,
из расчёта 50г/л в течение 12-16 часов.Профилактика:
Прежде всего, нельзя допускать травм внешнего покрова рыб. Исходя из этого, при ловле, транспортировке рыб нужно внимательно следить, чтобы рыбки оставались целыми, не причиняли повреждения друг другу и не находились в длительном стрессе.
 Важно своевременно проводить обслуживание аквариума и оборудования, следить за качеством воды
и используемого корма.
Для профилактики попадания болезнетворных микроорганизмов в аквариум, полезно ультрафиолетовое облучение воды.
Важно своевременно проводить обслуживание аквариума и оборудования, следить за качеством воды
и используемого корма.
Для профилактики попадания болезнетворных микроорганизмов в аквариум, полезно ультрафиолетовое облучение воды. 2. Бранхиомикозы (возбудитель - Branchiomyces)
Бранхиомикоз — острое заболевание, очень заразное, которое характеризуется некротическим распадом жабр. Если это заболевание появилось в аквариуме, то можно потерять всех его обитателей. Источником заражения могут выступать больные рыбки, некротизированные участки жаберных лепестков которых попадают в аквариумную воду со спорами грибков и разносятся по всему аквариуму.
Жабры карпа поражённые Branchiomyces sanguinis
Причины:
Возбудителями бранхиомикоза является грибки Branchiomyces demigrans и Branchiomyces sanguinis,
излюбленная локализация которых – жаберные лепестки (соединительная ткань и просветы кровеносных сосудов). Оба вида грибка великолепно развиваются при температуре воды 25-32 °С.
Грибки обитают исключительно в жабрах, а по кровеносным сосудам споры грибков могут разноситься по всему телу.
Жаберная гниль может поражать любых рыб , однако особенно опасная для тех рыбок,
чей иммунитет ослаблен какими-либо заболеваниями или неблагоприятными условиями обитания.
Болезнь имеет стремительное развитие и высокий процент заражения всего населения аквариума
– за неделю господства этих грибков в аквариуме может погибнуть до 70% его обитателей.
Заболевание поражает обычно пресноводных рыбок, в особенности, если они содержатся в неблагоприятных условиях.
Увеличивают вероятность возникновения заболевания: наличие в аквариумной воде различных органических веществ,
фрагментов подгнивших растений, слишком высокая температура воды в аквариуме, щелочная среда воды.
Если аквариум чистый, хорошо ухоженный, то это заболевание там никогда не появится.
Оба вида грибка великолепно развиваются при температуре воды 25-32 °С.
Грибки обитают исключительно в жабрах, а по кровеносным сосудам споры грибков могут разноситься по всему телу.
Жаберная гниль может поражать любых рыб , однако особенно опасная для тех рыбок,
чей иммунитет ослаблен какими-либо заболеваниями или неблагоприятными условиями обитания.
Болезнь имеет стремительное развитие и высокий процент заражения всего населения аквариума
– за неделю господства этих грибков в аквариуме может погибнуть до 70% его обитателей.
Заболевание поражает обычно пресноводных рыбок, в особенности, если они содержатся в неблагоприятных условиях.
Увеличивают вероятность возникновения заболевания: наличие в аквариумной воде различных органических веществ,
фрагментов подгнивших растений, слишком высокая температура воды в аквариуме, щелочная среда воды.
Если аквариум чистый, хорошо ухоженный, то это заболевание там никогда не появится.
Жабры рыбы поражённые Branchiomyces sanguinis
Рыбы, поражённые жаберной гнилью, теряют аппетит, становятся безучастными к внешним раздражителям. Вследствие того, что поражаются жабры
– дыхательный орган, то рыбки испытывают недостаток кислорода. Из-за этого они периодически всплывают на поверхность воды и заглатывают ртом
атмосферный воздух.
Происходит деформация жаберных крышек, а на жаберных лепестках можно заметить кровоизлияния точечного характера, а также на них могут быть участки яркокрасного,
темно-синего, бледного цвета. Затем пораженные участки жабр некротизируются и отторгаются, вследствие чего жабры выглядят искрошенными.
В терминальной стадии заболевания рыбка начинает плавать на боку, а затем погибает в таком же положении.
При обнаружении данной патологии, больных особей следует отсадить в карантинный аквариум, в котором разведена малахитовая зелень из расчёта 0,04 мг/л.
 Общий аквариум нужно освободить от грунта и растений, хорошо вымыть и продезинфицировать.
Если же начать вовремя лечение, то рыбка может выздороветь, однако жаберные лепестки регенерируют очень долго.
Общий аквариум нужно освободить от грунта и растений, хорошо вымыть и продезинфицировать.
Если же начать вовремя лечение, то рыбка может выздороветь, однако жаберные лепестки регенерируют очень долго. Профилактика:
Лучше профилактикой бранхиомикозов является поддержание чистоты воды и грунта в аквариуме. Если следовать этим рекомендациям, то бранхиомикоз аквариуму не страшен.
3. Системные микозы
Системные микозы поражают весь организм рыб в целом, иногда с преимущественным поражением каких-либо органов.
Candida — возбудители тяжёлых микозов. При этом происходит поражение кожи, жабр, крови, внутренних полостей,
почек и кишечника. У заболевших рыб вздувается брюшко, и воспаляются кишечник и почки.
Exophiala — вызывает поражение внутренних органов тропических морских рыбок, форелей, сомов.
Ochroconis — редко является патогенным для рыб, однако при поражении происходят патологические процессы в почках и иных внутренних органах. Тело больной рыбы вздуто, так как наполнено жидкостью, внутренние органы воспалены.
Тело больной рыбы вздуто, так как наполнено жидкостью, внутренние органы воспалены.
Неоновая болезнь – Плистифороз (Plistiphora hyphessobryconis).
Этим заболеванием страдают неоны, эритрозонусы, брахиданио, хемиграммусы.
Причины: Возбудителем плистифороза является грибок споровик Plistiphora hyphessobryconis.
Живёт в мышечной ткани рыбы. Возбудитель попадает в аквариум из другого заражённого аквариума вместе с растениями,
инвентарём, кормом, грунтом, если они не были подвержены дезинфекции, а также с самими аквариумными рыбками.
Далее источником заболевания является больная рыбка, споры грибков от неё очень быстро попадают в воду и заглатываются другими рыбками.
Распространение болезни очень быстрое. Если возбудитель попал в аквариум и проник в тело рыбки, то вылечить её уже невозможно.
Симптомы:
Сначала у неонов светящаяся на теле полоса теряет интенсивность цвета на определённых участках тела,
а затем становится вся блеклой. У остальных рыбок просто окраска тела становится тусклой.
Рыбы, которые обычно живут в стаях, начинают плавать по одиночке, перестают питаться,
теряют массу тела, ведут себя беспокойно даже по ночам, держатся в толще воды под углом 60° хвостовой частью,
и, чтобы принять горизонтальное положение, делают скачкообразные движения.
Вследствие таких изменений искривляется позвоночник, а брюшко становится впалым,
нередко происходит разрушение плавников.
У остальных рыбок просто окраска тела становится тусклой.
Рыбы, которые обычно живут в стаях, начинают плавать по одиночке, перестают питаться,
теряют массу тела, ведут себя беспокойно даже по ночам, держатся в толще воды под углом 60° хвостовой частью,
и, чтобы принять горизонтальное положение, делают скачкообразные движения.
Вследствие таких изменений искривляется позвоночник, а брюшко становится впалым,
нередко происходит разрушение плавников.
Лечение:
Излечение от этого заболевания невозможно. Лекарственные препараты лишь приглушают заболевание,
сдерживая рост мицелия гриба и образование спор. Это заболевание очень заразно и опасно,
поэтому не следует применять для лечения рыб ультрафиолетовые очистительные системы,
поскольку при проникновении туда возбудителя, удалить его из системы уже нельзя.
При обнаружении неоновой болезни всех рыбок нужно уничтожить, даже внешне здоровых,
поскольку они тоже могут быть источником грибка Plistiphora hyphessobryconis. Эта мера является особенно важной для тех аквариумистов, которые занимаются разведением аквариумных рыбок или специализированных зоомагазинов:
лучше потерять один аквариум, чем всех рыбок, которые имеются в наличии. После уничтожения рыбок,
аквариум и приборы, находящиеся в нём, следует вымыть и продезинфицировать для окончательного избавления от спор грибка. Профилактика:
Эта мера является особенно важной для тех аквариумистов, которые занимаются разведением аквариумных рыбок или специализированных зоомагазинов:
лучше потерять один аквариум, чем всех рыбок, которые имеются в наличии. После уничтожения рыбок,
аквариум и приборы, находящиеся в нём, следует вымыть и продезинфицировать для окончательного избавления от спор грибка. Профилактика:
Профилактировать данное заболевание невозможно.
Ихтиоспоридиоз (ихтиофоноз) или пьяная болезнь.
Ихтиоспоридиоз (ихтиофоноз) является одним из самых опасных и распространенных грибковых заболеваний аквариумных рыбок.
Этим заболеванием могут страдать также пресноводные и морские рыбы.
Причины:
Возбудителем данного заболевания являются грибок Ichthyosporidium hoferi из рода фикомицетол. Грибок паразитирует во всех тканях и внутренних органах рыб, исключая кожу, хрящевую и костную ткани.
 Заболевание поражает аквариумных рыбок всех возрастов.
Гибель всех рыбок в аквариуме наблюдается крайне редко. Источником заболевания являются заболевшие рыбки,
также трупы умерших от этого заболевания рыб, заражённая вода, которая содержит споры грибка I.hofeli.
Заражение рыбок происходит при заглатывании спор, которые поступают в воду из пищеварительного тракта больной рыбки.
Кроме того, заразить рыбу можно при кормлении её фаршем из морских рыб, поражённых ихтиоспоридиями.
Есть данные о том, что ихтиофонозм можно заразить рыб при кормлении некоторыми беспозвоночными,
содержащими в себе споры грибка I. hofeli.
Заболевание поражает аквариумных рыбок всех возрастов.
Гибель всех рыбок в аквариуме наблюдается крайне редко. Источником заболевания являются заболевшие рыбки,
также трупы умерших от этого заболевания рыб, заражённая вода, которая содержит споры грибка I.hofeli.
Заражение рыбок происходит при заглатывании спор, которые поступают в воду из пищеварительного тракта больной рыбки.
Кроме того, заразить рыбу можно при кормлении её фаршем из морских рыб, поражённых ихтиоспоридиями.
Есть данные о том, что ихтиофонозм можно заразить рыб при кормлении некоторыми беспозвоночными,
содержащими в себе споры грибка I. hofeli.После проникновения спор или цист гриба в желудок, начинается размножения паразита. Затем они проникают в кишечник, внедряются в слизистую оболочку и с током крови разносятся по всему организму, проникая при этом во внутренние органы и ткани. Новые споры грибка выводятся через кишечник естественным путём и заглатываются здоровыми особями.

Симптомы заболевания зависят от характера поражения, то есть от органа, который наиболее поражён грибком. К примеру, если грибок развивается преимущественно в нервной системе рыбы, то можно обнаружить симптомы, которые связаны с нарушением координации движений — заболевшая рыбка становится неспособной к характерным движениям, движется неуверенно, беспорядочно и вяло, движения её становятся судорожными.
Если произошло поражение жаберных лепестков, то рыба внешне ведёт себя как обычно, однако гибнет от удушья.
Если грибок размножается в печени и почках, то обращает на себя внимание пучеглазие, ерошение чешуи и скоплению жидкости в полости тела.
Если грибок паразитирует на плавательном пузыре, то это ведёт к нарушению гидростатического равновесия рыбы в воде, в результате чего она не может удержаться в толще воды и лежит на дне аквариума.
При паразитировании грибка в мышечной ткани и коже рыбка ведёт себя вяло, а на коже образуются поверхностные язвы, в которые могут внедряться уже другие болезнетворные микроорганизмы, ухудшая течение заболевания.

При всех этих проявлениях рыба также теряет аппетит, худеет, она становится более восприимчивой к неблагоприятной среде обитания и другим возбудителям инфекционных заболеваний.
Заболевание длиться долго, больше года, а рыбки массово никогда не погибают.
Лечение:
Вылечить ихтиоспоридиоз невозможно, поэтому поражённым этим заболеванием рыб целесообразно уничтожать.
Профилактика: Так как лечение не представляется возможным, то необходимо приложить огромные усилия для предотвращения проникновения возбудителя в аквариум.
Грибки могут находиться в морском корме ( измельчённая рыба, ракообразные). Поэтому для профилактики ихтиоспоридиоза лучше отказаться от его применения. Кроме того, нужно предотвращать поедание рыбами умерших особей – следует трупы рыбок немедленно удалять из аквариума, поскольку в них может находиться грибок.

Рекомендуемые препараты для лечения грибковых заболеваний:
HS Аqua FUNGICELL, JBL FUNGOL, Sera MYCOPUR, Tetra FungiStop
Аквариум соль
Пуд соли в аквариум- сколько соли в аквариум добавить?
ПУД СОЛИ В АКВАРИУМ сколько соли в аквариум добавлять-то?
Обыкновенная кухонная соль применяется в аквариумном мире в основном для лечения приболевших рыбок. С помощью поваренной соли лечат такие заболевания рыбок, как: хилодонеллез, триходиноз, тетрахименоз, оодиниумоз, апиозомоз. При этом рыбкам делают либо индивидуальные соляные ванночки либо добавляют соль в общий аквариум.
При лечении рыбок в общем аквариуме лучше использовать каменную соль. Соляной раствор готовят из расчета 1-1,5 чайной ложки соли на 10л. аквариумной воды. Лечение рыбы солью проводят при температура воды от 27 до 31С. Фильтр не отключают. Воду подменивают в обычном порядке.
Для лечения рыбок в отдельных ванночках рекомендуется 1 столовая ложка соли на 10л. аквариумной воды. Проводить лечение рыбок в отдельных ванночках – это морока, но мне кажется, этот способ лечения гораздо лучше переноситься рыбками, т.к. действие соли кратковременно.
!!!Побочные эффекты!!!: от соли рыбок «юлозит» - они крутятся, носятся и т.д., кроме того рыбки начинают тяжело дышать. Поэтому советую Вам аккуратно проводить такие процедуры. Лучше делать раствор слабее, тем более, если лечение проходят нежные, маленькие или слабые рыбки.
Совет: Не пересаживайте рыбку сразу после соляной ванночки в общий аквариум (этим Вы только навредите). Постепенно добавляйте чистую воду, до состояния «слабосолености», а потом уж присаживайте животинку.
С лечением солью разобрались… можно добавить лишь то, что слабый раствор простой соли можно использовать также для профилактики заболеваний рыбок. Особенно, если есть подозрения, что например новые рыбки заразны.
Стоит добавить, что некоторые виды рыбок любят подсоленную воду. Каждый вид таких рыбок имеет свои предпочтения солености. Например, тетрадон любит 1 столовую ложку соли на 10 литров воды.
Ну и конечно, есть специальная аквариумная соль для морского аквариума и морских солонолюбивых рыбок, но это уже другая история…
ДОПОЛНЕНИЕ: Соль поваренная, морская - антисептическое и фунгицидное средство. Уже много лет используется как общедоступное и довольно эффективное средство для лечения многих видов бактериальных и некоторых паразитарных заболеваний аквариумных рыб, а также как профилактическое средство при содержании многих видов живородящих карпозубых. Применяют для профилактики грибковой и бактериальной инфекции. Полезна (в комбинации с повышенной температурой) от многих эктопаразитов (кожных и жаберных сосальщиков), ихтиофтириусов, при проблемах со слизистой оболочкой, загноениях, случайных повреждениях кожного покрова и грибков.
 Лучше использовать пищевую каменную соль грубого помола, в кубиках и кристаллическую морскую соль, но только без всяких добавок. Нельзя использовать йодированную соль! Применяют для лечения Бранхиомикоза, Гиоза, Гиродактилеза, Дактилогироза, Диплозооноза, Костиоза, Колумнариоза, Лепидортоза, Плистофороза, Сапролегниоза, Сангвиникоза, Ихтиофтириоза, Хилодонеллеза, Тетраонхоза, Триходиниоза и эктопаразитов.
Лучше использовать пищевую каменную соль грубого помола, в кубиках и кристаллическую морскую соль, но только без всяких добавок. Нельзя использовать йодированную соль! Применяют для лечения Бранхиомикоза, Гиоза, Гиродактилеза, Дактилогироза, Диплозооноза, Костиоза, Колумнариоза, Лепидортоза, Плистофороза, Сапролегниоза, Сангвиникоза, Ихтиофтириоза, Хилодонеллеза, Тетраонхоза, Триходиниоза и эктопаразитов.Увеличение солености воды вызывает у рыб дополнительное слизеотделение, которое помогает устранить легкие инфекционные поражения. Некоторые виды рыб хорошо переносят соль (живородки, восточно-африканские цихлиды, радужницы), Некоторые виды рыб, в первую очередь харациновые и сомовидные, боциии некоторые беспозвоночные солевых ванн не выдерживают. Для большинства представителей родов Corydoras, Thoracatum, Dianema, Brochisи Aspidoras предельная концентрация составляет 1-2 граммана литр. Особенно вредно устраивать им продолжительные ванныв общем аквариуме при небольших концентрациях соли.
 Анциструсы и другие лорикариды к лечению солью относятся спокойно. Очень не любит соли суматранский барбус. Осторожно надо лечить солью молодых лабиринтовых рыбок. Не стоит применять соль в декоративных общих аквариумах с растениями. Высшим водным растениям очень не нравятся высокие концентрации ионов натрия и хлора, но водорослям, которые так злостно портят весь дизайн, они не мешают размножаться без меры. Регулярное добавление соли в аквариум ведет к засаливанию воды.По окончании лечения воду в аквариуме заменяют в 2-3 приема. Хочу еще раз обратить внимание читателей на необходимость точного подбора концентрации солевого раствора. Гарантированно убивает всю нечисть 4-5% раствор, но редкая аквариумная рыбка продержится внемдаже 1-2 минуты,не говоряужо минимально необходимых 5 минут. Но существенное лечебное действие оказывает даже 1.5-1.7% раствор. Его способны перенести почти все рыбы в течение 10-15 минут. При острой необходимости в нем можно и сомиков выкупать. Как правило, 2% раствор оказывается оптимальным (время купания 10 минут).
Анциструсы и другие лорикариды к лечению солью относятся спокойно. Очень не любит соли суматранский барбус. Осторожно надо лечить солью молодых лабиринтовых рыбок. Не стоит применять соль в декоративных общих аквариумах с растениями. Высшим водным растениям очень не нравятся высокие концентрации ионов натрия и хлора, но водорослям, которые так злостно портят весь дизайн, они не мешают размножаться без меры. Регулярное добавление соли в аквариум ведет к засаливанию воды.По окончании лечения воду в аквариуме заменяют в 2-3 приема. Хочу еще раз обратить внимание читателей на необходимость точного подбора концентрации солевого раствора. Гарантированно убивает всю нечисть 4-5% раствор, но редкая аквариумная рыбка продержится внемдаже 1-2 минуты,не говоряужо минимально необходимых 5 минут. Но существенное лечебное действие оказывает даже 1.5-1.7% раствор. Его способны перенести почти все рыбы в течение 10-15 минут. При острой необходимости в нем можно и сомиков выкупать. Как правило, 2% раствор оказывается оптимальным (время купания 10 минут). Очень внимательно наблюдайте за рыбками. Если их начинает выталкивать из воды,они лежат на поверхности на боку и не могут уйти вниз, значит надо срочно прекратить процедуру. Вовремя купания емкость с рыбами должна умеренно аэрироваться.
Очень внимательно наблюдайте за рыбками. Если их начинает выталкивать из воды,они лежат на поверхности на боку и не могут уйти вниз, значит надо срочно прекратить процедуру. Вовремя купания емкость с рыбами должна умеренно аэрироваться.Температуру воды надо поднять за 2-3 дня до 28-30°С при усиленной аэрации. Доза 1-2гр. соли на литр для профилактики, а для укоренившейся грибковой и бактериальной инфекции 10 гр/л -эту концентрацию достигают постепенно в течение 2 дней, увеличивая каждые 4-6 часов на 0,1%. Для лечения молодии ослабевшей рыбы применяют менее концентрированный раствор. Если рыбы начинают себя плохо чувствовать, то надо немедленно разбавить аквариумную воду свежей отстоянной водой. Лечение длится 10-30 дней. Для ванн доза 10-15 г/лна 20минут. Кратковременные солевые ванны хорошо помогают при таких заболеваниях аквариумных рыбок как сапролегниоз, костиоз, оодиниумоз, хилодонеллез, триходиноз, апиозомоз, тетрахименоз, гиродактилез, дактилогироз. Специфические средства борьбы с ними могут быть совершенно разными, но достаточно высокие концентрации соли убивают их всех.
 Соль также используется для нейтрализации нитритов, для борьбы с паразитами Piscinoodinumи пиявками. Отсоединения пиявок можно добиться с помощью краткосрочных ванн в 2,5% растворе соли.
Соль также используется для нейтрализации нитритов, для борьбы с паразитами Piscinoodinumи пиявками. Отсоединения пиявок можно добиться с помощью краткосрочных ванн в 2,5% растворе соли.Комментарий: Несмотря на наличие современных специализированных лекарств, поваренная соль и в настоящее время широко используется в аквариумистике. В малых дозах и при условии отсутствия чувствительных рыб может применяться в общем аквариуме, в больших дозах следует лечить в отдельной емкости.
fanfishka.ru>
Как лечить аквариумных рыбок с помощью соли
При каких заболеваниях используется соляной раствор
Правила использования соляного раствора для лечения рыбы
Как делать солевые ванны
AkvariumnyeRybki.ru>
Борис Гребенщиков - СОЛЬ (Full Album)
Другие статьи
Saprolegnia parasitica – обзор
1.
 08.3.1 Грибы
08.3.1 Грибы Грибы представляют собой таксономическую группу с хорошо развитым метаболизмом жирных кислот в эйкозаноиды, а также в другие классы оксилипинов. Химия жирных кислот грибов ранее рассматривалась в контексте грибковых липидов 15 и их биологической активности. 16 Таксономический порядок описания грибов является произвольным, а таксономические позиции указываются в скобках, так как в любой таксономической группе имеется недостаточное количество примеров, чтобы расположение, основанное на систематике, было полезным.Таксономическое положение этих родов и видов, описанных ниже, дано согласно Hawksworth et al . 17 В целом, жирные кислоты грибов являются высокополиненасыщенными и имеют большое количество цепей C 18 , причем C 16 и C 20 являются обычными, но менее распространенными. В некоторых случаях, таких как мицелиальный гриб Mortierella alpina (Zygomycota, Zygomycetes, Mucorales, Mortierellaceae), арахидоновая кислота является основной жирной кислотой, составляющей более 70% от общего количества жирных кислот. 18 В этой группе выделяются жирные кислоты с двойными связями ω3; из Saprolegnia parasitica была выделена и охарактеризована C-20-специфичная ω3-десатураза. 19
18 В этой группе выделяются жирные кислоты с двойными связями ω3; из Saprolegnia parasitica была выделена и охарактеризована C-20-специфичная ω3-десатураза. 19
Функции оксилипинов в грибах многочисленны и разнообразны. Например, добавление ингибиторов ЛО к культурам Lagenidium giganteum (Oomycota, Pythiales, Pythiaceae) приводило к стадиеспецифическому торможению различных онтогенетических и половых процессов, в том числе ооспорогенеза. 20 Было показано, что применение простагландинов устраняет это торможение. 21 В других случаях, таких как Laetisaria arvalis , 22 оксилипины, очевидно, используются в качестве аллелопатических агентов для подавления роста конкурирующих видов грибов.
В грибах предшественники ПНЖК окислительно метаболизируются различными путями как до очень простых эпокси- и гидроксижирных кислот, так и до более сложных и карбоциклических веществ. 15,23 В соответствии с их жирнокислотным составом, большинство из них происходят из жирных кислот C 18 , хотя в некоторых случаях происходит метаболизм кислот C 14 , C 16 и C 20 . В классе C 18 метаболизм происходит у различных видов с помощью окислительных ферментов, специфичных для C-8, C-9, C-10, C-12 и C-17. Ферментные системы, участвующие в начальном окислении этих субстратов жирных кислот, относятся как к цитохрому Р450, так и к классу LO.Сообщалось также о различных восковых эфирах с дополнительными участками окисления из грибов. 24
15,23 В соответствии с их жирнокислотным составом, большинство из них происходят из жирных кислот C 18 , хотя в некоторых случаях происходит метаболизм кислот C 14 , C 16 и C 20 . В классе C 18 метаболизм происходит у различных видов с помощью окислительных ферментов, специфичных для C-8, C-9, C-10, C-12 и C-17. Ферментные системы, участвующие в начальном окислении этих субстратов жирных кислот, относятся как к цитохрому Р450, так и к классу LO.Сообщалось также о различных восковых эфирах с дополнительными участками окисления из грибов. 24
Одной из наиболее распространенных тем в метаболизме грибов является окисление цитохромом P450 предшественников ненасыщенных жирных кислот до эпоксидов, таких как Puccia framinis tritici (стеблевая ржавчина пшеницы, Basidiomycota, Teliomycetes, Uredinales, 25 и Claviceps spp. (Ascomycota, Hypocreales, Clavicipitaceae). 26 По-видимому, олеиновая кислота является жирной кислотой, наиболее часто эпоксидируемой таким образом с образованием (-)- цис--9,10-эпоксистеариновой кислоты ( 4 ).Было показано, что молекулярный кислород метит образующуюся эпоксидную жирную кислоту. 25 Этот эпоксид был получен из ряда других грибов, высших растений и грамотрицательных бактерий. 26 Из большинства часто подвергается действию эпоксидгидролазы с образованием (+)- трео -9,10-дигидроксистеариновой кислоты ( 5 ). 25
(Ascomycota, Hypocreales, Clavicipitaceae). 26 По-видимому, олеиновая кислота является жирной кислотой, наиболее часто эпоксидируемой таким образом с образованием (-)- цис--9,10-эпоксистеариновой кислоты ( 4 ).Было показано, что молекулярный кислород метит образующуюся эпоксидную жирную кислоту. 25 Этот эпоксид был получен из ряда других грибов, высших растений и грамотрицательных бактерий. 26 Из большинства часто подвергается действию эпоксидгидролазы с образованием (+)- трео -9,10-дигидроксистеариновой кислоты ( 5 ). 25
Окислительные ферменты гриба Fusarium oxysporum (Ascomycota, Hypocreales, Hypocreaceae) изучались в течение значительного периода времени и позволили получить как LO, так и несколько цитохромов P450. F. oxysporum LO был выделен, кристаллизован и частично охарактеризован. 27 Этот предполагаемый LO уникален тем, что он имеет высокий оптимум pH (> 9), стабилизирован Co 2+ , имеет относительно небольшой размер (10–30 кДа) и наиболее легко утилизирует линолевую кислоту. . 28 Продукты грибкового LO метаболизма линолевой кислоты при рН 9 позже были охарактеризованы как соотношение 70:30 9-( 6 ) и 13-гидропероксиоктадекадиеновой кислоты ( 7 ).Кислород был включен в эти гидропероксикислоты из 18 O 2 . Хиральность процесса не исследована. Другие более полярные продукты образуются при взаимодействии этого ЛО с линолевой кислотой; однако они остаются неохарактеризованными. 27 Жирная кислота, метаболизирующая цитохром P450 из этого гриба (P450oxy), который оптимально окисляет лауриновую кислоту (C 12:0 ) в положениях ω2 и ω3 до гидроксижирных кислот, также уникален тем, что он каталитически самодостаточный фермент, содержащий домены Р450 и редуктазы.
27 Этот предполагаемый LO уникален тем, что он имеет высокий оптимум pH (> 9), стабилизирован Co 2+ , имеет относительно небольшой размер (10–30 кДа) и наиболее легко утилизирует линолевую кислоту. . 28 Продукты грибкового LO метаболизма линолевой кислоты при рН 9 позже были охарактеризованы как соотношение 70:30 9-( 6 ) и 13-гидропероксиоктадекадиеновой кислоты ( 7 ).Кислород был включен в эти гидропероксикислоты из 18 O 2 . Хиральность процесса не исследована. Другие более полярные продукты образуются при взаимодействии этого ЛО с линолевой кислотой; однако они остаются неохарактеризованными. 27 Жирная кислота, метаболизирующая цитохром P450 из этого гриба (P450oxy), который оптимально окисляет лауриновую кислоту (C 12:0 ) в положениях ω2 и ω3 до гидроксижирных кислот, также уникален тем, что он каталитически самодостаточный фермент, содержащий домены Р450 и редуктазы. 29 Эта двойственность активности, а также его молекулярный размер ( M r = 118 кДа), высокий каталитический оборот и региоселективность субстрата почти идентичны бактериям P450 из Bacillus megaterium , предполагая возможность тесной эволюционной связи между этими ферментами. 30
29 Эта двойственность активности, а также его молекулярный размер ( M r = 118 кДа), высокий каталитический оборот и региоселективность субстрата почти идентичны бактериям P450 из Bacillus megaterium , предполагая возможность тесной эволюционной связи между этими ферментами. 30
Частично характерный запах грибов обусловлен производным оксилипина фрагментом 1,5 Z -октадиен-3 R -ол ( 8 ). 31–33 Образование этого соединения белковой фракцией из Psalliota bispora (Basidiomycetes, Basidiomycetes, Agaricaceae) изучено достаточно подробно (схема 2). Путь инициируется уникальной диоксигеназой, которая превращает линолевую или линоленовую кислоты в соответствующие 8 E ,10-гидропероксиды, предположительно 10 S -стереоизомеры. 33 Эта реакция отличается от других диоксигеназ тем, что в результате окисления не образуется сопряженный диен. 10 S -гидропероксиоктадека-8 E ,12 Z -диеновая кислота является субстратом для предполагаемой гидропероксидлиазы 2 «гомолитического типа», которая фрагментирует связь С-10—С-11 и переносит дистальный кислород гидропероксида к С-14, возможно, согласованным образом. 33 Фрагмент C-1—C-10, 10-оксо-8 E -деценовая кислота ( 9 ) также был охарактеризован как продукт этого метаболизма P. bispora . 33 Любопытно, что энантиомер 1,5 Z -октадиен-3 S -ол ( 10 ) был выделен из красной водоросли Chondrococcus hornemannni . 34 34
10 S -гидропероксиоктадека-8 E ,12 Z -диеновая кислота является субстратом для предполагаемой гидропероксидлиазы 2 «гомолитического типа», которая фрагментирует связь С-10—С-11 и переносит дистальный кислород гидропероксида к С-14, возможно, согласованным образом. 33 Фрагмент C-1—C-10, 10-оксо-8 E -деценовая кислота ( 9 ) также был охарактеризован как продукт этого метаболизма P. bispora . 33 Любопытно, что энантиомер 1,5 Z -октадиен-3 S -ол ( 10 ) был выделен из красной водоросли Chondrococcus hornemannni . 34 34
Схема 2.
Пшеничная паразитарная грибная Gaeumannomyces Graminis (Ascomycota, Magnaporthaceae) обладает как диоксигеназой 35,36 и омега-гидроксилазой 37 и создает множество необычно продукты окисления линолевой кислоты. Основными продуктами диоксигеназы являются 8 R -Гидроксилинолея кислота ( 11 ) и 7 S , 8 S -дигидроксилинолея кислота ( 12 ) 35 , в то время как омега гидроксилаза в основном окисляет ω2 и ω3-положения различных субстратов жирных кислот. Этот последний фермент, предположительно цитохром Р450, подробно не изучался из этого источника, но, возможно, связан с аналогичной системой, описанной для других грибов (например, F.оксиспориум ). 29 Диоксигеназа G. graminis , а также другого гриба L. arvalis (Basidiomycota, Basidiomycetes, Stereales, Corticiaceae),
Основными продуктами диоксигеназы являются 8 R -Гидроксилинолея кислота ( 11 ) и 7 S , 8 S -дигидроксилинолея кислота ( 12 ) 35 , в то время как омега гидроксилаза в основном окисляет ω2 и ω3-положения различных субстратов жирных кислот. Этот последний фермент, предположительно цитохром Р450, подробно не изучался из этого источника, но, возможно, связан с аналогичной системой, описанной для других грибов (например, F.оксиспориум ). 29 Диоксигеназа G. graminis , а также другого гриба L. arvalis (Basidiomycota, Basidiomycetes, Stereales, Corticiaceae), 8 отличается от диоксигеназы 7 LO
38 9000 в субстрате требуется двойная связь 9 Z и насыщенная карбоксильная боковая цепь, и молекулярный кислород добавляется к C-8 без изменения положения или геометрии соседней двойной связи. 35,38 У обоих грибов диоксигеназа продуцирует 8 R -гидропероксид, и у обоих он восстанавливается с образованием гидроксикислоты, 8 R -гидроксилинолевой кислоты ( 11 ). В L. arvalis эта уникальная кислота, названная лаэтизаровой кислотой ( 11 ), была идентифицирована как аллелопатический агент, который быстро вызывает лизис гиф у потенциально конкурирующих грибов. 22 G. graminis превращает 8 R -гидропероксилинолевую кислоту в 7 S ,8 S -дигидроксилиноленовую кислоту ( а катализ-изомер 12 перегруппиров. 35 Охарактеризованы стереохимии абстрагирования водорода в реакциях диоксигеназы и гидропероксидизомеразы; диоксигеназа удаляет pro -8 S водород и антарафациально вставляет дикислород для чистой инверсии конфигурации в C-8, тогда как гидропероксидизомераза производит threo диол путем отщепления pro -7 S и супрафациальный внутримолекулярный перенос дистального гидропероксидного кислорода для чистого сохранения конфигурации при С-7. 36 Аналогичная внутримолекулярная перегруппировка гидропероксида в вицинальный диол была охарактеризована у красной водоросли Gracilariopsis lemaneiformis , хотя в этом случае образуется эритро диол.
В L. arvalis эта уникальная кислота, названная лаэтизаровой кислотой ( 11 ), была идентифицирована как аллелопатический агент, который быстро вызывает лизис гиф у потенциально конкурирующих грибов. 22 G. graminis превращает 8 R -гидропероксилинолевую кислоту в 7 S ,8 S -дигидроксилиноленовую кислоту ( а катализ-изомер 12 перегруппиров. 35 Охарактеризованы стереохимии абстрагирования водорода в реакциях диоксигеназы и гидропероксидизомеразы; диоксигеназа удаляет pro -8 S водород и антарафациально вставляет дикислород для чистой инверсии конфигурации в C-8, тогда как гидропероксидизомераза производит threo диол путем отщепления pro -7 S и супрафациальный внутримолекулярный перенос дистального гидропероксидного кислорода для чистого сохранения конфигурации при С-7. 36 Аналогичная внутримолекулярная перегруппировка гидропероксида в вицинальный диол была охарактеризована у красной водоросли Gracilariopsis lemaneiformis , хотя в этом случае образуется эритро диол. 1
1
S. parasitica (Oomycota, Saprolegniales, Saprolegniaceae) является богатым источником эйкозапентаеновой кислоты (EPA) и метил-направленной десатурации C 20 жирных кислот (например, AA ) в EPA было описано. 19 Впоследствии было сообщено о метаболизме АК в S. parasitica с выделением и полным структурным описанием двух новых эпоксидных спиртов, 11 S ,12 R -epoxy-15 S -гидрокси 5 Z , 8 Z , 13 Z , 13 E -осатриееная кислота ( 13 ) и 13 R , 14 R -3 R -Poxy-15 S -Hydroxy-5 Z , 8 Z ,11 Z -эйкозатриеновая кислота ( 14 ). 39,40 Также был зарегистрирован некоторый эндогенный метаболизм С 18 жирных кислот в аналогичные эпоксиспирты. 39 Было показано, что метаболиты C 20 образуются через посредство 15 S -гидроперокси-5,8,11,13-эйкозатетраеновой кислоты (15 S -гидропероксиэйкозатетраеновой кислоты) и Было показано, что кислород эпоксида в каждом случае происходит за счет внутримолекулярного переноса дистального кислорода гидропероксида (схема 3). 41 Предлагаемый путь включает последовательное действие 15 S -LO и гидропероксидизомеразы. Эти активности были частично очищены от грибка и на основе совместной хроматографии на нескольких системах поддержки и сходства в некоторых других свойствах предположили, что они принадлежат одному и тому же полипептиду 145–150 кДа. 22 Дальнейшее изучение пути с использованием различных субстратов C 18 показало, что гидропероксидизомераза всегда вводит эпоксид с одной и той же абсолютной стереохимией, независимо от региохимии или стереохимии гидропероксида (однако разные стереохимии эпоксидов получают в результате эпоксидирования цис или транс двойных связей) (см. схему 3). 33
41 Предлагаемый путь включает последовательное действие 15 S -LO и гидропероксидизомеразы. Эти активности были частично очищены от грибка и на основе совместной хроматографии на нескольких системах поддержки и сходства в некоторых других свойствах предположили, что они принадлежат одному и тому же полипептиду 145–150 кДа. 22 Дальнейшее изучение пути с использованием различных субстратов C 18 показало, что гидропероксидизомераза всегда вводит эпоксид с одной и той же абсолютной стереохимией, независимо от региохимии или стереохимии гидропероксида (однако разные стереохимии эпоксидов получают в результате эпоксидирования цис или транс двойных связей) (см. схему 3). 33
Схема 3.
Сапролегний гриб
Сапролегния – водяной гриб –
Как и любая пресноводная среда, пруды с карпами и золотыми рыбками являются живыми экосистемами. Они содержат растения, водоросли, беспозвоночных, простейших, бактерии и плесени или грибки. Многие формы жизни в наших прудах зависят друг от друга. Это называется симбиозом (совместное проживание). Крайней формой симбиоза является паразитизм, когда одна форма жизни живет за счет другой.Одной из наиболее распространенных форм паразитизма в наших прудах является сапролегния или водяной грибок. Для обычного обывателя не требуется больших зоологических подробностей о сапролегнии, чтобы понять, что это такое, что она делает и как обращаться с прудом и рыбой, если это становится проблемой, поэтому здесь не предлагается много подробностей о зоологии сапролегнии: просто good-
Они содержат растения, водоросли, беспозвоночных, простейших, бактерии и плесени или грибки. Многие формы жизни в наших прудах зависят друг от друга. Это называется симбиозом (совместное проживание). Крайней формой симбиоза является паразитизм, когда одна форма жизни живет за счет другой.Одной из наиболее распространенных форм паразитизма в наших прудах является сапролегния или водяной грибок. Для обычного обывателя не требуется больших зоологических подробностей о сапролегнии, чтобы понять, что это такое, что она делает и как обращаться с прудом и рыбой, если это становится проблемой, поэтому здесь не предлагается много подробностей о зоологии сапролегнии: просто good-
Что это такое: Сапролегния (или сок) — это пресноводный гриб, который просто означает, что он живет в пресноводной среде и нуждается в воде для роста и размножения. Сок также можно найти в солоноватой воде и влажной почве. Его часто называют «холодноводным» грибком, поскольку он процветает в более холодной воде, но хорошо живет и в широком диапазоне температур воды от 37 до 91 градуса по Фаренгейту (от 3 до 31 градуса по Цельсию). Хотя его также называют «плесень», сок — это род грибов, с той разницей, что «плесень» — это масса грибов.
Сок также можно найти в солоноватой воде и влажной почве. Его часто называют «холодноводным» грибком, поскольку он процветает в более холодной воде, но хорошо живет и в широком диапазоне температур воды от 37 до 91 градуса по Фаренгейту (от 3 до 31 градуса по Цельсию). Хотя его также называют «плесень», сок — это род грибов, с той разницей, что «плесень» — это масса грибов.
Под микроскопом сок состоит из нитей со сферическими концами. Именно в этих сферических концах находятся зооспоры или «семена» сока, которые позволяют ему размножаться и распространяться.Нити называются гифами и придают соку вид, напоминающий хлопок. Именно гифы, или, точнее, крючковатый конец гиф, проникают в ткани рыб в поисках питательных веществ. На приведенной ниже микрофотографии с увеличением
В воде сок похож на пушистую вату; однако из воды он кажется спутанным месивом слизи. Сок начинается либо белого, либо серого цвета. Серый цвет также может указывать на присутствие бактерий, растущих в структуре сока. Через короткий промежуток времени сок может стать коричневым или зеленым, поскольку органические частицы в воде (например, водоросли) прилипают к нитям. Обратите внимание на картинку справа. Это классическое проявление сока, проникшего в область спинного плавника кои из-за бактериальной инфекции. Зеленый цвет на самом деле представляет собой частицы водорослей, встроенные в нити сока.
Сок начинается либо белого, либо серого цвета. Серый цвет также может указывать на присутствие бактерий, растущих в структуре сока. Через короткий промежуток времени сок может стать коричневым или зеленым, поскольку органические частицы в воде (например, водоросли) прилипают к нитям. Обратите внимание на картинку справа. Это классическое проявление сока, проникшего в область спинного плавника кои из-за бактериальной инфекции. Зеленый цвет на самом деле представляет собой частицы водорослей, встроенные в нити сока.
По внешнему виду сок легко спутать с Epistylus, пресноводным паразитом, который представляет собой белое хлопковое вещество, растущее на коже рыбы.Эпистиль не собирает органические частицы и остается белым. Подтверждение Epistylus против sap должно быть сделано с помощью микроскопа.
Любимая пища сапа – отмершие органические ткани. Обычно мы можем видеть следы сока на мертвой и умирающей рыбе, живой и мертвой икре рыбы и даже на еде, оставленной в воде так долго, что она начала гнить. Обычно мы видим, что бесплодные яйца кои сначала заражаются грибком, а затем он распространяется, убивая живые оплодотворенные яйца. Зараженные яйца имеют типичное пушистое ватно-
Обычно мы видим, что бесплодные яйца кои сначала заражаются грибком, а затем он распространяется, убивая живые оплодотворенные яйца. Зараженные яйца имеют типичное пушистое ватно-
Первичный и вторичный захватчик: Обычно мы думаем о сапе как о «вторичном» захватчике. Это означает, что что-то еще нарушило целостность кожи рыбы, позволив бактериям проникнуть внутрь и обеспечить прямой доступ к тканям для внедрения сока гиф.При лечении смолы необходимо лечить ОБА смолу и первопричину. Более подробно об этом будет рассказано в разделе лечения ниже.
Тем не менее, сок может также быть первичным возбудителем при правильных условиях, и именно поэтому он получает репутацию «холодноводного» грибка. Все мы знаем, что условия холодной воды, в том числе резкие перепады температуры, вызывают сильный стресс у рыб и подавляют естественную иммунную систему рыб. Как указывалось выше, сок процветает в более холодной воде, производя и выделяя в воду увеличенное количество зооспор.Сочетание стресса, подавления иммунной системы и увеличения количества спор дает соку возможность вызывать серьезные проблемы в более холодной воде. Инфекции сока обычно являются причиной «зимней гибели».
Все мы знаем, что условия холодной воды, в том числе резкие перепады температуры, вызывают сильный стресс у рыб и подавляют естественную иммунную систему рыб. Как указывалось выше, сок процветает в более холодной воде, производя и выделяя в воду увеличенное количество зооспор.Сочетание стресса, подавления иммунной системы и увеличения количества спор дает соку возможность вызывать серьезные проблемы в более холодной воде. Инфекции сока обычно являются причиной «зимней гибели».
Ниже приведен список условий, поддерживающих распространение сока:
- Перенаселение – стресс и слишком много органических веществ в слишком малом количестве воды
- Обращение – стресс и удаление слизистой оболочки рыбы
- Целостность эпидермиса – открытые раны, обеспечивающие прямой доступ к тканям
- Паразиты и патогены – паразиты вызывают раны, которые позволяют болезнетворным микроорганизмам (например, бактериям) проникать в ткани, что приводит к изменению сока и стрессу
- Загрязнение – стресс и снижение качества воды
- Нерест – стресс и физическое повреждение
- Качество воды – стресс и ухудшение физиологических условий
- Вода перепады температуры – стресс.

Очевидно, что основной темой приведенного выше списка является «стресс», и это единственная вещь, от которой мы должны в первую очередь защищаться, чтобы наши рыбы были здоровы. В здоровых условиях наши рыбы имеют некоторую естественную защиту от сока, при этом слизистый слой является наиболее эффективной первой линией защиты. Слизистый слой обеспечивает способность отражать сокосодержащую атаку, отслаивая слой слизи и отправляя сок вместе с ним. Слизистая оболочка также обеспечивает естественный фунгицид на уровне клеток-
Смерть от сока: повышенная заболеваемость рыбы, вызванная соком, может быть связана с тремя
- Низкая температура воды
- Высокая концентрация сока зооспор
- Механический стресс
Мы знаем, что сок поражает рыбу, ослабленную любым из вышеперечисленных факторов, а подавленный характер иммунной системы в условиях холодной воды или сильного стресса делает рыбу в основном беззащитной. Однако то, что убивает рыбу при атаке сока, - это состояние, известное как гемодилюция. По определению, гемодилюция — это «снижение концентрации (как после кровоизлияния) клеток и твердых веществ в крови в результате поступления жидкости из тканей».
Однако то, что убивает рыбу при атаке сока, - это состояние, известное как гемодилюция. По определению, гемодилюция — это «снижение концентрации (как после кровоизлияния) клеток и твердых веществ в крови в результате поступления жидкости из тканей».
После того, как он (буквально!) укоренился, сок может быстро распространяться по поверхностным тканям рыбы. Хотя сок редко проникает глубоко в слои тканей, даже поверхностное повреждение начальных слоев тканей рыбы (и особенно жабр) может быть смертельным. Очевидно, что чем шире распространяется сап-инфекция, тем выше скорость гемодилюции и выше вероятность того, что рыба не выздоровеет. Таким образом, борьба с инфекцией сока быстро становится ключом к спасению рыбы.
Защита и лечение: очевидно, что лучшее «лекарство» от сока — это профилактика. Как уже упоминалось, сок присутствует в каждом пруду и занимает свое место в порядке жизни в экологии пруда. На самом деле это становится проблемой только тогда, когда что-то пошло не так с рыбой и/или прудом, или такое состояние, как холодная вода, подавляет иммунную систему рыбы. Некоторые из шагов, которые мы можем предпринять, чтобы снизить эффективность sap, включают:
Как уже упоминалось, сок присутствует в каждом пруду и занимает свое место в порядке жизни в экологии пруда. На самом деле это становится проблемой только тогда, когда что-то пошло не так с рыбой и/или прудом, или такое состояние, как холодная вода, подавляет иммунную систему рыбы. Некоторые из шагов, которые мы можем предпринять, чтобы снизить эффективность sap, включают:
- Создание среды, свободной от стресса
(начиная с отличного качества воды) - Активное снижение содержания органических веществ в пруду (хорошая механическая фильтрация и сбалансированная экология).Это также уменьшит естественное количество аэромонадных бактерий
- Быстрое удаление мертвой и умирающей рыбы и лишнего корма
- Надлежащее обращение (которое начинается с минимально возможного обращения)
- Уничтожение паразитов
- Увеличение потока воды в более теплых условиях
Но как бы мы ни старались, особенно в тех прудах, которые расположены в районах с холодной водой и/или резкими перепадами температуры воды, закисание всегда возможно. За исключением отмеченного выше, не существует разумных профилактических мер, включая использование средств против грибка
За исключением отмеченного выше, не существует разумных профилактических мер, включая использование средств против грибка
- Малахитовый зеленый (MG): Несомненно, это лучшее средство от всех грибковых заболеваний, включая сок. MG-ванны и погружения работают исключительно хорошо, и одна процедура обычно решает проблему (при условии, что все сопутствующие причины также устранены).Существуют определенные предостережения, связанные с использованием MG, такие как использование только в более прохладной, хорошо аэрированной воде, поэтому внимательно прочитайте этикетку для получения инструкций и мер предосторожности. MG не рекомендуется использовать в качестве обработки сока для широкого пруда
, поскольку уровни концентрации, необходимые для уничтожения сока, слишком высоки для того, чтобы обработка для широкого пруда была эффективной. 
- Соль: это далеко не самое лучшее лечение MG. Соль в диапазоне от 0,6 до 1,0% в течение 30 минут или меньше может помочь устранить сок. Предостережение при таком подходе заключается в том, что чем выше уровень соли, тем больше стресса будет испытывать рыба, поэтому тщательно проверьте стабильность вашей рыбы, прежде чем выполнять соляную ванну с высоким содержанием соли
. - Формалин: Формалин упоминается как средство для обработки сока, однако, вообще говоря, формалин неэффективен против большинства плесеней и грибков. Как MG и соль, формалин имеет свои собственные меры предосторожности, в том числе ограничение его использования в теплой воде, где могут возникнуть ситуации с низким содержанием кислорода. Обращайтесь с формалином с осторожностью, его токсичность хорошо известна. Разбавленные версии продуктов с формалином предлагают хороший один-два удара, где MG удаляет сок, а формалин уничтожает паразитов. Не рекомендуется применять формалин против открытых ран из-за вредного действия формалина на открытые ткани и клеточные структуры.

- Перманганат калия: в умелых руках полипропилен является одним из лучших средств для лечения сока. Обработка полипропиленом с концентрацией 4 частей на миллион (4 г/1000 литров) устранит большую часть сока, но для глубоко укоренившихся гиф может потребоваться дополнительная обработка поверхности полипропиленовой пастой. Обратной стороной ПП, конечно же, является неотъемлемая опасность его использования вообще. Не рекомендуется для тех, кто неопытен в его использовании.
Лечение рыбы, пораженной сап- В зависимости от размера основной раны могут потребоваться инъекционные препараты и помощь ветеринара.Если вы подозреваете, что холодная вода позволила соку стать первичным захватчиком, по-прежнему требуется внимание к поверхностным тканям пораженной рыбы, поскольку гифы сока проникают в ткани и могут позволить бактериям проникнуть в место раны.
В зависимости от размера основной раны могут потребоваться инъекционные препараты и помощь ветеринара.Если вы подозреваете, что холодная вода позволила соку стать первичным захватчиком, по-прежнему требуется внимание к поверхностным тканям пораженной рыбы, поскольку гифы сока проникают в ткани и могут позволить бактериям проникнуть в место раны.
Много было сказано о важности использования микроскопа в хобби Кои. Микроскоп с увеличением до 400x (например, объектив 40X и окуляр 10X) является бесценным инструментом для диагностики проблем с нашей рыбой, а также для просмотра почти всего спектра экологии наших прудов от водорослей до паразитов и личинок насекомых.При 200-кратном увеличении хорошо видна нитевидная структура сока, а при 400-кратном увеличении четко различимы гифы и сферические концы сока. Кроме того, при 200-кратном увеличении можно легко увидеть движение большинства паразитов, а при 400-кратном увеличении можно обнаружить и идентифицировать практически всех паразитов, которые обычно обитают в наших прудах.
Как видите, sap — одна из основных потенциальных проблем, к которой мы должны быть готовы. Поскольку сок всегда присутствует в наших прудах, необходимо принимать как можно больше профилактических мер, чтобы он не поражал рыб.Но даже у лучших хранителей прудов рано или поздно возникнет соконос, и когда это произойдет, лечение должно быть быстрым и полным, поскольку это не та проблема, которая исчезнет сама собой.
Болезни рыб: сапролегния | Рыбные пруды Фитца
Сапролегния — грибковое заболевание, поражающее рыб. Это серьезное заболевание, особенно для владельцев прудов, которые потратили большие суммы на свою рыбу, поскольку лекарства не существует, а уровень смертности среди пойманной рыбы высок.
Чем опасна сапролегния? Это грибок, относящийся к оомицетам. Обычно он напоминает вату, которая растет на телах рыб. Среди любителей аквариумов и прудов это наиболее широко признанный грибковый патоген, и чаще всего он является сапрофитом, что означает, что он обычно потребляет и процветает на разлагающемся животном или растительном материале.
Если его споры попадут на живую рыбу, рыба обычно будет защищена веществами в ее слизистом слое, которые останавливают прорастание.К сожалению, если у рыбы есть открытые раны, слизистый слой не обеспечит необходимой защиты, и тогда грибок попадет внутрь, где он сможет затем прорасти и передать особые стебли, называемые гифами. Гифы проникают в кожу рыбы и перемещаются дальше в ее ткани. В конечном итоге гриб выпустит гифы, несущие на себе особые тела, называемые зооспорангиями, и из них споры попадут в воду пруда или аквариума. Это может привести к распространению чумы на других рыб.
Гриб будет использовать рыбу в качестве источника пропитания и причинит при этом ужасный ущерб.В конце концов, рыба погибает, поскольку грибок настолько сильно повреждает кожу, что осмотический баланс внутри рыбы полностью нарушается, что в основном означает, что рыба не может контролировать свой солевой баланс и жидкости организма. Жабры часто становятся целью, обычно после жаберной болезни, поскольку патологические изменения, произошедшие в жабрах, обеспечивают отличное место для грибковых спор.
Это состояние чрезвычайно опасно для рыб, так как от него невозможно вылечить.Учитывая те тысячи долларов, которые некоторые владельцы прудов и аквариумов тратят на своих рыбок, последствия появления этой болезни могут быть катастрофическими. Поэтому лучшее решение — предотвратить его распространение в первую очередь.
Все пресноводные виды рыб подвержены сапролегнии. Грибок ваты довольно характерен и обычно связан с пятнами на рыбе, которые были повреждены в результате травмы. Одним из основных методов предотвращения этого заболевания является поддержание чистоты воды в пруду.Еще одно хорошее лекарство, имевшее некоторый успех, — малахитовый зеленый. Любые гифы, обнаруженные в воде пруда, должны быть удалены, и лучший способ сделать это — протереть загрязненный участок раствором, состоящим из 10% йода и провидона. Хранение рыбы в солевом растворе также может принести пользу, так как это повысит осмотический баланс, возникающий в результате этого. Владельцам прудов также важно максимально снизить уровень стресса у своих рыб, чтобы не усугубить состояние.
Владельцам прудов также важно максимально снизить уровень стресса у своих рыб, чтобы не усугубить состояние.
Koi Fungus Treatment & Identification 2022 (Images & Care)
Когда ваши кои больны или ведут себя иначе, ваша первая мысль, скорее всего, что у них просто плохая погода или у них какая-то вирусная или бактериальная инфекция. Тем не менее, есть вероятность, что это может быть грибковая инфекция, и хотя их, как правило, легче идентифицировать и, следовательно, лечить, к ним следует относиться так же серьезно, поскольку они могут быть чрезвычайно опасными и привести к смерти, если их не лечить.
Какие виды грибков поражают прудовых рыб? 1) Сапролегния (Очень часто) Грибок сапролегния вызывает рост ваты. Большинство грибов, поражающих кои и других прудовых рыб, принадлежат к семейству Saprolegniaceae, семейству пресноводных плесеней. Представители этого семейства достаточно выносливы, способны расти в широком диапазоне параметров рН, температуры и даже при высокой солености. Тем не менее, внезапные и продолжительные изменения качества воды могут способствовать более легкому размножению этих и других грибков.
Тем не менее, внезапные и продолжительные изменения качества воды могут способствовать более легкому размножению этих и других грибков.
В этом семействе грибы, которые обычно поражают кои, относятся к следующим родам: Saprolegnia , Achyla и Aphanomyces . Среди них наиболее частыми виновниками являются виды Saprolegnia, также известные как болезнь ваты из-за их похожего на вату внешнего вида при выращивании на рыбе, и могут появиться в любом месте на чешуе, плавниках, жабрах и даже в виде ротового грибка.
2) Dermocystidium (редко) Карась.Кисты в вентральной и каудальной областях. (1)
Dermocystidium — еще один род паразитических простейших, которые обычно группируются с грибами из-за их сходного внешнего вида и функций, хотя они, как и Ichthyophonus ниже, на самом деле не являются грибами. Большая часть литературы, которую вы найдете об инфекциях Dermocystidium , по-прежнему классифицирует их как грибковые, поэтому мы также включили этот род в статью. Dermocystidium koi — это вид, ответственный, в частности, за заражение кои.
Dermocystidium koi — это вид, ответственный, в частности, за заражение кои.
Хотя D. koi не является фатальным и встречается редко, он вызывает болезненные повреждения кожи, которые могут и, вероятно, ухудшат качество жизни ваших кои, поэтому их следует лечить немедленно. Это также ослабляет кои и может способствовать проникновению вторичных инфекций, что может привести к летальному исходу. Передача и заражение происходит, когда зооспоры D. Koi , которые представляют собой свободно плавающие пресноводные организмы, попадают на жабры или открытые раны рыбы, за которые они затем могут зацепиться.Следовательно, он должен присутствовать в воде или в рыбе, помещенной в пруд, чтобы распространиться на ваших карпов.
3) Ichthyophonus (очень редко)
Наконец, еще один редкий вид относится к роду Ichthyophonus , который на самом деле не содержит плесени или грибков, но часто группируется с плесенью из-за сходной этиологии, симптомов, симптомов и появление у рыб. На самом деле, Ichthyophonus — это одноклеточные эукариотические паразиты, которые совсем недавно были обнаружены в родстве как с грибами, так и с животными, что делает их членами уникального царства, известного как Protista (протисты), которые не являются ни растениями, ни животными, ни грибами, а группировать все самостоятельно.
На самом деле, Ichthyophonus — это одноклеточные эукариотические паразиты, которые совсем недавно были обнаружены в родстве как с грибами, так и с животными, что делает их членами уникального царства, известного как Protista (протисты), которые не являются ни растениями, ни животными, ни грибами, а группировать все самостоятельно.
Ichthyophonus hoferi (не путать с «их» паразитом) в частности, вызывают заболевание ихтиофониоз, которое встречается как у содержащихся в неволе, так и у диких рыб многих видов, включая кои. Это заболевание считается морской болезнью, поэтому для возникновения и распространения этой болезни обычно требуются более высокие концентрации соли, хотя есть некоторые сообщения о том, что она встречается у пресноводных рыб. После заражения, даже после исчезновения симптомов, рыба будет носителем на всю жизнь и может заразить других рыб, хотя передача кои, по-видимому, происходит только при проглатывании рыбы-носителя или тех, которые активно инфицированы.
Что вызывает грибковые инфекции у кои? Плохое качество воды, особенно при наличии избытка питательных веществ, может увеличить риск роста грибков.
Грибковые инфекции вызываются целым рядом факторов здравого смысла. По сути, если ваш пруд и/или рыба не здоровы, могут возникнуть грибковые инфекции. Плохое качество воды со слишком высоким или низким pH или температурой для вашей рыбы, слишком много аммиака или других загрязняющих веществ или слишком много разлагающихся веществ, которые добавляют слишком много питательных веществ в ваш пруд, являются рассадником многих болезней, будь то грибковые, бактериальные. или вирусный.
Если ваши рыбы уже больны, имеют открытые раны или находятся в состоянии стресса, их системы очень сильно нарушены, и это может позволить грибкам легко обосноваться на ваших рыбах и даже внутри них. Как правило, не перенасыщайте пруд, кормите кои сбалансированной пищей и регулярно проверяйте и поддерживайте качество воды.
- Плесневидные белые наросты на рыбе, особенно вокруг рта, жабр или любых ран
- Поражения или язвы на коже
- Вялость
- аппетит или потеря аппетита)
- Потеря защитного слизистого покрытия
- Задыхаясь от воздуха на поверхности
- Тусклая окраска
- Потеря веса и истощение
- Беспорядочное или необычное плавание
- Увеличенные внутренние органы с поражениями (это может, конечно, могут быть обнаружены только при вскрытии после смерти.)
- Отсутствие взаимодействия с другими рыбами
- Наличие других заболеваний, таких как бактериальная инфекция, которые чаще всего являются вторичными после того, как рыба-хозяин была ослаблена грибком ) ВАЖНО: Если вы не уверены, что все рыбы заражены грибком, вам следует обрабатывать их только в карантинном аквариуме, а не обрабатывать всю систему пруда. Используя любой из этих методов, сначала очень осторожно удалите видимый грибок, протерев его чистой влажной ватной палочкой, а затем приступайте к лечению.

Повышение уровня соли на 0,1-0,3% (или от 1 до 3 граммов соли на литр воды) может помочь вашей рыбе восстановить осморегулирующий баланс, нарушив жизненный цикл грибка. Это чаще всего используется для лечения сапролегниоза или ватной болезни, которая, как упоминалось выше, является наиболее распространенной грибковой инфекцией у кои. Поскольку хлопковые плесневые грибы могут выдерживать повышенный уровень соли, вам может потребоваться увеличить соленость на 1–2,5%, чтобы фактически убить сапролегнию.
Добавляйте больше соли только в том случае, если вы не заметите улучшения примерно через неделю, так как добавление слишком большого количества соли сразу же может нанести вред вашему кои.Если вы поднимете уровень соли до 2% или выше, не держите рыбу в этом растворе дольше получаса или около того. Соляные ванны с большей вероятностью действуют на паразитарные инфекции, такие как протистические, упомянутые выше, которые часто принимают за грибок, но, как правило, не очень эффективны против грибка.
 Если после соляной ванны симптомы все еще сохраняются, значит, у вашей рыбы действительно грибковая инфекция, и вам следует искать альтернативное лечение.
Если после соляной ванны симптомы все еще сохраняются, значит, у вашей рыбы действительно грибковая инфекция, и вам следует искать альтернативное лечение.Малахитовый зеленый и формалин часто смешивают вместе для лечения грибковых инфекций рыб.Если у вас есть крем, его можно наносить непосредственно на пораженные участки рыбы. Он также поставляется в жидком виде, который используется для создания ванны для рыб. Как правило, концентрация 0,05 ppm (5 мл на 10 галлонов воды) достаточна для борьбы с сапролегнией, а также с упомянутыми выше простейшими паразитами.
Ежедневно подменяйте 25% воды и добавляйте больше смеси малахитовой зелени и формалина. Как только вы перестанете видеть грибок, растущий или сохраняющийся на рыбе, вы сможете вернуть рыбу в пруд.Убедитесь, что вы покупаете малахитовый зеленый сорт без цинка , так как цинк может быть довольно токсичным для рыб. Не превышайте концентрацию малахитовой зелени в воде более 1 мг/л, так как это может быть токсично для рыб.
 Если в ванне содержится 1 часть на миллион малахитовой зелени, замачивайте рыбу не более чем на час. Преимущество малахитовой зелени и формалина заключается в том, что они, как правило, весьма эффективно справляются с грибками, но они могут сохраняться в рыбе в течение нескольких месяцев после обработки и токсичны, если их дозировать неправильно.
Если в ванне содержится 1 часть на миллион малахитовой зелени, замачивайте рыбу не более чем на час. Преимущество малахитовой зелени и формалина заключается в том, что они, как правило, весьма эффективно справляются с грибками, но они могут сохраняться в рыбе в течение нескольких месяцев после обработки и токсичны, если их дозировать неправильно.Перманганат калия доступен в виде кристаллов или порошка и смешивается с ведром воды для разбавления перед добавлением в карантинный резервуар.Он действует путем химического сжигания грибков, паразитов и водорослей, оказывая при этом минимальное негативное воздействие на рыб. В ходе этого процесса перманганат калия также потребляет кислород, поэтому очень важно правильно аэрировать воду, чтобы предотвратить гипоксию рыб и воды.
Чтобы вылечить карпов кои, погрузите их на 4 часа в ванну с концентрацией перманганата калия 2 миллиграмма на литр воды (2 ppm). В эти сроки и дозировку вы можете повторять по мере необходимости.
 Если вы дозируете больше, чем это, ваша рыба может стать стрессовой или даже получить ожоги.Некоторые источники и этикетки продуктов рекомендуют использовать 4 части на миллион продукта, но многие любители сообщают, что это привело к гибели до 50% их рыб, поэтому для безопасности предпочтительнее половинная доза.
Если вы дозируете больше, чем это, ваша рыба может стать стрессовой или даже получить ожоги.Некоторые источники и этикетки продуктов рекомендуют использовать 4 части на миллион продукта, но многие любители сообщают, что это привело к гибели до 50% их рыб, поэтому для безопасности предпочтительнее половинная доза.Достаточно неагрессивное средство для лечения грибковых и бактериальных инфекций, а также паразитов, таких как протисты, описанные в первом разделе этой статьи. Акрифлавин можно принимать в виде ванн примерно из расчета 10 мл на 150 галлонов воды или 200 мг. на 10 литров воды. При этой дозе 5 частей на миллион вы можете оставить кои в ванне на срок до 5 дней, если это необходимо.
Если грибковые инфекции являются тяжелыми, вы можете увеличить дозировку до 10 частей на миллион (37,8 мг на галлон воды), но не позволяйте кои оставаться в ванне не более 2 часов, так как они, скорее всего, начнут проявляться признаки стресса за пределами этой точки. С другой стороны, акрифлавин истощает полезные бактерии и азот, поэтому его не следует использовать в течение длительного периода времени.

5) Хлорамин-ТХлорамин-Т, хотя и очень эффективен против грибковых инфекций, никогда не должен использоваться в качестве растворов с высокой дозой, так как он может вызвать обширные повреждения кожи и жабр рыб.Как и сульфат меди, хлорамин-т довольно токсичен в мягкой кислой воде, поэтому дозировка зависит от параметров качества вашей воды. Пожалуйста, ознакомьтесь с этой таблицей, чтобы получить представление о том, как вы должны дозировать свой карантинный аквариум. Не забывайте постоянно проветривать аквариум во время обработки, так как хлорамин может снижать уровень кислорода.
Ссылки:
(1) Исследования ассоциированных протозоа-бактериальных инфекций карповых рыб из рыбной фермы, расположенной на реке Джиджия на северо-востоке Румынии – научный сотрудник ResearchGate.Доступно по адресу: https://www.researchgate.net/figure/Crucian-carp-Cyst-in-ventral-and-caudal-areas_fig2_265297756
Болезнь Columnaris у рыб: обзор с акцентом на взаимодействие бактерий с хозяином | Veterinary Research
"> Bernardet JF, Nakagawa Y, Holmes B: Предлагаемые минимальные стандарты для описания новых таксонов семейства Flavobacteriaceae и исправленное описание семейства. Int J Syst Evol Microbiol. 2002, 52: 1049-1070. 10.1099/ижс.0.02136-0.
КАС пабмед Google Scholar
Bernardet JF, Segers P, Vancanneyt M, Berthe M, Kersters K, Vandamme P: Разрубание гордиева узла: исправленная классификация и описание рода Flavobacterium , исправленное описание семейства Flavobacteriaceae и предложение Flavobacterium hydatis ном.
 ноябрь (базоним , Cytophaga aquatilis Strohl and Tait 1978). Int J Syst Evol Bacteriol. 1996, 46: 128-148. 10.1099/00207713-46-1-128.
ноябрь (базоним , Cytophaga aquatilis Strohl and Tait 1978). Int J Syst Evol Bacteriol. 1996, 46: 128-148. 10.1099/00207713-46-1-128.Артикул Google Scholar
Davis HS: Новое бактериальное заболевание пресноводных рыб. Бюллетень Бюро рыболовства США. 1922, 38: 37-63.
Google Scholar
Ordal EJ, Rucker RR: Патогенные миксобактерии.ПСЭБМ. 1944, 56: 15-18.
Google Scholar
Буллок Г.Л., Хсу Т.С., Шоттс Э.Б.: Колумнарис у рыб. Брошюра USFWS о заболеваниях рыб. 1986, 1986: 1-9.
Google Scholar
Garnjobst L: Cytophaga columnaris (Davis) в чистой культуре: миксобактерия, патогенная для рыб. J Бактериол. 1945, 49: 113-128.
Центральный пабмед КАС пабмед Google Scholar
">Triyanto , Wakabayashi H: Генотипическое разнообразие штаммов Flavobacterium columnare от больных рыб. Рыбный патол. 1999, 34: 65-71. 10.3147/jsfp.34.65.
Артикул Google Scholar
Ourth DD, Bachinski LM: Бактериальная сиаловая кислота модулирует активацию альтернативного пути комплемента канального сома ( Ictalurus punctatus ).Дев Комп Иммунол. 1987, 11: 551-564. 10.1016/0145-305Х(87)-9.
КАС пабмед Статья Google Scholar
">Decostere A, Haesebrouck F, Devriese LA: Характеристика четырех штаммов Flavobacterium columnare ( Flexibacter columnaris ), выделенных из тропических рыб.Вет микробиол. 1998, 62: 35-45. 10.1016/С0378-1135(98)00196-5.
КАС пабмед Статья Google Scholar
Figueiredo HCP, Klesius PH, Arias CR, Evans J, Shoemaker CA, Pereira DJ, Peixoto MTD: Выделение и характеристика штаммов Flavobacterium columnare из Бразилии. Дж. Фиш Дис. 2005, 28: 199-204. 10.1111/j.1365-2761.2005.00616.х.
КАС пабмед Статья Google Scholar
">Řehulka J, Minařík B: Параметры крови у речной форели Salvelinus fontinalis (Mitchill, 1815), пораженной колумбарисом. Аквак Рез. 2007, 38: 1182-1197. 10.1111/j.1365-2109.2007.01786.х.
Артикул КАС Google Scholar
Soto E, Mauel MJ, Karsi A, Lawrence ML: Генетическая и вирулентная характеристика Flavobacterium columnare канального сома ( Ictalurus punctatus ).J Appl Microbiol. 2008, 104: 1302-1310. 10.1111/j.1365-2672.2007.03632.х.
КАС пабмед Статья Google Scholar
">Hawke JP, Thune RL: Системная изоляция и чувствительность к противомикробным препаратам Cytophaga columnaris из коммерчески разводимого канального сома.Джей Аква Аним Здоровье. 1992, 4: 109-113. 10.1577/1548-8667(1992)004<0109:SIAASO>2.3.CO;2.
Артикул Google Scholar
Вагнер Б.А., Уайз Д.Дж., Кху Л.Х., Терхун Дж.С.: Эпидемиология бактериальных заболеваний канального сома пищевого размера. Джей Аква Аним Здоровье. 2002, 14: 263-272. 10.1577/1548-8667(2002)014<0263:TEOBDI>2.0.CO;2.
Артикул Google Scholar
">Баркер Г.А., Смит С.Н., Бромейдж Н.Р.: Влияние оксолиновой кислоты на бактериальную флору и успешность вылупления радужной форели, Oncorhynchus mykiss , яйца. Аквакультура. 1990, 9: 205-222.
Артикул Google Scholar
Fujihara MP, Nakatani RE: Защита антителами и иммунный ответ радужной форели кижуча на Chondrococcus columnaris .J Fish Res Bd Канада. 1971, 28: 1253-1258. 10.1139/ф71-191.
Артикул Google Scholar
Suomalainen L-R, Tiirola M, Valtonen ET: Лечение столбняка радужной форели: низкий pH и соль как возможные средства?.
 Орган «Дис Аква». 2005, 65: 115-120.
Орган «Дис Аква». 2005, 65: 115-120.КАС пабмед Статья Google Scholar
Kunttu HMT, Valtonen ET, Jokinen EI, Suomalainen LR: Сапрофитизм рыбного патогена как стратегия передачи.Эпидемии. 2009, 1: 96-100. 10.1016/ж.эпидем.2009.04.003.
ПабМед Статья Google Scholar
Fijan FJ: Антибиотические добавки для выделения Chondrococcus columnaris из рыбы. Приложение микробиол. 1968, 17: 333-334.
Google Scholar
Chowdhury MBR, Wakabayashi H: Выживание четырех основных бактериальных патогенов рыб в разных типах экспериментальной воды.Бангладеш J Microbiol. 1990, 7: 47-54.
Google Scholar
Росс А.Дж., Смит К.А.: Влияние температуры на выживаемость Aeromonas liquefaciens , Aeromonas salmonicida , Chondrococcus columnaris и Pseudomonas fluorescens .
 Программа Fish Cult. 1974, 36: 51-52. 10.1577/1548-8659 (1974) 36[51:EOTOSO]2.0.CO;2.
Программа Fish Cult. 1974, 36: 51-52. 10.1577/1548-8659 (1974) 36[51:EOTOSO]2.0.CO;2.Артикул Google Scholar
Kunttu HMT, Sundberg L-R, Pulkkinen K, Valtonen ET: Окружающая среда может быть источником вспышек Flavobacterium columnare на рыбных фермах.Environ Microbiol Rep. 2012, 4: 398-402. 10.1111/j.1758-2229.2012.00342.х.
ПабМед Статья Google Scholar
Wakabayashi H: Колумнарис. Бактериальные болезни рыб. Под редакцией: Инглис В., Робертс Р.Дж., Бромейдж Н.Р. 1993, Оксфорд, Англия: Научные публикации Блэквелла, 23–39.
Google Scholar
Пулккинен К., Суомалайнен Л.-Р., Рид А.Ф., Эберт Д., Ринтамяки П., Валтонен Э.Т.: Интенсивное разведение рыбы и эволюция вирулентности патогенов: случай колумбариса в Финляндии.Proc Biol Sci.
 2010, 277: 593-600. 10.1098/рспб.2009.1659.
2010, 277: 593-600. 10.1098/рспб.2009.1659.Центральный пабмед КАС пабмед Статья Google Scholar
Rucker RR, Earp BJ, Ordal EJ: Инфекционные болезни тихоокеанского лосося. Trans Am Fish Soc. 1953, 83: 297-312.
Артикул Google Scholar
Пача Р.Э., Ордал Э.Дж.: Гистопатология экспериментального столбняка у молоди лосося.Путь комп. J. 1967, 77: 419-423. 10.1016/0021-9975(67)-8.
КАС пабмед Статья Google Scholar
Foscarini R: Индукция и развитие бактериальной болезни жабр у угря ( Anguilla japonica ), экспериментально инфицированного Flexibacter columnaris: патологические изменения в сосудистой структуре жабр и сердечной деятельности. Аквакультура. 1989, 78: 1-20. 10.1016/0044-8486(89)
-1.

Артикул Google Scholar
Пача Р.Э., Ордал Э.Дж.: Миксобактериальные болезни лососевых рыб. Симпозиум по болезням рыб и моллюсков. Под редакцией: Специальное издание Американского общества рыболовства, Снешко С.Ф. 1970, 243-257. 5
Google Scholar
Decostere A: Flavobacterium columnare Инфекции у рыб: возбудитель и его адгезия к жаберной ткани.Верханделинген - KAGB. 2002, 64: 421-430.
КАС Google Scholar
Morrison C, Cornick J, Shum G, Zwicker B: Микробиология и гистопатология «седловидной» болезни сеголеток атлантического лосося, Salmo salar . J Бактериол. 1981, 78: 225-230.
Google Scholar
Decostere A, Haesebrouck F: Вспышка колумбариса у тропических аквариумных рыб.
 Ветеринар Рек. 1999, 144: 23-24. 10.1136/вр.144.1.23.
Ветеринар Рек. 1999, 144: 23-24. 10.1136/вр.144.1.23.КАС пабмед Статья Google Scholar
Ferguson HW: Системная патология рыб. 2006, Лондон: Scottian Press, 2
. Google Scholar
Michel C, Messiaen S, Bernardet J-F: Мышечные инфекции у завозной неоновой тетра, Paracheirodon innesi Myers: ограниченная встречаемость микроспоридий и преобладание тяжелых форм столбняка, вызванного азиатским геномоваром Flavobacterium columnare .Дж. Фиш Дис. 2002, 25: 253-263. 10.1046/j.1365-2761.2002.00364.x.
Артикул Google Scholar
Dalsgaard I: Механизмы вирулентности у Cytophaga psychrophila и других Cytophaga -подобных бактерий, патогенных для рыб. Энн Рев Фиш Дис. 1993, 3: 127-144.
Артикул Google Scholar
">Decostere A, Haesebrouck F, Charlier G, Ducatelle R: Ассоциация штаммов Flavobacterium columnare высокой и низкой вирулентности с жаберной тканью черной моллинезии ( Poecilia sphenops ). Вет микробиол. 1999, 67: 287-298. 10.1016/С0378-1135(99)00050-4.
КАС пабмед Статья Google Scholar
Olivares-Fuster O, Bullard SA, McElwain A, Llosa MJ, Arias CA: динамика адгезии Flavobacterium columnare к канальному сому Ictalurus punctatus и рыбке данио Danio rerio после погружения.Орган «Дис Аква». 2011, 96: 221-227. 10.3354/дао02371.
ПабМед Статья Google Scholar
">Трипати Н.К., Латимер К.С., Грегори К.Р., Ричи Б.В., Вули Р.Э., Уокер Р.Л.: Разработка и оценка экспериментальной модели кожного столбняка у кои Cyprinus carpio . Джей Вет Диагн Инвест. 2005, 17: 45-54. 10.1177/104063870501700109.
ПабМед Статья Google Scholar
Shieh HS: Исследования питания патогена рыб, Flexibacter columnaris .Письма микробиоса. 1980, 13: 129-133.
КАС Google Scholar
">Bader JA, Shoemaker CA, Klesius PH: Получение, характеристика и оценка вирулентности мутанта с дефектом адгезии Flavobacterium columnare , полученного с помощью β-лактамной селекции.Lett Appl Microbiol. 2005, 40: 123-127. 10.1111/j.1472-765X.2004.01641.x.
КАС пабмед Статья Google Scholar
Kunttu HMT, Jokinen EI, Valtonen ET, Sundberg LR: Вирулентные и невирулентные Flavobacterium columnare Морфология колоний: характеристика активности хондроитин AC-лиазы и адгезии к полистиролу. J Appl Microbiol. 2011, 111: 1319-1326. 10.1111/j.1365-2672.2011.05149.х.
КАС пабмед Статья Google Scholar
">Оливарес-Фустер О., Бейкер Дж.Л., Терхун Дж.С., Шумейкер К.А., Клезиус П.Х., Ариас К.Р.: Специфическая для хозяина связь между геномоваров Flavobacterium columnare и видами рыб. Сист Appl Microbiol. 2007, 30: 624-633. 10.1016/j.syapm.2007.07.003.
КАС пабмед Статья Google Scholar
Darwish AM, Ismaiel AA, Newton JC, Tang J: Идентификация Flavobacterium columnare с помощью видоспецифичной полимеразной цепной реакции и переименование штамма ATCC43622 в Flavobacterium johnsoniae .Молекулярные зонды. 2004, 18: 421-427. 10.1016/j.mcp.2004.07.002.
КАС пабмед Статья Google Scholar
">Shoemaker CA, Shelby RA, Klesius PH: Разработка непрямого ELISA для выявления гуморального ответа на инфекцию Flavobacterium columnare канального сома, Ictalurus punctatus .J Appl Аквакультура. 2003, 14: 43-52. 10.1300/J028v14n01_03.
Артикул Google Scholar
Panangala VS, Shelby RA, Shoemaker CA, Klesius PH, Mitra A, Morrison EE: Иммунофлуоресцентный тест для одновременного обнаружения Edwardsiella ictaluri и Flavobacterium columnare . Орган «Дис Аква». 2006, 68: 197-207.
Артикул Google Scholar
">Yeh H-Y, Shoemaker CA, Klesius PH: Чувствительное и быстрое обнаружение Flavobacterium columnare в канальном сомике Ictalurus punctatus методом изотермической амплификации с помощью петли. J Appl Microbiol. 2006, 100: 919-925. 10.1111/j.1365-2672.2006.02853.х.
КАС пабмед Статья Google Scholar
Panangala VS, Shoemaker CA, Klesius PH: Анализ полимеразной цепной реакции TaqMan в режиме реального времени для быстрого обнаружения Flavobacterium columnare .
 Аквак Рез. 2007, 38: 508-517. 10.1111/j.1365-2109.2007.01695.х.
Аквак Рез. 2007, 38: 508-517. 10.1111/j.1365-2109.2007.01695.х.КАС Статья Google Scholar
Suzuki M, Rappe MS, Giovanni SJ: Кинетическая погрешность в оценках структуры сообщества прибрежного пикопланктона, полученных путем измерения гетерогенности длины ампликона ПЦР гена малой субъединицы рРНК. Appl Environ Microbiol. 1998, 64: 4522-4529.
Центральный пабмед КАС пабмед Google Scholar
Suomalainen LR, Tiirola MA, Valtonen ET: действие Pseudomonas sp. .Ванны МТ5 на инфекции Flavobacterium columnare у радужной форели и на микробном разнообразии на коже и жабрах рыб. Орган «Дис Аква». 2005, 63: 61-68.
КАС пабмед Статья Google Scholar
Decostere A, Haesebrouck F, Turnbull JF, Charlier G: Влияние качества воды и температуры на адгезию штаммов Flavobacterium columnare с высокой и низкой вирулентностью к изолированным жаберным дугам.
 Дж. Фиш Дис.1999, 22: 1-11. 10.1046/j.1365-2761.1999.00132.x.
Дж. Фиш Дис.1999, 22: 1-11. 10.1046/j.1365-2761.1999.00132.x.Артикул Google Scholar
Klesius PH, Pridgeon JW, Aksoy M: Хемотаксические факторы Flavobacterium columnare в кожной слизи здорового канального сома ( Ictalurus punctatus ). FEMS Microbiol Lett. 2010, 310: 145-151. 10.1111/j.1574-6968.2010.02060.х.
КАС пабмед Статья Google Scholar
Klesius PH, Shoemaker CA, Evans JJ: Flavobacterium columnare хемотаксис для направления слизи сома.FEMS Microbiol Lett. 2008, 288: 216-220. 10.1111/j.1574-6968.2008.01348.x.
КАС пабмед Статья Google Scholar
Kunttu H: Характеристика бактериального патогена рыб Flavobacterium columnare и некоторых факторов, влияющих на его патогенность. Jyväskyla Stud Biol Environ Sci.
 2010, 206: 1-69.
2010, 206: 1-69.Google Scholar
Suomalainen LR, Tiirola M, Valtonen ET: Активность хондроитин-лиазы AC связана с вирулентностью патогенных рыб Flavobacterium columnare .Дж. Фиш Дис. 2006, 29: 757-763. 10.1111/j.1365-2761.2006.00771.х.
КАС пабмед Статья Google Scholar
Li N, Zhang LQ, Zhang J, Liu ZX, Huang B, Zhang SH, Nie P: Система рестрикции-модификации типа I и ее устойчивость к эффективности электропорации в Flavobacterium columnare . Вет микробиол. 2012, 160: 61-68. 10.1016/j.vetmic.2012.04.045.
КАС пабмед Статья Google Scholar
Старочик А.М., Нельсон Д.Р.: Влияние поверхностной слизи лосося на рост Flavobacterium columnare .Дж. Фиш Дис. 2008, 31: 59-69.
КАС пабмед Статья Google Scholar
">Текедар Х.К., Карси А., Гилласпи А.Ф., Дайер Д.В., Бентон Н.Р., Зайтшик Дж., Вамента С., Бейнс М.М., Гюльсой Н., Абоко-Коул М., Вальдбисер Г.К., Лоуренс М.Л.: Последовательность генома рыбного патогена Flavobacterium столбец ATCC 49512.J Бактериол. 2012, 194: 2763-2764. 10.1128/JB.00281-12.
Центральный пабмед КАС пабмед Статья Google Scholar
Паштет Дж. Л., Ордал Э. Дж.: Тонкая структура Chondrococcus columnaris . III. Поверхностные слои Chondrococcus columnaris . Джей Селл Биол. 1967, 35: 37-51. 10.
 1083/jcb.35.1.37.
1083/jcb.35.1.37.Центральный пабмед КАС пабмед Статья Google Scholar
LaFrentz BR, Klesius PH: Разработка независимого от культуры метода для характеристики хемотаксического ответа Flavobacterium columnare на слизь рыб.J Microbiol Meth. 2009, 77: 37-40. 10.1016/j.mimet.2008.12.011.
КАС Статья Google Scholar
Shoemaker CA, Olivares-Fuster O, Arias CR, Klesius PH: Геномовар Flavobacterium columnare влияет на смертность канального сома ( Ictalurus punctatus ). Вет микробиол. 2008, 127: 353-359. 10.1016/j.vetmic.2007.09.003.
КАС пабмед Статья Google Scholar
LaFrentz BR, LaPatra SE, Shoemaker CA, Klesius PH: Воспроизводимая модель заражения для исследования вирулентности геномоваров Flavobacterium columnare у радужной форели Oncorhynchus mykiss .
 Орган «Дис Аква». 2012, 101: 115-122. 10.3354/дао02522.
Орган «Дис Аква». 2012, 101: 115-122. 10.3354/дао02522.КАС пабмед Статья Google Scholar
Kunttu HMT, Suomalainen L-R, Jokinen EI, Valtonen ET: Flavobacterium columnare типы колоний: связь с адгезией и вирулентностью?. Микроб Патог. 2009, 46: 21-27. 10.1016/j.micpath.2008.10.001.
КАС пабмед Статья Google Scholar
Ариас К.Р., ЛаФренц С., Кай В., Оливарес-Фустер О.: Адаптивная реакция рыб на голодание у патогена Flavobacterium columnare: жизнеспособность клеток и ультраструктурные изменения.БМС микробиол. 2012, 12: 266-276. 10.1186/1471-2180-12-266.
Центральный пабмед пабмед Статья Google Scholar
Sun F, Peatman E, Li C, Liu S, Jiang Y, Zhou Z, Liu Z: Транскриптомные признаки прикрепления, подавление NF-κB и стимуляция IFN в жабрах сома после бактериальной инфекции columnaris.
 Дев Комп Иммунол. 2012, 38: 169-180. 10.1016/j.dci.2012.05.006.
Дев Комп Иммунол. 2012, 38: 169-180. 10.1016/j.dci.2012.05.006.КАС пабмед Статья Google Scholar
Tateno H, Yamaguchi T, Ogawa T, Muramoto K, Watanabe T, Kamiya H, Saneyoshi M: Иммуногистохимическая локализация рамнозо-связывающих лектинов у стальноголовой форели ( Oncorhynchus mykiss ).Дев Комп Иммунол. 2002, 26: 543-550. 10.1016/S0145-305X(02)00007-1.
КАС пабмед Статья Google Scholar
Beck BH, Farmer BD, Straus DL, Li C, Peatman E: Предполагаемая роль связывающего рамнозу лектина в патогенезе Flavobacterium columnare канального сома Ictalurus punctatus . Иммунитет к рыбным моллюскам. 2012, 33: 1008-1015.
КАС Статья Google Scholar
Алтинок И., Гризл Дж.М.: Влияние низкой солености на инфекцию Flavobacterium columnare эвригалинных и пресноводных стеногалинных рыб.
 Дж. Фиш Дис. 2001, 24: 361-367. 10.1046/j.1365-2761.2001.00306.x.
Дж. Фиш Дис. 2001, 24: 361-367. 10.1046/j.1365-2761.2001.00306.x.КАС Статья Google Scholar
Decostere A, Henckarts K, Ducatelle R, Haesebrouck F: Альтернативная модель для изучения ассоциации патогенов радужной форели ( Oncorhynchus mykiss L.) с жаберной тканью. Лаборатория Аним. 2002, 36: 396-402. 10.1258/002367702320389053.
КАС пабмед Статья Google Scholar
Офек И., Хасти Д.Л., Дойл Р.Дж.: Адгезины как структуры поверхности бактериальных клеток: общие концепции структуры, биогенеза и регуляции.Бактериальная адгезия к животным клеткам и тканям. Под редакцией: ASM Press. 2003, Вашингтон, округ Колумбия: ASM Press, 77-81.
Глава Google Scholar
Romero M, Avendaño-Herrera R, Magariños B, Cámara M, Otero A: Производство и расщепление ацилгомосеринлактона рыбным патогеном Tenacibaculum maritinum , член группы Cytophaga-Flavobacterium_Bacteroides FEMS Microbiol Lett.
 2009, 304: 131-139.
2009, 304: 131-139.Артикул Google Scholar
Camilli A, Bassler BL: Бактериальные низкомолекулярные сигнальные пути. Наука. 2006, 311: 1113-1116. 10.1126/научн.1121357.
Центральный пабмед КАС пабмед Статья Google Scholar
Вагнер-Дёблер И., Тиль В., Эберл Л., Аллгайер М., Бодор А., Мейер С., Эбнер С., Хеннинг А., Пукалл Р., Шульц С.: Открытие сложных смесей новых длинноцепочечных сигналов определения кворума в свободном -живые и ассоциированные с хозяином морские Alphaproteobacteria .Хим Био Хим. 2005, 6: 2195-2206. 10.1002/cbic.200500189.
ПабМед Статья КАС Google Scholar
Griffin BR: Характеристики хондроитин-AC-лиазы, продуцируемой Cytophaga columnaris . T Am Fish Soc. 1991, 120: 391-395.
 10.1577/1548-8659 (1991) 120<0391:COACAL>2.3.CO;2.
10.1577/1548-8659 (1991) 120<0391:COACAL>2.3.CO;2.КАС Статья Google Scholar
Newton JC, Wood TM, Hartley MM: Выделение и частичная характеристика внеклеточных протеаз, продуцируемых изолятами Flavobacterium columnare , полученными из канального сома.Джей Аква Аним Здоровье. 1997, 9: 75-85. 10.1577/1548-8667(1997)009<0075:IAPCOE>2.3.CO;2.
Артикул Google Scholar
Анакер Р.Л., Ордал Э.Дж.: Исследования миксобактерий Chondrococcus columnaris . II. Бактериоцины. J Бактериол. 1959, 78: 33-40.
КАС пабмед Google Scholar
Tiirola M, Valtonen ET, Rintamaki-Kinnunen P, Kulomaa MS: Диагностика флавобактериоза путем прямой амплификации генов рРНК.Орган «Дис Аква». 2002, 51: 93-100.
КАС пабмед Статья Google Scholar
">Араниши Ф., Мано Н., Накане М., Хиросе Х. Эпидермальная реакция японского угря на стресс окружающей среды.Рыба Физиол Биохим. 1998, 19: 197-203. 10.1023/А:1007746514851.
КАС Статья Google Scholar
Do Vale A, Marques F, Silva MT: Апоптоз нейтрофилов и макрофагов морского окуня ( Dicentrarchus labrax L.), вызванный экспериментальной инфекцией Photobacterium damselae subsp. рыбоядные . Иммунитет к рыбным моллюскам. 2003, 15: 129-144. 10.1016/С1050-4648(02)00144-4.
КАС Статья Google Scholar
">Ourth DD, Bachinski LM: Бактерицидный ответ канального сома Ictalurus punctatus классическим и альтернативным путями комплемента против бактериальных патогенов. J Appl Ихтиол. 1987, 3: 42-45. 10.1111/j.1439-0426.1987.tb00449.x.
Артикул Google Scholar
Kuo S-C, Chung HY, Kou GH: Исследования по искусственному заражению планирующих бактерий у культивируемых рыб.Рыбный патол. 1981, 15: 309-314. 10.3147/jsfp.15.309.
Артикул Google Scholar
Бебак Дж., Мэтьюз М., Шумейкер С.: Выживание вакцинированных, обученных кормлению мальков большеротого окуня ( Micropterus salmoides floridanus ) во время естественного воздействия Flavobacterium columnare .
 вакцина. 2009, 27: 4297-4301. 10.1016/j.vaccine.2009.05.026.
вакцина. 2009, 27: 4297-4301. 10.1016/j.vaccine.2009.05.026.КАС пабмед Статья Google Scholar
Becker CD, Fujihara MP: Бактериальный патоген Flexibacter columnaris и его эпизоотология среди речных рыб Колумбии.1978, Вашингтон, округ Колумбия: Американское рыболовное общество
. Google Scholar
Grabowski LD, LaPatra SE, Cain KD: Системный и слизистый ответ антител у тиляпии, Oreochromis niloticus (L.), после иммунизации Flavobacterium columnare . Дж. Фиш Дис. 2004, 27: 573-581. 10.1111/j.1365-2761.2004.00576.х.
КАС пабмед Статья Google Scholar
Moore AA, Eimers ME, Cardella MA: Попытки контролировать эпизоотии Flexibacter columnaris у канального сома, выращиваемого в пруду, путем вакцинации.
 Джей Аква Аним Здоровье. 1990, 2: 109-111. 10.1577/1548-8667(1990)002<0109:ATCCEI>2.3.CO;2.
Джей Аква Аним Здоровье. 1990, 2: 109-111. 10.1577/1548-8667(1990)002<0109:ATCCEI>2.3.CO;2.Артикул Google Scholar
Schachte JHJ, Mora EC: Производство агглютинирующих антител у канального сома ( Ictalurus punctatus ) против Chondrococcus columnaris . J Fish Res Board Канада. 1973, 30: 116-118. 10.1139/ф73-017.
Артикул Google Scholar
Ransom DP: Иммунный ответ лососевых: (а) пероральная иммунизация против Flexibacter columnaris.(b) эффекты комбинирования антигенов в парентерально вводимых поливалентных вакцинах. 1975, Корваллис, Орегон: магистерская диссертация. Университет штата Орегон
Google Scholar
Liewes EW, Van Dam RH: Процедуры и применение анализа стимуляции лейкоцитов рыб in vitro. Дев Комп Иммунол. 1982, 2: 223-232.

Google Scholar
Song Y-L: Сравнение штаммов Flexibacter columnaris, выделенных из рыбы в Северной Америке и других районах Тихоокеанского кольца.Кандидатская диссертация. 1986, Корваллис, Орегон: Университет штата Орегон
Google Scholar
AFS-FCS (2011 г.): Руководство по использованию лекарств, биопрепаратов и других химикатов в аквакультуре. Секция рыбоводства Американского общества рыболовства. http://www.fws.gov/fisheries/aadap/AFS-FCS%20documents/GUIDE_FEB_2011.pdf,
Karvonen A, Rintamäki P, Jokela J, Valtonen ET: Повышение температуры воды и риск заболеваний в водных системах : изменение климата увеличивает риск некоторых, но не всех болезней.Int J Паразитол. 2010, 40: 1483-1488. 10.1016/j.ijpara.2010.04.015.
ПабМед Статья Google Scholar
">Холт Р.А., Сандерс Дж.Е., Зинн Дж.Л., Фрайер Дж.Л., Пилчер К.С.: Связь температуры воды с инфекцией Flexibacter columnaris у стальноголовой форели ( Salmo gairdneri ), кижуча ( Oncorhynchus 90 90ook1), и 0.tshawytscha ) лосось. J Fish Res Board Банка. 1975, 32: 1553-1559. 10.1139/ф75-182.
Артикул Google Scholar
Suomalainen L-R, Reunanen H, Ijäs R, Valtonen ET, Tiirola M: Замораживание приводит к искажению результатов при молекулярном обнаружении Flavobacterium columnare . Appl Environ Microbiol. 2006, 72: 1702-1704. 10.1128/АЭМ.72.2.1702-1704.2006.

Центральный пабмед КАС пабмед Статья Google Scholar
Morris JM, Snyder-Conn E, Foott JS, Holt RA, Suedkamp MJ, Lease HM, Clearwater SJ, Meyer JS. сублетальные концентрации аммиака при pH 9.5. Arch Environ Contam Toxicol. 2006, 50: 256-263. 10.1007/s00244-004-0194-х.
КАС пабмед Статья Google Scholar
Bandilla M, Valtonen ET, Suomalainen L-R, Aphalo PJ, Hakalahti T: Связь между заражением эктопаразитами и восприимчивостью к бактериальным заболеваниям у радужной форели. Int J Паразитол. 2006, 36: 987-991. 10.1016/j.ijpara.2006.05.001.
КАС пабмед Статья Google Scholar
Дарвиш А.М., Митчелл А., Штраус Д.Л.: Оценка 4-часового статического лечения сульфатом меди против экспериментальной инфекции Flavobacterium columnare у канального сома ( Ictalurus punctatus ).
 Аквакультура рез. 2011, 43: 688-695.
Аквакультура рез. 2011, 43: 688-695.Артикул КАС Google Scholar
Thomas-Jinu S, Goodwin AE: Острая инфекция columnaris у канального сома, Ictalurus punctatus (Rafinesque): эффективность практических методов лечения в тепловодных прудах для аквакультуры. Дж. Фиш Дис. 2004, 27: 23-28. 10.1046/j.1365-2761.2003.00504.х.
КАС пабмед Статья Google Scholar
Sink TD, Lochmann RT, Goodwin AE, Mareceaux E: Показатели смертности среди золотистых чистильщиков, получавших диету с высоким содержанием жиров с пребиотиком молочных дрожжей или без него, до заражения Flavobacterium columnare .N Am J Аквакультура. 2007, 69: 305-308. 10.1577/А06-078.1.
Артикул Google Scholar
Kunttu HMT, Valtonen ET, Suomalainen LR, Vielma J, Jokinen IE: Эффективность двух иммуностимуляторов против инфекции Flavobacterium columnare у молоди радужной форели ( Oncorhynchus mykiss ).
 Иммунитет к рыбным моллюскам. 2009, 26: 850-857. 10.1016/j.fsi.2009.03.013.
Иммунитет к рыбным моллюскам. 2009, 26: 850-857. 10.1016/j.fsi.2009.03.013.КАС Статья Google Scholar
Бадер Дж.А., Нусбаум К.Е., Шумейкер К.А.: Сравнительная контрольная модель Flavobacterium columnare с истиранием и без истирания канального сома, Ictalurus punctatus (Rafinesque).Дж. Фиш Дис. 2003, 26: 461-467. 10.1046/j.1365-2761.2003.00479.x.
КАС пабмед Статья Google Scholar
Darwish AM, Bebak JA, Schrader KK: Оценка Aquaflor ® , сульфата меди и перманганата калия для борьбы с инфекцией Aeromonas hydrophila и Flavobacterium columnare у самок басса 69x09x09sops Morone saxatilis самец.Дж. Фиш Дис. 2012, 35: 637-647. 10.1111/j.1365-2761.2012.01393.х.
КАС пабмед Статья Google Scholar
">Conrad JF, Holt RA, Kreps TD: Дезинфекция проточной воды озоном.Прога Фиш-Культ. 1975, 37: 134-136. 10.1577/1548-8659 (1975) 37 [134:ODOFW]2.0.CO;2.
Артикул Google Scholar
Shoemaker CA, Klesius PH, Lim C, Yildirim M: Лишение корма канального сома, Ictalurus punctatus (Rafinesque), влияет на органосоматические показатели, химический состав и чувствительность к Flavobacterium columnare . Дж. Фиш Дис. 2003, 26: 553-561. 10.1046/j.1365-2761.2003.00489.x.
КАС пабмед Статья Google Scholar
">Дарвиш А.М., Митчелл А.Дж., Штраус Д.Л.: Оценка перманганата калия при экспериментальной подострой инфекции Flavobacterium columnare у канального сома, Ictalurus punctatus (Rafinesque). Дж. Фиш Дис. 2009, 32: 193-199. 10.1111/j.1365-2761.2008.01015.х.
КАС пабмед Статья Google Scholar
Райли Т.А.: Лечение Flavobacterium columnare и токсичности хлорамина-Т у канального сома.2000, Икталурус точечный. Магистерская диссертация: Обернский университет, Оберн, Алабама
Google Scholar
Меррифилд Д.Л., Димитроглу А., Фоуи А., Дэвис С.Дж., Бейкер РТМ, Бёгвальд Дж., Кастекс М., Рингё Э.
 Текущее состояние и будущие направления применения пробиотиков и пребиотиков для лососевых. Аквакультура. 2010, 302: 1-18. 10.1016/к.аквакультура.2010.02.007.
Текущее состояние и будущие направления применения пробиотиков и пребиотиков для лососевых. Аквакультура. 2010, 302: 1-18. 10.1016/к.аквакультура.2010.02.007.Артикул Google Scholar
Boutin S, Bernatchez L, Audet C, Derôme N: Антагонистический эффект местных кожных бактерий ручьевого гольца ( Salvelinus fontinalis ) против Flavobacterium columnare и F.психрофилум . Вет микробиол. 2012, 155: 355-361. 10.1016/j.vetmic.2011.09.002.
ПабМед Статья Google Scholar
Arias CR, Cai W, Peatman E, Bullard SA: Гибрид сома Ictalurus punctatus × I. furcatus проявляет более высокую устойчивость к столбняку, чем родительские виды. Орган «Дис Аква». 2012, 100: 77-81. 10.3354/дао02492.
ПабМед Статья Google Scholar
">Снешко С.Ф. Колумнариоз рыб. USFWS Fish Leafl. 1958, 46: 1-3.
Google Scholar
Amend DF, Ross AJ: Экспериментальный контроль столбняка с помощью нового нитрофуранового препарата P-7138. Прога Фиш-Культ. 1970, 32: 19-25. 10.1577/1548-8640 (1970) 32 [19: ECOCDW] 2.0.СО;2.
КАС Статья Google Scholar
Ross AJ: Исследования in vitro с нифурпиринолом (P-7138) и бактериальными патогенами рыб.
 Прога Фиш-Культ. 1972, 34: 18-20. 10.1577/1548-8640 (1972) 34[18:IVSWNP]2.0.CO;2.
Прога Фиш-Культ. 1972, 34: 18-20. 10.1577/1548-8640 (1972) 34[18:IVSWNP]2.0.CO;2.КАС Статья Google Scholar
Шираки К., Миямото Ф., Сато Т., Сонедзаки И., Яно К.: Исследования нового химиотерапевтического средства нифурпразина (НВ-115) против инфекционных заболеваний рыб.Рыбный патол. 1970, 4: 130-137. 10.3147/jsfp.4.130.
Артикул Google Scholar
Deufel J: Профилактические меры против бактериальных болезней мальков лососевых (Prophylaktische Massnahmen gegen bakterielle Erkrankungen der Salmonidenbrut). Остер Фиш. 1974, 27: 1-5.
Google Scholar
Endo T, Ogishima K, Hayasaka H, Kaneko S, Ohshima S: Применение оксолиновой кислоты в качестве химиотерапевтического средства против инфекционных заболеваний рыб-I.Антибактериальная активность, химиотерапевтические эффекты и фармакокинетика оксолиновой кислоты у рыб.
 Bull Jpn Soc Sci Fish. 1973, 39: 165-171. 10.2331/суисан.39.165.
Bull Jpn Soc Sci Fish. 1973, 39: 165-171. 10.2331/суисан.39.165.КАС Статья Google Scholar
Soltani M, Shanker S, Munday BL: Химиотерапия Cytophaga/Flexibacter -подобных бактерий (CFLB) у рыб: исследования, подтверждающие клиническую эффективность отдельных противомикробных препаратов. Дж. Фиш Дис. 1995, 18: 555-565.10.1111/j.1365-2761.1995.tb00360.x.
КАС Статья Google Scholar
Вуд JW: Лечение и лекарства. Болезни тихоокеанского лосося: их профилактика и лечение. 1974, штат Вашингтон: Департамент рыболовства, Инкубаторий, 7-16. 2
Google Scholar
Koski P, Hirvelä-Koski V, Bernardet JF: Инфекция Flexibacter columnaris у арктического гольца ( Salvelinus alpinus (L.)). Первая изоляция в Финляндии.
 Bull Eur Ass Fish Pathol. 1993, 31: 66-69.
Bull Eur Ass Fish Pathol. 1993, 31: 66-69.Google Scholar
Вольф К., Снешко С.Ф.: Применение антибиотиков и других противомикробных препаратов при лечении болезней рыб. Противомикробные агенты Chemother. 1963, 161: 597-603.
КАС пабмед Google Scholar
Gaunt PS, Gao D, Sun F, Endris R: Эффективность флорфеникола в борьбе со смертностью, вызванной инфекцией Flavobacterium columnare у канального сома.Джей Аква Аним Здоровье. 2010, 22: 115-122. 10.1577/Н09-057.1.
ПабМед Статья Google Scholar
Serrano PH: Ответственное использование антибиотиков в аквакультуре. FAO Fish Tech Pap. 2005, 469: 1-97.
Google Scholar
Declercq AM, Boyen F, Van den Broeck W, Bossier P, Karsi A, Haesebrouck F, Decostere A: Характеристика чувствительности к противомикробным препаратам изолятов Flavobacterium columnare , собранных по всему миру от 17 видов рыб.
 Дж. Фиш Дис. 2013, 36: 45-55. 10.1111/j.1365-2761.2012.01410.х.
Дж. Фиш Дис. 2013, 36: 45-55. 10.1111/j.1365-2761.2012.01410.х.КАС пабмед Статья Google Scholar
Darwish AM, Mitchell AJ: Оценка диквата против острой экспериментальной инфекции Flavobacterium columnare у канального сома, Ictalurus punctatus (Rafinesque). Дж. Фиш Дис. 2009, 32: 401-408. 10.1111/j.1365-2761.2009.01024.х.
КАС пабмед Статья Google Scholar
Marchand P-A, Phan T-M, Straus DL, Farmer BD, Stüber A, Meinelt T: Снижение роста in vitro в Flavobacterium columnare и Saprolegnia parasitica с помощью продуктов, содержащих перуксусную кислоту.Аквак Рез. 2012, 43: 1861-1866. 10.1111/j.1365-2109.2011.02995.х.
КАС Статья Google Scholar
Laanto E, Sundberg LR, Bamford JKH: Фаговая специфичность патогена пресноводных рыб Flavobacterium columnare .
 Appl Environ Microbiol. 2011, 77: 7868-7872. 10.1128/АЭМ.05574-11.
Appl Environ Microbiol. 2011, 77: 7868-7872. 10.1128/АЭМ.05574-11.Центральный пабмед КАС пабмед Статья Google Scholar
Prasad Y, Arpana , Kumar D, Sharma AK: Литические бактериофаги, специфичные для Flavobacterium columnare спасательного сома, Clarias batrachus (Linn.) от колумбариса. Дж. Энвайрон Биол. 2011, 32: 161-168.
ПабМед Google Scholar
Bernardet JF, Bowman JP: Род Flavobacterium . Прокариоты: Справочник по биологии бактерий: Том 7: Протеобактерии: подклассы дельта и эпсилон. Глубоко укореняющиеся бактерии. Под редакцией: Дворкин М., Фальков С. 2006 г., Нью-Йорк: Springer Science+Business Media, LLC, 481-531.
Google Scholar
Bernardet J-F, Grimont PAD: родство с дезоксирибонуклеиновой кислотой и фенотипическая характеристика Flexibacter columnaris sp.ноябрь, норн. rev., Flexibacter psychrophilus sp. ноя., ном. rev., и Flexibacter maritimus Wakabayashi, Hikida, and Masumura 1986. IJSB. 1989, 39: 346-354.
КАС Google Scholar
Decostere A, Haesebrouck F, Van Driessche E, Charlier G, Ducatelle R: Характеристика адгезии Flavobacterium columnare (Flexibacter columnaris) к жаберной ткани. Дж. Фиш Дис. 1999, 22: 465-474. 10.1046/j.1365-2761.1999.00198.x.
Артикул Google Scholar
Morley NJ, Lewis JW: Последствия вспышки колумбариса ( Flavobacterium columnare ) для гельминтофауны окуня ( Perca fluviatilis ) в водохранилище Королевы Марии, юго-восточная Англия.Дж. Гельминтол. 2010, 84: 186-192. 10.1017/S0022149X099
.
КАС пабмед Статья Google Scholar
Suomalainen L-R, Bandilla M, Valtonen ET: Иммуностимуляторы для профилактики столбняка радужной форели, Oncorhynchus mykiss (Walbaum). Дж. Фиш Дис. 2009, 32: 723-726. 10.1111/j.1365-2761.2009.01026.х.
ПабМед Статья Google Scholar
Shoemaker CA, Klesius PH, Drennan JD, Evans J: Эффективность модифицированной живой вакцины Flavobacterium columnare у рыб.Иммунитет к рыбным моллюскам. 2011, 30: 304-308. 10.1016/j.fsi.2010.11.001.
КАС Статья Google Scholar
Decostere A, Haesebrouck F, Devriese L: Разработка среды для селективного выделения Flavobacterium columnare из больных рыб.Дж. Клин Микробиол. 1997, 35: 322-324.
Центральный пабмед КАС пабмед Google Scholar
Bullard SA, McElwain A, Arias CR: Сканирующая электронная микроскопия «седловидных» поражений, связанных с экспериментальными инфекциями Flavobacterium columnare у канального сома, Ictalurus punctatus ( Siluriformes: Ictaluridae , 691), и , 691, Danio rerio ( Cypriniformes: Cyprinidae ).J World Aquacult Soc. 2011, 42: 906-913. 10.1111/j.1749-7345.2011.00527.х.
Артикул Google Scholar
Holt RA: Cytophaga psychrophila, возбудитель бактериальной холодноводной болезни лососевых рыб. 1988, Корваллис, Орегон: Университет штата Орегон
Google Scholar
Bernardet JF: « Flexibacter columnaris »: первое описание во Франции и сравнение со штаммами бактерий другого происхождения.Орган «Дис Аква». 1989, 6: 37-44.
Артикул Google Scholar
Welker TL, Shoemaker CA, Arias CR, Klesius PH: Передача и обнаружение Flavobacterium columnare у канального сома Ictalurus punctatus . Орган «Дис Аква». 2005, 63: 129-138.
КАС пабмед Статья Google Scholar
Speare DJ, Markham RJ, Despres B, Whitman K, MacNair N: Исследование жабр лососевых рыб с бактериальным заболеванием жабр с использованием зондов моноклональных антител для Flavobacterium branchiophilum и Cytophaga columnaris .Джей Вет Диагн Инвест. 1995, 7: 500-505. 10.1177/104063879500700413.
КАС пабмед Статья Google Scholar
Zhang J, Zou H, Wang LF, Li N, Wang GT, Huang B, Nie P: Конструирование двух селективных маркеров для интегративных/конъюгативных плазмид в Flavobacterium columnare . Чин Дж Океанол Лимнол. 2012, 30: 269-278. 10.1007/с00343-012-1077-з.
Артикул КАС Google Scholar
Zhang Y, Arias CR, Shoemaker CA, Klesius PH: Сравнение липополисахаридных и белковых профилей между штаммами Flavobacterium columnare из разных геномоваров. Дж. Фиш Дис. 2006, 29: 657-663. 10.1111/j.1365-2761.2006.00760.х.
КАС пабмед Статья Google Scholar
Ourth DD, Wilson EA: Бактерицидный сывороточный ответ канального сома против грамотрицательных бактерий.Дев Комп Иммунол. 1982, 6: 579-583. 10.1016/S0145-305X(82)80044-X.
КАС пабмед Статья Google Scholar
Suomalainen L-R, Tiirola M, Valtonen ET: Влияние условий выращивания на инфекцию Flavobacterium columnare радужной форели. Дж. Фиш Дис. 2005, 28: 271-277. 10.1111/j.1365-2761.2005.00631.х.
ПабМед Статья Google Scholar
Каннингем Ф.Л., Джек С.В., Хардин Д., Уиллс Р.В.: Факторы риска на уровне пруда, связанные с болезнью столбняка на коммерческих фермах по выращиванию сома в Миссисипи. Джей Аква Аним Здоровье. 2012, 24: 178-184. 10.1080/08997659.2012.675932.
ПабМед Статья Google Scholar
Роджерс В. А.: Основные болезни сомов: как идентифицировать и бороться с ними.Fish Farming Ind. 1971, 2: 20-26.
Google Scholar
LaFrentz BR, Shoemaker CA, Booth NJ, Peterson BC, Ourth DD: Индекс селезенки и уровни маннозо-связывающего лектина в четырех семействах канальных сомов, демонстрирующих различную восприимчивость к Flavobacterium columnare и Edwardsiella ictaluri .J Aquatic Anim Health. 2012, 24: 141-147. 10.1080/08997659.2012.675936.
Артикул Google Scholar
Серийная убийца скоплений рыб
Эта статья была подготовлена и профинансирована Норвежским ветеринарным институтом
Он душит своих жертв - медленно. Несмотря на лечение, микроорганизм Saprolegnia представляет собой постоянную проблему для рыбоводных заводов и производства мальков во всем мире, приводя к значительным потерям.
Норвежский ветеринарный институт
Норвежский ветеринарный институт является национальным институтом биомедицинских исследований в области здоровья животных, здоровья рыб и безопасности пищевых продуктов.
После того, как вы столкнулись с этой проблемой, от нее трудно избавиться. В среднем в отрасли из-за этой пресноводной плесени теряется 10 процентов икры и мальков рыб. В некоторых инкубаториях были зарегистрированы потери до 90 процентов.
Новое лечение, менее эффективное
Несмотря на лечение плесени, инфекции возвращаются снова и снова. Раньше для борьбы с сапролегнией использовали малахит. Этот препарат имел хороший эффект, но был запрещен к применению после того, как доказал свою канцерогенность.
Были внедрены новые лекарственные препараты, но, к сожалению, они не доказали свою эффективность.
«Мы подозреваем, что повторяющиеся инфекции в инкубаториях связаны с резервуаром сапролегнии, против которого сегодняшние средства лечения неэффективны.Биопленка может быть таким резервуаром, но мы не знали, в какой степени Saprolegnia способна образовывать биопленки. Поэтому мы исследовали это», — говорит Али Шимаа, научный сотрудник Норвежского ветеринарного института.
Сапролегниозная инфекция на рыбьей икре в лаборатории. (Фото: Симаа Али)
«С микроорганизмами, формирующими биопленки, часто очень трудно бороться. Формирование биопленок можно рассматривать как стратегию, которую микроорганизмы часто выбирают для выживания в агрессивной среде.Когда Saprolegnia сливаются и образуют сложные сообщества с другими микроорганизмами, микроорганизмы становятся сильнее и способны противостоять атакам внешних лакомств, включая дезинфицирующие средства», — продолжает она.
Такие микроорганизмы в скоплениях образуют защитную «кожу» или пленку, так называемую матрицу, которая действует как щит от вражеских атак.
Выявлена способность образовывать биопленки
Не все одинаково хорошо формируют биопленки, и никто ранее не исследовал, могут ли виды Saprolegnia образовывать такие сообщества микроорганизмов.В этом исследовании они изучили и проверили, могут ли сапролегении образовывать такие биопленки как в изолированной форме, так и в естественной среде, к которой они принадлежат.
«Ранее мы думали, что смертоносная Saprolegnia parasitica полагалась на рыбу для размножения, подобно вирусу в том смысле, что для размножения ей нужна клетка-хозяин. В более ранних исследованиях мы измеряли споры грибка в воде на входе и выходе из инкубатория. Это показало, что количество спор было выше в воде на выходе.
Шима Али. (Фото: Мари М. Пресс)
Считалось, что это распространение стало возможным благодаря рыбе. Поэтому исследователи были удивлены, когда исследование показало, что Saprolegnia parasitica образует биопленку и размножается бесполым путем, без присутствия рыб.
Они также обнаружили похожий вариант Saprolegnia australis. Поэтому вполне вероятно, что естественные биопленки служат резервуарами для Saprolegnia в дикой природе и в аквакультуре.
«Эти знания необходимы для разработки новой стратегии управления в будущем», — говорит она.
Проверенное сопротивление
В ходе исследования были протестированы различные химические вещества, используемые для борьбы с сапролегнией и борьбы с ней на биопленках сапролегнии. Опыты показали, что, несмотря на неоднократные обработки, сапролегнии снова вырастали.
Опыты показали, что, несмотря на неоднократные обработки, сапролегнии снова вырастали.
Используемые сегодня методы лечения дороги и не приносят пользы окружающей среде. Формалин является одним из веществ, используемых в настоящее время, но он запрещен во все большем количестве стран.
«Поэтому важно найти новые способы борьбы с этой плесенью-убийцей, — говорит Симаа.
"Сейчас мы работаем над новыми стратегиями борьбы с биопленкой Saprolegnia, среди которых возможность использования функционализированных наноматериалов.
Внешние ссылки
Связанный контент
В Дании ликвидирована страшная болезнь рыб
Исследователи успешно искоренили болезнь рыб VHS в Дании.Их методы теперь будут использоваться в других странах.
Выращенной рыбе не нужно есть рыбу
Рыба традиционно была важным ингредиентом корма в аквакультуре, теперь новое исследование показывает, как радужная форель, выращенная на ферме, может питаться кормом, полностью не содержащим рыбной муки, при этом быстро развиваясь и сохраняя хорошее здоровье.
Отчаянные рыбки
Они думают о разведении, так как сезон подходит к концу.Парни падают замертво с каждым часом, заставляя девочек-бычков изо всех сил охотиться за парой, которая станет отцом их потомства.
Эффективность Виркон-С для борьбы с сапролегниозом карпа, Cyprinus carpio L
1 и 2Университет, Пусан, Южная Корея
Tae-Jin Choi
2 Кафедра микробиологии Национального университета Пукён, Пусан, Южная Корея
Академический редактор: Карлос Гутьеррес
1 Выпускник Международной научной программы KOICA-PKNU , Национальный университет Пукионг, Пусан, Южная Корея
2 Кафедра микробиологии, Национальный университет Пукионг, Пусан, Южная Корея
Автор, ответственный за переписку.
Поступила в редакцию 15 февраля 2018 г.; Принято 8 сентября 2018 г.
Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение, воспроизведение и адаптацию на любом носителе и для любых целей при условии надлежащего указания авторства. Для атрибуции необходимо указать оригинального автора (авторов), название, источник публикации (PeerJ) и либо DOI, либо URL-адрес статьи.Резюме
Справочная информация
Saprolegnia parasitica – патоген рыб, вызывающий серьезные экономические потери во всем мире.Виркон-С — хорошо известное дезинфицирующее средство, проявляющее антимикробную активность в отношении бактерий, вирусов и грибков. В этом исследовании мы проверили противогрибковую активность Виркон-С против S . parasitica , основной возбудитель сапролегниоза.
Методы
Наименьшую концентрацию Virkon-S, предотвращающую прорастание или видимый рост спор, и процент прорастания спор определяли с использованием чашек с картофельно-декстрозным агаром, содержащих различные концентрации Virkon-S. Цитотоксический эффект оценивали с помощью анализа жизнеспособности клеток Ez-Cytox с клетками epithelioma papulosum cyprini ( EPC), выращенными в среде L-15, и проводили тесты на острую токсичность на культивируемых сеголетках карпа в течение 96 часов. Искусственное заражение S . parasitica проводили путем помещения рыб в аквариумы, содержащие зооспоры S . parasitica после удаления накипи и ранения в трех местах. Больных рыб содержали в аквариумах с концентрацией Виркон-С 2, 4 и 10 мг/л в течение 10 сут для наблюдения за эффектом лечения.
Цитотоксический эффект оценивали с помощью анализа жизнеспособности клеток Ez-Cytox с клетками epithelioma papulosum cyprini ( EPC), выращенными в среде L-15, и проводили тесты на острую токсичность на культивируемых сеголетках карпа в течение 96 часов. Искусственное заражение S . parasitica проводили путем помещения рыб в аквариумы, содержащие зооспоры S . parasitica после удаления накипи и ранения в трех местах. Больных рыб содержали в аквариумах с концентрацией Виркон-С 2, 4 и 10 мг/л в течение 10 сут для наблюдения за эффектом лечения.
Результаты
Результаты анализа in vitro показали, что Virkon-S может ингибировать прорастание спор и, как следствие, рост мицелия при концентрации всего лишь 4 ppm. Цитотоксического действия на клетки ЭПК не наблюдалось даже при концентрации до 100 м.д. Кроме того, не наблюдалось острой токсичности у обыкновенного карпа при концентрации 10 частей на миллион после 96-часового воздействия. Десятидневное лечение Виркон-С в дозах 4 и 10 мг/л привело к полному купированию искусственно индуцированного сапролегниоза у карпа.
Десятидневное лечение Виркон-С в дозах 4 и 10 мг/л привело к полному купированию искусственно индуцированного сапролегниоза у карпа.
Обсуждение
Эти данные свидетельствуют о том, что Виркон-С можно использовать для борьбы с сапролегниозом без вредного воздействия на рыб. Однако необходимы дальнейшие исследования воздействия на людей и продукты питания.
Ключевые слова: Сапролегниоз, Saprolegnia parasitica , Виркон-С, Искусственное заражение, Выздоровление Грандес, Родригес-Каденас и Аллер-Ганседо, 2007 г.; Джалилпур, Шенавар Масулех и Масумзаде, 2006 г.).Наиболее распространенным и экономически важным грибковым заболеванием выращиваемых рыб является сапролегниоз. Сапролегниоз, также известный как «зимний грибок», обычно возникает в период с октября по март, когда температура воды ниже 15 °C, но смертность обычно увеличивается по мере повышения температуры ранней весной (Osman et al., 2008). Инфекции Saprolegnia видны невооруженным глазом в виде белых пятен на коже зараженной рыбы или в виде «ваты» на икре рыб. От этих яиц грибок может распространяться на живые яйца посредством положительного хемотаксиса, что означает, что некоторые химические сигналы от живых яиц заставляют гриб двигаться к ним (Bruno & Wood, 1999).
От этих яиц грибок может распространяться на живые яйца посредством положительного хемотаксиса, что означает, что некоторые химические сигналы от живых яиц заставляют гриб двигаться к ним (Bruno & Wood, 1999).
Термин «сапролегниоз» описывает инфекцию грибами, фактически являющимися филогенетической линией грибоподобных микроорганизмов семейства Saprolegniaceae порядка Saprolegniales класса Oomycota . Два основных рода, Saprolegnia и Achlya семейства Saprolegniaceae , могут заражать рыбу или моллюсков. Хотя патогенные организмы, ответственные за сапролегниоз, еще не идентифицированы, три вида, включая Saprolegnia parasitica и S . diclina , которые представляют собой таксономически сложную группу и обозначаются как комплекс Saprolegnia (Willoughby, Pickering & Johnson, 1984), и Achlya hoferi являются основными этиологическими агентами этого заболевания, а S . parasitica известен как наиболее важный среди них (Van West, 2006). С . parasitica проникают в ткани эпидермиса, обычно колонизируя область хвоста или головы, а затем размножаются, покрывая всю поверхность тела (Willoughby, 1994).
parasitica известен как наиболее важный среди них (Van West, 2006). С . parasitica проникают в ткани эпидермиса, обычно колонизируя область хвоста или головы, а затем размножаются, покрывая всю поверхность тела (Willoughby, 1994).
Традиционно, S . Инфекции parasitica эффективно контролировались малахитовым зеленым (Oláh & Farkas, 1978; Srivastava & Srivastava, 1978; Alderman, 1985). Однако в 2002 году это соединение было запрещено во всем мире из-за его нежелательного воздействия на здоровье животных (Van West, 2006; Stammati et al., 2005; Srivastava, Sinha & Roy, 2004; Brock & Bullis, 2001). С тех пор активизировался поиск новых и эффективных веществ против инфекций Saprolegnia .Хотя химические вещества, включая формалин, перекись водорода, хлорид натрия (Rach et al., 2005; Barnes, Stephenson & Gabel, 2003; Schreier, Rach & Howe, 1996), сульфат меди (Straus et al., 2009), детергенты, такие как бронопол (Pottinger & Day, 1999) и озон (Forneris et al./GettyImages-532870385-47d7ad58136d475fb3c776798b04752f.jpg) , 2003) показали некоторую эффективность, но ни один из них не был так эффективен, как малахитовый зеленый. Использование этих типов соединений привело к ряду проблем, включая развитие устойчивости к фунгицидам и потенциально вредное воздействие на здоровье человека (Phillips et al., 2008; Стаммати и др., 2005). Таким образом, по-прежнему существует острая необходимость в разработке новых альтернатив, эффективных в борьбе с грибковыми инфекциями, а также безопасных для рыб и окружающей среды (Khosravi et al., 2012).
, 2003) показали некоторую эффективность, но ни один из них не был так эффективен, как малахитовый зеленый. Использование этих типов соединений привело к ряду проблем, включая развитие устойчивости к фунгицидам и потенциально вредное воздействие на здоровье человека (Phillips et al., 2008; Стаммати и др., 2005). Таким образом, по-прежнему существует острая необходимость в разработке новых альтернатив, эффективных в борьбе с грибковыми инфекциями, а также безопасных для рыб и окружающей среды (Khosravi et al., 2012).
Virkon-S был первоначально разработан компанией Antec International (Antec International Limited, Садбери, Саффолк, Великобритания) и запущен в производство в 1986 году для использования в сельском хозяйстве и животноводстве. Он считается одним из самых передовых дезинфицирующих средств для ферм. Это было одно из первых окислительных дезинфицирующих средств, которые использовались на ферме, и оно продолжает лидировать в животноводстве и биобезопасности ферм, успешно применяясь против 500 болезнетворных патогенов, включая вирусы, бактерии и грибки, вызывающие ящур. болезнь, птичий грипп, Salmonella и Campylobacter (Marchetti et al., 2006; Херндес и др., 2000). Благодаря широкому спектру антимикробной активности и относительной безопасности Virkon-S используется Продовольственной и сельскохозяйственной организацией Объединенных Наций и правительствами всего мира для обеспечения биобезопасности и усиления планирования действий в чрезвычайных ситуациях (http://www.virkon.com/en). /продукты-применения/дезинфицирующие средства/виркон-с/). В Корее Виркон-С был одобрен в качестве квазилекарства для животных и использовался в качестве дезинфицирующего средства для объектов аквакультуры в 2016 г.
болезнь, птичий грипп, Salmonella и Campylobacter (Marchetti et al., 2006; Херндес и др., 2000). Благодаря широкому спектру антимикробной активности и относительной безопасности Virkon-S используется Продовольственной и сельскохозяйственной организацией Объединенных Наций и правительствами всего мира для обеспечения биобезопасности и усиления планирования действий в чрезвычайных ситуациях (http://www.virkon.com/en). /продукты-применения/дезинфицирующие средства/виркон-с/). В Корее Виркон-С был одобрен в качестве квазилекарства для животных и использовался в качестве дезинфицирующего средства для объектов аквакультуры в 2016 г.
Несмотря на широкий спектр антимикробной активности Виркон-С, сообщений о его активность в отношении Saprolegnia .В этом исследовании мы проверили противогрибковую активность Виркон-С против S . parasitica in vitro и in vivo для определения возможности использования этого материала для борьбы с сапролегниозом в будущем.
Протокол животных, использованный в этом исследовании, был рассмотрен и одобрен Национальным комитетом по уходу за животными и их использованию Пукён (PKNU-IACUC), в котором излагаются этические процедуры и научный уход за животными, используемыми в исследованиях (номер утверждения PKNU-2017). -01).
Материалы и методы
Saprolegnia parasitica культурыS . parasitica был приобретен в Корейской коллекции типовых культур (KCTC 46452) и выращен на картофельно-декстрозном агаре (PDA) при 25 °C. Этот штамм был выделен из выращиваемой радужной форели на аквакультурной ферме в Вонджу, Канвондо, Корея, в 2016 году до осаждения.
Рыба и условия выращивания
Всего 100 мальков обыкновенного карпа, Cyprinus carpio , со средним размером и весом 11.5 ± 1 см и 17,6 ± 3 г соответственно были получены с аквакультурной фермы Намсанджу, расположенной в Санджу-си, Кёнсан-Пукто, Корея. Каждую рыбу проверяли на наличие инфекции и акклиматизировали в 450-литровых аквариумах для выращивания при 22 ± 2 °C в течение 10 дней. В период акклиматизации рыб кормили два раза в день надлежащим рационом согласно Ellsaesser & Clem (1986).
В период акклиматизации рыб кормили два раза в день надлежащим рационом согласно Ellsaesser & Clem (1986).
Виркон-С
Виркон-С был приобретен у Bayer Korea (Сеул, Корея) и 1 кг содержал тройную соль 500 г, гексаметафосфат 181 г, додецилбензолсульфокислоту натрия 150 г, яблочную кислоту 100 г, сульфаминовую кислоту 50 г. и натрия хлорида 15 г.Готовили 10% раствор с дистиллированной водой и при необходимости делали дополнительные разбавления.
Ингибирование прорастания спор
Ингибирующее действие Виркон-С на прорастание спор тестировали двумя методами. Во-первых, минимальная фунгицидная концентрация (MFC), определяемая как самая низкая концентрация химического вещества, которая предотвращает прорастание или видимый рост спор, была определена, как описано ранее (Yao et al., 2017; Hu et al., 2013). Споровую суспензию, содержащую ооспоры и зооспоры, готовили, как описано Yao et al.(2017). С . parasitica культивировали на PDA при 25 °C в течение 12 дней для индуцирования спор. Приблизительно 10 мл дистиллированной воды добавляли в каждую чашку Петри диаметром 87 мм, мицелий и споры соскребали и фильтровали через восемь слоев стерильной марли. Конечную концентрацию спор доводили до приблизительно 1 × 10 6 спор/мл с помощью гемоцитометра. Образец суспензии спор объемом 10 мкл наносили в центр чашки Петри диаметром 87 мм, содержащей 20 мл ФДА с 0, 2, 4, 10, 20 или 100 частей на миллион Виркон-С, и инкубировали при 25 °C.Через 72 ч инкубации измеряли диаметр роста мицелия. Ингибирование прорастания спор также определяли по проценту прорастания спор, как описано Király et al. (1974). Были приготовлены планшеты с ФДА, содержащие 0, 2, 4, 10, 20 и 100 м.д. Виркон-С, но общее количество ФДА составляло только 10 мл на каждый планшет. Это условие уменьшало рост мицелия, и пластинка была достаточно прозрачной, чтобы можно было наблюдать прорастание спор под световым микроскопом. На каждую чашку помещали по три капли 10-мкл суспензии спор и инкубировали при 25°С в течение 72 часов.
Приблизительно 10 мл дистиллированной воды добавляли в каждую чашку Петри диаметром 87 мм, мицелий и споры соскребали и фильтровали через восемь слоев стерильной марли. Конечную концентрацию спор доводили до приблизительно 1 × 10 6 спор/мл с помощью гемоцитометра. Образец суспензии спор объемом 10 мкл наносили в центр чашки Петри диаметром 87 мм, содержащей 20 мл ФДА с 0, 2, 4, 10, 20 или 100 частей на миллион Виркон-С, и инкубировали при 25 °C.Через 72 ч инкубации измеряли диаметр роста мицелия. Ингибирование прорастания спор также определяли по проценту прорастания спор, как описано Király et al. (1974). Были приготовлены планшеты с ФДА, содержащие 0, 2, 4, 10, 20 и 100 м.д. Виркон-С, но общее количество ФДА составляло только 10 мл на каждый планшет. Это условие уменьшало рост мицелия, и пластинка была достаточно прозрачной, чтобы можно было наблюдать прорастание спор под световым микроскопом. На каждую чашку помещали по три капли 10-мкл суспензии спор и инкубировали при 25°С в течение 72 часов. Процент всхожести спор определяли следующим образом:
Процент всхожести спор определяли следующим образом:
Процент всхожести спор = No. проросших спорОбщее количество исследованных спор × 100.
Ингибирование роста мицелия на чашках PDA
Ингибирование S . Рост мицелия parasitica тестировали на чашках PDA, содержащих различные концентрации Virkon-S, как описано Hu et al. (2013). Вкратце, 2 × PDA стерилизовали, охлаждали примерно до 65 °C и смешивали с таким же объемом Virkon-S, чтобы получить конечные концентрации Virkon-S 2, 4, 10, 20 и 100 частей на миллион.2 × PDA смешивали с таким же объемом стерильной воды в контрольных чашках. Аликвоты смеси (10 мл) выливали в чашки Петри диаметром 87 мм. В центр приготовленных чашек помещали блок PDA, колонизированный S aprolegnia , размером примерно 5 × 5 мм. Планшеты инкубировали при 25°C в течение 72 ч и измеряли диаметр роста мицелия. Процент ингибирования грибков рассчитывали на основе процентного ингибирования радиального роста (PIRG), как описано Dananjaya et al. (2017) следующим образом: PIRG (%) = [(R1 − R2)]/R1 × 100%, где R1 = радиальный рост в контроле и R2 = радиальный рост в лечении.
(2017) следующим образом: PIRG (%) = [(R1 − R2)]/R1 × 100%, где R1 = радиальный рост в контроле и R2 = радиальный рост в лечении.
Цитотоксичность Virkon-S в клетках эпителиомы папулосум киприни (EPC) клетки EPC, следуя процедурам, описанным Park et al. (2017). Клетки ЭПК (1 × 10
5 ) выращивали в среде L-15 с добавлением 10% эмбриональной бычьей сыворотки, пенициллина (62.5 мкг/мл) и стрептомицин (100 мкг/мл) в 96-луночных планшетах на ночь. Для лечения клеточную среду заменяли средой (100 мкл), содержащей 10, 100, 500, 1000, 5000 и 10000 частей на миллион Виркон-С. Необработанные клетки использовали в качестве отрицательного контроля. После 24 часов инкубации в каждую лунку добавляли 110 мкл среды, содержащей 10 мкл водорастворимого раствора тетразолия, и планшеты инкубировали еще 4 часа. Поглощение при 460 нм измеряли с использованием ридера для твердофазного иммуноферментного анализа (Molecular Devices, Кремниевая долина, Калифорния, США), а относительную жизнеспособность клеток рассчитывали, используя клетки, обработанные средой только в качестве контроля.
Острая токсичность у сазана
Испытания на токсичность только в воде проводились на культивируемых сеголетках сазана Cyprinus carpio с использованием пяти концентраций Виркон-С (2, 4, 10, 20 и 100 ppm) и три рыбы на концентрацию. Здоровые и здоровые рыбы, которые ранее не подвергались воздействию каких-либо загрязнителей или токсикантов, были отобраны на основании их активности и внешнего вида. Рыб акклиматизировали в течение 7 дней при 18 °C при постоянном освещении и кормлении коммерческими кормами.Трех рыб помещали в трехлитровую стеклянную колбу с различными концентрациями Виркон-С и выдерживали в течение 96 ч в аэрированной воде без подмены воды и кормления. Мертвую рыбу удаляли из колбы во избежание возможного ухудшения качества воды. Для каждой концентрации рассчитывали процент смертности рыб через 24, 48, 72 и 96 часов воздействия. После 96 часов воздействия все выжившие были переведены в 50-литровый резервуар, оборудованный аэрацией, и в течение 40 дней наблюдались за любыми эффектами после воздействия.
Ингибирование сапролегниоза препаратом Виркон-S
Пять групп по 20 рыб использовали для искусственного заражения S . parasitica и обработка препаратом Виркон-С. Три группы были искусственно инфицированы и обработаны Виркон-С в концентрациях 2, 4 и 10 частей на миллион. Рыб в группе положительного контроля заражали S . parasitica , но не обработанные Вирконом-С. Рыба в группе отрицательного контроля не была заражена S . parasitica без обработки Виркон-С.Рыб содержали в аквариуме из стекловолокна объемом 150 л, разделенном на три секции металлической сеткой, по шесть-семь рыб в каждой секции. Температуру воды фиксировали на уровне 17 ± 1 °С с помощью комнатного кондиционера. У всех рыб наблюдали за поведенческими и клиническими признаками инфекции.
Для искусственного заражения S . parasitica , рыбу очищали от чешуи и ранили в трех местах на одной стороне тела (макушка головы, центр тела и область хвоста) с помощью острого скальпеля. Площадь ранения составляла примерно 1 см 2 . Споры S . parasitica были приготовлены, как описано выше, и добавлены в резервуары, содержащие три экспериментальные группы и группу положительного контроля, в конечной концентрации 1 × 10 5 спор/мл (Willoughby, 1994; Hatai & Hoshiai, 1994).
Площадь ранения составляла примерно 1 см 2 . Споры S . parasitica были приготовлены, как описано выше, и добавлены в резервуары, содержащие три экспериментальные группы и группу положительного контроля, в конечной концентрации 1 × 10 5 спор/мл (Willoughby, 1994; Hatai & Hoshiai, 1994).
Через десять дней после добавления спор с помощью светового микроскопа наблюдали белый нарост, похожий на вату, на поверхности раны, который культивировали на PDA при 25 °C в течение 3 дней.Морфологические и микроскопические характеристики культуры сравнивали с характеристиками S . parasitica зарегистрированы в ходе предыдущих исследований (Hatai, Willoughby & Beakes, 1990; Willoughby, Pickering & Johnson, 1984). В эти резервуары для обработки добавляли раствор Виркон-С в конечных концентрациях 2, 4 и 10 частей на миллион для оценки эффекта обработки. Воду в аквариуме заменяли Виркон-С той же концентрации через 5 дней и регистрировали кумулятивную гибель в течение 10 дней. Рыб диагностировали по клиническим признакам и заживлению поражений через 10 дней после лечения.
Рыб диагностировали по клиническим признакам и заживлению поражений через 10 дней после лечения.
Результаты
Ингибирование прорастания спор
Ингибирование S . Прорастание спор parasitica с помощью Виркон-С проверяли, наблюдая рост мицелия из суспензии спор на чашках ПДА нормальной толщины (20 мл среды в чашках 87 мм) и подсчитывая прорастание спор на чашках ПДА половинной толщины. На чашках с 4, 10, 20 и 100 ppm Виркон-С через 72 ч после инкубации при 25 °C (–) признаков роста мицелия не наблюдалось.Рост мицелия на чашке, содержащей 2 ppm, составил 53,8% от контрольной чашки (35 и 65 мм соответственно) (). Таким образом, MFC был определен как менее или равный 4 ppm на планшетах PDA.
Ингибирование прорастания спор и, как следствие, роста мицелия на чашках с картофельно-декстрозным агаром (PDA) с использованием различных концентраций Virkon-S. Изображения получены через 72 часа после инкубации при 25 °C. А; 100 частей на миллион, В; 20 м. д., С; 10 м.д., Д; 4 м.д. и Е; 2 части на миллион. В контрольный планшет Виркон-С не добавляли.Фотография сделана первым автором.
д., С; 10 м.д., Д; 4 м.д. и Е; 2 части на миллион. В контрольный планшет Виркон-С не добавляли.Фотография сделана первым автором.
На чашках половинной толщины, содержащих 4, 10, 20 или 100 ppm Виркон-С, через 72 ч после инкубации при 25 °C признаков прорастания спор не наблюдалось. Небольшое количество спор на чашках с ПДА, содержащих 2 м.д., прорастало со скоростью 39,2% (22 из 56). Напротив, большинство спор на контрольных чашках прорастали со скоростью 96,2% (51 из 53 спор). Таким образом, скорость ингибирования прорастания спор была рассчитана как 59% при концентрации 2 ppm [(96.2–39,2)/96. 2 × 100].
Ингибирование роста мицелия
Рост S . parasitica на ФДА, содержащем 2, 4, 10, 20 и 100 ppm Виркон-С, наблюдали после инокуляции при 25°С в течение 72 ч. В чашках с 10, 20 и 100 мг/л Виркон-С (–) роста мицелия не наблюдалось. Был небольшой рост S . parasitica на чашках PDA, содержащих 4 ppm Virkon-S (). Степень ингибирования роста (IR) на чашках, содержащих 4 и 2 ppm, составляла 69. 2 и 25,6%, соответственно, при расчете IR как [%IR = 100 - 100X/Y], где X = рост мицелия в образце; Y = рост мицелия в контроле.
2 и 25,6%, соответственно, при расчете IR как [%IR = 100 - 100X/Y], где X = рост мицелия в образце; Y = рост мицелия в контроле.
А; 100 частей на миллион, В; 20 м.д., С; 10 м.д., Д; 4 м.д. и Е; 2 части на миллион. В контрольный планшет Виркон-С не добавляли. Фотография сделана первым автором.
Цитотоксичность Виркон-С в культивируемых клетках ЭПК
Цитотоксический эффект Виркон-С в клетках ЭПК показан в .Не выявлено влияния Виркон-С на жизнеспособность клеток при 10 и 100 м.д. Было небольшое снижение (97%) при 500 ч./млн. Однако жизнеспособность клеток внезапно падала, когда концентрация Виркон-С превышала 1000 частей на миллион. В анализах ингибирования роста мицелия и ингибирования прорастания спор 4 ppm было достаточно, чтобы ингибировать прорастание спор и, как следствие, рост мицелия. Даже концентрация 100 частей на миллион не приводила к какой-либо токсичности в клетках ЭПК. Поэтому в дальнейших экспериментах использовали концентрации 10 ppm и ниже.
Поэтому в дальнейших экспериментах использовали концентрации 10 ppm и ниже.
Результаты представляют собой среднее значение восьми повторов с указанием стандартных отклонений.
Испытание на острую токсичность Виркон-С у сазана
Острую токсичность Виркон-С у сазана исследовали путем помещения рыб в стеклянные колбы, содержащие пять различных концентраций Виркона-С, на срок до 96 часов. Как показано на рисунке, вся рыба в колбе со 100 ч/млн погибла в течение 24 часов. Более того, 75 и 100% кумулятивная смертность наблюдалась в течение 24 и 46 часов, соответственно, в колбе с 20 ч./млн.Однако в колбах, содержащих 10, 4 и 2 ppm Виркон-С, гибели не наблюдалось. Кроме того, у выживших после испытания на острую токсичность не было выявлено каких-либо последствий после воздействия, когда они содержались в резервуаре для культивирования в течение 40 дней. Таким образом, был сделан вывод, что 10 ppm, ингибирующие прорастание спор и рост мицелия, не вызывают цитотоксических эффектов в клетках ЭПК и поэтому могут быть определены как максимально допустимая концентрация токсиканта (МАТК) для Виркон-С.
Таблица 1
Суммарная смертность сазана при остром воздействии Виркон-С.
| Концентрация (частей на миллион) | Накопительное смертность (%) | ||||
|---|---|---|---|---|---|
| 24 ч | 48 ч | 72 ч | 96 ч | ||
| 100 | 100 | - | - | - | |
| 20 | 75 | 100 | - | - | |
| 10 | 0 | 0 | 0 | 0 | |
| 4 | 0 | 0 | 0 | 0 | 0 |
| 2 | 0 | 0 | 0 | 0 | |
Индукция искусственной инфекции и лечения с Вирконом-с
Семь дней после добавления S . parasitica спор в емкости, содержащие искусственно раненого сазана, появились типичные признаки сапролегниоза, в том числе хлопковидный рост грибов и изъязвление раны (). Мицелиальный рост, похожий на вату, удаляли из раны и наблюдали под микроскопом, чтобы подтвердить его сходство с инокулированным S . parasitica и помещали на чашку PDA, чтобы вызвать рост мицелия. Как ватно-подобный мицелиальный рост инфицированной рыбы, так и мицелий, выращенный на чашке PDA, показали одинаковые морфологические характеристики S . parasitica , что указывало на то, что заболевание было вызвано спорами S . parasitica , которые были добавлены в танки. Больных рыб обрабатывали Вирконом-С в конечной концентрации 2, 4 и 10 частей на миллион, и результаты показаны на рис. В течение 10-дневного периода лечения среди рыб, получавших 4 и 10 частей на миллион, не наблюдалось гибели. Однако кумулятивная смертность в аквариуме с 2 млн-1 достигла 50%.
parasitica спор в емкости, содержащие искусственно раненого сазана, появились типичные признаки сапролегниоза, в том числе хлопковидный рост грибов и изъязвление раны (). Мицелиальный рост, похожий на вату, удаляли из раны и наблюдали под микроскопом, чтобы подтвердить его сходство с инокулированным S . parasitica и помещали на чашку PDA, чтобы вызвать рост мицелия. Как ватно-подобный мицелиальный рост инфицированной рыбы, так и мицелий, выращенный на чашке PDA, показали одинаковые морфологические характеристики S . parasitica , что указывало на то, что заболевание было вызвано спорами S . parasitica , которые были добавлены в танки. Больных рыб обрабатывали Вирконом-С в конечной концентрации 2, 4 и 10 частей на миллион, и результаты показаны на рис. В течение 10-дневного периода лечения среди рыб, получавших 4 и 10 частей на миллион, не наблюдалось гибели. Однако кумулятивная смертность в аквариуме с 2 млн-1 достигла 50%. Кроме того, у рыб, получавших 4 и 10 частей на миллион, наблюдалось явное выздоровление от болезни.Как показано на рисунке, все грибковые образования в форме хлопка исчезли с тела рыбы. Кроме того, появлялись новые чешуйки, покрывавшие пораженную область, что свидетельствовало о полном выздоровлении от болезни.
Кроме того, у рыб, получавших 4 и 10 частей на миллион, наблюдалось явное выздоровление от болезни.Как показано на рисунке, все грибковые образования в форме хлопка исчезли с тела рыбы. Кроме того, появлялись новые чешуйки, покрывавшие пораженную область, что свидетельствовало о полном выздоровлении от болезни.
(А) Клинические признаки S parasitica на теле рыбы через 10 дней после искусственного наведения раны и воздействия грибковой зооспоры. (Б) Восстановление от сапролегниоза после лечения в течение 10 дней 10 мг/л Виркон-С.Прямоугольники обозначают пораженную область для искусственного заражения и показывают полное выздоровление от болезни. Масштабные полосы указывают 1 см. Фотографии сделаны первым автором.
Таблица 2
Лечение искусственно вызванного сапролегниоза препаратом Виркон-С.
| Обработанные концентрация (частей на миллион) | % заживления после лечения | Накопительное смертности (%) |
|---|---|---|
| 10 | 100 | 0 |
| 4 | 100 | 0 |
| 2 | 50 | 0 |
| Положительный контроль | 0 | 90 |
| Отрицательный контроль б | - | 0 |
Обсуждение
Так как малахит зеленый был запрещен для лечения сапролегниоза из-за возможной генотоксичности, канцерогенных эффектов и остаточной токсичности, это заболевание привело к серьезным экономическим потерям в отрасли разведения пресноводной рыбы (Van West, 2006). Хотя были опробованы многие альтернативы, в настоящее время нет доступных химических веществ, обеспечивающих достаточную защиту от болезни. Кроме того, санитарные проблемы, экологические ограничения и высокая стоимость также ограничивают использование этих синтетических противомикробных препаратов (Yao et al., 2010). Единственными соединениями, одобренными Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для борьбы с грибком, являются 37% формалина и 35% перекиси водорода, но их эффективность ниже, чем у малахитового зеленого (Straus et al., 2016).
Хотя были опробованы многие альтернативы, в настоящее время нет доступных химических веществ, обеспечивающих достаточную защиту от болезни. Кроме того, санитарные проблемы, экологические ограничения и высокая стоимость также ограничивают использование этих синтетических противомикробных препаратов (Yao et al., 2010). Единственными соединениями, одобренными Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов США для борьбы с грибком, являются 37% формалина и 35% перекиси водорода, но их эффективность ниже, чем у малахитового зеленого (Straus et al., 2016).
Virkon-S — хорошо известное дезинфицирующее средство, эффективность которого в отношении бактерий, вирусов и грибков доказана (Gehan et al., 2009). В этом исследовании мы показали, что Виркон-С обладает противогрибковой активностью в отношении S . parasitica in vitro и in vivo , и, насколько нам известно, эта активность была продемонстрирована впервые.
Минимальная концентрация для ингибирования прорастания спор и связанного с этим роста мицелия на чашках с ПДА составляла всего 4 части на миллион, а частичное (53,8%) ингибирование наблюдалось на чашке с ПДА, содержащей 2 части на миллион Виркон-С. Таким образом, было определено, что MFC составляет 4 м.д. на планшетах PDA.Когда эксперимент по ингибированию прорастания спор был повторен на тонких пластинах PDA для подсчета, полное ингибирование прорастания спор все еще происходило при 4 ч/млн, и было получено 59% ингибирование при 2 ч/млн. Хотя в нашем эксперименте было доказано, что концентрация Virkon-S всего 4 ppm эффективна для ингибирования прорастания, концентрация и время контакта, необходимые для инактивации грибков, по-видимому, специфичны для каждого грибка. Сообщалось, что 1 мин контакта с 1% Вирконом-С достаточно для инактивации Batrachochytrium dendrobatidis , что вызывает массовую гибель различных видов амфибий (Gold et al., 2013; Джонсон и др., 2003). Напротив, Гехан и соавт. (2009) сообщили, что видов Aspergillus fumigatus и Fusarium были устойчивы к 1% раствору Virkon-S после 30-минутного и даже 60-минутного контакта в присутствии органических материалов.
Таким образом, было определено, что MFC составляет 4 м.д. на планшетах PDA.Когда эксперимент по ингибированию прорастания спор был повторен на тонких пластинах PDA для подсчета, полное ингибирование прорастания спор все еще происходило при 4 ч/млн, и было получено 59% ингибирование при 2 ч/млн. Хотя в нашем эксперименте было доказано, что концентрация Virkon-S всего 4 ppm эффективна для ингибирования прорастания, концентрация и время контакта, необходимые для инактивации грибков, по-видимому, специфичны для каждого грибка. Сообщалось, что 1 мин контакта с 1% Вирконом-С достаточно для инактивации Batrachochytrium dendrobatidis , что вызывает массовую гибель различных видов амфибий (Gold et al., 2013; Джонсон и др., 2003). Напротив, Гехан и соавт. (2009) сообщили, что видов Aspergillus fumigatus и Fusarium были устойчивы к 1% раствору Virkon-S после 30-минутного и даже 60-минутного контакта в присутствии органических материалов.
Аналогичным образом Rogawansamy et al. (2015) сообщили, что 10% концентрация Virkon-S привела к среднему диаметру зоны ингибирования всего 19,25 мм (±7,08) для A . fumigatus и 18,67 мм (±1.15) для Penicillium chrysogenum . Кроме того, 5, 3 и 1 % Виркон-С не влияли на рост обоих грибов. Таким образом, кажется, что противогрибковый эффект Виркон-С против каждого целевого гриба необходимо проверить для практического применения Виркон-С.
(2015) сообщили, что 10% концентрация Virkon-S привела к среднему диаметру зоны ингибирования всего 19,25 мм (±7,08) для A . fumigatus и 18,67 мм (±1.15) для Penicillium chrysogenum . Кроме того, 5, 3 и 1 % Виркон-С не влияли на рост обоих грибов. Таким образом, кажется, что противогрибковый эффект Виркон-С против каждого целевого гриба необходимо проверить для практического применения Виркон-С.
Для использования Виркон-С для борьбы с сапролегниозом он должен быть безопасен для рыб или обработанных эмбрионов. Цитотоксичность Виркон-С тестировали с клетками ЭПК, полученными из толстоголового гольяна, Pimephales promelas. Никакого цитотоксического эффекта не наблюдалось при 10 и 100 ppm, хотя наблюдалось небольшое снижение жизнеспособности клеток (97%) при 500 ppm (). Сообщений о цитотоксичности Виркон-С в культивируемых клеточных линиях рыб не поступало. Однако его способность инактивировать вирусы животных была проверена на клетках животных. Например, Ву и соавт. (2017) сообщили, что цитотоксичность 1% Virkon-S на культивируемых клетках почки 21A детеныша хомячка полностью устранялась при разведении 1 к 81 (123 ppm) в среде для культивирования клеток, что аналогично нашим данным и значительно ниже рекомендуемого. 1% концентрация для использования в качестве дезинфицирующего средства.
Например, Ву и соавт. (2017) сообщили, что цитотоксичность 1% Virkon-S на культивируемых клетках почки 21A детеныша хомячка полностью устранялась при разведении 1 к 81 (123 ppm) в среде для культивирования клеток, что аналогично нашим данным и значительно ниже рекомендуемого. 1% концентрация для использования в качестве дезинфицирующего средства.
Наши результаты показали, что 4 ppm было достаточно для ингибирования прорастания спор и роста мицелия. Поэтому представляется, что Виркон-С можно было бы использовать для контроля роста S . parasitica без каких-либо цитотоксических эффектов в концентрации, которая может ингибировать грибок. Это было дополнительно подтверждено испытаниями на острую токсичность. У рыб, содержащихся при 2, 4 и 10 ppm в течение 96 ч, токсического эффекта не наблюдалось (1). Кроме того, эти рыбы не проявляли каких-либо последствий после воздействия в течение 40 дней после окончания теста.Принимая во внимание результаты всех экспериментов, было определено, что МАТХ составляет 10 частей на миллион.
Эффективность Виркон-С была проверена на рыбе, искусственно зараженной S . паразитический . Рыбы, которые были ранены и инокулированы S . parasitica спор показали явные симптомы сапролегниоза через 10 дней после инокуляции, что было подтверждено микроскопическим исследованием и морфологией колоний на чашках PDA. У рыб, обработанных 2, 4 и 10 частей на миллион Виркон-С, наблюдалось 50, 100 и 100% излечение от болезни, соответственно, после 10 дней лечения.Концентрации, необходимые для контроля заболевания, совпадали с концентрациями, полученными в результате анализа in vitro . В дополнение к 100% выживаемости обработанных рыб у всех выздоровевших рыб наблюдалась регенерация чешуи на пораженной области, что свидетельствует об успешном лечении.
Выводы
Виркон-С одобрен как квазилекарство, которое можно использовать в качестве дезинфицирующего средства для обработки объектов и оборудования аквакультуры в Корее. Результаты этого исследования показывают, что 4 млн Виркон-С также можно использовать для борьбы с сапролегниозом без токсического воздействия на культивируемые клетки рыб или рыб в аквариумах.Хотя необходимы дальнейшие исследования воздействия на человека, Виркон-С является хорошим кандидатом для борьбы с сапролегниозом, который вызывает огромные экономические потери в отрасли аквакультуры.
Результаты этого исследования показывают, что 4 млн Виркон-С также можно использовать для борьбы с сапролегниозом без токсического воздействия на культивируемые клетки рыб или рыб в аквариумах.Хотя необходимы дальнейшие исследования воздействия на человека, Виркон-С является хорошим кандидатом для борьбы с сапролегниозом, который вызывает огромные экономические потери в отрасли аквакультуры.
Дополнительная информация
Дополнительная информация 1
Тест на жизнеспособность клеток:Исходные данные для теста на жизнеспособность клеток EPC при различных концентрациях Virkon-S.
Заявление о финансировании
Эта работа была поддержана исследовательским грантом Национального университета Пукён (2017 г.).Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Дополнительная информация и декларации
Конкурирующие интересы
Авторы заявляют об отсутствии конкурирующих интересов.
Вклад автора
Хайтам Саид Рахман задумал и спроектировал эксперименты, провел эксперименты, проанализировал данные, предоставил реагенты/материалы/инструменты для анализа, подготовил рисунки и/или таблицы, написал или рецензировал проекты статьи, утвердил окончательный вариант .
Tae-Jin Choi задумал и разработал эксперименты, предоставил реагенты/материалы/инструменты для анализа, подготовил рисунки и/или таблицы, написал или просмотрел черновики статьи, утвердил окончательный вариант, получил разрешение на использование рыбы в экспериментах.
Этика животных
Была предоставлена следующая информация, касающаяся этических разрешений (т. е. утверждающий орган и любые ссылочные номера): комитета (PKNU-IACUC), который описывает этические процедуры и научный уход за животными, используемыми в исследованиях (номер одобрения PKNU-2017-01).
Доступность данных
Следующая информация была предоставлена относительно доступности данных:
Необработанные данные представлены в дополнительном файле.
Ссылки
Олдермен (1985) Олдермен DJ. Малахитовый зеленый: обзор. Журнал болезней рыб. 1985; 8: 289–298. doi: 10.1111/j.1365-2761.1985.tb00945.x. [CrossRef] [Google Scholar] Barnes, Stephenson & Gabel (2003) Barnes ME, Stephenson H, Gabel M. Использование обработки перекисью водорода и формалином во время инкубации яиц чавычи, не имеющих выхода к морю.Североамериканский журнал аквакультуры. 2003; 65: 151–154. doi: 10.1577/1548-8454(2003)65<151:UOHPAF>2.0.CO;2. [CrossRef] [Google Scholar] Брок и Буллис (2001) Брок Дж. А., Буллис Р. Профилактика и контроль заболеваний гамет и эмбрионов рыб и морских креветок. В: Ли К.С., Дональдсон Э.М., редакторы. Репродуктивная биотехнология в рыбоводстве. Эльзевир; Амстердам: 2001. С. 137–159. [CrossRef] [Google Scholar] Бруно и Вуд (1999) Бруно Д.В., Вуд Б.П. Saprolegnia и другие оомицеты.В: Woo PTK, Bruno DW, редакторы. Заболевания и расстройства, вирусные, бактериальные и грибковые инфекции. КАБ Интернэшнл; Уоллингфорд: 1999. стр. 599–653. [Google Scholar] Dananjaya et al. (2017) Dananjaya SHS, Udayangani RMC, Shin SY, Edussuriya M, Nikapitiya C, Lee J, De Zoysa M. In vitro и in vivo противогрибковая эффективность лаусона на растительной основе против комплекса видов Fusarium oxysporum . Микробиологические исследования. 2017; 201:21–29. doi: 10.1016/j.micres.2017.04.011.[PubMed] [CrossRef] [Google Scholar] Ellsaesser & Clem (1986) Ellsaesser CF, Clem LW. Гематологические и иммунологические изменения у канального сома, подвергшегося стрессу при обращении и транспортировке. Журнал биологии рыб. 1986; 28: 511–521. doi: 10.1111/j.1095-8649.1986.tb05187.x. [CrossRef] [Google Scholar]Forneris et al. (2003) Forneris G, Bellardi S, Palmegiano GB, Saroglia M, Sicuro B, Gasco L, Zoccarato I. Использование озона в разведении форели для снижения заболеваемости сапролегниозом. Аквакультура. 2003; 221:157–166.doi: 10.1016/S0044-8486(02)00518-5. [CrossRef] [Google Scholar] Фрегенеда-Грандес, Родригес-Каденас и Аллер-Ганседо (2007) Фрегенеда-Грандес Дж.
стр. 599–653. [Google Scholar] Dananjaya et al. (2017) Dananjaya SHS, Udayangani RMC, Shin SY, Edussuriya M, Nikapitiya C, Lee J, De Zoysa M. In vitro и in vivo противогрибковая эффективность лаусона на растительной основе против комплекса видов Fusarium oxysporum . Микробиологические исследования. 2017; 201:21–29. doi: 10.1016/j.micres.2017.04.011.[PubMed] [CrossRef] [Google Scholar] Ellsaesser & Clem (1986) Ellsaesser CF, Clem LW. Гематологические и иммунологические изменения у канального сома, подвергшегося стрессу при обращении и транспортировке. Журнал биологии рыб. 1986; 28: 511–521. doi: 10.1111/j.1095-8649.1986.tb05187.x. [CrossRef] [Google Scholar]Forneris et al. (2003) Forneris G, Bellardi S, Palmegiano GB, Saroglia M, Sicuro B, Gasco L, Zoccarato I. Использование озона в разведении форели для снижения заболеваемости сапролегниозом. Аквакультура. 2003; 221:157–166.doi: 10.1016/S0044-8486(02)00518-5. [CrossRef] [Google Scholar] Фрегенеда-Грандес, Родригес-Каденас и Аллер-Ганседо (2007) Фрегенеда-Грандес Дж. М., Родригес-Каденас Ф., Аллер-Ганседо Дж. М. Грибы, выделенные из культивируемой икры, мальков и маток кумжи в условиях инкубатора, пораженного сапролегниозом. Журнал биологии рыб. 2007; 71: 510–518. doi: 10.1111/j.1095-8649.2007.01510.x. [CrossRef] [Google Scholar] Gehan et al. (2009) Гехан З.М., Анвер В., Амер Х.М., Эль-Сабаг И.М., Резк А., Бадави Э.М. In vitro сравнение эффективности дезинфицирующих средств, используемых на коммерческих птицефабриках.Международный журнал птицеводства. 2009; 8: 237–241. doi: 10.3923/ijps.2009.237.241. [CrossRef] [Google Scholar]Gold et al. (2013) Голд К.К., Рид П.Д., Бемис Д.А., Миллер Д.Л., Грей М.Дж., Соуза М.Дж. Эффективность обычных дезинфицирующих средств и тербинафина в инактивации роста Batrachochytrium dendrobatidis в культуре. Болезни водных организмов. 2013; 107:77–81. doi: 10.3354/dao02670. [PubMed] [CrossRef] [Google Scholar] Hatai & Hoshiai (1994) Hatai K, Hoshiai GI. Патогенность кокса Saprolegnia parasitica .
М., Родригес-Каденас Ф., Аллер-Ганседо Дж. М. Грибы, выделенные из культивируемой икры, мальков и маток кумжи в условиях инкубатора, пораженного сапролегниозом. Журнал биологии рыб. 2007; 71: 510–518. doi: 10.1111/j.1095-8649.2007.01510.x. [CrossRef] [Google Scholar] Gehan et al. (2009) Гехан З.М., Анвер В., Амер Х.М., Эль-Сабаг И.М., Резк А., Бадави Э.М. In vitro сравнение эффективности дезинфицирующих средств, используемых на коммерческих птицефабриках.Международный журнал птицеводства. 2009; 8: 237–241. doi: 10.3923/ijps.2009.237.241. [CrossRef] [Google Scholar]Gold et al. (2013) Голд К.К., Рид П.Д., Бемис Д.А., Миллер Д.Л., Грей М.Дж., Соуза М.Дж. Эффективность обычных дезинфицирующих средств и тербинафина в инактивации роста Batrachochytrium dendrobatidis в культуре. Болезни водных организмов. 2013; 107:77–81. doi: 10.3354/dao02670. [PubMed] [CrossRef] [Google Scholar] Hatai & Hoshiai (1994) Hatai K, Hoshiai GI. Патогенность кокса Saprolegnia parasitica . В: Мюллер Г.Дж., редактор. Сапролегниоз лосося. Орегон: Министерство энергетики США, Управление энергетики Бонневилля; 1994. С. 87–98. [Google Scholar]Hatai, Willoughby & Beakes (1990) Hatai K, Willoughby LG, Beakes GW. Некоторые характеристики Saprolegnia , полученные из рыбоводных заводов Японии. Микологические исследования. 1990; 94: 182–190. doi: 10.1016/S0953-7562(09)80611-4. [CrossRef] [Google Scholar] Hernndez et al. (2000) Hernndez A, Martro E, Matas L, Martin M, Ausina V. Оценка in vitro эффективности 1% Virkon ® против бактерий, грибков, вирусов и спор с помощью руководств AFNOR.Журнал госпитальной инфекции. 2000; 46: 203–209. doi: 10.1053/jhin.2000.0818. [PubMed] [CrossRef] [Google Scholar] Hu et al. (2013) Hu XG, Liu L, Hu K, Yang XL, Wang GX. In vitro Скрининг фунгицидных химикатов на противогрибковую активность против Saprolegnia . Журнал Всемирного общества аквакультуры. 2013; 44: 528–535. doi: 10.1111/jwas.12052. [CrossRef] [Google Scholar] Jalilpoor, Shenavar Masouleh & Masoumzadeh (2006) Jalilpoor J, Shenavar Masouleh A, Masoumzadeh M.
В: Мюллер Г.Дж., редактор. Сапролегниоз лосося. Орегон: Министерство энергетики США, Управление энергетики Бонневилля; 1994. С. 87–98. [Google Scholar]Hatai, Willoughby & Beakes (1990) Hatai K, Willoughby LG, Beakes GW. Некоторые характеристики Saprolegnia , полученные из рыбоводных заводов Японии. Микологические исследования. 1990; 94: 182–190. doi: 10.1016/S0953-7562(09)80611-4. [CrossRef] [Google Scholar] Hernndez et al. (2000) Hernndez A, Martro E, Matas L, Martin M, Ausina V. Оценка in vitro эффективности 1% Virkon ® против бактерий, грибков, вирусов и спор с помощью руководств AFNOR.Журнал госпитальной инфекции. 2000; 46: 203–209. doi: 10.1053/jhin.2000.0818. [PubMed] [CrossRef] [Google Scholar] Hu et al. (2013) Hu XG, Liu L, Hu K, Yang XL, Wang GX. In vitro Скрининг фунгицидных химикатов на противогрибковую активность против Saprolegnia . Журнал Всемирного общества аквакультуры. 2013; 44: 528–535. doi: 10.1111/jwas.12052. [CrossRef] [Google Scholar] Jalilpoor, Shenavar Masouleh & Masoumzadeh (2006) Jalilpoor J, Shenavar Masouleh A, Masoumzadeh M. Грибковая флора в яйцах Acipenser persicus с особым акцентом на Saprolegnia sp.(Оомицеты) и смертность при массовой инкубации в инкубатории Шахид Бехешти. Журнал прикладной ихтиологии. 2006; 22: 265–268. doi: 10.1111/j.1439-0426.2007.00965.x. [CrossRef] [Google Scholar] Johnson et al. (2003) Джонсон М.Л., Бергер Л., Филлипс Л., Спиэр Р. Фунгицидное воздействие химических дезинфицирующих средств, ультрафиолетового света, высыхания и нагревания на хитрид амфибий, Batrachochytrium dendrobatidis . Болезни водных организмов. 2003; 57: 255–260. doi: 10.3354/dao057255. [PubMed] [CrossRef] [Google Scholar] Khosravi et al.(2012) Khosravi AR, Shokri H, Sharifrohani M, Mousavi HE, Moosavi Z. Оценка противогрибковой активности эфирных масел Zataria multiflora , Geranium herbarium и Eucalyptus camaldolensis в отношении радужной инфекции 4 — outtrica13 Saprolegnia parasit Saprolegnia parasit. ( Oncorhynchus mykiss ) яйца.
Грибковая флора в яйцах Acipenser persicus с особым акцентом на Saprolegnia sp.(Оомицеты) и смертность при массовой инкубации в инкубатории Шахид Бехешти. Журнал прикладной ихтиологии. 2006; 22: 265–268. doi: 10.1111/j.1439-0426.2007.00965.x. [CrossRef] [Google Scholar] Johnson et al. (2003) Джонсон М.Л., Бергер Л., Филлипс Л., Спиэр Р. Фунгицидное воздействие химических дезинфицирующих средств, ультрафиолетового света, высыхания и нагревания на хитрид амфибий, Batrachochytrium dendrobatidis . Болезни водных организмов. 2003; 57: 255–260. doi: 10.3354/dao057255. [PubMed] [CrossRef] [Google Scholar] Khosravi et al.(2012) Khosravi AR, Shokri H, Sharifrohani M, Mousavi HE, Moosavi Z. Оценка противогрибковой активности эфирных масел Zataria multiflora , Geranium herbarium и Eucalyptus camaldolensis в отношении радужной инфекции 4 — outtrica13 Saprolegnia parasit Saprolegnia parasit. ( Oncorhynchus mykiss ) яйца. Возбудители и болезни пищевого происхождения. 2012; 9: 674–679. doi: 10.1089/fpd.2011.1086. [PubMed] [CrossRef] [Google Scholar]Király et al. (1974) Кирай З., Клемент З., Солимоси Ф., Ворос Дж.Методы патологии растений с особым упором на селекцию на устойчивость к болезням. Академия Киада; Будапешт: 1974 г. [Google Scholar] Маркетти и др. (2006) Marchetti V, Mancianti F, Cardini G, Luchetti E. Оценка фунгицидной эффективности хлорида бензалкония (Steramina G uv) и Virkon-S против Microsporum canis для дезинфекции окружающей среды. Ветеринарные исследовательские коммуникации. 2006; 30: 255–261. doi: 10.1007/s11259-006-3199-2. [PubMed] [CrossRef] [Google Scholar] Олах и Фаркас (1978) Олах Дж., Фаркас Дж.Влияние температуры, рН, антибиотиков, формалина и малахитовой зелени на рост и выживаемость паразитов Saprolegnia и Achlya на рыбах. Аквакультура. 1978; 13: 273–288. doi: 10.1016/0044-8486(78)-1. [CrossRef] [Google Scholar]Osman et al. (2008) Осман Х.
Возбудители и болезни пищевого происхождения. 2012; 9: 674–679. doi: 10.1089/fpd.2011.1086. [PubMed] [CrossRef] [Google Scholar]Király et al. (1974) Кирай З., Клемент З., Солимоси Ф., Ворос Дж.Методы патологии растений с особым упором на селекцию на устойчивость к болезням. Академия Киада; Будапешт: 1974 г. [Google Scholar] Маркетти и др. (2006) Marchetti V, Mancianti F, Cardini G, Luchetti E. Оценка фунгицидной эффективности хлорида бензалкония (Steramina G uv) и Virkon-S против Microsporum canis для дезинфекции окружающей среды. Ветеринарные исследовательские коммуникации. 2006; 30: 255–261. doi: 10.1007/s11259-006-3199-2. [PubMed] [CrossRef] [Google Scholar] Олах и Фаркас (1978) Олах Дж., Фаркас Дж.Влияние температуры, рН, антибиотиков, формалина и малахитовой зелени на рост и выживаемость паразитов Saprolegnia и Achlya на рыбах. Аквакультура. 1978; 13: 273–288. doi: 10.1016/0044-8486(78)-1. [CrossRef] [Google Scholar]Osman et al. (2008) Осман Х. М., Солман В.Е., Нур Э.Л., Дин А.Е., Лайла А.М. Индукция сапролегниоза у Oreochromis niloticus с особым вниманием к его биологической борьбе. Глобальная ветеринария. 2008; 2:32–37. [Google Scholar]Park et al.(2017) Пак Ю.Дж., Мун Си, Кан Дж.Х., Чой Т.Дж. Противовирусное действие экстрактов корней Celosia cristata и Raphanus sativus в отношении вируса вирусной геморрагической септицемии. Архив вирусологии. 2017; 162:1711–1716. doi: 10.1007/s00705-017-3270-z. [PubMed] [CrossRef] [Google Scholar]Phillips et al. (2008) Филлипс А.Дж., Андерсон В.Л., Робертсон Э.Дж., Секомб С.Дж., Ван Уэст П. Новое понимание патогенных оомицетов животных. Тенденции микробиологии. 2008; 16:13–19. doi: 10.1016/j.tim.2007.10.013. [PubMed] [CrossRef] [Google Scholar] Pottinger & Day (1999) Pottinger TG, Day JG. Система заражения Saprolegnia parasitica для радужной форели: оценка Pyceze как противогрибкового средства как для рыб, так и для яиц. Болезни водных организмов. 1999; 36: 129–141.
М., Солман В.Е., Нур Э.Л., Дин А.Е., Лайла А.М. Индукция сапролегниоза у Oreochromis niloticus с особым вниманием к его биологической борьбе. Глобальная ветеринария. 2008; 2:32–37. [Google Scholar]Park et al.(2017) Пак Ю.Дж., Мун Си, Кан Дж.Х., Чой Т.Дж. Противовирусное действие экстрактов корней Celosia cristata и Raphanus sativus в отношении вируса вирусной геморрагической септицемии. Архив вирусологии. 2017; 162:1711–1716. doi: 10.1007/s00705-017-3270-z. [PubMed] [CrossRef] [Google Scholar]Phillips et al. (2008) Филлипс А.Дж., Андерсон В.Л., Робертсон Э.Дж., Секомб С.Дж., Ван Уэст П. Новое понимание патогенных оомицетов животных. Тенденции микробиологии. 2008; 16:13–19. doi: 10.1016/j.tim.2007.10.013. [PubMed] [CrossRef] [Google Scholar] Pottinger & Day (1999) Pottinger TG, Day JG. Система заражения Saprolegnia parasitica для радужной форели: оценка Pyceze как противогрибкового средства как для рыб, так и для яиц. Болезни водных организмов. 1999; 36: 129–141. doi: 10.3354/dao036129. [PubMed] [CrossRef] [Google Scholar] Rach et al. (2005) Рэйч Дж. Дж., Редман С., Баст Д., Гайковски М.П. Эффективность обработки перекисью водорода по сравнению с обработкой формалином для контроля смертности, связанной с сапролегниозом, на икре озерной форели.Североамериканский журнал аквакультуры. 2005; 67: 148–154. doi: 10.1577/A04-062.1. [CrossRef] [Google Scholar]Rogawansamy et al. (2015) Rogawansamy S, Gaskin S, Taylor M, Pisaniello D. Оценка противогрибковых средств для лечения грибкового заражения в воздушной среде внутри помещений. Международный журнал экологических исследований и общественного здравоохранения. 2015;12:6319–6332. doi: 10.3390/ijerph220606319. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Schreier, Rach & Howe (1996) Schreier TM, Rach JJ, Howe GE.Эффективность формалина, перекиси водорода и хлорида натрия в отношении зараженной грибком икры радужной форели. Аквакультура. 1996; 140:323–331. doi: 10.1016/0044-8486(95)01182-X.
doi: 10.3354/dao036129. [PubMed] [CrossRef] [Google Scholar] Rach et al. (2005) Рэйч Дж. Дж., Редман С., Баст Д., Гайковски М.П. Эффективность обработки перекисью водорода по сравнению с обработкой формалином для контроля смертности, связанной с сапролегниозом, на икре озерной форели.Североамериканский журнал аквакультуры. 2005; 67: 148–154. doi: 10.1577/A04-062.1. [CrossRef] [Google Scholar]Rogawansamy et al. (2015) Rogawansamy S, Gaskin S, Taylor M, Pisaniello D. Оценка противогрибковых средств для лечения грибкового заражения в воздушной среде внутри помещений. Международный журнал экологических исследований и общественного здравоохранения. 2015;12:6319–6332. doi: 10.3390/ijerph220606319. [Бесплатная статья PMC] [PubMed] [CrossRef] [Google Scholar] Schreier, Rach & Howe (1996) Schreier TM, Rach JJ, Howe GE.Эффективность формалина, перекиси водорода и хлорида натрия в отношении зараженной грибком икры радужной форели. Аквакультура. 1996; 140:323–331. doi: 10.1016/0044-8486(95)01182-X. [CrossRef] [Google Scholar]Srivastava & Srivastava (1978) Srivastava GC, Srivastava RC. Замечание о возможном применении оксалата малахитовой зелени в борьбе с рыбами-микозами. Микопатология. 1978; 64: 169–171. doi: 10.1007/BF00576369. [CrossRef] [Google Scholar] Шривастава, Синха и Рой (2004) Шривастава С., Синха Р., Рой Д. Токсикологическое воздействие малахитового зеленого.Водная токсикология. 2004; 66: 319–329. doi: 10.1016/j.aquatox.2003.09.008. [PubMed] [CrossRef] [Google Scholar] Stammati et al. (2005) Stammati A, Nebbia C, De Angelis I, Albo AG, Carletti M, Rebecchi C, Dacasto M. Влияние малахитового зеленого (MG) и его основного метаболита, лейкомалахитового зеленого (LMG), на две линии клеток человека. Токсикология in vitro. 2005; 19: 853–858. doi: 10.1016/j.tiv.2005.06.021. [PubMed] [CrossRef] [Google Scholar] Straus et al. (2016) Straus DL, Farmer BD, Ledbetter CK, Beck BH, Williams RS, Clark ML, Freeze TM.Использование сульфата меди для борьбы с сапролегниозом яиц в коммерческом инкубаторе солнечного окуня.
[CrossRef] [Google Scholar]Srivastava & Srivastava (1978) Srivastava GC, Srivastava RC. Замечание о возможном применении оксалата малахитовой зелени в борьбе с рыбами-микозами. Микопатология. 1978; 64: 169–171. doi: 10.1007/BF00576369. [CrossRef] [Google Scholar] Шривастава, Синха и Рой (2004) Шривастава С., Синха Р., Рой Д. Токсикологическое воздействие малахитового зеленого.Водная токсикология. 2004; 66: 319–329. doi: 10.1016/j.aquatox.2003.09.008. [PubMed] [CrossRef] [Google Scholar] Stammati et al. (2005) Stammati A, Nebbia C, De Angelis I, Albo AG, Carletti M, Rebecchi C, Dacasto M. Влияние малахитового зеленого (MG) и его основного метаболита, лейкомалахитового зеленого (LMG), на две линии клеток человека. Токсикология in vitro. 2005; 19: 853–858. doi: 10.1016/j.tiv.2005.06.021. [PubMed] [CrossRef] [Google Scholar] Straus et al. (2016) Straus DL, Farmer BD, Ledbetter CK, Beck BH, Williams RS, Clark ML, Freeze TM.Использование сульфата меди для борьбы с сапролегниозом яиц в коммерческом инкубаторе солнечного окуня. Североамериканский журнал аквакультуры. 2016;78:243–250. doi: 10.1080/15222055.2016.1146183. [CrossRef] [Google Scholar] Straus et al. (2009) Штраус Д.Л., Митчелл А.Дж., Картер Р.Р., Стиби Дж.А. Оптимизация обработки сульфатом меди для борьбы с грибком икры канального сома. Журнал здоровья водных животных. 2009; 21:91–97. doi: 10.1577/H07-057.1. [PubMed] [CrossRef] [Google Scholar] Ван Уэст (2006) Ван Уэст P. Saprolegnia parasitica, оомицетный патоген с рыбным аппетитом: новые вызовы старой проблеме.Миколог. 2006; 20:99–104. doi: 10.1016/j.mycol.2006.06.004. [CrossRef] [Google Scholar]Willoughby (1994) Willoughby LG. Грибы и болезни рыб. Рыбы Пресс; Stirling: 1994. [Google Scholar]Willoughby, Pickering & Johnson (1984) Willoughby LG, Pickering AD, Johnson HG. Поликлеточный гель-анализ воды на споры Saprolegniaceae (грибы), особенно на споры возбудителя Saprolegnia рыб. Гидробиология. 1984; 114: 237–248. doi: 10.1007/BF00031875. [CrossRef] [Google Scholar] Wu et al.(2017) Wu G, Selden D, Fooks AR, Banyard A.
Североамериканский журнал аквакультуры. 2016;78:243–250. doi: 10.1080/15222055.2016.1146183. [CrossRef] [Google Scholar] Straus et al. (2009) Штраус Д.Л., Митчелл А.Дж., Картер Р.Р., Стиби Дж.А. Оптимизация обработки сульфатом меди для борьбы с грибком икры канального сома. Журнал здоровья водных животных. 2009; 21:91–97. doi: 10.1577/H07-057.1. [PubMed] [CrossRef] [Google Scholar] Ван Уэст (2006) Ван Уэст P. Saprolegnia parasitica, оомицетный патоген с рыбным аппетитом: новые вызовы старой проблеме.Миколог. 2006; 20:99–104. doi: 10.1016/j.mycol.2006.06.004. [CrossRef] [Google Scholar]Willoughby (1994) Willoughby LG. Грибы и болезни рыб. Рыбы Пресс; Stirling: 1994. [Google Scholar]Willoughby, Pickering & Johnson (1984) Willoughby LG, Pickering AD, Johnson HG. Поликлеточный гель-анализ воды на споры Saprolegniaceae (грибы), особенно на споры возбудителя Saprolegnia рыб. Гидробиология. 1984; 114: 237–248. doi: 10.1007/BF00031875. [CrossRef] [Google Scholar] Wu et al.(2017) Wu G, Selden D, Fooks AR, Banyard A.





 Если после соляной ванны симптомы все еще сохраняются, значит, у вашей рыбы действительно грибковая инфекция, и вам следует искать альтернативное лечение.
Если после соляной ванны симптомы все еще сохраняются, значит, у вашей рыбы действительно грибковая инфекция, и вам следует искать альтернативное лечение. Если в ванне содержится 1 часть на миллион малахитовой зелени, замачивайте рыбу не более чем на час. Преимущество малахитовой зелени и формалина заключается в том, что они, как правило, весьма эффективно справляются с грибками, но они могут сохраняться в рыбе в течение нескольких месяцев после обработки и токсичны, если их дозировать неправильно.
Если в ванне содержится 1 часть на миллион малахитовой зелени, замачивайте рыбу не более чем на час. Преимущество малахитовой зелени и формалина заключается в том, что они, как правило, весьма эффективно справляются с грибками, но они могут сохраняться в рыбе в течение нескольких месяцев после обработки и токсичны, если их дозировать неправильно. Если вы дозируете больше, чем это, ваша рыба может стать стрессовой или даже получить ожоги.Некоторые источники и этикетки продуктов рекомендуют использовать 4 части на миллион продукта, но многие любители сообщают, что это привело к гибели до 50% их рыб, поэтому для безопасности предпочтительнее половинная доза.
Если вы дозируете больше, чем это, ваша рыба может стать стрессовой или даже получить ожоги.Некоторые источники и этикетки продуктов рекомендуют использовать 4 части на миллион продукта, но многие любители сообщают, что это привело к гибели до 50% их рыб, поэтому для безопасности предпочтительнее половинная доза.
 ноябрь (базоним , Cytophaga aquatilis Strohl and Tait 1978). Int J Syst Evol Bacteriol. 1996, 46: 128-148. 10.1099/00207713-46-1-128.
ноябрь (базоним , Cytophaga aquatilis Strohl and Tait 1978). Int J Syst Evol Bacteriol. 1996, 46: 128-148. 10.1099/00207713-46-1-128. Орган «Дис Аква». 2005, 65: 115-120.
Орган «Дис Аква». 2005, 65: 115-120. Программа Fish Cult. 1974, 36: 51-52. 10.1577/1548-8659 (1974) 36[51:EOTOSO]2.0.CO;2.
Программа Fish Cult. 1974, 36: 51-52. 10.1577/1548-8659 (1974) 36[51:EOTOSO]2.0.CO;2. 2010, 277: 593-600. 10.1098/рспб.2009.1659.
2010, 277: 593-600. 10.1098/рспб.2009.1659.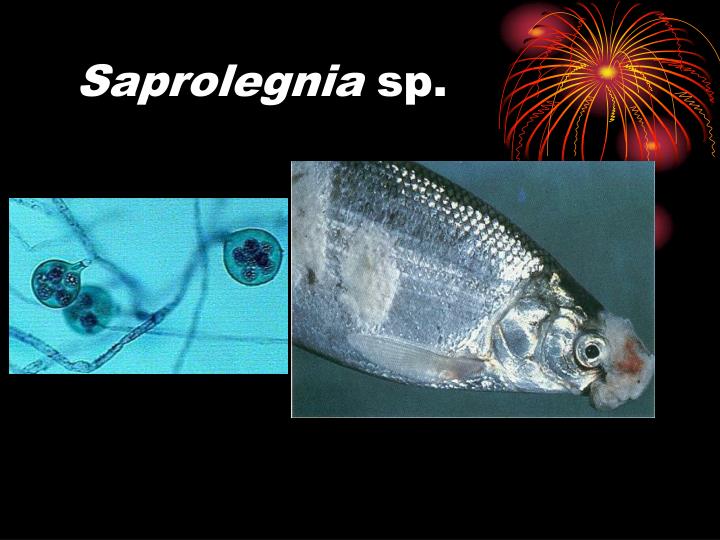
 Ветеринар Рек. 1999, 144: 23-24. 10.1136/вр.144.1.23.
Ветеринар Рек. 1999, 144: 23-24. 10.1136/вр.144.1.23. Аквак Рез. 2007, 38: 508-517. 10.1111/j.1365-2109.2007.01695.х.
Аквак Рез. 2007, 38: 508-517. 10.1111/j.1365-2109.2007.01695.х. Дж. Фиш Дис.1999, 22: 1-11. 10.1046/j.1365-2761.1999.00132.x.
Дж. Фиш Дис.1999, 22: 1-11. 10.1046/j.1365-2761.1999.00132.x. 2010, 206: 1-69.
2010, 206: 1-69. 1083/jcb.35.1.37.
1083/jcb.35.1.37. Орган «Дис Аква». 2012, 101: 115-122. 10.3354/дао02522.
Орган «Дис Аква». 2012, 101: 115-122. 10.3354/дао02522. Дев Комп Иммунол. 2012, 38: 169-180. 10.1016/j.dci.2012.05.006.
Дев Комп Иммунол. 2012, 38: 169-180. 10.1016/j.dci.2012.05.006. Дж. Фиш Дис. 2001, 24: 361-367. 10.1046/j.1365-2761.2001.00306.x.
Дж. Фиш Дис. 2001, 24: 361-367. 10.1046/j.1365-2761.2001.00306.x. 2009, 304: 131-139.
2009, 304: 131-139. 10.1577/1548-8659 (1991) 120<0391:COACAL>2.3.CO;2.
10.1577/1548-8659 (1991) 120<0391:COACAL>2.3.CO;2. вакцина. 2009, 27: 4297-4301. 10.1016/j.vaccine.2009.05.026.
вакцина. 2009, 27: 4297-4301. 10.1016/j.vaccine.2009.05.026. Джей Аква Аним Здоровье. 1990, 2: 109-111. 10.1577/1548-8667(1990)002<0109:ATCCEI>2.3.CO;2.
Джей Аква Аним Здоровье. 1990, 2: 109-111. 10.1577/1548-8667(1990)002<0109:ATCCEI>2.3.CO;2.

 Аквакультура рез. 2011, 43: 688-695.
Аквакультура рез. 2011, 43: 688-695. Иммунитет к рыбным моллюскам. 2009, 26: 850-857. 10.1016/j.fsi.2009.03.013.
Иммунитет к рыбным моллюскам. 2009, 26: 850-857. 10.1016/j.fsi.2009.03.013. Текущее состояние и будущие направления применения пробиотиков и пребиотиков для лососевых. Аквакультура. 2010, 302: 1-18. 10.1016/к.аквакультура.2010.02.007.
Текущее состояние и будущие направления применения пробиотиков и пребиотиков для лососевых. Аквакультура. 2010, 302: 1-18. 10.1016/к.аквакультура.2010.02.007. Прога Фиш-Культ. 1972, 34: 18-20. 10.1577/1548-8640 (1972) 34[18:IVSWNP]2.0.CO;2.
Прога Фиш-Культ. 1972, 34: 18-20. 10.1577/1548-8640 (1972) 34[18:IVSWNP]2.0.CO;2. Bull Jpn Soc Sci Fish. 1973, 39: 165-171. 10.2331/суисан.39.165.
Bull Jpn Soc Sci Fish. 1973, 39: 165-171. 10.2331/суисан.39.165. Bull Eur Ass Fish Pathol. 1993, 31: 66-69.
Bull Eur Ass Fish Pathol. 1993, 31: 66-69. Дж. Фиш Дис. 2013, 36: 45-55. 10.1111/j.1365-2761.2012.01410.х.
Дж. Фиш Дис. 2013, 36: 45-55. 10.1111/j.1365-2761.2012.01410.х. Appl Environ Microbiol. 2011, 77: 7868-7872. 10.1128/АЭМ.05574-11.
Appl Environ Microbiol. 2011, 77: 7868-7872. 10.1128/АЭМ.05574-11.