Ротавирус у кошек
Ротавирус у кошек – род вирусов Rotavirus из семейства реовирусов, вызывающих ротавирусные инфекции, так же известные как «кишечный» или «желудочный грипп» (к реальному вирусу гриппа отношение не имеет), у кошек, других животных и человека. Ротавирус поражает стенки тонкого кишечника, нарушая его работу.
Ротавирус: откуда
• Употребление еды\воды, загрязненной частицами фекалий зараженных животных\людей
• Вдыхание частиц фекалий зараженных животных\людей
Ротавирус распространен повсеместно и поражает практически всех млекопитающих, включая домашний скот, кошек, собак и людей. При этом существует несколько различных штаммов вирусов, каждый из которых «специализируется» на своем виде млекопитающих. Однако в редких случаях происходит перекрестное заражение или мутация одного штамма, под влиянием другого. Таким образом, кошка может заразиться ротавирусом от человека, а человек – от кошки, но такое происходит нечасто.
Обычно вирусом заражается молодняк (дети) млекопитающих, а также пожилые особи, и особи с ослабленными иммунитетом.
Ротавирус у кошек: симптомы
• Повышение температуры
• Беспокойство или угнетение
• Боль в животе
• Рвота
• Диарея (иногда с кровью)
• Обезвоживание
Чаще всего, ротавирус наблюдается у котят на искусственном вскармливании, для них он может быть смертелен, особенно при отсутствии своевременной помощи. Взрослые здоровые кошки, обычно, справляются с инфекцией самостоятельно в течение двух-трех суток.
Ротавирус у кошек: лечение
Лечение при ротавирусе поддерживающие – животное переводится на специальную диету, осуществляется внутривенное и\или подкожное ведение глюкозы, физраствора и других препаратов против обезвоживания.
Ротавирус у кошек: профилактика
Вакцинации от ротавирусов для котов не существует. Для предотвращения заражения рекомендуется соблюдение элементарной гигиены и исключение общения кошки как с домашним скотом, так и с ее уличными собратьями.
Для предотвращения заражения рекомендуется соблюдение элементарной гигиены и исключение общения кошки как с домашним скотом, так и с ее уличными собратьями.
Вакцинация от ротавируса для людей давно разработана, и подтвердила свою эффективность. Обязательно сделайте такую прививку своему ребенку, если ему еще нет 7 лет, и он активно общается с животными.
Вирусные инфекции кошек – Ветеринарные клиники Доктор Вет
Проблема вирусных инфекций у кошек стоит остро, поскольку они вызывают тяжелые заболевания, нередко приводящие к смертельному исходу. Каждая пятая кошка поступает в ветеринарную клинику с острыми респираторными симптомами, каждая третья страдает хроническим течением заболевания. Нередко кошки являются скрытыми носителями.
Особенно остро проблема вирусных инфекций возникает в питомниках, у заводчиков и тех, у кого дома живет не одна кошка. Передача вирусов происходит как при непосредственном контакте с больным животным или вирусоносителем, так и через воздух, подстилки, клетки, посуду и т.
Ниже описаны основные виды инфекционных заболеваний.
Инфекционная панлейкопения (FPV).
Одна из наиболее опасных и заразных вирусных инфекций кошек. Другие названия данного заболевания – кошачья чумка, кошачья атаксия, кошачья лихорадка, контагиозный агранулоцитоз или инфекционный парвовирусный энтерит.
Возбудители «обитают» в слюне, выделениях из носа, в моче и фекалиях. Вирусы очень стойкие (сохраняются в щелях пола и мебели больше года). По некоторым данным, распространение может происходить через кровососущих насекомых, а также от больной матери потомству.
Инкубационный период – 3-10 дней. Чаще всего заболевание регистрируется весной и осенью. Поскольку симптомы весьма разнообразны, распознать инфекцию бывает непросто. Панлейкопения поражает практически все системы органов.
Коронавирусный энтерит (FCov).
FECV – энтеропатогенные коронавирусы. В первую очередь поражают кишечный эпителий, вызывая у кошек энтериты, протекающие сравнительно легко. Передача вирусов зачастую происходит через фекалии, реже – через слюну. Коронавирусный энтерит сравнительно безопасен. Возникает у котят и длится около 2-4 недель, сопровождается поносом. К смертельному исходу приводит довольно редко. У взрослых кошек инфекция протекает бессимптомно. У переболевших животных развивается иммунитет. Но существует риск перехода вируса в хроническую форму.
В первую очередь поражают кишечный эпителий, вызывая у кошек энтериты, протекающие сравнительно легко. Передача вирусов зачастую происходит через фекалии, реже – через слюну. Коронавирусный энтерит сравнительно безопасен. Возникает у котят и длится около 2-4 недель, сопровождается поносом. К смертельному исходу приводит довольно редко. У взрослых кошек инфекция протекает бессимптомно. У переболевших животных развивается иммунитет. Но существует риск перехода вируса в хроническую форму.
Инфекционный перитонит (FIР).
Возбудитель данной инфекции – коронавирус (FIРV). Размножается на кончиках ворсинок кишечного эпителия. Наиболее подвержены заболеванию котята, молодые животные в возрасте до 2 лет и старые кошки с ослабленной иммунной системой. Передается заболевание фекально-оральным путем. Возможен переход FECV в FIРV через мутацию в организме кошек-носителей. Инкубационный период заболевания – 2-3 недели. Существует бессимптомное вирусоносительство. На начальной стадии обычно протекает бессимптомно.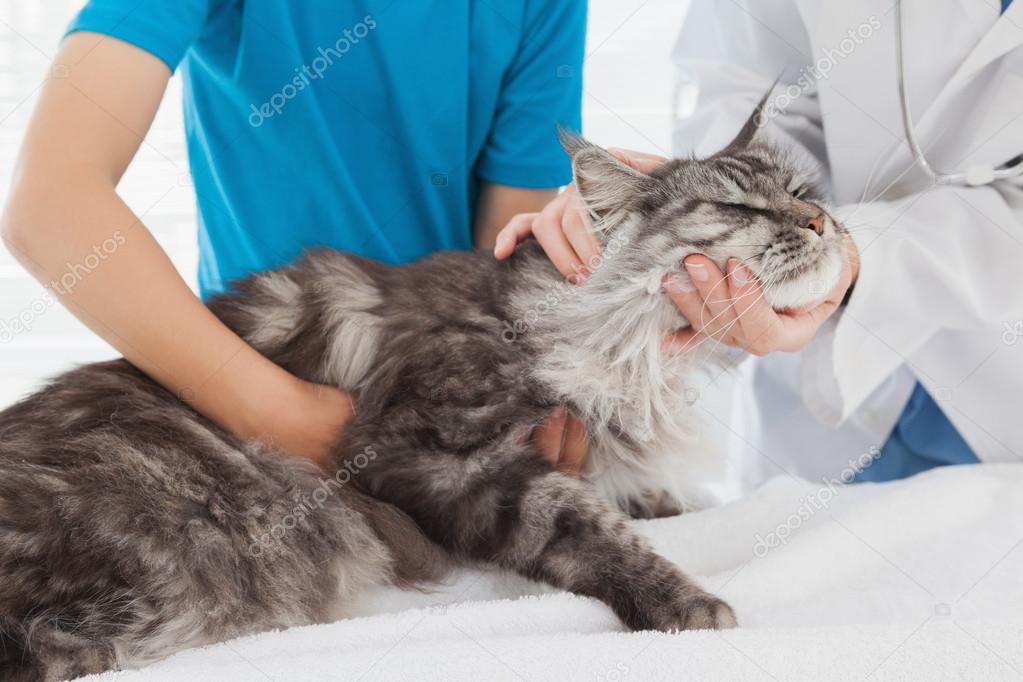
Преобладающие симптомы – асциты и выпоты в плевральную полость, затруднение дыхания, потеря веса, анорексия, вялость, иногда легкая лихорадка, увеличение лимфатических узлов и печени. Распространение процесса на другие органы приводит к появлению симптомов их дисфункции, например, гепатопатии, почечной недостаточности, иногда к поражению центральной нервной системы и глаз.
Герпесвирус (FHV) или вирусный ринотрахеит.
Калицивироз кошек (FCV).
Приблизительно 70-80% инфекций верхних дыхательных путей кошек приходится на герпесвирусные и калицивироз. Эти группы вирусных инфекций видоспецифичны и не опасны для человека.
Основные пути передачи – контактный и воздушно-капельный. Возможна передача от матери к плодам. Вирус может перейти от больного животного. Также заразны биологические жидкости носителей – выделения из глаз и носа, моча, кал, сперма, молоко. Вектором-переносчиком чаще всего служит человек. Вирус можно передать через корма, одежду, предметы ухода.
Вирус можно передать через корма, одежду, предметы ухода.
Обнаружить герпесвирус в выделениях животного возможно уже через 24 часа после заражения.
Основные симптомы – лихорадка, катаральное воспаление верхних дыхательных путей, поражение глаз.
Хламидиоз (Chlamydophila felis).
Это инфекционное заболевание вызывается хламидиями. Пути передачи – воздушно-капельный, при прямом контакте с больной кошкой, половым путем, от матери к потомству, через предметы обихода.
Наиболее распространено среди котят (от 5 недель до 9 месяцев). Встречается и у взрослых кошек. После выздоровления бывают рецидивы заболевания. В проявлении симптомов огромную роль играет стресс. Естественный иммунитет к этому заболеванию относительно неэффективен и неполон, поэтому в большой колонии кошек инфекция может присутствовать в течение нескольких лет.
Определяется через выделения из глаз, может быть в вагинальных и ректальных мазках.
Заболевание нередко проходит бессимптомно. Возможные симптомы – ринит, бронхит и бронхиолит, хронический конъюнктивит (чаще односторонний), может наблюдаться незначительное истечение из уретры или влагалища, но чаще всего симптомы скрытые.
Профилактикой особо опасных и сложных вирусных заболеваний (панлейкопении, герпесвируса и калицивироза) является своевременная вакцинация кошек.
В нашей лаборатории проводятся исследования на вирусные инфекции иммунохроматографическим методом (метод ИХА), так называемый «экспресс-метод», и методом ИФА.
Нужно всегда помнить, что для успешного излечения заболевания необходимо как можно раньше обратиться к специалистам!
Читайте также
Энтерит у кошки - виды энтеритов, симптомы и лечение
Многие хозяева, увидев у кошки расстройства стула, не придают этому особого значения. И это одна из их главных ошибок, потому что своевременная диагностика и лечение заболевания – это залог здоровья вашего питомца.
Расстройства стула, боли в брюшной области и обезвоживание могут быть вызваны энтеритом. Это опасное заболевание с высоким уровнем смертности, встречающееся у кошек и других животных. Здесь вы узнаете, как своевременно распознать признаки энтерита, и обеспечить лечение патологии.
Смотрите в этой статье:
Энтерит – что это?
Основные причины воспаления
Симптомы заболевания: на что обратить внимание?
Диагностика
Каким может быть энтерит у кошек?
Лечение энтерита: методы и препараты
Диета для кошек при энтерите
Энтерит – что это?
Энтерит – это хроническое воспалительное заболевание тонкой кишки. Оно сопровождается нарушением функций пищеварительной системы и дистрофическими изменениями слизистых оболочек тонкой кишки.
Как самостоятельное заболевание энтерит встречается редко. Обычно он протекает в более легких формах (например, как гастроэнтерит или гастроэнтероколит). По симптомам и причинам эти заболевания схожи, но по последствиям, прогнозу и уровню смертности гораздо более благоприятные.
Формы энтерита:
- Первичная. К ней относятся случаи энтерита, вызванные инфекционными заболеваниями пищевого типа (например, кишечной палочкой). В 8 из 10 случаев они развиваются из-за некачественного питания и воды. Попадая в организм кошки, инфекционные возбудители вызывают расстройство пищеварения, ощущение боли и дискомфорта в брюшной области.
- Вторичная. Эта форма энтерита возникает при других непищевых инфекциях. К таким опасным и тяжелым заболеваниям относится чумка (болезнь Карре), панлейкопения, сальмонеллез. В этом случае требуется незамедлительное обращение к ветеринару в Москве, поскольку эти инфекционные заболевания способны привести к необратимым последствиям.
Основные причины воспаления
Частая причина энтерита у кошек – это нарушение питания
 Спровоцировать воспаление в тонкой кишке может даже резкий переход с одного типа корма на другой (например, с домашнего на профессиональный).
Спровоцировать воспаление в тонкой кишке может даже резкий переход с одного типа корма на другой (например, с домашнего на профессиональный).Другие причины энтерита у кошек:
Механические повреждения. Травмы слизистых оболочек (например, при проглатывании мелкой трубчатой косточки или инородного предмета) приводят к расстройствам стула, болям в эпигастральной области и развитию воспаления.
Несвоевременная вакцинация. Эта частая причина вирусного энтерита, представляющего наибольшую опасность для животного. Если вы опоздали с вакцинацией или вообще её не проводите, то вирус может передаться вашему питомцу от другого заболевшего животного.
Паразитарные заболевания. Их вызывают паразитические черви (глисты, гельминты). Попадая в организм кошки, они больше всего поражают тонкий отдел кишечника и выделяют отравляющие вещества. Все это способствует развитию энтерита.
Химическое отравление. Бытовая химия, лекарственные препараты и даже некоторые виды растений могут вызвать отравление у вашего питомца. Они поступают в организм с кормом или случайно, а затем приводят к сильному воспалению тонкой кишки.
Бытовая химия, лекарственные препараты и даже некоторые виды растений могут вызвать отравление у вашего питомца. Они поступают в организм с кормом или случайно, а затем приводят к сильному воспалению тонкой кишки.
Симптомы заболевания: на что обратить внимание?
Первое, что указывает на развитие энтерита – это расстройства стула. Подозреваете, что у вашей кошки воспаление кишечника? Тогда обратите внимание на каловые массы. При энтерите они содержат большое количество непереваренного корма, слизи и крови.
Нормальным считается расстройства стула не более 2-3 раз подряд (например, если вы ввели новый корм). Однако, если состояние питомца не меняется, то обращайтесь в ветеринарную клинику в Москве!
Симптомы энтерита у кошек:
- тусклая, взлохмаченная шерсть,
- болезненность в брюшной области,
- урчание в животе,
- диарея,
- рвота,
- апатия,
- общая слабость,
Энтерит приводит к обезвоживанию организма кошки, а в тяжелых случаях – к повышению температуры тела.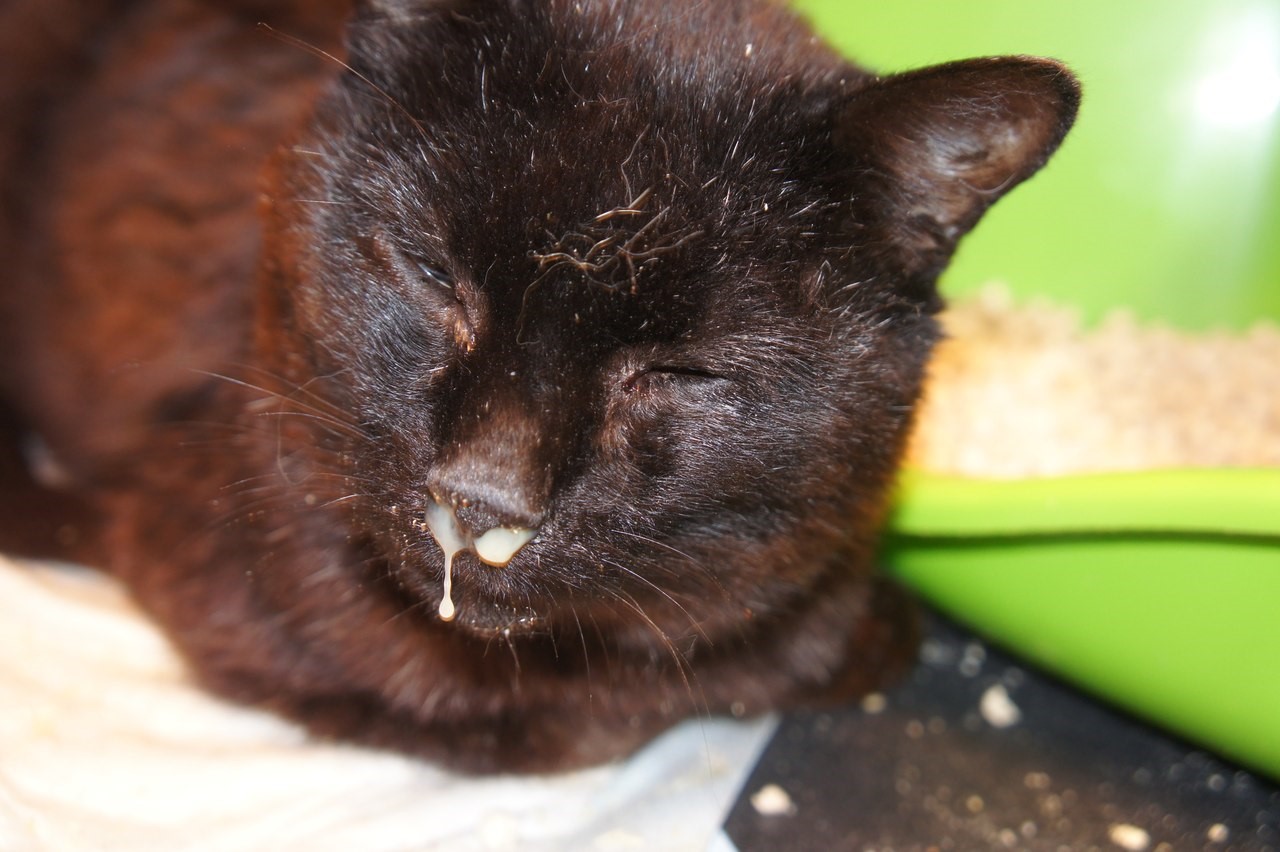 Стоит насторожиться, если температура у вашего питомца составляет более 39,2 °С. Для измерения рекомендуем использовать ветеринарный термометр.
Стоит насторожиться, если температура у вашего питомца составляет более 39,2 °С. Для измерения рекомендуем использовать ветеринарный термометр.
Специфические признаки
При кислотном энтерите каловые массы у питомца имеют пенистые выделения. Это вызвано повышенным образованием газов и нарушением работы всей пищеварительной системы. При этом кошка выгибается при спазмах, издает жалобное мяуканье и ведет себя беспокойно.
При щелочном энтерите животное находится в апатичном и подавленном состоянии. Кошка отказывается от корма. На языке появляется беловатый налет, присутствует резкий и неприятный запах из полости рта.
Диагностика
Поставить диагноз может только ветеринар. Для этого он собирает анамнез (информацию о болезни) и тщательно расспрашивает хозяина кошки. Будьте готовы к тому, чтобы рассказать ветеринару о начале заболевания, замеченных признаках и состоянии каловых масс питомца.
Если внешнего осмотра недостаточно для постановки диагноза, то проводятся лабораторный анализ кала. При подозрении на вирусную или бактериальную природу заболевания, специалист производит бактериальный посев.
При подозрении на вирусную или бактериальную природу заболевания, специалист производит бактериальный посев.
Получив все данные исследований и анализов, ветеринар составляет программу лечения энтерита у кошки. Он учитывает:
- возраст питомца,
- состояние здоровья,
- форму энтерита,
- наличие сопутствующих заболеваний.
Диагностика занимает не более 1-2 дней.
Каким может быть энтерит у кошек?
Энтерит у кошек может быть бактериальным или вирусным. Бактериальный энтерит развивается, когда животное заражается сальмонеллезом, туберкулезом или другими инфекциями, влияющими на желудочно-кишечный тракт.
Вирусный энтерит развивается при попадании в организм отдельных групп вирусов (например, ротавируса). Он делится еще на несколько видов, которые важно определить при диагностике заболевания: парвовирусный, коронавирусный и ротавирусный.
Питомец может заразиться вирусным энтеритом, контактируя с больными животными. Например, через общий лоток, миску или игрушки. «Принести» энтерит может даже сам хозяин с улицы, если на подошве обуви останутся частицы экскрементов больного животного.
Парвовирусный энтерит
Парвовирусный энтерит крайне опасен для кошек. Он отличается высокой степенью заразности, но человеку не передается. Приводит к тяжелому поражению пищеварительной системы, интоксикации и обезвоживанию всего организма.
У кошки, заразившейся парвовирусным энтеритом или гастроэнтеритом, ухудшается общее самочувствие. Бледнеют слизистые оболочки, наблюдается сухость в полости рта. Позывы к мочеиспусканию сокращаются, но при этом присутствует повышенная жажда.
Другие признаки парвовирусного энтерита:
- снижение уровня лейкоцитов в крови,
- отказ от питания,
- повышение температуры тела,
- общее подавленное состояние,
- частая рвота.
Специальной противовирусной терапии не разработано, поэтому лечение направлено на облегчение симптомов. После выздоровления животное в течение 6-8 недель остается носителем инфекции, поэтому оно опасно для других кошек.
После выздоровления животное в течение 6-8 недель остается носителем инфекции, поэтому оно опасно для других кошек.
Коронавирусный
Коронавирусный энтерит у кошек имеет среднюю степень заразности. Это означает, что ваш питомец может не заболеть при контакте с больным животным, если у неё крепкая иммунная система и нет других тяжелых заболеваний.
В особой группе риска находятся пожилые кошки и котята до 4 месяцев, поскольку их организм ослаблен и не может противостоять инфекционным заболеваниям.
Основной признак коронавирусного энтерита – это диарея. При этом она может быть частой: до 5-7 раз в сутки. В каловых массах при этом будут присутствовать фрагменты корма и слизи. Специфического лечения не существует, поэтому все процедуры направлены только на устранение симптомов.
Для человека коронавирусный энтерит кошек не опасен. Другое дело – это животные. Кошка, переболевшая данной инфекцией, останется её носителем на всю жизнь. Это значит, что животное может быть потенциальным источником заражения для других питомцев.
Это значит, что животное может быть потенциальным источником заражения для других питомцев.
Еще одна особенность коронавирусного энтерита – это вероятность мутации возбудителя в вирус, способный вызвать развитие инфекционного перитонита. Это происходит редко, но в любом случае нужно быть максимально осторожным и внимательным!
Ротавирусный
Диарею у кошек могут вызвать и другие виды гастроэнтеритов. Один из них – ротавирусный. Чаще всего он встречается у котят до 6-8 месяцев, поскольку их организм ослаблен и не способен противостоять инфекционным заболеваниям.
Симптомы ротавирусного гастроэнтерита схожи с коронавирусной формой. Инкубационный период составляет от 1 до 5 дней. Наблюдается диарея, полное отсутствие аппетита, упадок сил, рвота (в особенности после корма и вода).
Ротавирусный энтерит относится к излечимым заболеваниям. Однако ветеринарная помощь котенку должна быть оказана в минимальные сроки, поэтому при возникновении подозрений сразу обращайтесь в клинику.
Лечение энтерита: методы и препараты
Лечение коронавирусного, парвовирусного или других форм энтерита направлено на устранение или облегчение симптомов. Первое, что назначает ветеринар – это инфузионную терапию (капельницу). Она необходима для устранения обезвоживания, возникающего при диарее и рвоте.
Кошке ставят капельницы с солевыми и витаминными растворами. Чаще всего используется обычный физиологический раствор (раствор хлорида натрия 0,9%). Он устраняет обезвоживание, снижает нагрузку на почки и повышает кровяное давление.
Дальнее лечение разрабатывается индивидуально, в зависимости от состояния кошки:
- При обнаружении вторичной бактериальной инфекции, протекающей на фоне энтерита, назначаются антибиотики.
- При рвоте назначаются противорвотные препараты, прием которых важно обеспечить в соответствии с рекомендациями врача.
- При отсутствии перистальтики кишечника назначаются прокинетики, которые стимулируют моторику ЖКТ и ускоряет движение перерабатываемой пищи по пищеварительной системе.

Диета для кошек при энтерите
Голодная диета. Назначается в первые 1-2 дня после начала лечения. Предполагает полный отказ от любого корма. Главное, обеспечить кошке свободный доступ к чистой питьевой воде. Рекомендуем использовать кипяченую воду комнатной температуры.
Щадящая диета. Первый прием пищи – это отварная овсянка. Она мягко обволакивает стенки кишечника за счет склизкой текстуры, поэтому улучшает его перистальтику и восстанавливает поврежденные слизистые оболочки.
Если кошка уже начала восстанавливаться, начинайте добавлять в рацион немного мясного фарша. Выбирайте нежирные сорта мяса (курица, индейка). Затем постепенно вводите в рацион остальные продукты, избегая нежелательных. Запрещенными продуктами для кошек являются:
- свинину,
- кости,
- сосиски,
- рыбные и мясные консервы,
- печень,
- сырое мясо и рыба,
- соленые, жирные и копченые продукты.
Помните, что при энтерите действовать нужно быстро. Чем раньше вы обнаружите заболевание, тем благоприятнее будет прогноз для вашего питомца!
Чем раньше вы обнаружите заболевание, тем благоприятнее будет прогноз для вашего питомца!
Смотрите также:
Ротавирус контангеозен и крайне опасен
Ротавирусная инфекция - это инфекционное заболевание, вызываемое ротавирусом. Часто его называют "кишечный грип". Но ротавирус к вирусу гриппа не имеет никакого отношения. Ротавирусная инфекция характеризуется осенне-зимним подъемом заболеваемости, то есть заболевают чаще с ноября по апрель. Бывают и спорадические вспышки заболевания, но чаще бывают во время эпидемии гриппа или ОРВИ.
Инкубационный период ротавирусной инфекции, то есть это период от контакта с вирусом до начала заболевания - от суток до пяти суток. Начинается заболевание, вызванное этой инфекцией, с повышения температуры (бывает очень высокая температура до 39 градусов по Цельсию) с общего недомогания, слабости, может быть насморк, боли в горле. К этим симптомам присоединяются еще кишечные симптомы, то есть боли в животе, тошнота, рвота, диарея.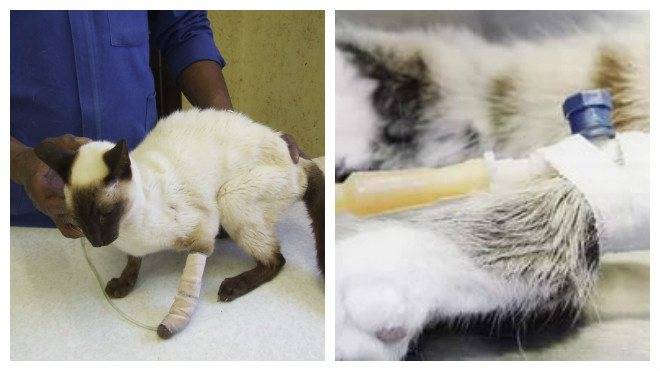 Это и есть особенностью "кишечного гриппа".
Это и есть особенностью "кишечного гриппа".
Болезнь характеризуется очень высокой контагиозностью, то есть заразностью. При возникновении первых признаков заболевания человек становится крайне заразен для окружающих. Поэтому, если вы почувствовали такие симптомы, то вам нужно обязательно обратиться к врачу-терапевту, для назначения вам адекватного лечения. При этом, важно минимизировать контакты - необходимо соблюдать домашний режим во избежание осложнений и распространения заболевания.
Ротавирусной инфекцией болеют как взрослые, так и дети. Стоит отметить, что дети переносят заболевание тяжелее, чем взрослые, потому что у них еще не сформирован иммунитет. У детей также чаще бывают осложнения после ротавирусной инфекции. Самое серьезное осложнение - обезвоживание организма в связи с тем, что выражен такой кишечный синдром, как рвота и диарея.
У детей также чаще бывают осложнения после ротавирусной инфекции. Самое серьезное осложнение - обезвоживание организма в связи с тем, что выражен такой кишечный синдром, как рвота и диарея.
Заразиться ротавирусной инфекцией можно только от человека к человеку: воздушно-капельным путем, то есть при чиханье и кашле пациента, и элементарно-бытовым, контактным путем, то есть через предметы обихода, через зараженную воду. Профилактика ротавирусной инфекции - это просто соблюдение санитарно-гигиенических норм, то есть мытье рук, кипячение воды, мытье предметов обихода, если в семье кто-то заболел. И максимальная изоляция заболевшего человека от других членов семьи.
Мы в соцсетях:
Чем опасна ротавирусная инфекция и как предупредить заболевание?
Ротавирусная инфекция (РВИ) – острое инфекционное заболевание, характеризующееся симптомами общей интоксикации и поражением желудочно-кишечного тракта, часто приводящим к обезвоживанию организма.
Возбудителем заболевания является ротавирус, который относительно устойчив во внешней среде и на различных объектах может сохранять жизнеспособность до 30 дней.
Источником инфекции является больной человек или носитель вируса, у которого симптомы заболевания отсутствуют (вирусоносителями чаще всего являются дети старшего возраста и взрослые).
Основной механизм передачи – фекально-оральный (возбудитель попадает в организм человека через рот). Заражение чаще всего происходит контактно-бытовым путем (при несоблюдении правил личной гигиены через «грязные руки», окружающие предметы обихода).
Основными факторами передачи являются предметы обихода, детские игрушки, соски, инфицированные возбудителем руки взрослых и детей. Также определенное значение в распространении заболевания имеют продукты питания, как правило, не подвергающиеся термической обработке (чаще – немытые или плохо вымытые фрукты, овощи, ягоды), и вода.
Инкубационный период (время от момента попадания возбудителя в организм до появления симптомов заболевания) длится от 12 ч до 7 дней (чаще 1-2 дня).
Основными симптомами РВИ являются: многократная рвота и диарея, боли, вздутие и урчание в животе, снижение аппетита, повышение температуры тела. Нередко у заболевших может отмечаться покраснение зева, насморк, воспаление слизистой глаз, сухой кашель, увеличение шейных лимфатических узлов.
При обильном жидком стуле и рвоте ребенок может потерять большое количество жидкости, что приводит к обезвоживанию. Потеря жидкости опасна для организма – отмечается снижение артериального давления, учащение сердечных сокращений, обмороки, а при тяжёлом течении – острая сердечно-сосудистая и почечная недостаточность.
Чаще всего случаи заболевания ротавирусной инфекцией регистрируются в зимне-весенний период года. Группой риска являются дети первых двух лет жизни, что объясняется их высокой восприимчивостью к инфекции и недостаточно сформированными в этом возрасте гигиеническими навыками. Кроме того, не соблюдение элементарных правил личной гигиены со стороны родителей при уходе за детьми может также привести к возникновению заболевания у малышей.
С целью профилактики ротавирусной инфекции, как и других острых кишечных инфекций, особое внимание следует уделять выполнению следующих профилактических мероприятий:
- соблюдать правила личной гигиены – тщательно мыть руки тёплой водой с мылом (после прихода домой с улицы, после посещения туалета, перед приготовлением пищи и перед едой, после контакта с домашними животными), следует коротко стричь ногти;
- надежное средство профилактики кишечных заболеваний у новорожденных и детей раннего возраста – грудное вскармливание.
 Грудное молоко способствует формированию нормальной микрофлоры желудочно-кишечного тракта, повышает иммунитет, снижает восприимчивость к патогенной микрофлоре. При грудном вскармливании необходимо соблюдать гигиену молочных желёз. Если ребёнок находится на искусственном вскармливании, то молочную смесь следует готовить на один приём, т.к. при длительном хранении может произойти размножение микроорганизмов. Для разведения смеси рекомендуется использовать кипячёную воду;
Грудное молоко способствует формированию нормальной микрофлоры желудочно-кишечного тракта, повышает иммунитет, снижает восприимчивость к патогенной микрофлоре. При грудном вскармливании необходимо соблюдать гигиену молочных желёз. Если ребёнок находится на искусственном вскармливании, то молочную смесь следует готовить на один приём, т.к. при длительном хранении может произойти размножение микроорганизмов. Для разведения смеси рекомендуется использовать кипячёную воду; - как только ребенок начал самостоятельно передвигаться – ползать, ходить, необходимо чаще делать влажную уборку помещений, не ходить в уличной обуви по полу, следить за чистотой игрушек;
- соблюдать сроки и условия хранения продуктов питания и правила приготовления пищи. Сырые и готовые продукты питания следует хранить в холодильнике раздельно, например, на разных полках: сырые продукты – снизу (чтобы исключить подтекание на готовые продукты), готовые – сверху. Продукты, не подвергающиеся термической обработке (особенно овощи, фрукты), перед употреблением необходимо промывать горячей водой и ошпаривать.
 При завершении приготовления одного продукта и перехода к другому (например, от мясных изделий к фруктовому или овощному пюре) следует вымыть руки, заменить использованную разделочную доску и нож для сырых продуктов на аналогичный инвентарь для готовой продукции;
При завершении приготовления одного продукта и перехода к другому (например, от мясных изделий к фруктовому или овощному пюре) следует вымыть руки, заменить использованную разделочную доску и нож для сырых продуктов на аналогичный инвентарь для готовой продукции; - готовить пищу необходимо чистыми кухонными принадлежностями и в чистой одежде;
- для питья использовать кипяченую или бутилированную воду (особенно для маленьких детей).
как лечить и как не заразиться?
Ротавирусная инфекция — участившееся инфекционное заболевание, с которым сталкивается большинство родителей. Однако о лечении своего ребенка знает далеко не каждый.
Педиатр GMS Clinic Анастасия Вартомянц-Чупрякова рассказала информационному порталу «Здоровые дети», чем опасен ротавирус, как его лечить, и существуют ли способы профилактики.
Анастасия, что такое Ротавирус?
Это кишечная инфекция, которая вызывается вирусом семейства Реовирусы. Инфицирование происходит из-за попадания ротавируса на слизистую ротовой полости, вирус проникает дальше в пищеварительный тракт и начинает размножаться в тонком кишечнике, вызывая неблагоприятные последствия.
Инфицирование происходит из-за попадания ротавируса на слизистую ротовой полости, вирус проникает дальше в пищеварительный тракт и начинает размножаться в тонком кишечнике, вызывая неблагоприятные последствия.
У ротавируса есть восемь видов, но человек может заразиться лишь тремя из них, при этом болезнь протекает абсолютно одинаково. Чаще всего в нашей стране заражаются ротавирусом вида А.
Ротавирусная инфекция характеризуется сезонностью, вирус активен при высокой влажности и устойчив к низким и высоким температурам. Чаще всего дети болеют в зимне-весенний и осенне-зимний период.
Какие симптомы характерны при заболевании ротавирусной инфекцией?
Характерно острое начало — рвота, жидкий стул, боли в животе, повышение температуры.
Как передается заболевание?
Через грязные руки инфекция попадает в рот, то есть фекально-оральным путем. Воздушно-капельным путем ротавирус не передается.
В каком возрасте дети наиболее подвержены заболеванию?
До пяти лет практически каждый ребенок хотя бы раз в жизни переболевает ротавирусом, в той или иной степени. Данная инфекция поражает все возрастные слои населения.
Как происходит массовое заражение детей в школе?
Дети не соблюдают простых правил личной гигиены — после посещения туалетной комнаты не моют руки. Дальше происходят рукопожатие, игры, съели яблочко, поделились яблоком с другом, откусили шоколадку у друга и так далее. Таким образом распространяется инфекция.
Чем опасен ротавирус?
Главная опасность — это потеря жидкости. Обезвоживание и интоксикация ведут к нарушению функций организма.
В течение какого времени после инфицирования проявляются симптомы заболевания?
Инкубационный период — от нескольких часов до нескольких суток. Чаще всего симптомы проявляются на первые — вторые сутки.
Чаще всего симптомы проявляются на первые — вторые сутки.
Сколько длится острый период заболевания?
Это индивидуально для каждого случая. Чаще всего — от трех до пяти суток. Первые трое суток — самое тяжелое течение заболевания.
Что делать, если у ребенка высокая температура?
Если температура выше, чем 38,5 °C, то ее нужно сбивать жаропонижающими средствами. При преобладании рвоты — лучше ректальные свечки, при превалировании диарейного синдрома — суспензия через рот. Препаратами выбора могут быть парацетамол и ибупрофен.
Существует ли особая опасность для маленьких детей до года?
Как я уже говорила, мы боимся потери жидкости, соответственно, чем меньше человечек, тем меньший объем жидкости находится в его организме. Если у ребенка будет многократная рвота и обильный жидкий стул, значит ребенок быстрым темпом дойдет до обезвоживания. Поэтому в тяжелых случаях — однозначно стационар.
Можно ли лечить заболевание самостоятельно?
При первых симптомах заболевания необходимо обратиться к доктору, чтобы он посмотрел ребенка, сделал необходимые анализы и назначил правильное лечение. До осмотра у врача нужно начать отпаивать ребенка водой — небольшими порциями. Заниматься самостоятельным лечением ребенка не следует.
Нужно ли кормить ребенка до назначения лечения врачом?
Во время болезни ротавирусной инфекцией дети чаще всего от еды отказываются, так как превалирует рвота. Но если ребенок просит есть, то это должна быть еда не жирная, не содержащая большого количества клетчатки. Прекрасно подходит рисовая каша, которая закрепляет стул и является сорбентом.
В народе принято при заболевании ротавирусом давать детям Регидрон. Нужно ли это делать?
Регидрон — это солевой раствор, он является лекарственным препаратом. Принимать его или нет — решает только врач.
Принимать его или нет — решает только врач.
Можно ли осуществлять лечение на дому?
Все зависит от степени тяжести заболевания. Если форма легкая — лечение можно проводить на дому. Если заболевание средне-тяжелое или тяжелое — стационар. В любом случае, это определяет врач.
Что делать, если у ребенка в классе много случаев заболевания?
Необходимо объяснить ребенку, что очень важно соблюдать правила личной гигиены.
Какие меры предосторожности принимать в квартире, если болеет ребенок?
В этом случает также необходимо соблюдать правила гигиены. Если рвотные или каловые массы попадают на поверхность, это место нужно обрабатывать дезинфицирующими средствами. Мыть руки чаще.
Какая должна быть восстановительная терапия после того, как спали основные симптомы заболевания?
Соблюдение элиминационной диеты (от англ. Elimination — исключение, устранение — это диета с исключением некоторых продуктов из рациона) — необходимо на время исключить из рациона жирные продукты и продукты с повышенным содержанием клетчатки, а также продукты, вызывающие послабление кишечника, с постепенным расширением диеты.
Elimination — исключение, устранение — это диета с исключением некоторых продуктов из рациона) — необходимо на время исключить из рациона жирные продукты и продукты с повышенным содержанием клетчатки, а также продукты, вызывающие послабление кишечника, с постепенным расширением диеты.
Какая существует профилактика этого заболевания?
Профилактика — соблюдение правил личной гигиены и вакцинация. Вакцинация проводится для детей в возрасте до 32 недель, то есть в грудничковом возрасте. Это вакцина Ротатек. Существует еще вторая вакцина — Ротарикс — она делается до 24 недели. Если ребенку сделали прививку в этом возрасте, то вакцина защитит от заболевания, если в более позднем возрасте, то вакцинация уже не будет иметь положительного эффекта. Во время заболевания вакцинация также не принесет результата.
Источник: healthy-kids.ru
Ротавирусная инфекция телят (rotaviridae infection bovinum)
Ротавирусная инфекция телят (rotaviridae infection bovinum) – остро протекающая, высококонтагиозная болезнь новорожденных телят, характеризующаяся профузным поносом, дегидратацией организма, развитием катарального или катарально-геморрагического гастроэнтерита и высокой летальностью.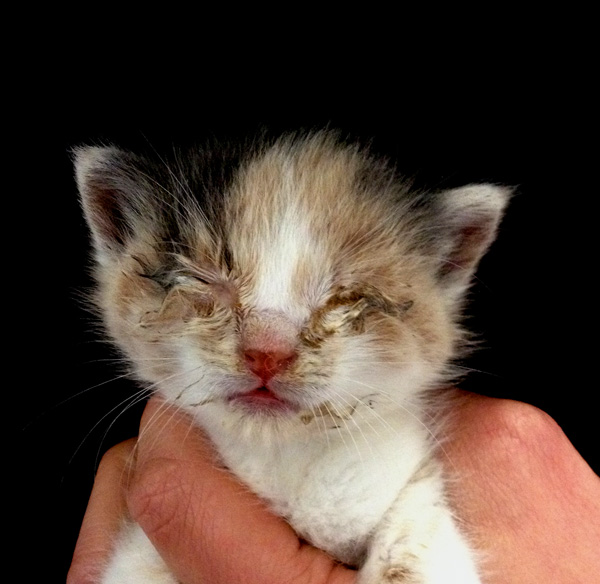
Этиология. Возбудитель ротавирусной инфекции относится к семейству Reoviridae, роду Rotavirus. Все ротавирусы морфологически идентичны и имеют общий внутренний антиген, выявленный в РСК, РИФ, РИД и ИФА.
Полные вирионы имеют правильную сферическую архитектонику, напоминающую форму колеса. Эта форма зрелых вирионов является специфической особенностью ротавирусов, позволяющая дифференцировать их от энтеровирусов.
Эпизоотологические данные. В естественных условиях болеют новорожденные телята в возрасте 2-12 дней, но чаще в первые 2-6 дней жизни, когда заболеваемость составляет 75,5-100%, при 30%-ной летальности. Более подвержены заболеванию телочки (45,5%), чем бычки (32,0%). У взрослых животных заболевание протекает бессимптомно и сопровождается длительным выделением возбудителя во внешнюю среду. Источник возбудителя инфекции — больные и переболевшие животные, выделяющие вирус во внешнюю среду с экскрементами. В 1 мл фекалий больного теленка может содержаться до 1 млрд. вирионов.
В 1 мл фекалий больного теленка может содержаться до 1 млрд. вирионов.
Установлена длительная персистенция вируса у лактирующих коров, что подтверждается наличием специфических антител у 95% исследованных животных. Это указывает на широкое вирусоносительство.
Факторами передачи возбудителя может быть посуда, станки, предметы ухода, спецодежда, руки обслуживающего персонала, инфицированные выделениями больных животных. Заражение происходит алиментарным путем и внутриутробно. В распространении инфекции существенную роль могут играть собаки и кошки. Установлено близкое родство ротавирусов крыс и людей к штамму бычьего ротавируса группы В.
Течение и симптомы. Инкубационный период у телят колеблется от 12-18 часов до 2-суток. Течение болезни сверхострое и острое. Она продолжается от 2 до 5 суток и проявляется профузным поносом, общей депрессией, отказом от корма, незначительным, кратковременным повышением температуры тела. При этом фекалии водянистые, соломенно-желтого цвета, иногда со слизью, кислого запаха. Интенсивно развивается дегидротация организма и депрессия, дегенерация мышечной ткани и западение глаз. Установлено, что чем моложе теленок, тем длиннее период диареи. Наибольшее число вирионов (10 частиц/мл) в фекалиях больных телят содержится в начале болезни, а с 5—6-го дня их число уменьшается. У 4—14-дневных телят ротавирусная инфекция может осложняться коронавирусным энтеритом и эшерихиозом. В этом случае болезнь протекает тяжело и заканчивается летальным исходом. При вскрытии основные патологоанатомические изменения у павших телят обнаруживают в тонком кишечнике в виде катарального или катарально-геморрагического воспаления. Стенка кишечника истончена, слизистая оболочка гиперемирована. В кишечнике — жидкое желтовато-зеленое содержимое, в сычуге — сгустки молозива и молока. Регистрируют петехиальные кровоизлияния под серозной оболочкой предсердий и точечные – на селезенке, а также гиперплазию брыжеечных лимфатических узлов, атрофию лимфофолликулов. При гистологическом исследовании обнаруживают некротический энтерит.
Интенсивно развивается дегидротация организма и депрессия, дегенерация мышечной ткани и западение глаз. Установлено, что чем моложе теленок, тем длиннее период диареи. Наибольшее число вирионов (10 частиц/мл) в фекалиях больных телят содержится в начале болезни, а с 5—6-го дня их число уменьшается. У 4—14-дневных телят ротавирусная инфекция может осложняться коронавирусным энтеритом и эшерихиозом. В этом случае болезнь протекает тяжело и заканчивается летальным исходом. При вскрытии основные патологоанатомические изменения у павших телят обнаруживают в тонком кишечнике в виде катарального или катарально-геморрагического воспаления. Стенка кишечника истончена, слизистая оболочка гиперемирована. В кишечнике — жидкое желтовато-зеленое содержимое, в сычуге — сгустки молозива и молока. Регистрируют петехиальные кровоизлияния под серозной оболочкой предсердий и точечные – на селезенке, а также гиперплазию брыжеечных лимфатических узлов, атрофию лимфофолликулов. При гистологическом исследовании обнаруживают некротический энтерит.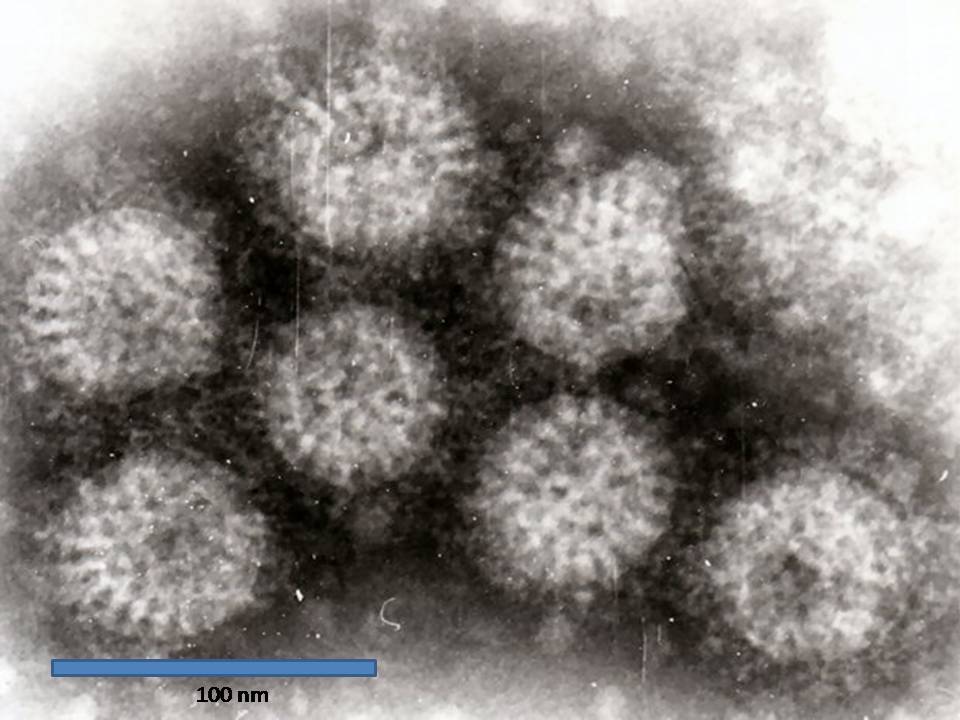
Диагноз на ротавирусную инфекцию. При диагностике учитывают широкий диапазон показателей: эпизоотологические данные, клинические признаки болезни, патологоанатомические изменения с обязательным проведением вирусологических и иммунологических исследований.
Лабораторная диагностика ротавирусной инфекции новорожденных телят основана на выявлении специфических антигенов в исходном вируссодержащем материале с использованием реакции иммунодиффузии (РИД), иммунофлуоресценции (РИФ), иммуноферментном анализе (ИФА) и иммуноэлектронной микроскопии. Определение наличия антиротавирусных глобулинов в сыворотке крови больных и переболевших телят, а также в крови и молозиве коров проводится с целью оценки иммунного статуса организма телят и изучения эпизоотической ситуации.
Дифференциальный диагноз. Ротавирусную инфекцию дифференцируют от вирусной диареи, парво- и коронавирусной инфекции, хламидиоза, колибактериоза.
Лечение. Для лечения используют гипериммунные сыворотки и сыворотки реконвалесцентов, в которых имеются антитела к ротавирусу одновременно с антибактериальными и иммуностимулирующими препаратами, пробиотики. Применяют также симптоматические методы лечения.
Профилактика и меры борьбы. Для специфической профилактики используют живые и инактивированные моно- и ассоциированные вакцины, гипериммунные сыворотки. Для ликвидации заболевания используют общие противоэпизоотические мероприятия – ограничение движения скота, дезинфекция, карантинирование больных животных, соблюдение принципа пусто-занято.
Гастроэнтерит кошек и раздражение желудка у кошек
Обзор
Гастроэнтерит — это воспаление желудка и кишечника, часто вызывающее рвоту и диарею. Причин гастроэнтерита много.
К ним относятся:
- Неосмотрительность в питании, которая относится к употреблению в пищу неподходящих вещей, мусора/пищевых отходов или инородных тел, таких как веревки или мишура
- Комки шерсти, также очень распространенные
- Изменения в диете
- Паразитарная инфекция
- Вирусная инфекция
- Бактериальная инфекция
- Обструкция
- Заболевание почек
- Диабет
- Воспалительное заболевание кишечника
- Стресс
- Рак
Риск / Знаки
Любой кот может развиться гастроэнтерит , который может быть легким и самоограничивающимся или, в некоторых случаях, приводить к сильной рвоте и диарее (иногда с кровью), что приводит к снижению аппетита, обезвоживанию и электролитному дисбалансу. Немедленно обратитесь к ветеринару, если рвота и диарея часты или сильны.
Немедленно обратитесь к ветеринару, если рвота и диарея часты или сильны.
Диагностика/лечение
Поскольку причин гастроэнтерита очень много, обязательно предоставьте своему ветеринару подробный анамнез вашей кошки, включая ответы на следующие вопросы:
- Симптомы?
- Какие-либо предшествующие медицинские проблемы или лекарства
- Контакт с другими кошками (например, посещение парикмахера или детский сад)?
- Неконтролируемый доступ во двор?
- Изменения в корме для кошек?
- Проглатывание посторонних предметов?
- Проглатывание мусора или пищи людей?
Чтобы определить основную причину, ваш ветеринар может порекомендовать комбинацию следующих тестов:
- Химические анализы для оценки функции почек, печени и поджелудочной железы, а также уровня сахара
- Общий анализ крови для оценки воспаления , инфекция, анемия и другие состояния, связанные с кровью
- Анализы электролитов, чтобы убедиться, что ваша кошка не обезвожена и не страдает электролитным дисбалансом
- Рентген брюшной полости для оценки наличия инородных тел и/или обструкции желудочно-кишечного тракта
- Ультразвуковая визуализация пищеварительного тракта вашей кошки и других основных органов брюшной полости
- Эндоскопия для оценки слизистой оболочки желудка и кишечного тракта и получения биопсии для окончательного диагноза
- Специальные тесты для исключения вирусных инфекций, таких как кошачий лейкоз и кошачий вирус иммунодефицита
- Анализы кала для определения того, могут ли фекальные паразиты быть причиной e
- Специальные фекальные тесты, такие как посев и анализ полимеразной цепной реакции (ПЦР)
Кошки с гастроэнтеритом, независимо от причины, часто обезвожены, и им может потребоваться введение жидкости под кожу (подкожно) или непосредственно в вены (внутривенно). В зависимости от степени тяжести вашего питомца могут госпитализировать, чтобы контролировать диарею и рвоту. В менее тяжелых случаях ваш ветеринар может порекомендовать мягкую диету вместе с лекарствами и инструкциями о том, как ухаживать за вашим другом дома. Очень важно, чтобы вы тщательно следовали инструкциям по лечению от вашего ветеринара.
В зависимости от степени тяжести вашего питомца могут госпитализировать, чтобы контролировать диарею и рвоту. В менее тяжелых случаях ваш ветеринар может порекомендовать мягкую диету вместе с лекарствами и инструкциями о том, как ухаживать за вашим другом дома. Очень важно, чтобы вы тщательно следовали инструкциям по лечению от вашего ветеринара.
Профилактика
Чтобы предотвратить или свести к минимуму риск гастроэнтерита у вашей кошки, соблюдайте соответствующую диету, избегайте контакта со столовыми остатками, мусором или инородными телами, следите за ежемесячными профилактическими средствами широкого спектра действия от паразитов и избегайте контакта с больными кошками.
Если у вас есть какие-либо вопросы или опасения, вы всегда должны посетить или позвонить своему ветеринару — это ваш лучший ресурс для обеспечения здоровья и благополучия ваших питомцев.
Кошачий кишечный коронавирус – пищеварительная система
В большинстве случаев лечение не требуется
В тяжелых случаях может потребоваться поддерживающая терапия
 Лечение, при необходимости, симптоматическое и поддерживающее (например, инфузионная терапия, пероральные растворы электролитов, противорвотные средства). Специфической противовирусной терапии нет. Смерть от FECV-ассоциированного гастроэнтерита встречается редко.
Лечение, при необходимости, симптоматическое и поддерживающее (например, инфузионная терапия, пероральные растворы электролитов, противорвотные средства). Специфической противовирусной терапии нет. Смерть от FECV-ассоциированного гастроэнтерита встречается редко.Борьба и профилактика FECV обычно являются проблемой только в племенных питомниках и спасательных приютах. Необходимо максимально предотвратить проглатывание зараженных вирусом фекальных частиц. Фекальное загрязнение окружающей среды можно свести к минимуму при достаточном количестве лотков, ежедневной очистке лотков, еженедельной дезинфекции лотков и стрижке/чистке меха с задней части длинношерстных кошек.FECV может выживать в помещении до 7 недель в сухих условиях, но легко инактивируется большинством коммерческих дезинфицирующих средств.
В идеале кошек следует содержать небольшими (три-четыре кошки) закрытыми группами. Комната, клетки, подстилка и лотки должны быть продезинфицированы между группами. Хотя это непрактично в приюте, кошек следует размещать группами в соответствии с их статусом антител (иммунофлуоресцентный тест на антитела сероположительный или серонегативный) и статусом выделения вируса (на основе фекальной ПЦР).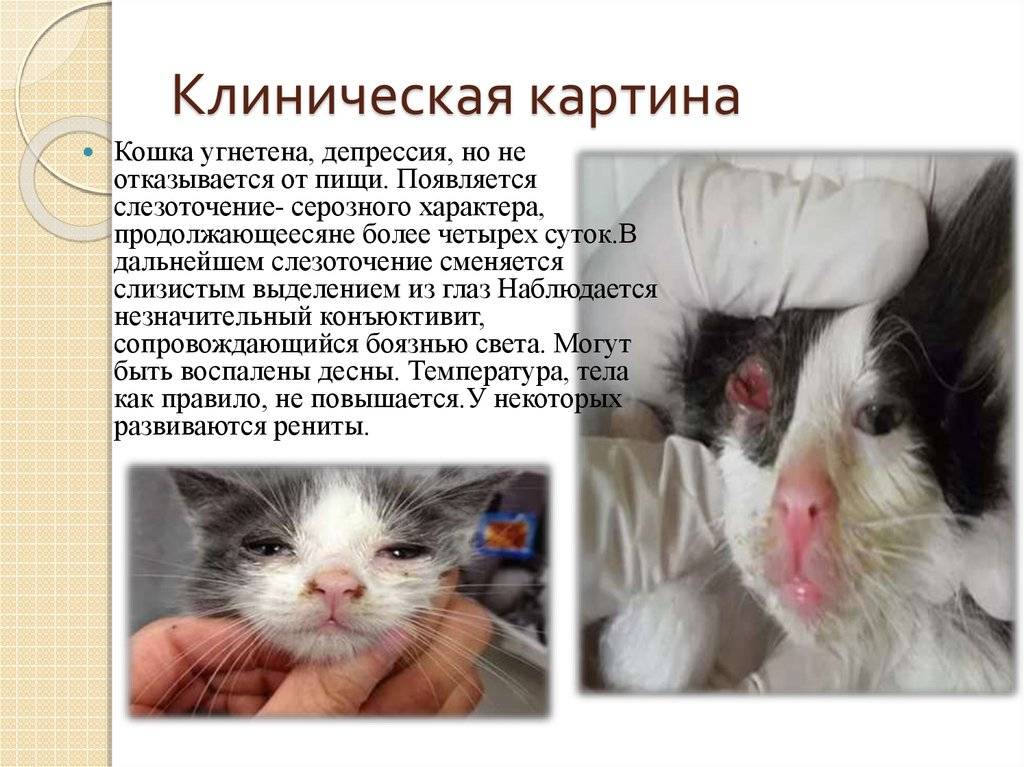 Серопозитивных кошек можно повторно тестировать каждые 3-6 месяцев и переводить в серонегативные группы по мере снижения их титра антител. В ситуации спасения или приюта кошек следует размещать поодиночке. Для выявления кошек-носителей FECV требуется девять ежемесячных последовательных положительных тестов RT-PCR кала, в то время как для выявления кошки, которая устранила инфекцию FECV, требуется пять последовательных отрицательных тестов RT-PCR кала.
Серопозитивных кошек можно повторно тестировать каждые 3-6 месяцев и переводить в серонегативные группы по мере снижения их титра антител. В ситуации спасения или приюта кошек следует размещать поодиночке. Для выявления кошек-носителей FECV требуется девять ежемесячных последовательных положительных тестов RT-PCR кала, в то время как для выявления кошки, которая устранила инфекцию FECV, требуется пять последовательных отрицательных тестов RT-PCR кала.
Серопозитивных кошек следует скрещивать только с другими серопозитивными кошками, а серонегативных кошек – с другими серонегативными кошками.Котята, рожденные от серопозитивных вязок или от серопозитивных маток, защищены от инфекции материнским иммунитетом примерно до 6-недельного возраста. Котята, отлученные от серопозитивных маток в возрасте 6 недель, вряд ли заразятся от самки. Серологическое тестирование котят следует отложить до 10-11-недельного возраста, когда возможна сероконверсия.
Новые кошки должны быть подвергнуты серологическому тестированию перед введением в питомник или программу разведения. Только серонегативные и свободные от вируса (фекальная ПЦР) кошки должны быть помещены в питомник, свободный от FECV, или в питомник, пытающийся устранить вирус.Серопозитивные кошки менее склонны к развитию FIP, чем серонегативные кошки, при попадании в среду, эндемическую по FECV. Вакцинация интраназальным термочувствительным мутантом FECV обычно не рекомендуется, но может быть рассмотрена для серонегативных кошек старше 16 недель, попавших в эндемическую по FECV среду. Вакцинация приведет к сероконверсии и не полностью защитит кошек, ранее подвергшихся воздействию FECV, от развития FIP.
Только серонегативные и свободные от вируса (фекальная ПЦР) кошки должны быть помещены в питомник, свободный от FECV, или в питомник, пытающийся устранить вирус.Серопозитивные кошки менее склонны к развитию FIP, чем серонегативные кошки, при попадании в среду, эндемическую по FECV. Вакцинация интраназальным термочувствительным мутантом FECV обычно не рекомендуется, но может быть рассмотрена для серонегативных кошек старше 16 недель, попавших в эндемическую по FECV среду. Вакцинация приведет к сероконверсии и не полностью защитит кошек, ранее подвергшихся воздействию FECV, от развития FIP.
Acke, E., McGill, K., Golden, O., Jones, B., Fanning, S. and Whyte, P. | 2009 | Распространенность термофильных видов Campylobacter у домашних кошек и собак в Ирландии. Veterinary Record, 164, 44-47 | |
Al Saif, N. and Brazier, J. | 1996 | Распространение Clostridium difficile в окружающей среде Южного Уэльса. | |
Андерсон, А., Hartmann, K., Leutenegger, C., Proksch, A., Mueller, R. and Unterer, S. | 2017 | Роль собачьего цирковируса у собак с острой геморрагической диареей. Veterinary Record, 180, 542-542 | |
Battersby, I. and Harvey, A. | 2006 | Дифференциальная диагностика и лечение острой диареи у собак и кошек. In Practice, 28, 480-488 | |
Beutin, L. | 1999 | Escherichia coli как патоген у собак и кошек.Vet Research, 30, 285-298 | |
Borriello, S., Honor, P., Turner, T. and Barclay, F. | 1983 | Домашние домашние животные, резервуар для инфекции Clodiffestridium . Journal of Clinical Pathology, 36, 84-87 | |
Burnens, A., Angeloz-Wick, B. and Nicolet, J. | 1992 | Сравнение частоты носительства кампилобактерий и здоровых животных . | |
Cassutto, B.и Кук, Л. | 2002 | Эпидемиологическое обследование энтеротоксемии, связанной с Clostridium perfringens, в армейском ветеринарном лечебном учреждении. Военная медицина, 167, 219-222 | |
Кейв Н., Маркс С., Касс П., Мелли А. и Брофи М. | 2002 | Оценка рутинной диагностики с диареей. Журнал Американской ветеринарной медицинской ассоциации, 221, 52–59 | |
Чабан, Б., Ngeleka, M. and Hill, J. | 2010 | Обнаружение и количественная оценка 14 видов Campylobacter у домашних собак показывает увеличение видового разнообразия в фекалиях животных, страдающих диареей. BMC Microbiology, 10, 73 | |
Chandler, M. | 2002 | Собака с хронической диареей. In Practice, 24, 18–27. и кошки, госпитализированные в отделение интенсивной терапии. | |
Cooper, S. | 2011 | Рецидивирующая диарея у кошек. In Practice, 33, 272-281 | |
Энгвалл Э., Брандстрем Б., Андерссон Л., Баверуд В., Троуальд-Уиг Г. и Инглунд Л. | 2003 | Выделение и идентификация термофильных видов Campylobacter в образцах фекалий шведских собак. Scandinavian Journal of Infectious Diseases, 35, 713-718 | |
ESCCAP (Европейский научный совет по паразитам животных-компаньонов) | 2018 | Руководящие принципы 06 – Борьба с кишечными инфекциями у собак и простейшими бактериями 06.Malvern: ESCCAP, 4 | |
Fantasia, M., Grazia Mingrone, M., Crotti, D. и Boscato, C. | 1985 | Изоляция Yersinia enter Италия. Journal of Clinical Microbiology, 22, 314-315 | |
Фукусима Х., Накамура Р., Иицука С., Цубокура М. | 1984 | Проспективное систематическое исследование Yersinia spp.у собак. Journal of Clinical Microbiology, 19, 616-622 | |
German, A., Cunliffe, N. and Morgan, K. | 2016 | Консистенция фекалий и факторы риска диареи и запоров переселение в приюты. Journal of Feline Medicine and Surgery, 19, 57-65 | |
Goddard, A. and Leisewitz, A. | 2010 | Собачий парвовирус. Ветеринарные клиники Северной Америки.Small Animal Practice, 40, 1041–1053 | |
Хакетт, Т. и Лаппин, М. | 2003 | Распространенность кишечных патогенов у собак Северо-Центрального Колорадо. Journal of the American Animal Hospital Association, 39, 52-56 | |
Hald, B. and Madsen, M. | 1997 | Здоровые щенки и котята как носители Campylobacter spp. Кампилобактер упсалиенсис.Journal of Clinical Microbiology, 35, 3351-3352 | |
Hald, B. | 2004 | характер экскреции термофильных Campylobacter spp. у молодых домашних собак в Дании. Journal of Clinical Microbiology, 42(5), pp.2003-2012 | |
Hall, E. | 2009 | Диарея собак: рациональный подход к диагностическим и терапевтическим дилеммам.На практике, 31, 8-16 | |
Холл Э. и Дэй М. | 2017 | Заболевание тонкой кишки. В: E. Ettinger, E. Feldman and E. Côté, ed., Учебник ветеринарной медицины внутренних органов, 8-е изд. Сент-Луис, Миссури: Elsevier, 1516-1592 | |
Хаббард, К., Скелли, Б., МакКелви, Дж. и Вуд, Дж. | 2007 | Риск Ветеринарная запись, 161, 755-757 | |
Джоффе, Д.и Schlesinger, D. | 2002 | Предварительная оценка риска заражения сальмонеллой у собак, которых кормят сырой курицей. | |
Джонс П., Доусон С., Гаскелл Р., Койн К., Тирни А., Сетцкорн К., Рэдфорд А. и Noble, P. | 2014 | Эпиднадзор за диареей в практике обращения с мелкими животными через Сеть ветеринарного надзора за мелкими животными (SAVSNET).The Veterinary Journal, 201, 412-418 | |
Langlois, D., Koenigshof, A. and Mani, R. | 2019 | Лечение острой диареи метронидазолом при острой диарее контролируемое клиническое исследование. Journal of Veterinary Internal Medicine, 34, 98-104 | |
Лефевр С., Уолтнер-Тьюз Д., Перегрин А., Рейд-Смит Р., Ходж Л., Арройо Л. и Weese, J. | 2006 | Распространенность зоонозных агентов у собак, посещающих госпитализированных людей в Онтарио: последствия для инфекционного контроля.Journal of Hospital Infection, 62, 458-466 | |
Мадуэлл, Б., Беа, Дж. | 1999 | Clostridium Difficile: обследование фекального носительства у кошек в ветлечебнице. Journal of Veterinary Diagnostic Investigation, 11, 50-54 | |
Marks, S. and Kather, E. | 2003 | Бактериально-ассоциированная диарея у собак: критическая оценка.Ветеринарные клиники Северной Америки: Small Animal Practice, 33, 1029-1060 | |
Marks, S. | 2000 | Диагностический и терапевтический подход к кошкам с хронической диареей. Journal of Feline Medicine and Surgery, 2, 105-109 | |
Маркс, С., Катер, Э., Касс, П. и Мелли, А. | 2002 | Генотип и генотип perfringens и Clostridium difficile у больных диареей и здоровых собак.Journal of Veterinary Internal Medicine, 16, 533 | |
Маккензи Э., Рил Дж., Банс Х., Касс П., Нельсон младший С. и Маркс С. | 2010 | Распространенность диареи и энтеропатогенов у ездовых собак. Journal of Veterinary Internal Medicine, 24, 97-103 | |
Морли П., Строхмейер Р., Танксон Дж., Хаятт Д., Даргатц Д. и Федорка-Крей П. | 2006 | Оценка связи между кормлением сырым мясом и заражением Salmonella enterica в питомнике грейхаундов.Журнал Американской ветеринарной медицинской ассоциации, 228, 1524-1532 | |
Олсон П., Хедхаммар А., Фарис А., Кровачек К. и Вадстрем Т. 26 | 06 1995 9025 9025 Энтеротоксигенные бактерии Escherichia coli (ETEC) и Klebsiella pneumoniae, выделенные от собак с диареей. Ветеринарная микробиология, 10, 577-589 | ||
Ortega, A., Martínez-Castañeda, J., Bautista-Gómez, L., Muñoz, R. и Hernández, I. | 2017 | Идентификация коинфекции ротавирусом и парвовирусом у собак с гастроэнтеритом в Мексике.Бразильский журнал микробиологии, 48(4), стр. | |
Парсонс Б., Портер К., Ривар Р., Стависки Дж., Уильямс Н., Пинчбек Г. , Бертлс Р., Кристли Р., Герман А., Рэдфорд А., Харт С., Гаскелл Р. и Доусон С. | 2010 | Распространенность Campylobacter spp. в поперечном исследовании собак, посещающих ветеринарные клиники в Великобритании, и индикаторов риска, связанных с линькой. The Veterinary Journal, 184, 66-70 | |
Перрин, Дж., Buogo, C., Gallusser, A., Burnens, A. и Nicolet, J. | 1993 | Кишечный носитель Clostridium difficile у новорожденных собак. Journal of Veterinary Medicine, Series B, 40, 222-226 | |
Pospischil, A., Mainil, J., Baljer, G. and Moon, H. | 1987 | Attachment кишечник телят и кошек при диарее. Ветеринарная патология, 24, 330-334 | |
Райли, Т., Adams, J., O’Neill, G. and Bowman, R. | 1991 | Желудочно-кишечный носитель Clostridium difficile у кошек и собак, посещающих ветеринарные клиники. | |
Росси, М., Ханнинен, М., Ревез, Дж., Ханнула, М. и Занони, Р. | 2008 | диагностика Campylobacter spp., кишечной Helicobacter spp. и Anaerobiospirillum spp. у здоровых и страдающих диареей собак и кошек.Veterinary Microbiology, 129, 304-314 | |
Sancak, A., Rutgers, H., Hart, C. and Batt, R. | 2004 | хроническая диарея. Veterinary Record, 154, 101-106 | |
Sandberg, M., Bergsjø, B., Hofshagen, M., Skjerve, E. and Kruse, H. | 2002 Факторы риска инфекции Campbactery | 6 у норвежских кошек и собак.Preventive Veterinary Medicine, 55, 241-253||
Santín, M. | 2013 | Клинические и субклинические инфекции Cryptosporidium у животных. New Zealand Veterinary Journal, 61, 1-10 | |
Шульц Б., Штраух К., Мюллер Р., Эйххорн В. | 2008 | Сравнение распространенность кишечных вирусов у здоровых собак и собак с острой геморрагической диареей по данным электронной микроскопии.Journal of Small Animal Practice, 49(2), 84-88 | |
Синглтон Д., Арсевска Э., Смит С., Баркер Э., Джуэлл С., Брант Б., Санчес-Вискайно Ф., Доусон С., Пинчбек Г., Ноубл П., Джонс П. и Рэдфорд А. | 2019 | Надзор за болезнями мелких животных: желудочно-кишечные заболевания, назначение антибактериальных препаратов и тритрихомонады плод. Veterinary Record, 184, 211-216 | |
Смит К., Крут С., Hammermueller, J., Gyles, C. and Wilson, J. | 1998 | ) Исследование случай-контроль вероцитотоксигенной кишечной палочки у кошек с диареей. Canadian Journal of Veterinary Research, 62, 87-92 | |
Spain, C., Scarlett, J., Wade, S. and McDonough, P. | 2001 | Распространенность кишечных зоотических инфекций младше 1 года в Центральном штате Нью-Йорк. | |
Ставиский Дж., Пинчбек Г., Герман А., Доусон С., Гаскелл Р., Ривар Р. и Рэдфорд А. | 2010 | Распространенность собачьего кишечного коронавируса в поперечном обследовании собак представление в ветеринарных клиниках. Veterinary Microbiology, 140, 18-24 | |
Стависки Дж., Рэдфорд А., Гаскелл Р., Доусон С., Герман А., Парсонс Б., Клегг С., Ньюман , J. and Pinchbeck, G. | 2011 | Исследование случай-контроль возбудителя и факторов риска диареи образа жизни у собак.Preventive Veterinary Medicine, 99, 185-192 | |
Теннант Б., Гаскелл Р., Келли Д., Картер С. и Гаскелл К. собака после ороназальной прививки. Research in Veterinary Science, 51, 11-18 | |||
Таплер Т., Леви Дж., Сабшин С., Такер С., Грейнер Э. и Лойтенеггер К. | 2012 | Энтеропатогены, выявленные у собак, поступающих в приют для животных во Флориде с нормальным стулом или диареей. | |
Tysnes, K., Skancke, E. and Robertson, L. | 2014 | Subclinical Giardin заражение человека. Trends in Parasitology, 30, 520-527 | |
Ван Иммерсил Ф., Пасманс Ф., Де Бак Дж., Рыхлик И., Градецка Х., Коллард Дж., Вильдемауве С. ., Heyndrickx, M., Ducatelle, R. и Haesebrouck, F. | 2004 | Кошки как источник риска передачи сальмонелл, устойчивых к противомикробным препаратам. Emerging Infectious Diseases, 10, 2169–2174 | |
Weese, J. | 2011 | Бактериальный энтерит у собак и кошек: диагностика, терапия и зоонозный потенциал. Ветеринарные клиники Северной Америки: Практика мелких животных, 41, 287-309 | |
Виз, Дж., Стаемпфли, Х., Прескотт, Дж., Крут, С., Greenwood, S. и Weese, H. | 2001 | Роль Clostridium difficile и энтеротоксигенных Clostridium perfringens при диарее у собак. | |
Wieland, B., Regula, G., Danuser, J., Wittwer, M., Burnens, A., Wassenaar, T. and Stark, K. | 2005 | Campylobacter spp. у собак и кошек в Швейцарии: анализ факторов риска и молекулярная характеристика с помощью AFLP.Journal of Veterinary Medicine Series B, 52, 183-189 |
Происхождение редких штаммов ротавируса крупного рогатого скота, обнаруженных у японских детей
Ключевые слова
ротавирусный гастроэнтерит, эндемичный штамм, генотип, G6P [9], ротавирус крупного рогатого скота, рекомбинация
Ротавирус (RV) является важным вирусным патогеном, вызывающим острый гастроэнтерит (AGE) у людей. Поскольку большинство младенцев получили ротавирусную вакцину, ротавирусные инфекции среди младенцев и детей раннего возраста с тех пор значительно снизились в развитых странах [1].Ежегодно вакцина предотвращает от 40 000 до 50 000 госпитализаций среди младенцев и детей младшего возраста в США [2]. Вирус RV поражает не только человека, но и различных молодых домашних и диких животных, таких как обезьяны, крупный рогатый скот, свиньи, лошади, собаки, кошки, крысы, куры и олени [3-6]. Хотя природа РВ встречается у многих млекопитающих и птиц, заражение человека РВ-инфекцией практически ограничено людьми. Сообщения об эпидемическом штамме в местных районах очень важны для расследования пандемии от эпидемии в регионе.
Вирус RV поражает не только человека, но и различных молодых домашних и диких животных, таких как обезьяны, крупный рогатый скот, свиньи, лошади, собаки, кошки, крысы, куры и олени [3-6]. Хотя природа РВ встречается у многих млекопитающих и птиц, заражение человека РВ-инфекцией практически ограничено людьми. Сообщения об эпидемическом штамме в местных районах очень важны для расследования пандемии от эпидемии в регионе.
RV, член семейства Reoviridae, имеет 11 сегментов двухцепочечной РНК в качестве генома, а вирусная частица состоит из внешнего капсида, внутреннего капсида и ядра [7]. В некоторых группах РВ внешний капсид состоит из двух структурных белков, VP4 и VP7, которые содержат антигены нейтрализации. Внутренний капсид состоит из структурного белка VP6. Основываясь на антигенности внутреннего капсидного белка VP6 и геномных характеристиках, RV подразделяют на семь групп (A-G), среди которых группа A RV является основным этиологическим агентом у людей и животных. Для эпидемиологических исследований РВ принята система генетической классификации, основанная на белках наружного капсида VP7 (G-тип) и VP4 (P-тип) [8].
Для эпидемиологических исследований РВ принята система генетической классификации, основанная на белках наружного капсида VP7 (G-тип) и VP4 (P-тип) [8].
В то время как по крайней мере 12 генотипов G были выделены у людей, G1, G2, G3, G4 и новый G9 являются основными генотипами ротавирусов человека [3]. Несколько генотипов P (P[1]–[3], P[5], P[7], P[9]–[11], P[14], P[19] и P[25]) имеют спорадически выявляли в человеческой популяции [9-11]. Среди генотипов P человека P [8] является наиболее распространенным генотипом во всем мире, за ним следуют P [4] и P [6].Также известно 6 неструктурных белков (NSP) [3]. В RV человека было идентифицировано пять распространенных комбинаций генотипов G и P (геногрупп): G1P[8], G2P [4], G3P[8], G4P[8] и G9P[8] в созвездии Wa-подобного генома. (I1-R1-C1-M1-A1-N1-T1-E1-h2) и G2P[4] в созвездии, подобном DS-1 (I2-R2-C2-M2-A2-N2-T2-E2- ч3) . AU-1-подобные ротавирусы составляют третью группу РВ человека, которая распространяется с низкой распространенностью и имеет четкую констелляцию генов (G3-P[9]-I3-R3-C3-M3-A3-N3-T3-E3). -h4) .
-h4) .
Несмотря на то, что ротавирус человека G6 довольно редок, он является основным типом среди РВ крупного рогатого скота.В исследовании японских коров 59,1% изолятов принадлежали к G6. Первый штамм G6P[9], PA151, был выделен у итальянского ребенка с AGE [12], за ним последовали штамм Se584 из США [13], несколько венгерских штаммов [14]. Впоследствии G6P[9] был обнаружен в Японии [15-17], Австралии [18] и Тунисе [19]. Обычно во всем мире бычьи штаммы G6 комбинировали с P[5], P[1] и другими [20].
В последнее время все чаще анализируются полногеномные последовательности штаммов RV, чтобы понять межвидовую передачу, рекомбинацию и эволюционные отношения между RV человека и животных.В предыдущем исследовании [15,16] были определены почти полноразмерные последовательности всех генных сегментов для изучения генетического происхождения уникальных человеческих G6P[9] RV, обнаруженных в Японии. Авторы [21] считали, что их изоляты представляли собой события реассортации между бычьими ротавирусами человека и человеческими/кошачьими AU-1-подобными ротавирусами. G6 является распространенным генотипом у крупного рогатого скота/буйволов [22], овец [23] и коз [24,25] и был идентифицирован спорадически или с низкой распространенностью у кроликов и свиней [26].G6P [14] в Египте [27] и G6P [9] в Буркина-Фасо [28] в обоих случаях были зарегистрированы как редкий вирус. Пациент, у которого недавно в Японии были обнаружены уникальные человеческие G6P[9] RV, ранее не имел контактов с очевидными бычьими или другими источниками инфекции.
G6 является распространенным генотипом у крупного рогатого скота/буйволов [22], овец [23] и коз [24,25] и был идентифицирован спорадически или с низкой распространенностью у кроликов и свиней [26].G6P [14] в Египте [27] и G6P [9] в Буркина-Фасо [28] в обоих случаях были зарегистрированы как редкий вирус. Пациент, у которого недавно в Японии были обнаружены уникальные человеческие G6P[9] RV, ранее не имел контактов с очевидными бычьими или другими источниками инфекции.
Все остальные гены обнаруженного штамма, за исключением NSP3, были относительно тесно связаны по крайней мере с одним из человеческих G6 RV, о которых сообщалось в? Европе и США. В исследовании, проведенном в префектуре Мияги, Япония, G6P [9] (M72S11) на образец был обнаружен у 2-летнего малыша в 2011 г. [29].Также G6P [9] был обнаружен более чем у 3 кошек префектуры Миэ в Японии. Эти данные свидетельствуют о том, что человеческий вирус G6, возникший в результате рекомбинации между человеческим и кошачьим или бычьим вирусом, распространен во всем мире, несмотря на низкую распространенность. Поскольку генотипы нескольких генных сегментов различаются среди этих человеческих штаммов G6, это позволяет предположить, что ротавирусы ?G6 могут независимо встречаться в различных местах или странах посредством рекомбинации среди местных штаммов.
Поскольку генотипы нескольких генных сегментов различаются среди этих человеческих штаммов G6, это позволяет предположить, что ротавирусы ?G6 могут независимо встречаться в различных местах или странах посредством рекомбинации среди местных штаммов.
Хотя инфекции кошачьими ротавирусами (FRV) редко вызывают тяжелые заболевания у кошек [30,31], FRV привлекли внимание как постоянные, хотя и нечастые, источники заболеваний человека.Человеческий RV с генетической гомологией FRV был выделен из широко распространенных географических регионов, включая Японию [32,33], Израиль [34], Тунис и США [35]. Кроме того, предполагаемые реассортантные ротавирусы человека/кошки были выявлены у детей в Италии [36].
Два генотипа G и P, идентифицированные комбинации, переносимые ротавирусами, циркулирующими в популяции кошек, представляли собой G3P[9] и G6P[9]. Генотипы G3P[9] и G6P[9] были выделены у человека. G3P[9] является признанным кошачьим генотипом (созвездия AU-1-подобных и BA222-подобных генотипов [37]. Ferine RV (G6P[9] и G3P[9]) были обнаружены с низкой распространенностью (3,0%) в популяции кошек в Соединенном Королевстве. G6 был более распространенным генотипом (84%) и был обнаружен в Шотландии, Мидлендсе и Корнуолле, которые являются географически отдельными регионами, охватывающими всю территорию Соединенного Королевства [37]. Это похоже на оценки из других стран, включая Японию, но показывает региональные и сезонные различия. Стратегии продольной выборки, основанные на этой распространенности, можно использовать для более подробного изучения динамики передачи.Отсутствие связи между РВ-инфекцией и диареей у кошек резко отличается от таковой у людей.
Ferine RV (G6P[9] и G3P[9]) были обнаружены с низкой распространенностью (3,0%) в популяции кошек в Соединенном Королевстве. G6 был более распространенным генотипом (84%) и был обнаружен в Шотландии, Мидлендсе и Корнуолле, которые являются географически отдельными регионами, охватывающими всю территорию Соединенного Королевства [37]. Это похоже на оценки из других стран, включая Японию, но показывает региональные и сезонные различия. Стратегии продольной выборки, основанные на этой распространенности, можно использовать для более подробного изучения динамики передачи.Отсутствие связи между РВ-инфекцией и диареей у кошек резко отличается от таковой у людей.
Инфекция также была связана с диареей и снижением продуктивности у коров [38], поросят-сосунов и лошадей. Сообщается о бессимптомных инфекциях, хотя их значение в передаче не совсем понятно из-за отсутствия популяционных исследований [39]. У коров бессимптомные особи выделяют такие же вирусные титры, как и у клинически инфицированных особей, и постулируется роль вирулентных и авирулентных штаммов RV [40]. Бессимптомная инфекция может быть отражением характера взаимоотношений G6P[9] и G3P[9] с кошачьим хозяином [41].
Бессимптомная инфекция может быть отражением характера взаимоотношений G6P[9] и G3P[9] с кошачьим хозяином [41].
Была предложена возможность происхождения кошек G6 в какой-то исторический момент. С кластеризацией опубликованных генотипов G6 человека с нашими генотипами G6 кошек, а не с опубликованными генотипами G6 крупного рогатого скота [42], было убедительно предположение, что генотипы G6P[9] были примерами зоонозной или антропозоонозной передачи между кошками и людьми.
2021 Copyright ОАТ.Все права защищены G6P[9] — относительно распространенный кошачий ротавирус с низкой распространенностью в популяции кошек в Японии. Случаи передачи между кошками или быками и людьми, вероятно, существуют, хотя они нечасты и не вызывают вспышек заболевания. Наблюдение за RV в популяции домашних животных важно для изучения генетического разнообразия ротавируса, выяснения роли бессимптомного носительства, изучения зоонозного риска и мониторинга потенциальной роли нечеловеческих ротавирусов в эволюции RV.
Конфликт интересов
Никаких коммерческих отношений или потенциального конфликта интересов, связанных с представлением этой рукописи.
Каталожные номера
- Steele AD, Cunliffe N, Tumbo J, Madhi SA, De Vos B, et al. (2009) Обзор ротавирусной инфекции и вакцинации детей, инфицированных вирусом иммунодефицита человека. J Infect Dis 200 (Приложение 1): S57-62. [Перекрестная ссылка]
- Numazaki K (2016) Характеристики ротавирусных инфекций до и после внедрения ротавирусных вакцин в Японии. Aperito J Infect Dis Vaccines 2: 1-15.
- Эстес М.К., Гринберг Х.Б. (2013) Ротавирусы. В: Филдс Б.Н., Найп Д.М., Хоули П.М. (ред.) Вирусология Филдса. Липпинкотт, Уильямс и Уилкинс, Филадельфия, 1347–1401 гг.
- Гош С., Кобаяши Н. (2014) Экзотические ротавирусы у животных и ротавирусы у экзотических животных.
 Вирусная болезнь 25: 158-172. [Перекрестная ссылка]
Вирусная болезнь 25: 158-172. [Перекрестная ссылка] - Santos N, Hoshino Y (2005)Глобальное распространение серотипов/генотипов ротавируса и его значение для разработки и внедрения эффективной ротавирусной вакцины. Rev Med Virol 15: 29-56. [Перекрестная ссылка]
- Martella V, Bányai K, Matthijnssens J, Buonavoglia C, Ciarlet M (2010) Зоонозные аспекты ротавирусов. Vet Microbiol 140: 246-255. [Перекрестная ссылка]
- Gentsch JR, Laird AR, Bielfelt B, Griffin DD, Banyai K, et al. (2005) Разнообразие серотипов и рекомбинация между штаммами ротавируса человека и животных: последствия для программ ротавирусной вакцины. J Infect Dis 192 (доп.1): С146-С159. [Перекрестная ссылка]
- Matthijnssens J, Ciarlet M, McDonald SM, Attoui H, Bányai K, et al. (2011) Единообразие номенклатуры штаммов ротавируса, предложенное Рабочей группой по классификации ротавирусов (RCWG).
 Арх Вирол 156(8): 1397-1413. [Перекрестная ссылка]
Арх Вирол 156(8): 1397-1413. [Перекрестная ссылка] - Мандал П., Маллик С., Наяк М.К., Мукерджи А., Гангули Н. и др. (2016) Полное генотипирование изолятов ротавирусов G12P[11] и G10P[14] необычных видов и доказательства частой реассортации in vivo среди ротавирусов, обнаруженных у детей с диареей в Калькутте, Индия, в 2014 г. Арх Вирол 161: 2773-2785. [Перекрестная ссылка]
- Steyer A, NagliÄ T, Jamnikar-CigleneÄki U, Kuhar U (2017) Обнаружение и полногеномный анализ зоонозного штамма G8P[14] ротавируса, выделенного у ребенка с диареей. Объявление генома 5. [Crossref]
- Делогу Р., Ло Прести А., Руджери Ф.М., Целла Э., Джованетти М. и др. (2013) Полногеномная характеристика ротавируса G8P[8], появившегося среди детей с диареей в Хорватии в 2006 г. J Clin Microbiol 51: 1583-1588. [Перекрестная ссылка]
- Герна Г., Сарасини А., Пареа М.
 , Ариста С., Миранда П. и др. (1992)Выделение и характеристика двух различных штаммов ротавируса человека со специфичностью G6. J Clin Microbiol 30: 9-16. [Перекрестная ссылка]
, Ариста С., Миранда П. и др. (1992)Выделение и характеристика двух различных штаммов ротавируса человека со специфичностью G6. J Clin Microbiol 30: 9-16. [Перекрестная ссылка] - Гриффин Д.Д., Накагоми Т., Хосино Ю., Накагоми О., Кирквуд К.Д. и др. (2002) Национальная система эпиднадзора за ротавирусами. Характеристика нетипируемых штаммов ротавируса из США: идентификация нового реассортанта ротавируса (P2A[6],G12) и редкого штамма P3[9], родственного бычьим ротавирусам. Вирол 294: 256-269. [Перекрестная ссылка]
- Баньяи К., Генч Дж. Р., Гриффин Д. Д., Холмс Дж. Л., Гласс Р. И. и др. (2003) Генетическая изменчивость ротавирусов человека серотипа G6: идентификация новой линии, выделенной в Венгрии. J Med Virol 71: 124-134. [Перекрестная ссылка]
- Ямамото Д., Кавагутия М., Гош С., Итикава М., Нумадзаки К. и др. (2011)Обнаружение и полный геномный анализ ротавируса человека G6P[9] в Японии.
 Вирусные гены 43: 215-223.[Перекрестная ссылка]
Вирусные гены 43: 215-223.[Перекрестная ссылка] - Numazaki K, Ichikawa M (2014)Клинические и вирусологические характеристики ротавирусного гастроэнтерита и распространенность штаммов в Точиги, Япония. In Vivo 28:1141-1147. [Перекрестная ссылка]
- Cooney MA, Gorrell RJ, Palombo EA (2001) Характеристика и филогенетический анализ белков VP7 ротавирусов человека серотипов G6 и G8. J Med Microbiol 50: 462-467. [Перекрестная ссылка]
- Diwakarla S, Clark R, Palombo EA (2002)Расширение распространения ротавирусов человека серотипа G6 в Австралии. Микробиол Иммунол 46: 499-502. [Перекрестная ссылка]
- Бен Хадж Фредж М., Хейлен Э., Целлер М., Фодха И., Бенхамида-Ребай М. и др. (2013) Кошачье происхождение штамма ротавируса, Тунис, 2008. Emerg Infect Dis 19: 630-634. [Перекрестная ссылка]
- Ямникар-Цигленецкий Ю.
 , Кухар Ю., Штурм С., Кирбис А., Рацки Н. и др. (2016)Первое обнаружение и характеристика всего генома штамма ротавируса группы А G6P[15] косули. Vet Microbiol 191: 52-59.[Перекрестная ссылка]
, Кухар Ю., Штурм С., Кирбис А., Рацки Н. и др. (2016)Первое обнаружение и характеристика всего генома штамма ротавируса группы А G6P[15] косули. Vet Microbiol 191: 52-59.[Перекрестная ссылка] - Numazaki K, Ichikawa M (2017) Исследование происхождения штаммов ротавируса крупного рогатого скота, обнаруженных у детей района Насу, Точиги, Япония. Журнал инфекционных болезней и эпидемиологии 3: 1-8.
- Чанг К.О., Парвани А.В., Саиф Л.Дж. (2000) Сравнительный анализ последовательности генов VP7 ротавирусов группы А крупного рогатого скота G6, G8 и G10 и дальнейшая характеристика подтипов G6. Арх Вирол 145: 725-737.[Перекрестная ссылка]
- Fitzgerald TA, Munoz M, Wood AR, Snodgrass DR (1995) Серологическая и геномная характеристика ротавирусов группы А ягнят. Арх Вирол 140: 1541-1548. [Перекрестная ссылка]
- Гош С., Алам М.М., Ахмед М.
 У., Талукдар Р.И., Пол С.К. и др. (2010) Полное созвездие генома штамма ротавируса группы А коз обнаруживает общую эволюцию со штаммами ротавируса жвачных животных и человека. J Gen Virol 91: 2367-2373.[Перекрестная ссылка]
У., Талукдар Р.И., Пол С.К. и др. (2010) Полное созвездие генома штамма ротавируса группы А коз обнаруживает общую эволюцию со штаммами ротавируса жвачных животных и человека. J Gen Virol 91: 2367-2373.[Перекрестная ссылка] - Pratelli A, Martella V, Tempesta M, Buonavoglia C (1999) Характеристика с помощью полимеразной цепной реакции ротавирусов жвачных животных, выделенных в Италии. Microbiologica 22: 105-109. [Перекрестная ссылка]
- Gouvea V, Santos N, Timenetsky Mdo C (1994) Идентификация ротавируса G крупного рогатого скота и свиньи с помощью ПЦР. J Clin Microbiol 32: 1338-1340. [Перекрестная ссылка]
- Эль Шериф М., Эсона М.Д., Ван Ю., Генч Дж. Р., Цзян Б. и др.(2011)Обнаружение первого штамма ротавируса человека G6P[14] у ребенка с диареей в Египте. Заразить Genet Evol 11: 1436-1442. [Перекрестная ссылка]
- Nordgren J, Nitiema LW, Sharma S, Ouermi D, Traore AS, et al.
 (2012) Появление необычных ротавирусов G6P[6] у детей, Буркина-Фасо, 2009–2010 гг. Emerg Infect Dis 18: 589-597. [Перекрестная ссылка]
(2012) Появление необычных ротавирусов G6P[6] у детей, Буркина-Фасо, 2009–2010 гг. Emerg Infect Dis 18: 589-597. [Перекрестная ссылка] - Отчеты о наблюдении за инфекционными агентами IASR, Национальный институт инфекционных заболеваний (NIID, Япония.Том. 35 р. 298-300: 2014. (на японском языке)
- Hoshino Y, Baldwin CA, Scott FW (1981) Выделение и характеристика кошачьего ротавируса. J Gen Virol 54: 313-323. [Перекрестная ссылка]
- Mochizuki M, Nakagomi T, Nakagomi O (1997) Выделение от диарейных и бессимптомных котят трех штаммов ротавируса, принадлежащих к геногруппе AU-1 ротавирусов человека. J Clin Microbiol 35: 1272-1275. [Перекрестная ссылка]
- Nakagomi O, Nakagomi T, Oyamada H, Suto T (1985) Относительная частота подгрупп ротавируса человека 1 и 2 у японских детей с острым гастроэнтеритом. J Med Virol 17: 29-34. [Перекрестная ссылка]
- Nakagomi T, Nakagomi O (1989) Гибридизация РНК-РНК идентифицирует ротавирус человека, который генетически связан с ротавирусом кошек.
 J Virol 63: 1431-1434. [Перекрестная ссылка]
J Virol 63: 1431-1434. [Перекрестная ссылка] - Aboudy Y, Shif I, Zilberstein I, Gotlieb-Stematsky T (1988) Использование поликлональных и моноклональных антител и анализ вирусной РНК при обнаружении необычных ротавирусов группы А человека. J Med Virol 25: 351-359.[Перекрестная ссылка]
- Nakagomi T, Nakagomi O (2000) Ротавирус человека HCR3 обладает констелляцией геномной РНК, неотличимой от кошачьих и собачьих ротавирусов. Арх Вирол 145: 2403-2409. [Перекрестная ссылка]
- Де Грация С., Джамманко Г.М., Мартелла В., Рамирес С., Коломба С. и др. (2008) Редкие AU-1-подобные G3P[9] ротавирусы человека с Kun-подобным геном NSP4, обнаруженные у детей с диареей в Италии. J Clin Microbiol 46: 357-360.[Перекрестная ссылка]
- Накагоми О., Ошима А., Абуди Ю., Шиф И., Мотидзуки М. и др. (1990)Молекулярная идентификация путем РНК-РНК-гибридизации человеческого ротавируса, который тесно связан с ротавирусами кошачьего и собачьего происхождения.
 J Clin Microbiol 28: 1198-1203. [Перекрестная ссылка]
J Clin Microbiol 28: 1198-1203. [Перекрестная ссылка] - Дхама К., Чаухан Р.С., Махендран М., Малик С.В. (2009)Ротавирусная диарея у крупного рогатого скота и других домашних животных. Ветрез коммуна 33: 1-23. [Перекрестная ссылка]
- Мухопадья И., Саркар Р., Менон В.К., Бабджи С., Пол А. и др.(2013)Выделение ротавируса у симптоматических и бессимптомных детей с использованием количественной ПЦР с обратной транскрипцией. J Med Virol 85: 1661-1668. [Перекрестная ссылка]
- Bridger JC, Oldham G (1987) Авирулентные ротавирусные инфекции защищают телят от болезней, вызывая и не вызывая высокие уровни нейтрализующих антител. J Gen Virol 68: 2311-2317. [Перекрестная ссылка]
- Герман А.С., Итурриза-Гомара М., Дав В., Сандрасегарам М., Накагоми Т. и др.(2015) Молекулярная эпидемиология ротавируса у кошек в Соединенном Королевстве .
 J Clin Microbiol 53: 455-464.
J Clin Microbiol 53: 455-464. - Kalica AR, Greenberg HB, Wyatt RG, Flores J, Sereno MM, et al. (1981) Гены ротавирусов человека (штамм Wa) и крупного рогатого скота (штамм UK), кодирующие антигены нейтрализации и подгруппы. Вирусология 112: 385-390.
Ротавирусная диарея крупного рогатого скота и других домашних животных
Adah, M.I., Nagashima, S., Wakuda, M. and Taniguchi, K., 2003. Тесная связь между ротавирусами крупного рогатого скота серотипа G8 и человеческим, выделенными в Нигерии. Journal of Clinical Microbiology , 41, 3945–3950
PubMed КАС Google Scholar
Агравал Д.К., Сингх Н.П. и Чаухан, Р.С., 2002. Колостральные антитела против ротавирусной инфекции у новорожденных телят. Журнал иммунологии и иммунопатологии , 4, 107–109
Google Scholar
Айх, П. , Wilson, H.L., Kaushik, R.S., Potter, A.A., Babiuk, L.A. and Griebel, P., 2007. Сравнительный анализ врожденных иммунных реакций после заражения новорожденных телят бычьим ротавирусом и бычьим коронавирусом. Journal of General Virology , 88, 2749–2761
, Wilson, H.L., Kaushik, R.S., Potter, A.A., Babiuk, L.A. and Griebel, P., 2007. Сравнительный анализ врожденных иммунных реакций после заражения новорожденных телят бычьим ротавирусом и бычьим коронавирусом. Journal of General Virology , 88, 2749–2761
PubMed КАС Google Scholar
Альфьери А.Ф., Альфиери А.А., Баррейрос М.А., Лейте Дж.П. и Рихценхайн Л.Дж., 2004 г. Генотипы G и P штаммов ротавируса группы А, циркулирующие у телят в Бразилии, 1996–1999 гг. Ветеринарная микробиология , 99, 167–173
PubMed Google Scholar
Альфьери А.А., Парацци М.Е., Такиучи Э., Медичи К.С. и Alfieri, A.F., 2006. Частота ротавируса группы А у телят с диареей в бразильских стадах крупного рогатого скота, 1998–2002 гг. Здоровье и производство тропических животных , 38, 521–526
PubMed КАС Google Scholar
Барбоза, Э. Ф., Фигейредо, Х.Ч.П., Гарсия, А.М., Лобато, З.И.П. и Lage, A.P., 1998. Ротавирус группы А у телят в штате Минас-Жерайс, Бразилия. Ciencia Rural , 28, 435–439
Ф., Фигейредо, Х.Ч.П., Гарсия, А.М., Лобато, З.И.П. и Lage, A.P., 1998. Ротавирус группы А у телят в штате Минас-Жерайс, Бразилия. Ciencia Rural , 28, 435–439
Google Scholar
Баррандеги, М., Паррено, В., Лагос Мармол, М., Понт Лезика, Ф., Ривас, К., Валле, К. и Фернандес, Ф., 1998. Профилактика ротавирусной диареи у жеребят путем парентеральная вакцинация кобыл: полевые испытания. Разработка биологических стандартов , 92, 253–257
CAS Google Scholar
Бендали, Ф., Bichet, H., Schelcher, F. и Sanaa, M., 1999. Характер диареи у новорожденных телят мясного направления на юго-западе Франции. Ветеринарные исследования , 30, 61–74
PubMed КАС Google Scholar
Бильбао, Г.Н., Чакана, П.А., Мендибуру, А., Родригес, Э., Блэкхолл, Дж.О. и Terzolo, H.R., 2006. Профилактика неонатальной диареи у молочных телят с использованием иммуноглобулинов яичного желтка (IgY). Revue Medicinia Veterinaria Buenos Aires , 87, 135–139
Revue Medicinia Veterinaria Buenos Aires , 87, 135–139
Google Scholar
Берч, К.Дж., Хит, Р.Л., Маршалл, Дж.А., Лю, С. и Гаст, И.Д., 1985. Выделение кошачьих ротавирусов и их связь с изолятами человека и обезьян по электроферотипу и серотипу. Journal of General Virology , 66, 2731–2735
PubMed КАС Google Scholar
Блатт, Ю.Е. и Conner, ME, 2007. Ротавирус: в кишечник и дальше! Текущие мнения в области гастроэнтерологии , 23, 39–43
Google Scholar
Бриджер, Дж.C., 1994. Определение вирулентности бычьего ротавируса. Journal of General Virology , 75, 2807–2812
PubMed Google Scholar
Бриджер, Дж. К., Вуд, Г. Н., Джонс, Дж. М., Флеветт, Т. Х., Брайден, А. С. и Davies, H., 1975. Передача ротавирусов человека гнотобиотическим поросятам. Journal of Medical Microbiology , 8, 565–569
Journal of Medical Microbiology , 8, 565–569
PubMed КАС Google Scholar
Брюссов, Х., Nakagomi, O., Gerna, G. и Eichhorn, W., 1992. Выделение птичьего ротавируса группы А от теленка с диареей. Journal of Clinical Microbiology , 30, 67–73
PubMed КАС Google Scholar
Каструччи Г., Фриджери Ф., Феррари М., Чилли В., Калеффи Ф., Альдрованди В. и Нигрелли А., 1984a. Эффективность молозива от коров, вакцинированных ротавирусом, для защиты телят от экспериментально индуцированной ротавирусной инфекции. Сравнительная иммунология и микробиология , 7, 11–18
CAS Google Scholar
Каструччи Г., Фриджери Ф., Феррари М., Чилли В., Альдрованди В., Калеффи Ф. и Гатти Р., 1984b. Сравнительное изучение штаммов ротавирусов крупного рогатого скота и кроликов. Сравнительная иммунология и микробиология , 7, 171–178
Google Scholar
Каструччи, Г. , Frigeri, F., Ferrari, M., Cilli, V., Aldronvandi, V., Gatti, R. and Rampichini, L., 1985. Сравнение штаммов ротавируса крупного рогатого скота, обезьян и свиней. Европейский журнал эпидемиологии , 1, 274–280
, Frigeri, F., Ferrari, M., Cilli, V., Aldronvandi, V., Gatti, R. and Rampichini, L., 1985. Сравнение штаммов ротавируса крупного рогатого скота, обезьян и свиней. Европейский журнал эпидемиологии , 1, 274–280
PubMed КАС Google Scholar
Каструччи Г., Фриджери Ф., Феррари М., Альдрованди В., Тассини Ф. и Гатти Р., 1988a. Защита новорожденных телят от экспериментальной ротавирусной инфекции путем скармливания молочных выделений вакцинированных коров. Microbiologica , 11, 379–385
PubMed КАС Google Scholar
Каструччи Г., Фригери Ф., Феррари М., Чилли В., Гуаланди Г.Л. и Альдрованди В., 1988b. Диарея новорожденных телят, вызванная ротавирусом. Сравнительная иммунология и микробиология , 11, 71–84
CAS Статья Google Scholar
Чейси Д. и Бэнкс Дж., 1986. Репликация атипичного ротавируса овец в тонком кишечнике и культуре клеток.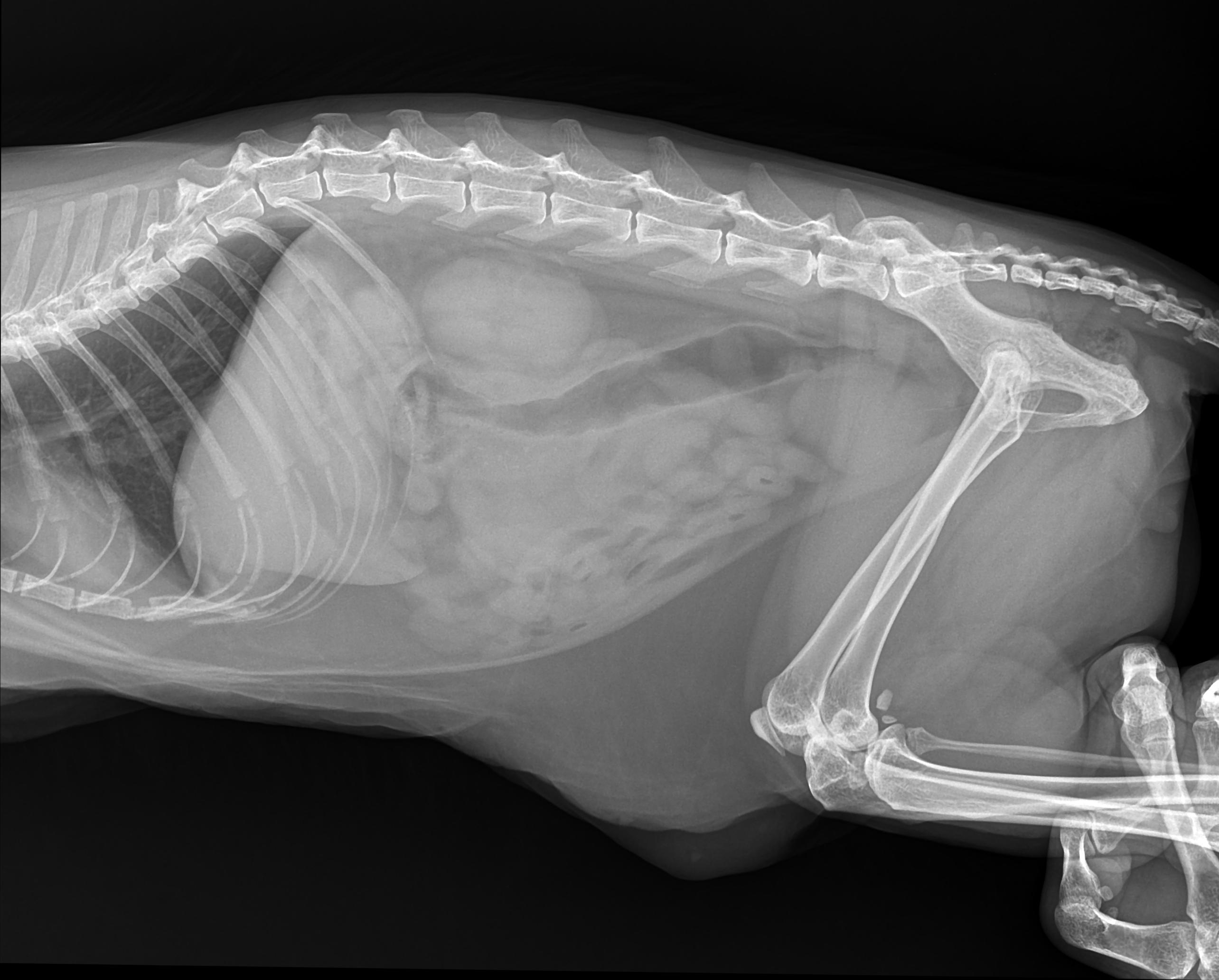 Journal of General Virology , 67, 567–576
Journal of General Virology , 67, 567–576
PubMed Google Scholar
Чаухан, Р.С. и Сингх, Н.П., 1992а. Экспресс-диагностика ротавирусной инфекции у телят методом дот-иммуносвязывания. Ветеринарная запись , 130, 381
PubMed КАС Google Scholar
Чаухан Р.С. и Сингх Н.П., 1992b. Клеточный иммунный ответ у телят, инфицированных ротавирусом: анализ ингибирования миграции лейкоцитов. Journal of Comparative Pathology , 107, 115–118
PubMed КАС Google Scholar
Чаухан, Р.С. и Сингх, Н.П., 1992c. Выявление ротавирусной инфекции у телят методом иммунофлуоресценции. Journal of Applied Animal Research , 1, 51–55
Google Scholar
Чаухан Р.С. и Сингх Н.П., 1992d. Оценка повреждения кишечника у телят, инфицированных ротавирусом, с помощью теста мальабсорбции D-ксилозы. Индийский журнал ветеринарной патологии , 16, 13–16
Индийский журнал ветеринарной патологии , 16, 13–16
Google Scholar
Чаухан, Р.С. и Сингх, Н.П., 1992e. Цитопатология, индуцированная ротавирусом в клетках почек плода макаки-резус (MA104). Индийский журнал ветеринарной патологии , 16, 76–78
Google Scholar
Чаухан Р.С. и Сингх Н.П., 1993а. Ротавирусная инфекция у телят – электронно-микроскопические исследования. Израильский журнал ветеринарных исследований , 48, 110–112
Google Scholar
Чаухан, Р.С. и Сингх, Н.П., 1993b. Ротавирусная инфекция телят – диагностика с помощью электрофореза в полиакриламидном геле. Индийский журнал наук о животных , 63, 1–3
Google Scholar
Чаухан Р.С. и Сингх Н.П., 1996. Эпидемиология ротавирусной инфекции у телят в Индии. Международный журнал наук о животных , 11, 221–223
Международный журнал наук о животных , 11, 221–223
Google Scholar
Чаухан, Р.С. и Сингх, Н.П., 1999. Обнаружение ротавируса у экспериментально инфицированных телят с использованием иммунопероксидазного метода. Индийский журнал наук о животных , 69, 239–291
Google Scholar
Чаухан Р.С. и Сингх, Н.П., 2001. Демонстрация клеток, продуцирующих антиротавирусные антитела, в кишечнике телят с использованием метода иммунопероксидазы. Журнал иммунологии и иммунопатологии , 3, 41–44
Google Scholar
Чаухан, Р.С., Дхама, К. и Махендран, М., 2008 г. Патобиология ротавирусной диареи у телят, ее диагностика и контроль: обзор. Журнал иммунологии и иммунопатологии , 10, 1–13
Google Scholar
Чинсангарам, Дж., Шор, К. Э., Гутербок, В., Уивер, Л.Д. и Osburn, B.I., 1995. Распространенность ротавирусов группы А и группы В в фекалиях новорожденных молочных телят из Калифорнии. Сравнительная иммунология и микробиология , 18, 93–103
Э., Гутербок, В., Уивер, Л.Д. и Osburn, B.I., 1995. Распространенность ротавирусов группы А и группы В в фекалиях новорожденных молочных телят из Калифорнии. Сравнительная иммунология и микробиология , 18, 93–103
CAS Google Scholar
Ciarlet, M., Pina, C.I., Garcia, O. и Liprandi, F., 1997. Идентификация ротавирусов крупного рогатого скота в Венесуэле: антигенная и молекулярная характеристика штамма ротавируса крупного рогатого скота. Исследования в области вирусологии , 148, 289–297
PubMed КАС Google Scholar
Чиарлет, М., Кроуфорд, С.Э., Бароне, К., Бертолотти-Чиарлет, А., Рэмиг, Р.Ф., Эстес, М.К. и Conner, M.E., 1998. Субъединичная ротавирусная вакцина, введенная парентерально кроликам, индуцирует активный защитный иммунитет. Journal of Virology , 72, 9233–9246
PubMed КАС Google Scholar
Чиарлет, М. , Ia, P., Conner, M.E. и Liprandi, F., 2001. Антигенный и молекулярный анализы показывают, что штамм ротавируса лошадей H-1 тесно связан со свиными, но не с лошадиными ротавирусами: межвидовая передача от свиней к лошадям? Вирусные гены , 22, 5–20
, Ia, P., Conner, M.E. и Liprandi, F., 2001. Антигенный и молекулярный анализы показывают, что штамм ротавируса лошадей H-1 тесно связан со свиными, но не с лошадиными ротавирусами: межвидовая передача от свиней к лошадям? Вирусные гены , 22, 5–20
PubMed КАС Google Scholar
Кук, Н., Бриджер, Дж., Кендалл, К., Гомара, М.И., Эль-Аттар, Л. и Грей, Дж., 2004. Зоонозный потенциал ротавируса. Journal of Infection , 48, 289–302
PubMed Google Scholar
Day, JM, Spackman, E. and Pantin-Jackwood, M., 2007. Мультиплексный тест RT-PCR для дифференциальной идентификации астровируса индейки типа 1, астровируса индейки типа 2, астровируса курицы, вируса птичьего нефрита, и птичий ротавирус. Болезни птиц , 51, 681–684
PubMed Google Scholar
Де Грация, С., Мартелла В., Джамманко Г. М., Гомара М. И., Рамирес С., Касио А., Коломба К. и Ариста С., 2007 г. Штамм ротавируса G3P[3] собачьего происхождения у ребенка с острым гастроэнтеритом . Emerging Infectious Diseases , 13, 1091–1093
М., Гомара М. И., Рамирес С., Касио А., Коломба К. и Ариста С., 2007 г. Штамм ротавируса G3P[3] собачьего происхождения у ребенка с острым гастроэнтеритом . Emerging Infectious Diseases , 13, 1091–1093
PubMed Google Scholar
Де Лиу, П.В., Элленс, Д.Дж., Стравер, П.Дж., Балкен, Дж.А.М., Меерман, А. и Баанвингер, Т., 1980. Ротавирусные инфекции у телят в молочных стадах. Исследования в области ветеринарии , 29, 135–141
PubMed Google Scholar
де Вердье Клингенберг, К.и Svensson, L., 1998. Ротавирус группы А как причина неонатального энтерита телят в Швеции. Acta Veterinaria Scandinavia , 39, 195–199
Google Scholar
Деннехи, М., Борн, В., Стил, Д. и Уильямсон, А.Л., 2007 г. Оценка рекомбинантной БЦЖ, экспрессирующей ротавирус VP6, в качестве антиротавирусной вакцины. Вакцина , 25, 3646–3657
Вакцина , 25, 3646–3657
PubMed КАС Google Scholar
Дессельбергер, У., Iturriza-Gomara, M. and Gray, J.J., 2001. Эпидемиология и эпиднадзор за ротавирусом. В: Чедвик Д., Гуд Дж. А. (ред.), Вирусы гастроэнтерита, Уайли, Нью-Йорк, США, 82–100.
Google Scholar
Дессельбергер У., Грей Дж. и Эстес М.К., 2005 г. Ротавирусы. В: B.W.J. Мэхи и В.Т. Meulen (eds), Topley and Wilson’s Microbiology and Microbial инфекция, ASM Press, USA, 946–958
Google Scholar
Дхама, К., Чаухан, Р.С., Катариа, Дж.М., Махендран, М. и Томар, С., 2005 г. Птичий грипп: текущие перспективы. Журнал иммунологии и иммунопатологии , 7, 1–33
Google Scholar
Дхама К., Махендран М., Гупта П.К. и Рай А., 2008 г. ДНК-вакцины и их применение в ветеринарной практике: современные перспективы. Ветеринарные исследовательские коммуникации 32 , 341–356
Ветеринарные исследовательские коммуникации 32 , 341–356
PubMed КАС Google Scholar
Дхаракул, Т., Rott, L. и Greenberg, H.B., 1990. Восстановление после хронической ротавирусной инфекции у мышей с тяжелым комбинированным иммунодефицитом: элиминация вируса, опосредованная адоптивным переносом иммунных CD8+T-лимфоцитов. Journal of Virology , 64, 4375–4382
PubMed КАС Google Scholar
Додет Б., Хезелтин Э., Мэри К. и Салиу П., 1997. Ротавирусы в медицине и ветеринарии. Sante , 7, 195–199
PubMed КАС Google Scholar
Дуань З., Ли, Д., Чжан, К., Лю, Н., Хуанг, К., Цзян, X., Цзян, Б., Гласс, Р., Стил, Д., Тан, Дж., Ван, З. и Fang, Z., 2007. Новый ротавирус человека генотипа G5P[6], обнаруженный в образце стула китайской девочки с диареей. Journal of Clinical Microbiology , 45, 1614–1617
Journal of Clinical Microbiology , 45, 1614–1617
PubMed КАС Google Scholar
Эллис, Г.Р. и Daniels, E., 1988. Сравнение прямой электронной микроскопии и иммуноферментного анализа для обнаружения ротавирусов у телят, ягнят, поросят и жеребят. Австралийский ветеринарный журнал , 65, 133–135
PubMed КАС Google Scholar
Эстес М.К., 2001. Ротавирусы и их репликация. В: Найп, Д.М., Хоули, П.М. (ред.), Вирусология Филда, Липпинкотт Уильямс и Уилкинс, Филадельфия, США, 1747–1785 гг.
Google Scholar
Эстес, М.К., 2003. Ротавирусный энтеротоксин NSP4: текущее состояние и проблемы, В: Дессельбергер, У., Грей, Дж. (ред.), Вирусный гастроэнтерит, Elsevier Science, Амстердам, Нидерланды, 207–224.
Google Scholar
Фернандес, Ф. М., Коннер, М.Е., Ходжинс, Д.К., Парвани, А.В., Нильсен, П.Р., Кроуфорд, С.Е., Эстес, М.К. и Saif, L.J., 1998. Пассивный иммунитет к ротавирусу крупного рогатого скота у новорожденных телят, получавших молозиво от коров, иммунизированных рекомбинантными вакцинами на основе ядерных частиц (CLP) или вирусоподобных частиц (VLP) против ротавируса SA11. Вакцина , 16, 507–516
М., Коннер, М.Е., Ходжинс, Д.К., Парвани, А.В., Нильсен, П.Р., Кроуфорд, С.Е., Эстес, М.К. и Saif, L.J., 1998. Пассивный иммунитет к ротавирусу крупного рогатого скота у новорожденных телят, получавших молозиво от коров, иммунизированных рекомбинантными вакцинами на основе ядерных частиц (CLP) или вирусоподобных частиц (VLP) против ротавируса SA11. Вакцина , 16, 507–516
PubMed КАС Google Scholar
Fukai, K., Sakai, T. and Kamata, H., 1998. Распространение серотипов G и генотипов P бычьего ротавируса группы А, выделенного в Японии. Австралийский ветеринарный журнал , 76, 418–422
PubMed КАС Google Scholar
Фукаи К., Маэда Ю., Фудзимото К., Ито Т. и Сакаи Т., 2002. Изменения в распространенности ротавирусов типов G и P у страдающих диареей телят из префектуры Кагосима в Японии. Ветеринарная микробиология , 86, 343–349
PubMed КАС Google Scholar
Фукаи, К. , Сайто, Т., Фукуда, О., Хагивара, А., Иноуэ, К. и Сато, М., 2006. Молекулярная характеристика лошадиного ротавируса группы А, Насуно, выделенного в префектуре Тотиги , Япония. Ветеринарный журнал , 172, 369–373
, Сайто, Т., Фукуда, О., Хагивара, А., Иноуэ, К. и Сато, М., 2006. Молекулярная характеристика лошадиного ротавируса группы А, Насуно, выделенного в префектуре Тотиги , Япония. Ветеринарный журнал , 172, 369–373
CAS Google Scholar
Фукаи К., Takahashi, T., Tajima, K., Koike, S., Iwane, K. и Inoue, K., 2007. Молекулярная характеристика нового бычьего ротавируса группы A. Ветеринарная микробиология , 123, 217–224
PubMed КАС Google Scholar
Фултон, Р.В., Джонсон, К.А., Пирсон, Дж. и Вуд, Г.Н., 1981. Выделение ротавируса у новорожденной собаки с диареей. Американский журнал ветеринарных исследований , 42, 841–843
PubMed КАС Google Scholar
Гарайкоэчеа, Л., Бок К., Джонс Л.Р., Комбесси Г., Одеон А., Фернандес Ф. и Паррено В., 2006 г. Молекулярная характеристика ротавируса крупного рогатого скота, циркулирующего в мясных и молочных стадах в Аргентине в течение 10 лет. период (1994–2003 гг.). Ветеринарная микробиология , 118, 1–11
период (1994–2003 гг.). Ветеринарная микробиология , 118, 1–11
PubMed КАС Google Scholar
Гарсия-Диас, А., Лопес-Андухар, П., Родригес Диас, Дж., Монтава, Р., Торрес Барсело, К., Рибес, Дж. М. и Буэса, Дж., 2004.Назальная иммунизация мышей ротавирусной ДНК-вакциной, которая индуцирует защитные кишечные антитела IgA. Вакцина , 23, 489–498
PubMed КАС Google Scholar
Гош С., Варгезе В., Самайдар С., Синха М., Кобаяши Н. и Наик Т.Н., 2007a. Молекулярная характеристика штаммов ротавируса крупного рогатого скота группы А G3P[3]. Архив вирусологии , 152, 1935–1940
PubMed КАС Google Scholar
Гош С., Варгезе В., Синха М., Кобаяши Н. и Найк Т.Н., 2007b. Доказательства передачи между штатами и увеличения распространенности штаммов ротавируса крупного рогатого скота группы B с новым генотипом VP7 среди страдающих диареей телят в восточных и северных штатах Индии. Эпидемиология инфекций , 135, 1324–1330
Эпидемиология инфекций , 135, 1324–1330
CAS Google Scholar
Гилл Х. и Прасад Дж., 2008 г. Пробиотики, иммуномодуляция и польза для здоровья. Достижения в области экспериментальной и медицинской биологии , 606, 423–454
Google Scholar
Грэм, К.L., Takada, Y. and Coulson, B.S., 2006. Белок шипа ротавируса VP5* связывает интегрин альфа-2-бета-1 на поверхности клеток и конкурирует с вирусом за связывание клеток и инфекционность. Journal of General Virology , 87, 1275–1283
PubMed КАС Google Scholar
Gueguen, C., Maga, A., McCrae, M.A. и Bataillon, G., 1996. Ротавирусы коз и крупного рогатого скота в западной Франции: групповая идентификация путем северной гибридизации. Ветеринарные исследования , 27, 171–176
PubMed КАС Google Scholar
Гулати Б. Р., Дипа Р., Сингх Б.К. и Rao, C.D., 2007. Разнообразие ротавирусов индийских лошадей: идентификация штаммов генотипа G10, P6[1] и G1 и нового штамма генотипа VP7 (G16) в образцах жеребят, страдающих диареей, в Индии. Journal of Clinical Microbiology , 45, 972–978
Р., Дипа Р., Сингх Б.К. и Rao, C.D., 2007. Разнообразие ротавирусов индийских лошадей: идентификация штаммов генотипа G10, P6[1] и G1 и нового штамма генотипа VP7 (G16) в образцах жеребят, страдающих диареей, в Индии. Journal of Clinical Microbiology , 45, 972–978
PubMed КАС Google Scholar
Гумусова С.O., Yazici, Z., Albayrak, H. и Meral, Y., 2007. Распространенность ротавируса и коронавируса у здоровых телят и телят с диареей. Медицина Ветеринария , 63, 62–64
Google Scholar
Холл Г.А., Парсонс К.Р., Рейнольдс Д.Дж. и Morgan, J.H., 1985. Обнаружение энтеропатогенных вирусов в залитых парафином тканях кишечника телят с помощью иммунопероксидазы. Журнал медицинской микробиологии , 19, 14
Google Scholar
Холл, Г.А., Бриджер, Дж.К., Парсон, К.Р. и Cook, R., 1993. Изменение вирулентности ротавируса: сравнение патогенеза у телят двух ротавирусов с разной вирулентностью. Ветеринарная патология , 30, 223–233
Ветеринарная патология , 30, 223–233
PubMed КАС Google Scholar
Hammami, S., Castro, AE и Osburn, BI, 1990. Сравнение электрофореза в полиакриламидном геле, иммуноферментного анализа и реакции агглютинации для прямой идентификации бычьего ротавируса из фекалий и коэлектрофореза вирусных РНК. Journal of Veterinary Diagnostic Investigation , 2, 184–190
PubMed КАС Google Scholar
Hasso, S.A. and Pandey, R., 1986. Возможные половые различия в восприимчивости телят к ротавирусной инфекции. Canadian Journal of Veterinary Research , 50, 287–288
PubMed КАС Google Scholar
Генрих Х.В., Ширмайер Х., Lange, E. и Granzow, H., 1983. Перекрестная инфекция ротавирусами разных видов. Архив экспериментальной ветеринарной медицины , 37, 55–60
CAS Google Scholar
Herrmann, J. E., 2006. ДНК-вакцины против кишечных инфекций. Вакцина , 24, 3705–3708
E., 2006. ДНК-вакцины против кишечных инфекций. Вакцина , 24, 3705–3708
PubMed КАС Google Scholar
Holland, R.E., 1990. Некоторые инфекционные причины диареи у молодых сельскохозяйственных животных. Клинические микробиологические обзоры , 3, 345–375
CAS Google Scholar
Хосино Ю., Болдуин К.А. и Scott, F.W., 1981. Выделение и характеристика кошачьего ротавируса. Journal of General Virology , 54, 313–323
PubMed КАС Google Scholar
Hoshino, Y., Wyatt, R.G., Scott, F.W. и Appel, M.J., 1982. Выделение и характеристика собачьего ротавируса. Архив вирусологии , 72, 113–125
PubMed КАС Google Scholar
Hoshino, Y., Wyatt, RG, Greenberg, HB, Kalica, AR, Flores, J. and Kapikian, AZ, 1983. Серологическое сравнение собачьего ротавируса с различными обезьяньими и человеческими ротавирусами путем уменьшения бляшек, нейтрализации и ингибирования гемагглютинации. тесты. Инфекция и иммунитет , 41, 169–173
Серологическое сравнение собачьего ротавируса с различными обезьяньими и человеческими ротавирусами путем уменьшения бляшек, нейтрализации и ингибирования гемагглютинации. тесты. Инфекция и иммунитет , 41, 169–173
PubMed КАС Google Scholar
Хуан Дж.А., Нагеша, Х.С., Снодграсс, Д.Р. и Holmes, I.H., 1992. Молекулярный и серологический анализ двух бычьих ротавирусов (B-11 и B-60), вызывающих диарею у телят в Австралии. Journal of Clinical Microbiology , 30, 85–92
PubMed КАС Google Scholar
Хусейн А.Х., Корналья Э., Сабер М.С. и el-Azhary, Y., 1995. Распространенность ротавирусов серотипов G6 и G10 группы A у молочных телят в Квебеке. Canadian Journal of Veterinary Research , 59, 235–237
PubMed КАС Google Scholar
Имагава Х., Исида С., Уэсуги С. , Масанобу К., Фукунага Ю. и Накагоми О., 1994. Генетический анализ ротавируса лошадей методом гибридизации РНК-РНК. Journal of Clinical Microbiology , 32, 2009–2012
, Масанобу К., Фукунага Ю. и Накагоми О., 1994. Генетический анализ ротавируса лошадей методом гибридизации РНК-РНК. Journal of Clinical Microbiology , 32, 2009–2012
PubMed КАС Google Scholar
Jackwood, P.M.J., Spackman, E., Day, J.M. and Rives, D., 2007. Периодический мониторинг коммерческих индеек на наличие кишечных вирусов указывает на постоянное присутствие астровируса и ротавируса на фермах. Болезни птиц , 51, 674–680
Google Scholar
Каминджоло, Дж.С. и Adesiyun, A.A., 1994. Ротавирусная инфекция у телят, поросят, ягнят и козлят в Тринидаде. Британский ветеринарный журнал , 150, 293–299
PubMed КАС Google Scholar
Кан, Б.К., Сонг, Д.С., Юнг, К.И., Ли, К.С., Пак, С.Дж., О, Дж.С., Ан, Д.Дж., Ян, Дж.С., Мун, Х.Дж., Ли, С.С., Юн, Ю.Д. и Парк, Б.К., 2007. Генетическая характеристика собачьего ротавируса, выделенного от щенка в Корее, и экспериментальное воспроизведение болезни. Journal of Veterinary Diagnostic Investigation , 19, 78–83
Генетическая характеристика собачьего ротавируса, выделенного от щенка в Корее, и экспериментальное воспроизведение болезни. Journal of Veterinary Diagnostic Investigation , 19, 78–83
PubMed Google Scholar
Кхамрин, П., Манекарн, Н., Пиракоме, С., Ягю, Ф., Окицу, С. и Усидзима, Х., 2006. Молекулярная характеристика редкого реассортантного штамма ротавируса человека G3P[3] выявила доказательства множественной межвидовой передачи от человека к животному. Journal of Medical Virology , 78, 986–994
PubMed КАС Google Scholar
Кхамрин П., Манекарн Н., Пиракоме С., Чан-ит В., Ягю Ф., Окицу С. и Ушиджима Х., 2007. Новый свиной ротавирус генотипа P[ 27] разделяет новую филогенетическую линию со штаммом ротавируса свиней G2. Вирусология , 361, 243–252
Google Scholar
Хараламбиев К. Х., Георгиев, Г.К. и Митов Б., 1983. Иммуноферментный анализ (ИФА) для выявления ротавируса. Ветеринарный бюллетень , 53, 5274
Х., Георгиев, Г.К. и Митов Б., 1983. Иммуноферментный анализ (ИФА) для выявления ротавируса. Ветеринарный бюллетень , 53, 5274
Google Scholar
Ким Ю., Нильсен П.Р., Ходжинс Д., Чанг К.О. и Саиф Л.Дж., 2002а. Реакции лактогенных антител у коров, вакцинированных рекомбинантными бычьими ротавирусоподобными частицами (ВПЧ) двух серотипов или инактивированными бычьими ротавирусными вакцинами. Вакцина , 20, 1248–1258
PubMed КАС Google Scholar
Ким Б., Бауэрсок Т., Грибель П., Кидане А., Бабюк Л.А., Санчес М., Аттах-Поку С., Каушик Р.С. и Мутвири, Г.К., 2002b. Иммунные ответы слизистых оболочек после пероральной иммунизации ротавирусными антигенами, инкапсулированными в альгинатные микросферы. Journal of Controlled Release , 85, 191–202
PubMed КАС Google Scholar
Kohara, J. and Tsunemitsu, H., 2000. Корреляция между материнскими сывороточными антителами и защитой от бычьей ротавирусной диареи у телят. Journal of Veterinary Medical Science , 62, 219–221
and Tsunemitsu, H., 2000. Корреляция между материнскими сывороточными антителами и защитой от бычьей ротавирусной диареи у телят. Journal of Veterinary Medical Science , 62, 219–221
PubMed КАС Google Scholar
Комото С., Сасаки Дж. и Танигучи К., 2006 г. Система обратной генетики для введения сайт-специфических мутаций в двухцепочечный РНК-геном инфекционного ротавируса. Proceedings of the National Academy of Science, USA , 103, 4646–4651
CAS Google Scholar
Ли, Дж.Б., Юн, С.Дж., Накагоми, Т., Пак, С.Ю., Ким, Т.Дж., Сонг, К.С., Джанг, Х.К., Ким, Б.С. и Nakagomi, O., 2003. Выделение, серологическая и молекулярная характеристика первого ротавируса коз G3. Архив вирусологии , 148, 643–657
PubMed КАС Google Scholar
Легротталье Р., Вольпе А., Рицци В. и Агрими П. , 1993. Выделение и идентификация ротавирусов как этиологических агентов неонатальной диареи у детей.Электрофоретическая характеристика с помощью PAGE. Новая микробиология , 16, 227–235
, 1993. Выделение и идентификация ротавирусов как этиологических агентов неонатальной диареи у детей.Электрофоретическая характеристика с помощью PAGE. Новая микробиология , 16, 227–235
CAS Google Scholar
Луан, Дж. Дж., Ян, С. Х., Чжан, В. Дж., Гао, Ю. Д., Чжун, Дж. Ф. и Чжао, Х. К., 2006. Быстрое обнаружение ротавируса крупного рогатого скота с помощью полугнездового анализа ОТ-ПЦР. Китайский журнал зоонозов , 22, 671–673
CAS Google Scholar
Лугинбуль, А., Reitt, K., Metzler, A., Kollbrunner, M., Corboz, L. and Deplazes, P., 2005. Полевое исследование распространенности и диагностики агентов, вызывающих диарею, у новорожденных телят в швейцарской ветеринарной клинике. . Schweiz Arch Tierheilkd , 147, 245–252
PubMed КАС Google Scholar
Малик, С.В.С., Кумар, А. и Бхилегаонкар, К.Н., 1995. Ротавирус – новый энтеропатоген человека и животных: обзор. Journal of Communicable Diseases , 27, 199–207
и Бхилегаонкар, К.Н., 1995. Ротавирус – новый энтеропатоген человека и животных: обзор. Journal of Communicable Diseases , 27, 199–207
PubMed КАС Google Scholar
Малик С.В.С., Барбудде С.Б., Равул Д.Б., Вайдья В.М. и Sahare, A.M., 2005. Информационный бюллетень по ротавирусам (Глобальный статус ротавирусных инфекций у человека и животных), В: Справочник по здоровью животных и производству, CAB International, Уоллингфорд, Великобритания.
Мартелла, В., Прателли, А., Греко, Г., Джентиле, М., Фьоренте, П., Темпеста, М. и Буонаволья, К., 2001a. Вариация нуклеотидной последовательности гена VP7 двух ротавирусов типа G3, выделенных от собак. Вирусные исследования , 74, 17–25
PubMed КАС Google Scholar
Мартелла В., Прателли А., Элиа Г., Декаро Н., 2001b. Tempesta M., Buonavoglia C., Выделение и генетическая характеристика двух штаммов ротавируса собак G3P5A [3] в Италии. Journal of Virological Methods , 96, 43–49
Journal of Virological Methods , 96, 43–49
PubMed КАС Google Scholar
Мартелла В., Баньяи К., Лоруссо Э., Беллачикко А.Л., Декаро Н., Камеро М., Боццо Г., Мошиду П., Ариста С., Пеццотти, Г., Лавацца А. и Буонаволья К., 2007а.Распространенность ротавирусов группы С у поросят-отъемышей и поросят после отъема с энтеритом. Ветеринарная микробиология , 123, 26–33
PubMed Google Scholar
Мартелла В., Чиарлет М., Баньяи К., Лоруссо Э., Ариста С., Лавацца А., Пеццотти Г., Декаро Н., Кавалли А. и Лусенте , МС, 2007б. Идентификация штаммов ротавируса свиней группы А, несущих новый генотип VP4 (P) в итальянских стадах свиней. Journal of Clinical Microbiology , 45, 577–580
PubMed КАС Google Scholar
Маскареньяс, Дж.Д., Лейте, Дж.П., Лима, Дж.К., Хайнеманн, М.Б. , Оливейра, Д.С., Араужо, И.Т., Соарес, Л.С., Гусмао, Р.Х., Габбай, Ю.Б. и Linhares, A.C., 2007. Обнаружение неонатального штамма ротавируса человека с генами VP4 и NSP4 свиного происхождения. Journal of Medical Microbiology , 56, 524–532
, Оливейра, Д.С., Араужо, И.Т., Соарес, Л.С., Гусмао, Р.Х., Габбай, Ю.Б. и Linhares, A.C., 2007. Обнаружение неонатального штамма ротавируса человека с генами VP4 и NSP4 свиного происхождения. Journal of Medical Microbiology , 56, 524–532
PubMed КАС Google Scholar
McNulty, M.S., 2003. Ротавирусные инфекции, в: Saif Y.M., Barnes HJ, Glisson J.R., Fadly A.M., Макдугалд Л.Р., Суэйн Д.Е., (ред.), Болезни домашней птицы, издательство штата Айова, Эймс, США, 308–317.
Google Scholar
McNulty, M.S., Allan, G.M., Thompson, D.J., O’Boyle, J.D., 1978. Антитела к ротавирусу у собак и кошек. Ветеринарная запись , 102, 534–535
PubMed КАС Google Scholar
Мебус, Калифорния, Андердал, Н.Р., Родос, М.B. и Twiehaus, M.J., 1969. Диарея (понос) у телят, воспроизведенная вирусом из полевой вспышки. Бюллетень сельскохозяйственных исследований Университета Небраски , 233, 1–16
Бюллетень сельскохозяйственных исследований Университета Небраски , 233, 1–16
Google Scholar
Мебус, Калифорния, Коно, М., Андердал, Н.Р. и Твихаус, М.Дж., 1971а. Размножение клеточной культуры вируса диареи новорожденных телят (Scour). Канадский ветеринарный журнал , 12, 69–72
CAS Google Scholar
Мебус, К.А., Стейр, Э.Л., Андердал, Н.Р. и Twiehaus, M.J., 1971b. Патология диареи новорожденных телят, индуцированной реоподобным вирусом. Ветеринарная патология , 8, 490–505
Google Scholar
Мебус, Калифорния, Вятт, Р.Г. и Капикян А.З., 1977. Поражения кишечника, вызванные у гнотобиотических телят вирусом детского гастроэнтерита человека. Ветеринарная патология , 14, 273–282
PubMed КАС Статья Google Scholar
Мендес В. М., Де Бир, М.К., Гузен, Г.Х. и Steele, A.D., 1994. Выделение и предварительная характеристика ротавируса коз. Onderstepoort Journal of Veterinary Research , 61, 291–294
М., Де Бир, М.К., Гузен, Г.Х. и Steele, A.D., 1994. Выделение и предварительная характеристика ротавируса коз. Onderstepoort Journal of Veterinary Research , 61, 291–294
PubMed КАС Google Scholar
Mochizuki, M., Nakagomi, T. и Nakagomi, O., 1997. Выделение от диарейных и бессимптомных котят трех штаммов ротавируса, принадлежащих к геногруппе AU-1 ротавирусов человека. Journal of Clinical Microbiology , 35, 1272–1275
PubMed КАС Google Scholar
Мори Ю., Sugiyama, M., Takayama, M., Atoji, Y., Masegi, T., Minamoto, N., 2001. Передача птичьего ротавируса от птицы к млекопитающему: анализ его патогенности на гетерологичной мышиной модели. Вирусология , 288, 63–70
PubMed КАС Google Scholar
Muller, H. and Johne, R., 2007. Ротавирусы: разнообразие и зоонозный потенциал — краткий обзор. Berlin Munch Tierarztl Wochenschr , 120, 108–112
Berlin Munch Tierarztl Wochenschr , 120, 108–112
Google Scholar
Муниаппа, Л., Георгиев, Г.К. и Хараламбиев К., 1987. Ротавирусный энтерит буйволов. Ветеринария Науки , 24, 10–14
Google Scholar
Муньос М., Ланца И., Альварес М. и Карменес П., 1995a. Распространенность нейтрализующих антител к 9 штаммам ротавируса, представляющим 7 G-серотипов, в сыворотке крови овец. Ветеринарная микробиология , 45, 351–361
PubMed КАС Google Scholar
Муньос, М., Альварес М., Ланца И. и Карменес П., 1995b. Вспышка диареи, связанная с атипичными ротавирусами у козлят. Исследования в области ветеринарии , 59, 180–182
PubMed КАС Google Scholar
Мураками Т., Хирано Н., Инке А., Титосэ К., Цушия К., Оно К. , Найто Ю., Янгихара Т., 1986. Защитные эффекты перорального вводили иммуноглобулины против экспериментальной диареи телят. Японский журнал ветеринарии , 48, 237–245
, Найто Ю., Янгихара Т., 1986. Защитные эффекты перорального вводили иммуноглобулины против экспериментальной диареи телят. Японский журнал ветеринарии , 48, 237–245
PubMed КАС Google Scholar
Мерфи, Ф.А., Гиббс, Э.П.Дж., Хорзинек, М.С. и Studdert, MJ, 1999. Reoviridae. В: Ф.А. Мерфи, Э.П.Дж. Гиббс, М.К. Horzinek and M.J. Studdert (eds), Veterinary Virology, Academic Press, USA, 391–404
Google Scholar
Майерс Т.Дж. и Schat, K.A., 1990. Активность интраэпителиальных лейкоцитов цыпленка естественными клетками-киллерами против инфицированных ротавирусом клеток-мишеней. Ветеринарная иммунология и иммунопатология , 26, 157–170
PubMed КАС Google Scholar
Накагоми О.и Nakagomi, T., 1991. Генетическое разнообразие и сходство ротавирусов млекопитающих в отношении межвидовой передачи ротавируса. Архив вирусологии , 120, 43–55
Архив вирусологии , 120, 43–55
PubMed КАС Google Scholar
Накагоми Т., Мацуда Ю., Ошима А., Мочизуки М. и Накагоми О., 1989. Характеристика штамма ротавируса собак с помощью анализов нейтрализации и молекулярной гибридизации. Архив вирусологии , 106, 145–150
PubMed КАС Google Scholar
Накагоми О., Ohshima, A., Aboudy, Y., Shif, I., Mochizuki, M., Nakagomi, T. and Gotlieb-Stematsky, T., 1990. Молекулярная идентификация путем РНК-РНК-гибридизации ротавируса человека, который является близкородственным к ротавирусам кошачьего и собачьего происхождения. Journal of Clinical Microbiology , 28, 1198–1203
PubMed КАС Google Scholar
Незервуд, Т., Вуд, Дж.Л., Таунсенд, Х.Г., Мамфорд, Дж.А. и Chanter, N., 1996. Диарея жеребят между 1991 и 1994 годами в Соединенном Королевстве, связанная с Clostridium perfringens , ротавирусом, Strongyloides westeri и Cryptosporidium spp. . Эпидемиология инфекций , 117, 375–383
. Эпидемиология инфекций , 117, 375–383
CAS Google Scholar
Отто П., Либлер-Тенорио Э.М., Эльшнер М., Ритц Дж., Лорен У. и Диллер Р., 2006 г. Выявление ротавирусов и поражений кишечника у цыплят-бройлеров из стад с насморком и синдром задержки роста (RSS). Болезни птиц , 50, 411–418
PubMed Google Scholar
Паломбо, Э.A., 2002. Генетический анализ ротавирусов группы А: доказательства межвидовой передачи генов ротавирусов. Вирусные гены , 24, 11–20
PubMed КАС Google Scholar
Пак, С.Х., Саиф, Л.Дж., Чон, К., Лим, Г.К., Пак, С.И., Ким, Х.Х., Пак, С.Дж., Ким, Ю.Дж., Чон, Дж.Х., Канг, М.И. и Чо, К.О., 2006. Молекулярная характеристика новых штаммов ротавируса крупного рогатого скота G5. Journal of Clinical Microbiology , 44, 4101–4112
PubMed КАС Google Scholar
Парра, Г. И., Видалес Г., Гомес Х.А., Фернандес Ф.М., Паррено В. и Бок К., 2008 г. Филогенетический анализ ротавируса свиней в Аргентине: увеличение разнообразия штаммов G4 и свидетельства межвидовой передачи. Ветеринарная микробиология , 126, 243–250
И., Видалес Г., Гомес Х.А., Фернандес Ф.М., Паррено В. и Бок К., 2008 г. Филогенетический анализ ротавируса свиней в Аргентине: увеличение разнообразия штаммов G4 и свидетельства межвидовой передачи. Ветеринарная микробиология , 126, 243–250
PubMed КАС Google Scholar
Пол, П.С. и Лиоо Ю.С., 1993. Иммуногены ротавирусов. Ветеринарная микробиология , 37, 299–317
PubMed КАС Google Scholar
Пизанелли, Г., Martella, V., Pagnini, U., DeMartino, L., Lorusso, E., Iovane, G. and Buonavoglia, C., 2005. Распределение генотипов G (VP7) и P (VP4) в ротавирусах группы А буйволов изолированы в Южной Италии. Ветеринарная микробиология , 110, 1–6
PubMed КАС Google Scholar
Рамани С. и Канг П., 2007 г. Бремя болезней и молекулярная эпидемиология ротавирусных инфекций группы А в Индии. Индийский журнал медицинских исследований , 125, 619–632
Индийский журнал медицинских исследований , 125, 619–632
PubMed КАС Google Scholar
Рэмиг, Р.Ф., 2004. Патогенез кишечной и системной ротавирусной инфекции. Journal of Virology , 78, 10213–10220
PubMed КАС Google Scholar
Rao, C.D., Gowda, K. and Reddy, B.S., 2000. Анализ последовательности генов VP4 и VP7 нетипируемых штаммов идентифицировал новую пару белков внешнего капсида, представляющих новые генотипы P и G в бычьих ротавирусах. Вирусология , 276, 104–113
PubMed КАС Google Scholar
Рати, Р., Кадиан С.К., Хурана Б., Гровер Ю.П. и Gulati, B.R., 2007. Оценка иммунного ответа на ротавирус крупного рогатого скота после перорального и внутрибрюшинного введения мышам. Индийский журнал экспериментальной биологии , 45, 212–216
PubMed Google Scholar
Рединг П. С., Холмсков У. и Андерс Э.М., 1998. Противовирусная активность бычьих коллектинов против ротавирусов. Journal of General Virology , 79, 2255–2263
С., Холмсков У. и Андерс Э.М., 1998. Противовирусная активность бычьих коллектинов против ротавирусов. Journal of General Virology , 79, 2255–2263
PubMed КАС Google Scholar
Рейди, Н., Леннон Г., Фаннинг С., Пауэр Э. и О’Ши Х., 2006 г. Молекулярная характеристика и анализ штаммов ротавируса крупного рогатого скота, циркулировавших в Ирландии в 2002–2004 гг. Ветеринарная микробиология , 117, 242–247
PubMed КАС Google Scholar
Rohwedder, A., Schutz, KI, Minamoto, N. and Brussow, H., 1995. Анализ последовательности ротавируса голубя, индейки и курицы VP8* идентифицирует ротавирус 993/83, выделенный из фекалий телят, как ротавирус голубей. Вирусология , 210, 231–235
PubMed КАС Google Scholar
Саиф Л.Дж. и Фернандес Ф.М., 1996. Ветеринарные вакцины против ротавируса группы А. Journal of Infectious Diseases , 174, 98–106
Journal of Infectious Diseases , 174, 98–106
Google Scholar
Сато К., Инака Ю., Шинозаки Т. и Матумото М., 1981. Нейтрализующие антитела к бычьему ротавирусу у различных видов животных. Ветеринарная микробиология , 6, 259–261
Google Scholar
Schlafer, D.H. и Scott, F.W., 1979. Распространенность нейтрализующих антител к ротавирусу телят у крупного рогатого скота в Нью-Йорке. Cornell Veterinarian , 69, 262–271
PubMed КАС Google Scholar
Schroeder, B.A., Street, J.E., Kalmakoff, J. and Bellamy, A.R., 1982. Отношения последовательности между сегментами генома штаммов ротавируса человека и животных. Journal of Virology , 43, 379–385
PubMed КАС Google Scholar
Schwers, A., Hoyois, P., Chappuis, G. , Dagenais, L. and Pastoret, P.P., 1982. Распространение бычьего ротавируса кошками и собаками. Annals Research in Veterinary Science , 13, 303–308
, Dagenais, L. and Pastoret, P.P., 1982. Распространение бычьего ротавируса кошками и собаками. Annals Research in Veterinary Science , 13, 303–308
CAS Google Scholar
Селим С.А., Азиз К.М., Саркер А.Дж. и Рахман, Х., 1991. Ротавирусная инфекция телят в Бангладеш. Сообщения о ветеринарных исследованиях , 15, 327–333
PubMed КАС Google Scholar
Шауки С.А., Саиф Ю.М. и Swayne, D.E., 1993. Роль циркулирующего материнского антиротавирусного IgG в защите поверхности слизистой оболочки кишечника у индюшат. Болезни птиц , 37, 1041–1050
PubMed КАС Google Scholar
Шен С., Burke B. и Desselberger U., 1994. Реаранжировка гена VP6 ротавируса группы А в сочетании с точковой мутацией, влияющей на стабильность тримера. Journal of Virology , 68, 1682–1688
PubMed КАС Google Scholar
Снодграсс, Д.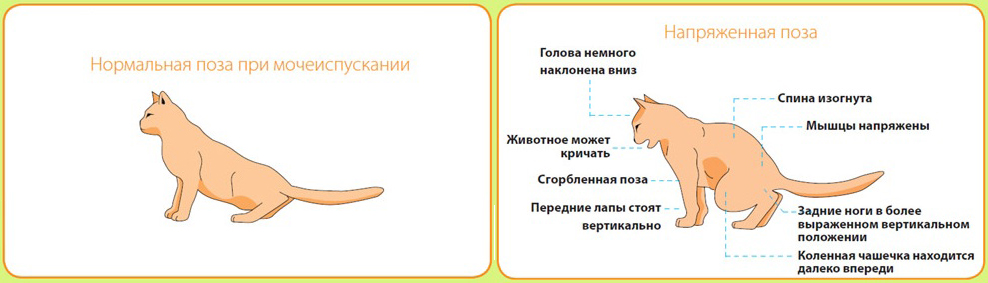 Р., Херринг, Дж.А., Кэмпбелл, И., Инглис, Дж.М., Харгривз, Ф.Д., 1984. Сравнение атипичного ротавируса у телят, поросят, ягнят и человека. Journal of General Virology , 65, 909–914
Р., Херринг, Дж.А., Кэмпбелл, И., Инглис, Дж.М., Харгривз, Ф.Д., 1984. Сравнение атипичного ротавируса у телят, поросят, ягнят и человека. Journal of General Virology , 65, 909–914
PubMed Google Scholar
Снодграсс, Д.Р., Фицджеральд Т., Кэмпбелл И., Скотт Ф.М., Браунинг Г.Ф., Миллер Д.Л., Херринг А.Дж. и Greenberg, H.B., 1990. Ротавирусы серотипов 6 и 10 преобладают у крупного рогатого скота. Journal of Clinical Microbiology , 28, 504–507
PubMed КАС Google Scholar
Сонг, Д.С., Канг, Б.К., О, Дж.С., Ха, Г.В., Ян, Дж.С., Мун, Х.Дж., Джанг, Ю.С. и Park, B.K., 2006. Мультиплексная ПЦР с обратной транскрипцией для быстрого дифференциального обнаружения вируса эпидемической диареи свиней, вируса трансмиссивного гастроэнтерита и ротавируса группы А свиней. Журнал ветеринарных диагностических исследований , 18, 278–281
Google Scholar
Стил А. Д., Гейер А. и Гердес Г.Х., 2004 г. Ротавирусные инфекции. В: Coetzer, J.A.W. и Тастин, Р.К. (ред.), Инфекционные болезни домашнего скота, Oxford University Press, Южная Африка, 1256–1264.
Д., Гейер А. и Гердес Г.Х., 2004 г. Ротавирусные инфекции. В: Coetzer, J.A.W. и Тастин, Р.К. (ред.), Инфекционные болезни домашнего скота, Oxford University Press, Южная Африка, 1256–1264.
Google Scholar
Штейер А., Полсак-Приятель М., Барлич-Маганя Д., Jamnikar, U., Mijovski, J.Z., Marin, J., 2007. Молекулярная характеристика нового генотипа ротавируса свиней P, обнаруженного у бессимптомной свиньи в Словении. Вирусология , 359, 275–282
PubMed КАС Google Scholar
Сугияма М., Гото К., Уэмукай Х., Мори Ю., Ито Н., Минамото Н., 2004 г. кислоты на поверхности клеток. Journal of Veterinary Medical Science , 66, 461–463
PubMed КАС Google Scholar
Сунил-Чандра, Н.П. и Mahalingam, S., 1994. Диарея, связанная с ротавирусом, у телят-буйволов в Шри-Ланке. Исследования в области ветеринарии , 56, 393–396
PubMed КАС Google Scholar
Svensson, L. , 2000. Диагностика пищевых вирусных инфекций у пациентов. International Journal of Food Microbiology , 59, 117–126
, 2000. Диагностика пищевых вирусных инфекций у пациентов. International Journal of Food Microbiology , 59, 117–126
PubMed КАС Google Scholar
Суэйн П. и Дхама К., 1999. Диарея у телят. Индийское сельское хозяйство , 48, 25–27
Google Scholar
Тан, Дж.А. и Schnagl, R., 1981. Инактивация ротавируса дезинфицирующими средствами. Медицинский журнал Австралии , 1, 19–32
PubMed КАС Google Scholar
Теодорофф Т.А., Цунэмицу Х., Окамото К., Кацуда К., Комото М., Кавасима К., Накагоми Т. и Накагоми О., 2005 г. Преобладание свиного ротавируса G9 у японских поросят с диареей : близкое родство их генов VP7 с генами недавних штаммов G9 человека. Journal of Clinical Microbiology , 43, 1377–1378
PubMed КАС Google Scholar
Терретт Л. А., Саиф Л.Дж., Тейл К.В. и Kohler, E.M., 1987. Физико-химическая характеристика свиного параротавируса и обнаружение вируса и вирусных антител с помощью иммунофлуоресценции клеточной культуры. Journal of Clinical Microbiology , 25, 268–272
А., Саиф Л.Дж., Тейл К.В. и Kohler, E.M., 1987. Физико-химическая характеристика свиного параротавируса и обнаружение вируса и вирусных антител с помощью иммунофлуоресценции клеточной культуры. Journal of Clinical Microbiology , 25, 268–272
PubMed КАС Google Scholar
Тейл, К.В., Лэнс, С.Э. и McCloskey, C.M., 1996. Ротавирусы, связанные с диареей новорожденных ягнят в двух операциях по откорму ягнят в Вайоминге. Journal of Veterinary Diagnostic Investigation , 8, 245–248
PubMed КАС Google Scholar
Цунэмицу, Х., Имагава Х., Того М., Сёдзи Т., Кавасима К., Хорино Р., Имаи К., Нисимори Т., Такаги М. и Хигучи Т., 2001. Преобладание Ротавирусы группы А лошадей G3B и G14 одного серотипа VP4 в Японии. Архив вирусологии , 146, 1949–1962
PubMed КАС Google Scholar
Ципори С. , Шервуд Д., Ангус К.В., Кэмпбелл И. и Гордон М., 1981. Диарея у ягнят: экспериментальные инфекции энтеротоксигенной кишечной палочкой, ротавирусом и Cryptosporidium sp. Инфекция и иммунитет , 33, 401–406
, Шервуд Д., Ангус К.В., Кэмпбелл И. и Гордон М., 1981. Диарея у ягнят: экспериментальные инфекции энтеротоксигенной кишечной палочкой, ротавирусом и Cryptosporidium sp. Инфекция и иммунитет , 33, 401–406
PubMed КАС Google Scholar
Ципори, С., 1985. Относительная важность кишечных патогенов, поражающих новорожденных домашних животных. Достижения в области ветеринарии и сравнительной медицины , 29, 103–193
PubMed КАС Google Scholar
Ван Пинкстерен, Л.А., Брюс, М.Г., Кэмпбелл, И., Вуд, А., Кларк, С.Дж., Беллман, А., Морейн, Б. и Снодграсс, Д.Р., 1999. Влияние оральных ротавирусных/Iscom вакцин на иммунный ответ у гнотобиотических ягнят. Ветеринарная иммунология и иммунопатология , 71, 53–67
PubMed Google Scholar
Варгезе В., Гош С., Дас С., Бхаттачарья С. К., Кришнан Т., Кармакар П., Кобаяши Н. и Наик Т.Н., 2006. Характеристика VP1, VP2 и Сегменты гена VP3 ротавируса человека тесно связаны со штаммами свиней. Вирусные гены , 32, 241–247
К., Кришнан Т., Кармакар П., Кобаяши Н. и Наик Т.Н., 2006. Характеристика VP1, VP2 и Сегменты гена VP3 ротавируса человека тесно связаны со штаммами свиней. Вирусные гены , 32, 241–247
PubMed КАС Google Scholar
Варшней Б., Джаганнатх М.Р., Ветанаягам Р.Р., Кодхандхараман С., Джаганнатх Х.В., Гауда К., Сингх Д.К. и Rao, C.D., 2002. Распространенность и антигенная изменчивость ротавирусов серотипа G10 и обнаружение штаммов серотипа G3 у телят, страдающих диареей: значение для происхождения реассортантных бессимптомных штаммов типа G10P11 или P11 у новорожденных детей в Индии. Архив вирусологии , 147, 143–165
Google Scholar
Vende, P., Karoum, R., Manet, G., Rizet, C., Schelcher, F., Cohen, J. and Navetat, H., 1999. Молекулярная эпидемиология или ротавирусы крупного рогатого скота в районе Шароле . Ветеринарные исследования , 30, 451–456
PubMed КАС Google Scholar
Вильярреал, Л. Ю.Б., Ульяна, Г., Валенсуэла, К., Chacon, J.L.V., Saidenberg, A.B.S., Sanches, A.A., Brandao, P.E., Jerez, J.A. и Ferreira, A.J.P., 2006. Обнаружение и выделение ротавируса у цыплят с симптомами или без них. Revue Brasilia Ciencia Avicola , 8, 187–191
Ю.Б., Ульяна, Г., Валенсуэла, К., Chacon, J.L.V., Saidenberg, A.B.S., Sanches, A.A., Brandao, P.E., Jerez, J.A. и Ferreira, A.J.P., 2006. Обнаружение и выделение ротавируса у цыплят с симптомами или без них. Revue Brasilia Ciencia Avicola , 8, 187–191
Google Scholar
Вани, С.А., Бхат, М.А., Исхак, С.М., Ашрафи, М.А., Буч, А.С. и Haq, M., 2003. Обнаружение ротавируса группы А, подобного млекопитающим, у кур, страдающих диареей. Ветеринарная микробиология , 94, 13–18
PubMed КАС Google Scholar
Вани С.А., Бхат, М.А., Научу, Р., Мунши, З.Х. и Бах, А.С., 2004. Доказательства ротавирусной инфекции, связанной с диареей у новорожденных ягнят в Индии. Здоровье и производство тропических животных , 36, 27–32
PubMed КАС Google Scholar
Ватанабэ Т., Охта К., Ширахата Т. , Гото Х., Цунода Н., Тагами М. и Акита Х., 1993. Профилактическое введение колостральных иммуноглобулинов крупного рогатого скота при диарее жеребят с ротавирусом. Journal of Veterinary Medical Science , 55, 1039–1040
, Гото Х., Цунода Н., Тагами М. и Акита Х., 1993. Профилактическое введение колостральных иммуноглобулинов крупного рогатого скота при диарее жеребят с ротавирусом. Journal of Veterinary Medical Science , 55, 1039–1040
PubMed КАС Google Scholar
Вигдоровиц, А., Мозговой, М., Сантос, MJD, Паррено, В., Гомес, К., Перес-Фильгейра, Д.М., Троно, К.Г., Риос, Р.Д., Франзоне, П.М., Фернандес, Ф. , Carillo, C., Babiuk, LA, Escribano, JM и Borac, MV, 2004. Защитный лактогенный иммунитет, придаваемый пищевой пептидной вакциной против бычьего ротавируса, продуцируемого в трансгенных растениях. Journal of General Virology , 85, 1825–1832
PubMed КАС Google Scholar
Woode, G.N., 1976. Вирусная диарея у телят. Ветеринарный ежегодник , 16, 30–34
Google Scholar
Вуд, Г.Н. and Bridger, J.C., 1975. Вирусный энтерит телят. Veterinary Record , 96, 85–88
and Bridger, J.C., 1975. Вирусный энтерит телят. Veterinary Record , 96, 85–88
PubMed КАС Google Scholar
Вуд, Г.N. и Crouch, C.F., 1978. Природные и экспериментально индуцированные ротавирусные инфекции домашних и лабораторных животных. Журнал Американской ветеринарной медицинской ассоциации , 173, 522–526
CAS Google Scholar
Вуд, Г. Н., Бью, М. Е. и Деннис, М. Дж., 1978. Исследования перекрестной защиты, индуцированной у телят ротавирусами телят, детей и жеребят. Veterinary Record , 103, 32–34
PubMed КАС Google Scholar
Ясон, К.В. и Шат К.А., 1985. Выделение и характеристика птичьих ротавирусов. Болезни птиц , 29, 499–508
PubMed КАС Google Scholar
Ясон, К.В. и Шат К. А., 1987. Патогенез ротавирусной инфекции в различных возрастных группах кур и индеек: клиника и вирусология. Американский журнал ветеринарных исследований , 48, 977–983
А., 1987. Патогенез ротавирусной инфекции в различных возрастных группах кур и индеек: клиника и вирусология. Американский журнал ветеринарных исследований , 48, 977–983
PubMed КАС Google Scholar
Йолкен Р.Х., Лосонский Г.А., Вондерфехт С., Лейстер Ф. и Ви С.Б., 1985. Антитела к ротавирусу человека в коровьем молоке. Медицинский журнал Новой Англии, 312, 605–610
PubMed КАС Google Scholar
Распространенность, коинфекция и сезонность фекальных энтеропатогенов от кошек с диареей в Республике Корея (2016–2019 гг.): ретроспективное исследование | BMC Veterinary Research
В этом исследовании мы оценили распространенность, клинические особенности и сезонность кошачьих энтеропатогенов в Республике Корея.Это первое крупномасштабное исследование по оценке клинических особенностей и распространенности 19 кошачьих энтеропатогенов с использованием ОТ-ПЦР в реальном времени в Республике Корея. У большинства кошек с диареей в нашем исследовании были диагностированы энтеропатогены: FECV, Clostridium perfringens , Campylobacter spp., E. coli и FPV, являющиеся наиболее распространенными патогенами, выделенными из стула страдающих диареей кошек. Эти данные аналогичны результатам предыдущих исследований [1, 3, 4, 11, 12], но несколько отличались от предыдущих исследований.Расхождения могут быть связаны с различными факторами, такими как различия в методологиях, регионах, среде обитания и сопутствующих заболеваниях, что влияет на виды и распространенность идентифицированных энтеропатогенов. Преобладали бактериальные инфекции, хотя наиболее частым энтеропатогеном в этом исследовании был FECV. Примечательно, что пик бактериальных инфекций пришелся на октябрь, вирусных инфекций — на ноябрь, а протозойных инфекций — на август. Распространенность вирусных и протозойных инфекций различалась в зависимости от возраста кошек.Когда были исследованы модели инфекций, соотношение для одиночных инфекций, смешанных инфекций и коинфекций составило 35,72, 9,87 и 54,41% соответственно.
У большинства кошек с диареей в нашем исследовании были диагностированы энтеропатогены: FECV, Clostridium perfringens , Campylobacter spp., E. coli и FPV, являющиеся наиболее распространенными патогенами, выделенными из стула страдающих диареей кошек. Эти данные аналогичны результатам предыдущих исследований [1, 3, 4, 11, 12], но несколько отличались от предыдущих исследований.Расхождения могут быть связаны с различными факторами, такими как различия в методологиях, регионах, среде обитания и сопутствующих заболеваниях, что влияет на виды и распространенность идентифицированных энтеропатогенов. Преобладали бактериальные инфекции, хотя наиболее частым энтеропатогеном в этом исследовании был FECV. Примечательно, что пик бактериальных инфекций пришелся на октябрь, вирусных инфекций — на ноябрь, а протозойных инфекций — на август. Распространенность вирусных и протозойных инфекций различалась в зависимости от возраста кошек.Когда были исследованы модели инфекций, соотношение для одиночных инфекций, смешанных инфекций и коинфекций составило 35,72, 9,87 и 54,41% соответственно. FECV был преобладающим среди одиночных инфекций, и наиболее распространенными моделями инфекции были комбинация Clostridium perfringens и C. coli при смешанных инфекциях и комбинация Clostridium perfringens и FECV при коинфекциях.
FECV был преобладающим среди одиночных инфекций, и наиболее распространенными моделями инфекции были комбинация Clostridium perfringens и C. coli при смешанных инфекциях и комбинация Clostridium perfringens и FECV при коинфекциях.
FECV часто выявляли в этом исследовании.Поскольку FECV является повсеместным и в основном субклиническим, это исследование могло также иметь высокую долю субклинических инфекций FECV [34]. Однако в нашем исследовании значение порогового цикла (C T ) использовалось для количественной оценки вирусной нагрузки, чтобы определить, была ли инфекция положительной. FECV показал самую высокую распространенность среди одиночных инфекций, а значение C T и вирусная нагрузка коррелировали в ПЦР в реальном времени [35]. Следовательно, FECV является основным патогеном, который следует учитывать при диагностике инфекционной кошачьей диареи.
Clostridium perfringens является преобладающим микроорганизмом в фекалиях большинства хищников [18, 36]. Поскольку Clostridium perfringens является нормальным обитателем кишечника кошек, не страдающих диареей [34], ПЦР-анализ Clostridium perfringens затруднителен при попытке определить, является ли этот микроорганизм возбудителем диареи. В этом исследовании был обнаружен α-токсин, экспрессируемый Clostridium perfringens . Энтеротоксины, а не сама Clostridium perfringens , могут вызывать энтерит, и наши выводы основаны на результатах ДНК-амплификации α-токсина [18].Предыдущие исследования показали, что α-токсин из Clostridium perfringens был обнаружен только в образцах фекалий от кошек с диареей, а не от бессимптомных кошек [12, 36]; однако сообщалось и об противоположных результатах [1]. Таким образом, необходимы дальнейшие исследования, чтобы определить, является ли Clostridium perfringens причиной диареи.
Поскольку Clostridium perfringens является нормальным обитателем кишечника кошек, не страдающих диареей [34], ПЦР-анализ Clostridium perfringens затруднителен при попытке определить, является ли этот микроорганизм возбудителем диареи. В этом исследовании был обнаружен α-токсин, экспрессируемый Clostridium perfringens . Энтеротоксины, а не сама Clostridium perfringens , могут вызывать энтерит, и наши выводы основаны на результатах ДНК-амплификации α-токсина [18].Предыдущие исследования показали, что α-токсин из Clostridium perfringens был обнаружен только в образцах фекалий от кошек с диареей, а не от бессимптомных кошек [12, 36]; однако сообщалось и об противоположных результатах [1]. Таким образом, необходимы дальнейшие исследования, чтобы определить, является ли Clostridium perfringens причиной диареи.
Campylobacter spp. является основной причиной инфекционной диареи у кошек [37, 38] и занимает третье место среди всех микроорганизмов в нашем исследовании.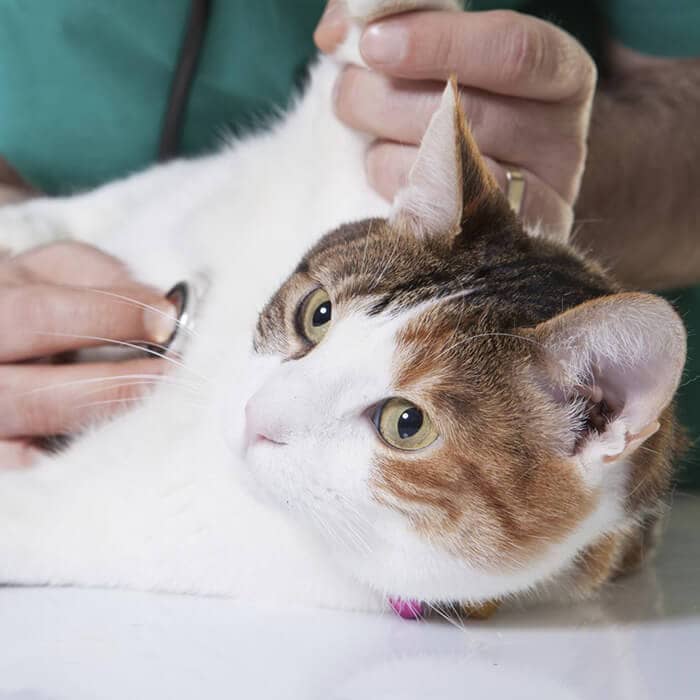 В предыдущих исследованиях Campylobacter spp. был обнаружен как у больных диареей, так и у здоровых кошек [39, 40], а распространенность Campylobacter spp. у кошек с диареей был выше, чем у клинически здоровых кошек [41]. Однако в некоторых исследованиях аналогичные показатели были обнаружены у здоровых кошек [39, 40, 42], что подтверждает возможность субклинической инфекции. В качестве альтернативы, эти расхождения могут быть связаны с различиями в методах тестирования, которые включают бактериальную культуру, иммуноферментный анализ и ПЦР. Campylobacter helveticus , Campylobacter upsaliensis и C. jejuni также часто обнаруживаются у кошек [39]. Поскольку C. coli и C. jejuni являются наиболее распространенными патогенами из-за их термофильных характеристик [20], мы оценили эти два патогена как панель ПЦР [38]. В отличие от предыдущих исследований на кошках, собаках и людях, в которых было обнаружено, что C. jejuni является преобладающей бактерией, наши результаты показали, что C.
В предыдущих исследованиях Campylobacter spp. был обнаружен как у больных диареей, так и у здоровых кошек [39, 40], а распространенность Campylobacter spp. у кошек с диареей был выше, чем у клинически здоровых кошек [41]. Однако в некоторых исследованиях аналогичные показатели были обнаружены у здоровых кошек [39, 40, 42], что подтверждает возможность субклинической инфекции. В качестве альтернативы, эти расхождения могут быть связаны с различиями в методах тестирования, которые включают бактериальную культуру, иммуноферментный анализ и ПЦР. Campylobacter helveticus , Campylobacter upsaliensis и C. jejuni также часто обнаруживаются у кошек [39]. Поскольку C. coli и C. jejuni являются наиболее распространенными патогенами из-за их термофильных характеристик [20], мы оценили эти два патогена как панель ПЦР [38]. В отличие от предыдущих исследований на кошках, собаках и людях, в которых было обнаружено, что C. jejuni является преобладающей бактерией, наши результаты показали, что C. jejuni встречался реже, чем C.coli [41, 43, 44]. Распространенность Campylobacter spp. может варьироваться в зависимости от вида, возраста, основного заболевания, времени года, региона и сопутствующей инфекции, что может объяснить более высокие показатели C. coli [20, 45]. Однако, поскольку результаты этого исследования отличались от результатов предыдущих исследований, необходимы дальнейшие исследования подвидов кампилобактериоза кошек.
jejuni встречался реже, чем C.coli [41, 43, 44]. Распространенность Campylobacter spp. может варьироваться в зависимости от вида, возраста, основного заболевания, времени года, региона и сопутствующей инфекции, что может объяснить более высокие показатели C. coli [20, 45]. Однако, поскольку результаты этого исследования отличались от результатов предыдущих исследований, необходимы дальнейшие исследования подвидов кампилобактериоза кошек.
E. coli является хорошо известным кишечным микроорганизмом, и его патогенность зависит от различных факторов вирулентности [18].Среди известных диареегенных E. coli у кошек наше исследование показало снижение распространенности в порядке EPEC > ETEC > EHEC > энтероинвазивные E. coli (EIEC). В совокупности распространенность E. coli была четвертой по распространенности. EPEC был наиболее распространенным подтипом среди E. coli в нашем исследовании, что согласуется с предыдущим отчетом [46]. Однако в нескольких исследованиях сообщалось об обнаружении ETEC, EHEC и EIEC в кале у кошек с диареей, и известно, что EPEC и EHEC также присутствуют у здоровых кошек.
Однако в нескольких исследованиях сообщалось об обнаружении ETEC, EHEC и EIEC в кале у кошек с диареей, и известно, что EPEC и EHEC также присутствуют у здоровых кошек.
FPV — патоген, включенный в основной график вакцинации кошек [47]. В этом исследовании мы не знали недавний вакцинальный статус зарегистрированных кошек; поэтому возможно, что ложноположительные результаты были получены у лиц, недавно получивших вакцины с модифицированным живым вирусом [18]. В нашем исследовании, поскольку распространенность FPV была выше в промежуточной и пожилой возрастной группе, чем в группе раннего возраста, вероятность субклинической инфекции из-за молодого возраста была низкой.
T. fetus и G. lamblia были наиболее распространенными протозойными инфекциями в этом исследовании, как и в предыдущих отчетах [48]. Инфекция T. fetus представляет собой возникающее желудочно-кишечное заболевание у кошек [49]. Хотя T. fetus не входит в состав микрофлоры, этот микроорганизм был обнаружен в образцах фекалий кошек с диареей или без нее [50]. Патогенез T. fetus -ассоциированной диареи у кошек до конца не известен [51]. На сегодняшний день у хронически инфицированных кошек сохраняется клиническая ремиссия; однако диарея рецидивирует из-за изменения питания или стресса [52].Хотя для G. lamblia характерна субклиническая инфекция, клинические симптомы также обычны из-за ее высокой инфекционности, особенно у котят и в питомниках. G. lamblia является потенциальным зоонозным простейшим, который поражает большинство млекопитающих и вызывает диарею [34]. Хотя часто встречаются субклинические инфекции, даже если результат теста на G. lamblia положительный, ветеринары должны уделять пристальное внимание гигиене при обращении с этими кошками.
Патогенез T. fetus -ассоциированной диареи у кошек до конца не известен [51]. На сегодняшний день у хронически инфицированных кошек сохраняется клиническая ремиссия; однако диарея рецидивирует из-за изменения питания или стресса [52].Хотя для G. lamblia характерна субклиническая инфекция, клинические симптомы также обычны из-за ее высокой инфекционности, особенно у котят и в питомниках. G. lamblia является потенциальным зоонозным простейшим, который поражает большинство млекопитающих и вызывает диарею [34]. Хотя часто встречаются субклинические инфекции, даже если результат теста на G. lamblia положительный, ветеринары должны уделять пристальное внимание гигиене при обращении с этими кошками.
В нашем исследовании вирус иммунодефицита кошек (FIV) был обнаружен только у одной кошки.Эта кошка была в промежуточной возрастной группе и была представлена как смешанная инфекция FECV. Не исключено, что кишечная микрофлора была инфицирована FIV. Взаимосвязь между FIV-инфекцией и различными другими энтеропатогенами еще не выяснена.
Сезонное распространение инфекции может варьироваться в зависимости от вида возбудителя. В нашем исследовании мы проанализировали сезонность 10 наиболее распространенных энтеропатогенов, а также сезонность инфекции по видовому типу: бактериальному, вирусному или протозойному.Бактериальные и вирусные инфекции показали значительные различия в распространенности в зависимости от месяца, в то время как протозойные инфекции не отличались. В ветеринарии лишь несколько исследований оценивали сезонность по типу инфекции [43, 53]. В нашем исследовании Clostridium perfringens , FPV, EPEC, ETEC и EHEC показали значительные различия в распространенности в зависимости от времени года. Инфекции FECV и Campylobacter spp., наиболее часто идентифицируемых патогенов в нашем исследовании, происходили равномерно в течение года без сезонности, как и в предыдущих исследованиях [43].Напротив, инфекция Campylobacter spp. чаще встречается летом и осенью у кошек [53]. Однако трудно сделать вывод о клинической значимости этих результатов. Мы показали только описательные данные каждого месяца. Поскольку подобных исследований в ветеринарии немного, сравнение с результатами нашего исследования затруднено. Во-вторых, поскольку это исследование проводилось локально, трудно представить инфекцию в других регионах. В-третьих, это результаты тестирования только одной диагностической лаборатории; следовательно, если мы объединим их с результатами анализов другой диагностической лаборатории, можно будет наблюдать другие модели инфицирования.В предыдущем исследовании на людях климат, биологические свойства патогенов и привычки питания людей могли влиять на сезонность инфекционной диареи [13]. Необходимы дополнительные долгосрочные крупномасштабные исследования сезонности инфекционной диареи кошек.
Мы показали только описательные данные каждого месяца. Поскольку подобных исследований в ветеринарии немного, сравнение с результатами нашего исследования затруднено. Во-вторых, поскольку это исследование проводилось локально, трудно представить инфекцию в других регионах. В-третьих, это результаты тестирования только одной диагностической лаборатории; следовательно, если мы объединим их с результатами анализов другой диагностической лаборатории, можно будет наблюдать другие модели инфицирования.В предыдущем исследовании на людях климат, биологические свойства патогенов и привычки питания людей могли влиять на сезонность инфекционной диареи [13]. Необходимы дополнительные долгосрочные крупномасштабные исследования сезонности инфекционной диареи кошек.
Некоторые возбудители чаще встречаются у кошек определенного возраста [37, 49, 54]. В нашем исследовании были выявлены различия в распространенности FECV, C. coli , T. fetus и EPEC в зависимости от возраста кошек. EIEC, FECV, C.coli и EPEC были более распространены в группе раннего возраста. У котят распространенность возбудителей выше, потому что у котят меньше образование антител, чем у взрослых кошек [18, 50]. Например, диарея, связанная с FECV, чаще всего встречается у молодых котят [18]. В нашем исследовании распространенность FECV (31,33%) была самой высокой у кошек в возрасте до 1 года. В других исследованиях сообщалось о более высоком уровне Campylobacter spp. показатели распространенности среди кошек в возрасте до 1 года [39, 41, 43]. Напротив, С.jejuni не выявил различий в распространенности в зависимости от возраста, тогда как C. coli отличался среди возрастных групп. EPEC также показал самую высокую распространенность в группе раннего возраста (7,53%), тогда как EIEC и ETEC показали самую высокую распространенность в старшей возрастной группе (1,25 и 5,42% соответственно). На сегодняшний день исследования взаимосвязи между распространенностью энтеропатогенов и возрастом кошек ограничены кошками с диареей, ассоциированной с E.
EIEC, FECV, C.coli и EPEC были более распространены в группе раннего возраста. У котят распространенность возбудителей выше, потому что у котят меньше образование антител, чем у взрослых кошек [18, 50]. Например, диарея, связанная с FECV, чаще всего встречается у молодых котят [18]. В нашем исследовании распространенность FECV (31,33%) была самой высокой у кошек в возрасте до 1 года. В других исследованиях сообщалось о более высоком уровне Campylobacter spp. показатели распространенности среди кошек в возрасте до 1 года [39, 41, 43]. Напротив, С.jejuni не выявил различий в распространенности в зависимости от возраста, тогда как C. coli отличался среди возрастных групп. EPEC также показал самую высокую распространенность в группе раннего возраста (7,53%), тогда как EIEC и ETEC показали самую высокую распространенность в старшей возрастной группе (1,25 и 5,42% соответственно). На сегодняшний день исследования взаимосвязи между распространенностью энтеропатогенов и возрастом кошек ограничены кошками с диареей, ассоциированной с E. coli . Однако в этом исследовании распространенность G.lamblia выше в группе раннего возраста (4,82%) и группе среднего возраста (4,83%), чем в группе старшего возраста (1,25%). G. lamblia и T. fetus имели значительно более высокие показатели распространенности у кошек в возрасте до 1 года, чем у кошек более старшего возраста [5]. Напротив, в нашем исследовании распространенность T. fetus не была связана с возрастом. Кроме того, доля Clostridium perfringens была значительно выше в старшей возрастной группе, аналогично предыдущему исследованию, демонстрирующему более высокие концентрации бактерий в фекалиях у кошек старше 9 лет [55].Однако, поскольку количество кошек в каждой возрастной группе не было сбалансированным, это могло повлиять на результаты данного исследования. Результаты следует интерпретировать с учетом этого момента. Необходимы дальнейшие исследования, чтобы убедиться, что количество кошек в каждой возрастной группе сбалансировано.
coli . Однако в этом исследовании распространенность G.lamblia выше в группе раннего возраста (4,82%) и группе среднего возраста (4,83%), чем в группе старшего возраста (1,25%). G. lamblia и T. fetus имели значительно более высокие показатели распространенности у кошек в возрасте до 1 года, чем у кошек более старшего возраста [5]. Напротив, в нашем исследовании распространенность T. fetus не была связана с возрастом. Кроме того, доля Clostridium perfringens была значительно выше в старшей возрастной группе, аналогично предыдущему исследованию, демонстрирующему более высокие концентрации бактерий в фекалиях у кошек старше 9 лет [55].Однако, поскольку количество кошек в каждой возрастной группе не было сбалансированным, это могло повлиять на результаты данного исследования. Результаты следует интерпретировать с учетом этого момента. Необходимы дальнейшие исследования, чтобы убедиться, что количество кошек в каждой возрастной группе сбалансировано.
Процент множественных инфекций в нашем исследовании составил 64,28%, что выше, чем в предыдущем исследовании (44%) [1]. Сопутствующая инфекция другими патогенами может усилить тяжесть симптомов у некоторых кошек из-за возможности совместного патогенеза и симбиотических взаимоотношений [5, 18], например.g., коинфекция FPV и Salmonella spp. [56]. Колебания кишечной микробиоты могут вызывать вторичные и третьи инфекции [57]. В этом исследовании комбинированная инфекция Clostridium perfringens плюс C. coli преобладала при смешанных инфекциях. Коинфекции также часто обнаруживались как Clostridium perfringens плюс FECV и C. coli плюс FECV. Хотя распространенность протозойных инфекций была ниже, чем у бактериальных и вирусных инфекций, такие инфекции играют важную роль в структуре инфекций.У кошек, положительных на T. fetus , усиление диареи связано с присутствием Cryptosporidium [58]. Giardia и Cryptosporidium также взаимозависимы [59]. Наши результаты аналогичны предыдущим результатам, демонстрирующим, что простейшие, связанные с коинфекцией, были в первую очередь Giardia и T. fetus [8, 57, 60,61,62].
Наши результаты аналогичны предыдущим результатам, демонстрирующим, что простейшие, связанные с коинфекцией, были в первую очередь Giardia и T. fetus [8, 57, 60,61,62].
Из 19 патогенов, исследованных в этом исследовании, все энтеропатогены обладали зоонозным потенциалом, кроме FECV, FPV, FIV и C.cayetanensis , а их общая распространенность составила 63,1%. Зоонозные энтеропатогены могут передаваться через фекалии животных и при прямом контакте с животным [63]. Таким образом, иммуносупрессия у владельцев или ветеринарного персонала может увеличить риск заражения; информация о зоонозном потенциале этих организмов должна быть предоставлена владельцам или ветеринарному персоналу. Новые зоонозные энтеропатогены, которые представляют проблему для человека, включают Salmonella spp., Campylobacter spp., C. coli, и C. jejuni, , причем последние два наиболее часто встречаются при острых желудочно-кишечных заболеваниях человека [21, 64]. Распространенность Salmonella spp. инфекция у кошек с диареей была очень низкой (0,25%) в этом исследовании, но сообщалось, что она достигает 6% в предыдущих исследованиях [1]. Хотя распространенность Salmonella spp. в этом исследовании был низким, в некоторых случаях была показана передача инфекции от кошек человеку [65, 66]. Точно так же сообщалось, что домашняя кошка также является источником передачи инфекции EHEC своему владельцу [67].Кроме того, поскольку это важный зоонозный патоген, тот факт, что Salmonella spp. и ЭГКП были выявлены даже в небольшом проценте кошачьих фекалий, что важно с точки зрения общественной гигиены; эту коинфекцию следует тщательно контролировать.
Это исследование имеет некоторые ограничения. Во-первых, было трудно сделать вывод, что патогены, обнаруженные в этом исследовании, были причиной кошачьей диареи. Некоторые патогены, обнаруженные в этом исследовании, обнаруживаются и у здоровых кошек [1, 4].В нашем исследовании не сравнивались результаты между кошками с диареей и бессимптомными кошками. Кроме того, поскольку это исследование проводилось с использованием только образцов стула и клинической информации от пациентов из различных ветеринарных клиник, неясно, была ли фактическая причина диареи первичной инфекцией. Во-вторых, невозможно было подтвердить, применялись ли антибиотики непосредственно перед тестом. Использование антибиотиков могло повлиять на результаты этого исследования. В-третьих, это исследование было проведено ретроспективно путем извлечения результатов теста, заказанного коммерческой лабораторией.Следовательно, методы сбора фекалий могли быть непоследовательными или не соблюдаться должным образом, что приводило к потенциальному перекрестному загрязнению. Однако, поскольку лаборатория заранее указала метод сбора, возможность перекрестного загрязнения была очень низкой. Наконец, в этом исследовании выявление энтеропатогенов осуществлялось только методом ПЦР в реальном времени. Этот метод обладает наибольшей чувствительностью среди лабораторных тестов, включая иммуноферментный анализ, посев бактерий и выделение вирусов.Однако он может привести к ложноположительным результатам из-за способности выявлять патогены у носителей [18, 68]. Невозможно определить, является ли конкретный организм причиной диареи, только на основе ПЦР в реальном времени. Чтобы свести к минимуму эту возможность, мы считали возбудителя диареи возбудителем только тогда, когда значение C T было меньше 40.
Crystal Boudreaux, Ph.D. | Школа остеопатической медицины Западной Вирджинии
Crystal Boudreaux, Ph.D.
Доцент кафедры микробиологии
Кафедра биомедицинских наук
Офис: A326
Телефон: 304.793.6822
Образование и обучение
Бакалавр биологических наук со специализацией в области химии, Государственный университет Николлса
Кандидат наук, вирусная иммунология, Университет штата Миссисипи
Постдокторская подготовка, молекулярная биология ротавируса, Технологический исследовательский институт Вирджинии Carilion
Исследовательский интерес
Лаборатория Будро интересуется клеточными факторами хозяина, которые играют роль в репликации ротавируса.Ротавирусы остаются основной причиной смерти детей от диареи во всем мире. В штате Западная Вирджиния кишечные заболевания являются вторым наиболее распространенным типом вспышек заболеваний. Недавний эпиднадзор показал, что в Западной Вирджинии была зарегистрирована половина среднего числа ротавирусных инфекций по Южному региону. Различные атрибуции из-за сельских населенных пунктов в штате могут привести к увеличению вспышек.
Вирусы разрушают клеточные факторы и сигнальные пути, чтобы управлять клеточной средой для эффективной репликации.Все вирусы не имеют одинакового подхода к разрушению клеточных факторов, однако большинство вирусов кодируют белки, которые перенаправляют рекрутирование клеточных белков. Ротавирусы представляют собой трехслойные, безоболочечные, сегментированные двухцепочечные РНК-вирусы с жизненным циклом, полностью происходящим в цитоплазме инфицированных клеток. Для идентификации клеточных белков-кандидатов, которые могут быть вовлечены в репликацию ротавируса, был проведен скрининг РНК-интерференции (РНКи) с использованием библиотеки коротких шпилечных РНК (кшРНК), кодируемых лентивирусами, с упором исключительно на клеточные киназы.Наша цель - выяснить механизмы, с помощью которых эти клеточные киназы способствуют развитию ротавирусной инфекции. Эта работа важна для разработки новых противовирусных препаратов.
Текущие члены лаборатории
Мишель Ваной-Уорнер, лаборант
Финансирование
Текущая поддержка исследований
- Западная Вирджиния IDeA Network of Biomedical Research Excellence (WV-INBRE) Награда за крупный исследовательский проект
P20GM103434
Название проекта: Роль промежуточных звеньев пути AMPK в патогенезе ротавируса
Роль: PI 01.01.20 – настоящее время 300 000 долларов.00 - Институт клинических переводов Западной Вирджинии (WVCTSI) Национальные институты здравоохранения (NIGMS)
5U54GM10492-04
Название проекта: Выяснение взаимодействующего белка серинтреонинкиназы 11 в качестве предиктора инфекции SARS-CoV-2 с использованием модели ротавируса
Роль: ИП 01.07.20-настоящее время 30 000,00 долларов США
Завершенная поддержка исследований
- Инновационные биомедицинские исследования в Западной Вирджинии 01.09.17-01.09.18 30 000,00 долларов США
(WVINBRE) Награда за развитие научных исследований факультета P20GM103434
Роль: PI
Награды и почести
- Премия президента WVSOM за выдающийся преподавательский состав (2020 г.)
- Премия VTCRI, занявшая второе место за лучшую презентацию после докторантуры (2016)
- Научный сотрудник ASM (2014)
- Премия Макклески SCB-ASM (2011)
- Выдающийся научный сотрудник года (2010)
- Премия Стравинского SCB-ASM (2007, 2009)
- Дональд Захариас, помощник преподавателя года (2008)
Публикации
Steger CL, Boudreaux CE, LaConte LE, Pease JB, McDonald SM.Полимераза VP1 ротавируса группы А и белки сердцевинной оболочки VP2: межгенотипическая изменчивость последовательности и функциональная совместимость in vitro. Дж. Вирол 2019. 93 (2). PMID: 30355692.
Steger CL, Boudreaux CE, Cohen C, McDonald SM. Места контакта белка коровой оболочки ротавируса на полимеразе, необходимые для надежного синтеза дцРНК in vitro. Дж Вирол 2019. 93 (20). PMID: 31341048
Чо М.Дж., Эллебрехт С.Т., Хаммерс С.М., Мукерджи Э.М., Саппарапу Г., Будро С.Е., Макдональд С.М., Кроу младший Дж.Э., Пейн А.С. 2016. Детерминанты перекрестной реактивности Vh2-46 на аутоантиген десмоглеина 3 обыкновенной пузырчатки и антиген ротавируса VP6. Журнал иммунологии . 197 (4): 1065-73.
Будро К.Э., Келли Д.Ф., Макдональд С.М. (2015). Электронно-микроскопический анализ промежуточных продуктов сборки-репликации ротавируса. Вирусология . 477:32-41.
Boudreaux C.E.*, Vile D.C.*, Gilmore B.L., Tanner J.R., Kelly D.F., McDonald S.M. (2013). Субдомены оболочки ядра ротавируса, участвующие в инкапсуляции полимеразы в вирусоподобные частицы. Дж. Генерал Вирол . 94 (часть 8): 1818-26.
Гилмор Б.Л., МакКелл А.О., Будро С.Е., Дьюкс М.Дж., Макдональд С.М., Келли Д.Ф. (2013). Молекулярный надзор за вирусными процессами с использованием мембран из нитрида кремния. Микромашины . 4(1), 90-102.
Чамбли Л.Б., Будро С.Е., Коутс К.С. (2013). Аберрантные плацентарные иммунные параметры у кошек, инфицированных вирусом иммунодефицита кошек (FIV), предполагают вызванные вирусом изменения в функции Т-клеток. Вирол. Журнал .10:238.
Будро К.Э., Чамбли Л.Б., Скотт В.Л., Уайз Д.А., Коутс К.С. (2012). Дисбаланс динамики популяций плацентарных регуляторных Т-клеток и клеток Th27 у беременной кошки, инфицированной FIV. Вирол. Журнал . 9:88.
Скотт В.Л., Будро С.Е., Локетт Н.Н., Клэй Б.Т., Коутс К.С. (2011). Нарушение регуляции цитокинов в плацентах на ранних и поздних сроках от кошек, инфицированных вирусом иммунодефицита кошек (FIV). утра. Дж. Репрод. Иммунол. 65:480-491.
Локетт Н.Н., Скотт В.Л., Будро К.Е., Клэй Б.Т., Пруэтт С.Б., Райан П.Л., Коутс, К.С. (2010). Экспрессия маркеров активации регуляторных Т-клеток (Treg) в тканях эндометрия на ранних и поздних сроках беременности у кошек, инфицированных вирусом иммунодефицита кошек (FIV).

 Грудное молоко способствует формированию нормальной микрофлоры желудочно-кишечного тракта, повышает иммунитет, снижает восприимчивость к патогенной микрофлоре. При грудном вскармливании необходимо соблюдать гигиену молочных желёз. Если ребёнок находится на искусственном вскармливании, то молочную смесь следует готовить на один приём, т.к. при длительном хранении может произойти размножение микроорганизмов. Для разведения смеси рекомендуется использовать кипячёную воду;
Грудное молоко способствует формированию нормальной микрофлоры желудочно-кишечного тракта, повышает иммунитет, снижает восприимчивость к патогенной микрофлоре. При грудном вскармливании необходимо соблюдать гигиену молочных желёз. Если ребёнок находится на искусственном вскармливании, то молочную смесь следует готовить на один приём, т.к. при длительном хранении может произойти размножение микроорганизмов. Для разведения смеси рекомендуется использовать кипячёную воду; При завершении приготовления одного продукта и перехода к другому (например, от мясных изделий к фруктовому или овощному пюре) следует вымыть руки, заменить использованную разделочную доску и нож для сырых продуктов на аналогичный инвентарь для готовой продукции;
При завершении приготовления одного продукта и перехода к другому (например, от мясных изделий к фруктовому или овощному пюре) следует вымыть руки, заменить использованную разделочную доску и нож для сырых продуктов на аналогичный инвентарь для готовой продукции; Журнал медицинской микробиологии, 45, 133-137
Журнал медицинской микробиологии, 45, 133-137 Журнал ветеринарной медицины, серия B, 39, 175-180
Журнал ветеринарной медицины, серия B, 39, 175-180 Veterinary Microbiology, 129, 209-214
Veterinary Microbiology, 129, 209-214 , Оцуки К. и Каваока Ю.
, Оцуки К. и Каваока Ю. , Pedersen, K., Waino, M., Jorgensen, J. and Madsen, M.
, Pedersen, K., Waino, M., Jorgensen, J. and Madsen, M. The Canadian Veterinary Journal, 43, 441-442
The Canadian Veterinary Journal, 43, 441-442 , Краегель, С., Уинтроп, М., Танг, Ю. и Сильва, Дж.
, Краегель, С., Уинтроп, М., Танг, Ю. и Сильва, Дж.
 769-773
769-773 Epidemiology and Infection, 107, 659-665
Epidemiology and Infection, 107, 659-665 и Хартманн К.
и Хартманн К. Журнал Американской ветеринарной медицинской ассоциации, 241, 338-343
Журнал Американской ветеринарной медицинской ассоциации, 241, 338-343 Journal of Veterinary Internal Medicine, 15, 374
Journal of Veterinary Internal Medicine, 15, 374 Вирусная болезнь 25: 158-172. [Перекрестная ссылка]
Вирусная болезнь 25: 158-172. [Перекрестная ссылка] Арх Вирол 156(8): 1397-1413. [Перекрестная ссылка]
Арх Вирол 156(8): 1397-1413. [Перекрестная ссылка] , Ариста С., Миранда П. и др. (1992)Выделение и характеристика двух различных штаммов ротавируса человека со специфичностью G6. J Clin Microbiol 30: 9-16. [Перекрестная ссылка]
, Ариста С., Миранда П. и др. (1992)Выделение и характеристика двух различных штаммов ротавируса человека со специфичностью G6. J Clin Microbiol 30: 9-16. [Перекрестная ссылка] Вирусные гены 43: 215-223.[Перекрестная ссылка]
Вирусные гены 43: 215-223.[Перекрестная ссылка] , Кухар Ю., Штурм С., Кирбис А., Рацки Н. и др. (2016)Первое обнаружение и характеристика всего генома штамма ротавируса группы А G6P[15] косули. Vet Microbiol 191: 52-59.[Перекрестная ссылка]
, Кухар Ю., Штурм С., Кирбис А., Рацки Н. и др. (2016)Первое обнаружение и характеристика всего генома штамма ротавируса группы А G6P[15] косули. Vet Microbiol 191: 52-59.[Перекрестная ссылка] У., Талукдар Р.И., Пол С.К. и др. (2010) Полное созвездие генома штамма ротавируса группы А коз обнаруживает общую эволюцию со штаммами ротавируса жвачных животных и человека. J Gen Virol 91: 2367-2373.[Перекрестная ссылка]
У., Талукдар Р.И., Пол С.К. и др. (2010) Полное созвездие генома штамма ротавируса группы А коз обнаруживает общую эволюцию со штаммами ротавируса жвачных животных и человека. J Gen Virol 91: 2367-2373.[Перекрестная ссылка] (2012) Появление необычных ротавирусов G6P[6] у детей, Буркина-Фасо, 2009–2010 гг. Emerg Infect Dis 18: 589-597. [Перекрестная ссылка]
(2012) Появление необычных ротавирусов G6P[6] у детей, Буркина-Фасо, 2009–2010 гг. Emerg Infect Dis 18: 589-597. [Перекрестная ссылка] J Virol 63: 1431-1434. [Перекрестная ссылка]
J Virol 63: 1431-1434. [Перекрестная ссылка] J Clin Microbiol 28: 1198-1203. [Перекрестная ссылка]
J Clin Microbiol 28: 1198-1203. [Перекрестная ссылка] J Clin Microbiol 53: 455-464.
J Clin Microbiol 53: 455-464.