РОНКОЛЕЙКИН инструкция по применению, состав, показания, противопоказания, побочные эффекты – жидкость 500 тыс.ME
Домашние животные и пушные звери
Лечебное применение
Вирусные, бактериальные и грибковые заболевания: 2-5 инъекций в/в или п/к из расчета 10 000-15 000 МЕ/кг с интервалом 24-72 ч.
Онкологические заболевания: 5 в/в или п/к инъекций из расчета 15 000-20 000 МЕ/кг, повторные курсы проводят через месяц.
Профилактическое применение
Для усиления эффективности действия вакцин и уменьшения поствакцинальных осложнений: одна п/к инъекция 5000 МЕ/кг одновременно или за 24-48 ч до вакцинации.
Профилактика вирусных, бактериальных и грибковых заболеваний: 1-2 введения п/к, в/в или перорально из расчета 5000 МЕ/кг с интервалом 48 ч.
Предотвращение возникновения осложнений при хирургическом вмешательстве: до и/или после операции - 1-2 п/к или в/в инъекции с интервалом 48 ч.
Снятие стресса при различных манипуляциях, транспортировке:
С целью нормализации иммунитета старых и ослабленных животных: 2 п/к инъекции из расчета 10 000 МЕ/кг с интервалом 48 часов один раз в 3-6 месяцев.
Лошади
Респираторные заболевания (эмфизема легких, бронхиты, пневмонии): вводят п/к, в/в в дозе 1000 МЕ/кг 2-3 инъекции с интервалом 24-72 часа; перорально вводят в дозе 1000 МЕ/кг 2-3 раза с интервалом 24-72 ч.
Для предотвращения рецидивов хронической патологии органов дыхания: вводят ежемесячно однократно п/к, в/в, перорально в дозе 2000 МЕ/кг с интервалом 48-72 ч.
Кожные заболевания (фотоэкзантемы, многоформная эритема): 2 инъекции в/в в дозе 1000 МЕ/кг с интервалом 48 ч в сочетании с местной противовоспалительной терапией. Дерматиты: в/в капельно или п/к 3-5 инъекций с интервалом 48 часов в той же дозе.
Нарушения минерального обмена: двукратно по 1000 МЕ/кг в/в, п/к с интервалом 48-72 ч, повторные курсы проводят через месяц и через 2 месяца.
При травматических повреждениях, пододерматитах, ожогах и обморожениях: 2-3 инъекции (первая - в/в капельно, последующие - п/к) в дозе 1000-2000 МЕ/кг с интервалом 48 ч.
При онкологических заболеваниях (меланосаркома): 3-5 инъекций из расчета 1000-2000 МЕ/кг с интервалом 48-72 ч: первое введение - в/в капельно, второе – п/к, далее - 1-2 п/к инъекции в месяц.
Для коррекции иммунитета жеребят: 2 инъекции из расчета 1000-2000 МЕ/кг в/в, п/к или перорально; первое введение - на 3-4 день, а второе - на 10-14 день после рождения.
Для предотвращения распространения вирусных инфекций: 2-3 инъекции в/в, п/к из расчета 1000 МЕ/кг всему поголовью, контактировавшему с больными животными.
Для профилактики транспортного стресса:
Старым и ослабленным животным: п/к, в/в, перорально в дозе 1000 МЕ/кг массы тела ежемесячно 2-3 инъекции.
В период больших физических нагрузок вводят для повышения резервных возможностей организма: 1 раз в неделю п/к, в/в, перорально в дозе 1000 МЕ/кг.
Иммунореабилитация после применения кортикостероидов и курса других иммунодепрессантов: п/к, в/в, перорально в дозе 1000 МЕ/кг 2-3 раза с интервалом 48-72 ч.
Крупный рогатый скот (КРС)
Для стимуляции иммунитета у новорожденных телят: однократно п/к по 100 000 МЕ на одного теленка.
Для профилактики и лечения вирусных, бактериальных заболеваний: 1-3 п/к инъекции из расчета 2000-3000 МЕ/кг с интервалом 48 ч.
Для усиления эффективности вакцинации: однократно одновременно с вакцинацией п/к из расчета 1000-2000 МЕ/кг.
При некробактериозе: 2-3 инъекции п/к или в/в (медленно) в дозе 1000 МЕ/кг с интервалом 7-10 дней.
При хламидиозе: трехкратно п/к с интервалом 7 дней из расчета 1000 МЕ/кг.
Для нормализации (восстановления) половой цикличности у коров с гипофункцией яичников, проявляющейся длительной анафродезией: двукратно 500 000 МЕ/кг с интервалом 36 ч.
Мелкий рогатый скот
Те же показания и дозы, что и у КРС.
Свиньи
Для стимуляции иммунитета у новорожденных поросят: однократно п/к, перорально в дозе 3000-5000 МЕ/кг;
Для профилактики вирусных, бактериальных и грибковых заболеваний: 1-2 п/к инъекции из расчета 2000 МЕ/кг с интервалом 48 ч.
Для усиления эффективности вакцинации: однократно одновременно с вакцинацией молодняка п/к из расчета 2000-3000 МЕ/кг.
Сельскохозяйственная птица
Применяют для стимуляции иммунитета молодняка и для усиления эффективности вакцинации и уменьшения поствакцинальных осложнений: однократно п/к, перорально из расчета 2000-3000 МЕ/кг.
Дикие и экзотические животные
Применяют у всех видов экзотических животных по 2-5 в/в или п/к инъекций из расчета 1000-10 000 МЕ/кг (в зависимости от размера и вида животного) с интервалом 24-72 ч.
Парнокопытным животным применяют в тех же дозах, что при лечении крупного и мелкого рогатого скота. Непарнокопытным животным применяют в тех же дозах, что при лечении лошадей.
Непарнокопытным животным применяют в тех же дозах, что при лечении лошадей.
При лечении экзотических птиц можно использовать интраназальный метод введения.
Рыбы
Осетровым и их гибридам
при хирургическом вмешательстве: до операции - однократно в/в в дозе 2000 МЕ/кг и после операции - двукратно п/к по 5000 МЕ/кг с интервалом 24 ч. В качестве антистрессовой терапии и повышения жизнестойкости молоди: однократно перорально за 7 дней стресса в дозе 6000 МЕ/кг, или трехкратно в дозе 2000 МЕ/кг с интервалом 48 ч при стрессах, связанных с хендлингом, или в виде получасовых ванн в дозе 300 000 МЕ/100 л.Лососевым и их гибридам для обработки икры и личинок при переводе на экзогенное питание: 15-минутные ванны из расчета 250 000 МЕ/100 л воды, однократно. Для молоди весом до 3 грамм в качестве профилактики вирусных, бактериальных и грибковых заболеваний – перорально вместе с кормом 3 дня подряд в дозе 4000 МЕ/кг (3 курса с интервалом 10-14 дней).
Форели производителям в посленерестовый период - трехкратное орошение корма перед кормлением в дозе 2000 МЕ/кг ихтиомассы с интервалом 5 дней.
Аквариумным рыбам для профилактики и лечения вирусных, бактериальных и грибковых заболеваний: применяют экспозиции в емкостях с чистой водой, в которую добавлен Ронколейкин из расчета 50 000 МЕ/10 л воды.
Способы приготовления и введения растворов
П/к введение
К содержимому ампулы или флакона добавляют 1.5-2 мл 0.9% раствора натрия хлорида для инъекций или воды для инъекций и вводят в область шеи; у рыб применяют воду для инъекций или 0.65% раствора натрия хлорида.
В/в введение
Содержимое ампулы или флакона переносят в капельницу, где в качестве растворителя используют 0.9% раствор натрия хлорида для инъекций и вводят в вену; у рыб применяют 0.65% раствор натрия хлорида и вводят в хвостовую вену.
Интраназальный
Содержимое ампулы или флакона разводят в 5 мл 0.
Пероральный
Содержимое ампулы или флакона разводят в 10 мл 0.9% раствора натрия хлорида для инъекций и выпаивают. Наилучший эффект достигается при медленном вливании раствора под язык. У рыб используют орошение корма.
Наружный
Содержимое ампулы или флакона разводят в 10-20 мл 0.9% раствора натрия хлорида и используют в виде аппликаций или орошения раневой поверхности.
Внутрипузырный
Содержимое ампулы или флакона разводят в 5-50 мл (в зависимости от размера животного) 0.9% раствора натрия хлорида и вводят через катетер в полость мочевого пузыря.
При разведении Ронколейкина не следует сильно встряхивать ампулу, чтобы избежать пенообразования.
Особенностей лекарственной реакции при первичном или курсовом применении препарата не установлено.
Специальные меры при пропуске приема одной или нескольких доз лекарственного препарата не предусмотрены, курс лечения продолжают.
РОНКОЛЕЙКИН, RONCOLEUKIN - инструкция по применению лекарства, отзывы, описание, цена
Фирма-производитель: БИОТЕХ ООО (Россия)
р-р д/в/в и п/к введения 500 мкг/1 мл: амп. 5 шт. Рег. №: ЛС-001810
Клинико-фармакологическая группа:
Интерлейкин. Препарат с противоопухолевой и иммуномодулирующей активностью
Форма выпуска, состав и упаковка
Раствор для в/в и п/к введения прозрачный, бесцветный или светло-желтого цвета.
| 1 мл | |
| рекомбинантный интерлейкин-2 человека | 500 мкг (500 тыс.МЕ) |
Вспомогательные вещества: натрия додецилсульфат (солюбилизатор), D-маннит (стабилизатор), дитиотреитол (восстановитель), аммоний углекислый кислый, вода д/и.
1 мл - ампулы (5) - пачки картонные.
Описание активных компонентов препарата «
Ронколейкин»Фармакологическое действие
Рекомбинантный интерлейкин-2 (рИЛ-2), структурный и функциональный аналог эндогенного интерлейкина-2 (ИЛ-2).
ИЛ-2 продуцируется субпопуляцией Т-лимфоцитов, усиливая их пролиферацию и последующий синтез ИЛ-2.
Биологические эффекты ИЛ-2 опосредуются его связыванием со специфичекими рецепторами, представленными на различных клеточных мишенях.
ИЛ-2 направленно влияет на рост, дифференцировку и активацию Т- и B-лимфоцитов, моноцитов, макрофагов, олигодендроглиальных клеток, клеток Лангерганса. От его присутствия зависит развитие цитолитической активности натуральных киллеров и цитотоксических Т-лимфоцитов. ИЛ-2 вызывает образование лимфокин-активированных киллеров и активирует опухоль-инфильтрирующие клетки.
Расширение спектра лизирующего действия эффекторных клеток обусловливает элиминацию разнообразных патогенных микроорганизмов, инфицированных и малигнизированных клеток, что обеспечивает иммунную защиту, направленную против опухолевых клеток, а также возбудителей вирусной, бактериальной и грибковой инфекции.
Показания
— комплексная терапия септических состояний различной этиологии, сопровождающихся иммуносупрессией, у взрослых: посттравматический сепсис, хирургический сепсис, акушерско-гинекологический сепсис, ожоговый сепсис, раневой сепсис, другие септические состояния;
— лечение рака почки у взрослых.
Режим дозирования
Препарат вводят п/к или в/в капельно 1 раз/сут в дозах до 2 мг.
Курс лечения при септических состояниях различной этиологии (при посттравматическом, хирургическом, акушерско-гинекологическом, ожоговом, раневом и других видах сепсиса): проводят 1-3 п/к или в/в введения по 0.5-1 мг с перерывами в 1-3 дня.
Курс лечения Ронколейкином при раке почки включает:
— однократное п/к или в/в введение препарата в дозе 500 мкг за 24 ч до операции;
— в составе 8-недельного курса иммунохимиотерапии, по 2 мг в/в через 48 ч, первые 4 недели лечения.
Повторные курсы - через 1-2 месяца.
Правила приготовления и введения растворов
Раствор для в/в и п/к введения. Для п/к введения содержимое ампулы разводят в 1.5-2 мл изотонического раствора натрия хлорида для инъекций. Раствор препарата должен быть прозрачным, бесцветным и не содержать посторонних включений. Для в/в введения полученный раствор переносят в 400 мл изотонического раствора натрия хлорида для инъекций.
Для предотвращения потери биологической активности препарата Ронколейкин к раствору в капельнице необходимо добавить 10% раствор человеческого сывороточного альбумина в количестве:
8 мл – при использовании ампулы с 1 мг (1 000 000 МЕ) рИЛ-2 ;
6 мл – при использовании ампулы с 500 мкг (500 000 МЕ) рИЛ-2 ;
4 мл – при использовании ампулы с 250 мкг (250 000 МЕ) рИЛ-2;
2 мл - при использовании ампулы со 100 мкг (100 000 МЕ) рИЛ-2 .
Инфузия всего объема раствора осуществляется в/в капельно в течение 4-6 ч.
Побочное действие
Возможно: в отдельных случаях - появление кратковременного озноба и повышение температуры тела в процессе введения Ронколейкина, что купируется обычными терапевтическими средствами и не является основанием для прерывания введения препарата, а также отмены курса терапии.![]()
Противопоказания
— аутоиммунные заболевания;
— тяжелые заболевания сердечно-сосудистой системы;
— беременность;
— повышенная чувствительность к дрожжам;
— повышенная чувствительность к интерлейкину-2 и другим компонентам препарата.
Беременность и лактация
Препарат противопоказан при беременности.
Особые указания
Лечение следует проводить под врачебным контролем. При повторных курсах терапии Ронколейкином обязательно контролировать соотношение субпопуляций лимфоцитов CD4+/CD8+.
На основании клинических испытаний в ведущих медицинских центрах установлена эффективность препарата Ронколейкин для профилактики и компенсации иммунодефицитных состояний при следующих заболеваниях и состояниях: сепсис, перитонит, панкреатит, остеомиелит, диабетическая стопа, коррекция вторичного иммунодефицита после оперативных вмешательств, пневмония, туберкулез, ВИЧ-инфекция, гепатит C, цитомегаловирусная инфекция, хламидиоз, вторичное бесплодие, рассеянный склероз, гнойный синусит.![]()
Ронколейкин содержит восстановленную форму рекомбинантного интерлейкина-2 (рИЛ-2) в отличие от альдеслейкина, в котором рИЛ-2 представлен окисленной формой. Указанные вещества различаются по активности. Активность 1.1 мг рИЛ-2 альдеслейкина соответствует 18 000 000 МЕ. При растворении активность окисленной формы рИЛ-2 не меняется.
Восстановленная форма рИЛ-2, содержащаяся в дрожжевом препарате Ронколейкин, имеет активность 1 000 000 МЕ в 1 мг. При п/к или в/в введении она спонтанно переходит в биологически активную окисленную форму рИЛ-2 и достигает биологической активности, равной 12 000 000 МЕ/кг.
Таким образом, 1 мг альдеслейкина по активности соответствует 1.5 мг Ронколейкина. При использовании схем, разработанных для препаратов бактериального происхождения необходимо вводить коэффициент пересчета, равный 1.5 (таблица).
| Альдеслейкин | Ронколейкин | |||
| Масса (кг) | Биологическая активность (МЕ) | Масса (кг) | Биологическая активность (МЕ) | |
1. 0 0 | Окисленная форма рИЛ-2 | 1.0 | Восстановленная форма рИЛ-2 | Окисленная форма рИЛ-2 |
| 16 300 000 | 1 000 000 | 12 000 000 | ||
Передозировка
Данные по передозировке препарата Ронколейкин не предоставлены.
Лекарственное взаимодействие
Лечение препаратом Ронколейкин можно сочетать со всеми другими лекарственными средствами.
Условия отпуска из аптек
Препарат отпускается по рецепту.
Условия и сроки хранения
Список Б. Раствор для в/в и п/к введения следует хранить в недоступном для детей месте при температуре от 2° до 8°С . Срок годности - 2 года. Транспортирование проводят в картонных коробках при температуре от 2° до 8°С; допускается транспортирование при температуре от 9° до 25°С в течение 10 сут.
Лекарственное взаимодействие
Лечение препаратом Ронколейкин можно сочетать со всеми другими лекарственными средствами.
Ронколейкин — инструкция по применению
Ронколейкин® вводят 1 раз в сутки подкожно или внутривенно капельно по 0,5-1,0 мг с интервалами 1-3 дня, на курс — 1-3 введения.
Для внутривенного введения препарат из ампулы переносят в 400 мл изотонического раствора натрия хлорида для инъекций. Инфузия всего объёма раствора осуществляется капельно в течение 4-6 часов. Раствор препарата должен быть прозрачным, бесцветным и не содержать посторонних включений.
Иммунотерапию Ронколейкином® проводят после завершения неотложных и срочных оперативных вмешательств, направленных на устранение жизнеугрожающих последствий основного заболевания/травмы, санации и адекватного дренирования инфекционного очага.
При лечении тяжёлого сепсиса проводят от одного до трёх курсов Ронколейкина®. Курс включает 2 в/в инфузии в дозе 0,5 мг через день. Критерием для назначения второго и третьего курсов Ронколейкина® является сохраняющаяся в ходе лечения лимфопения (абсолютная и/или относительная).
При впервые выявленном инфильтративном деструктивном туберкулёзе лёгких — 3 в/в инфузии Ронколейкина® в дозе 0,5 мг с интервалом 48 часов на фоне специфической полихимиотерапии.
Для предоперационной подготовки при прогрессирующем фиброзно-кавернозном туберкулёзе (ФКТ) лёгких на фоне специфической полихимиотерапии:
- при одностороннем ФКТ — 3 в/в введения Ронколейкина® по 1 мг с интервалом 48 часов;
- при распространенном ФКТ лёгких с двусторонней очаговой диссеминацией — 7 в/в введений Ронколейкина®: 3 введения в течение первой недели по 1 мг с интервалом 48 часов, далее по 1 мг два раза в неделю в течение двух недель.
Рекомендуемый курс иммунотерапии должен быть завершен за 7 — 10 дней до оперативного вмешательства.
Назначение Ронколейкина® при туберкулёзе лёгких нецелесообразно при дефиците массы тела более 30 %.
Курс лечения Ронколейкином® диссеминированных и местнораспространенных форм почечноклеточного рака включает:
- однократное п/к или в/в введение препарата в дозе 0,5 мг за 24 часа до операции;
- в составе 8-недельного курса иммунохимиотерапии по 2,0 мг в/в через день в течение первых четырёх недель лечения.
 Повторные курсы проводят через 1-2 мес.,
Повторные курсы проводят через 1-2 мес.,
У детей Ронколейкин® применяют внутривенно капельно.
Схемы применения соответствуют таковым у взрослых.
Препарат разводят в натрия хлорида растворе изотоническом 0,9 % для инъекций.
Разовая доза препарата и объём изотонического раствора у детей зависит от возраста:
- от 0 до 1 мес. — 0,1 мг в 30-50 мл раствора;
- от 1 мес. до 1 года — 0,125 мг в 100 мл раствора;
- от 1 года до 7 лет — 0,25 мг в 200 мл раствора;
- старше 7 лет — 0,5 мг в 200 мл раствора;
- старше 14 лет — 0,5 мг в 400 мл раствора.
РОНКОЛЕЙКИН: инструкция, отзывы, аналоги, цена в аптеках
Ронколейкин - средство для применения при иммунодефиците.
Фармакологические свойства
Интерлейкин-2 продуцируется субпопуляцией Т-лимфоцитов (Т-хелперы I) в ответ на антигенную стимуляцию. Синтезированный ИЛ-2 воздействует на Т-лимфоциты, усиливая их пролиферацию и последующий синтез ИЛ-2.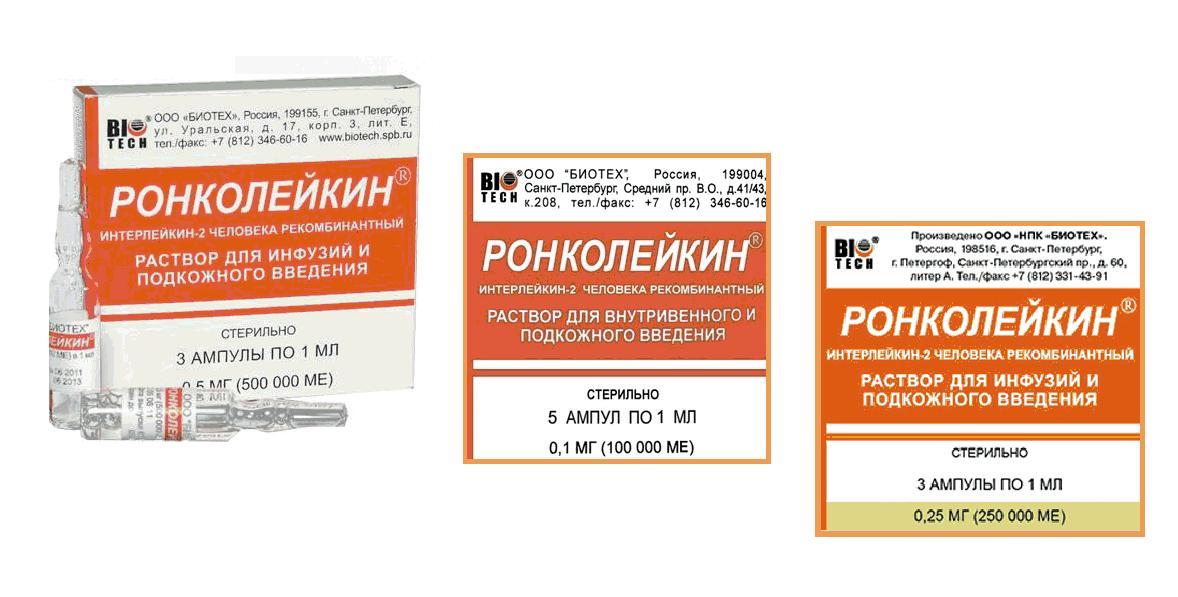
Биологические эффекты ИЛ-2 опосредуются его связыванием со специфическими рецепторами, представленными на различных клеточных мишенях.
ИЛ-2 направленно влияет на рост, дифференцировку и активацию Т- и В-лимфоцитов, моноцитов, макрофагов, олигодендроглиальных клеток, клеток Лангерганса. От его присутствия зависит развитие цитолитической активности натуральных киллеров и цитотоксических
Т-лимфоцитов. ИЛ-2 вызывает образование лимфокин-активированных киллеров и активирует опухоль-инфильтрирующие клетки.
Расширение спектра лизирующего действия эффекторных клеток обусловливает элиминацию разнообразных патогенных микроорганизмов, инфицированных и малигнизированных клеток, что обеспечивает иммунную защиту, направленную против опухолевых клеток, а также возбудителей вирусной, бактериальной и грибковой инфекции.
Показания к применению
Препарат Ронколейкин применяется в составе комплексной терапии у взрослых: обычный вариабельный иммунодефицит; комбинированный иммунодефицит; острый перитонит; острый панкреатит; остеомиелит; эндометрит; тяжелая пневмония; сепсис; послеродовый сепсис; туберкулез легких; другие генерализованные и тяжелые локализованные инфекции; инфицированные термические и химические ожоги; диссеминированные и местнораспространенные формы почечноклеточного рака.
У детей с 0 лет: обычный вариабельный иммунодефицит; комбинированный иммунодефицит; острый перитонит; острый панкреатит; остеомиелит; тяжелая пневмония; бактериальный сепсис новорожденных; сепсис; другие генерализованные и тяжелые локализованные инфекции.
Способ применения
Ронколейкин вводят 1 раз в сутки подкожно или внутривенно капельно по 0,5 - 1,0 мг с интервалами 1 - 3 дня, на курс - 1-3 введения. Для внутривенного введения препарат из ампулы переносят в 400 мл изотонического раствора натрия хлорида для инъекций.
Инфузия всего объема раствора осуществляется капельно в течение 4-6 часов. Раствор препарата должен быть прозрачным, бесцветным и не содержать посторонних включений.Иммунотерапию Ронколейкином проводят после завершения неотложных и срочных оперативных вмешательств, направленных на устранение жизнеугрожающих последствий основного заболевания/травмы, санации и адекватного дренирования инфекционного очага.
При лечении тяжелого сепсиса проводят от одного до трех курсов Ронколейкина.
 Курс включает 2 в/в инфузии в дозе 0,5 мг через день. Критерием для назначения второго и третьего курсов Ронколейкина является сохраняющаяся в ходе лечения лимфопения (абсолютная и/или относительная).
Курс включает 2 в/в инфузии в дозе 0,5 мг через день. Критерием для назначения второго и третьего курсов Ронколейкина является сохраняющаяся в ходе лечения лимфопения (абсолютная и/или относительная).При впервые выявленном инфильтративном деструктивном туберкулезе легких - 3 в/в инфузии Ронколейкина в дозе 0,5 мг с интервалом 48 часов на фоне специфической полихимиотерапии.
Для предоперационной подготовки при прогрессирующем фиброзно-кавернозном туберкулезе (ФКТ) легких на фоне специфической полихимиотерапии:
при одностороннем ФКТ – 3 в/в введения Ронколейкина по 1 мг с интервалом 48 часов;
при распространенном ФКТ легких с двусторонней очаговой диссеминацией – 7 в/в введений Ронколейкина: 3 введения в течение первой недели по 1 мг с интервалом 48 часов, далее по 1 мг два раза в неделю в течение двух недель. Рекомендуемый курс иммунотерапии должен быть завершен за 7 – 10 дней до оперативного вмешательства.
Назначение Ронколейкина при туберкулезе легких нецелесообразно при дефиците массы тела более 30 %.

Курс лечения Ронколейкином диссеминированных и местнораспространенных форм почечноклеточного рака включает:
- однократное п/к или в/в введение препарата в дозе 0,5 мг за 24 часа до операции;
- в составе 8-недельного курса иммунохимиотерапии по 2,0 мг в/в через день в течение первых четырех недель лечения. Повторные курсы проводят через 1 - 2 мес.
У детей Ронколейкин применяют внутривенно капельно. Схемы применения соответствуют таковым у взрослых. Препарат разводят в натрия хлорида растворе изотоническом 0,9% для инъекций. Разовая доза препарата и объем изотонического раствора у детей зависит от возраста:
- от 0 до 1 мес. – 0,1 мг в 30-50 мл раствора;
- от 1 мес. до 1 года – 0,125 мг в 100 мл раствора;
- от 1 года до 7 лет – 0,25 мг в 200 мл раствора;
- старше 7 лет – 0,5 мг в 200 мл раствора;
- старше 14 лет – 0,5 мг в 400 мл раствора.
Симптомы передозировки, меры по оказанию помощи при передозировке
Проявления передозировки наблюдались при разовой дозе Ронколейкина выше 7 мг в виде лихорадки, нарушения ритма сердца, гипотонии, дерматологическиих аллергических реакций.
 Данные побочные явления купируются после отмены введения препарата, при необходимости проводится симптоматическая терапия.
Данные побочные явления купируются после отмены введения препарата, при необходимости проводится симптоматическая терапия.Противопоказания
Противопоказаниями к применению препарата Ронколейкин являются: повышенная чувствительность к интерлейкину-2 или любому компоненту препарата в анамнезе; аллергия к дрожжам; беременность; аутоиммунные заболевания, сердечная недостаточность III ст., легочно-сердечная недостаточность III ст., метастатическое поражение головного мозга, терминальная стадия почечноклеточного рака.
С осторожностью при хронической почечной недостаточности, декомпенсированной печеночной недостаточности.
Беременность
Препарат Ронколейкин противопоказан при беременности.
Взаимодействие с другими лекарственными средствами
Лечение препаратом Ронколейкин можно сочетать с лечением всеми другими лекарственными средствами.
При применении Ронколейкина на фоне длительной терапии препаратами глюкокортикостероидов активность действия препарата может снижаться.
Ронколейкин нельзя смешивать с другими лекарственными препаратами в одном шприце или флаконе.
Побочные действия
В отдельных случаях в процессе введения Ронколейкина возможно появление кратковременного озноба и повышение температуры тела, что купируется обычными терапевтическими средствами и не является основанием для прерывания введения препарата, а также курса лечения. При подкожном введении препарата отмечались местные реакции - болезненность, уплотнение, покраснение в месте инъекции.
Передозировка
Симптомы передозировки наблюдались при приеме препарата Ронколейкин разовой дозе выше 7 мг в виде лихорадки, нарушения ритма сердца, гипотонии, дерматологических аллергических реакций.
Лечение: данные симптомы купируются после отмены введения препарата, при необходимости проводится симптоматическая терапия.
Условия хранения
Препарат Ронколейкин хранят при температуре от 2°С до 8°С. Допускается транспортировка при температуре от 9°С до 25°С в течение 10 суток.
Хранить в недоступном для детей месте.
Форма выпуска
Ронколейкин - раствор для инфузий и подкожного введения.
В ампулах по 1 мл в дозах по 1 мг рИЛ-2 (1 000 000 ME), 0,5 мг рИЛ-2 (500 000 ME) или 0,25 мг рИЛ-2 (250 000 ME).
По 3 или 5 ампул в пачке.
Состав
1 мл раствора Ронколейкин содержит активные вещества: интерлейкин-2 человека рекомбинантный 0,25 мг, 0,5 мг или 1 мг (=250 000 МЕ / 500 000 МЕ / 1 000 000 МЕ).
Вспомогательные вещества: натрия лаурилсульфат - 2,5 мг / 5 мг / 10 мг; маннитол - 12,5 мг / 25 мг / 50 мг; дитиотреитол - 0,08 мг; аммония гидрокарбонат - 0,79 мг; вода для инъекций - до 1 мл.
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
| |||||
|
Инструкция «Ронколейкин»: показания и дозы
«Ронколейкин» назначают в комплексном лечении для повышения иммунитета при патологических состояниях организма.
«Ронколейкин»: инструкция по применению
Показания
1. Септические инфекции, гнойно-воспалительные процессы различной этиологии: сепсис после травм, после операций, сепсис, акушерский, ожоговый; в случаях снижения числа лимфоцитов в крови. Препарат сокращает сроки лечения, уменьшает тяжесть патологического состояния, уменьшает степень эндотоксемии.Установлено, что «Ронколейкин», отзывы пациентов это подтверждают, способствует уменьшению приема антибиотиков.
Септические инфекции, гнойно-воспалительные процессы различной этиологии: сепсис после травм, после операций, сепсис, акушерский, ожоговый; в случаях снижения числа лимфоцитов в крови. Препарат сокращает сроки лечения, уменьшает тяжесть патологического состояния, уменьшает степень эндотоксемии.Установлено, что «Ронколейкин», отзывы пациентов это подтверждают, способствует уменьшению приема антибиотиков.
Применение «Ронколейкина» при перитоните позволяет улучшить состояние больных, уменьшить количество осложнений в послеоперационном периоде, снизить летальность.
При хроническом остеомиелите назначают в комплексной терапии для быстрой ликвидации гнойного процесса в костях, ускорения заживления послеоперационной раны и снижения вероятности рецидива заболевания.
2. Инструкция «Ронколейкин» предписывает применение при лечении внутренних болезней. При различных формах пневмонии включают средства для снижения интоксикации, для сокращения продолжительности лихорадочного периода, для снижения риска развития хронизации и рецидивов.
Препарат значительно снижает вероятность развития пневмонии при лечении мозгового инсульта, дает положительные результаты при бронхиальной астме различного генеза, позволяет снизить дозы кортикостероидов у больных с гормонозависимой формой.
Рекомендуется
Что делать, если потрескалась кожа на руках?
Каждый из нас хотя бы раз в жизни сталкивался с небольшим, но очень, когда трескается кожа на руках. В это время появляются ранки разного размера, которые болят и доставляют неудобства, особенно при контакте с водой или моющими средствами. ...
При язвенной болезни введение «Ронколейкина» позволяет добиться успешного лечения пораженного участка двенадцатиперстной кишки, избежать рецидива, добиться элиминации Helicobacter pylori, отказа от антибактериальных препаратов.
3. Как указано в инструкции, «Ронколейкин» следует применять при пиелонефрите как средство, ускоряющее элиминацию возбудителя, купирующее основные клинические симптомы, сокращающее сроки пребывания в стационаре, снижающее риск рецидива.
4. При лечении инфекционных заболеваний, таких как туберкулез, рожа, инфекционный эндокардит, гепатит С, бруцеллез, энцефалит, менингит, герпес, геморрагическая лихорадка, псевдотуберкулез, грибковые инфекции, СПИД, микоплазмоз, хронический простатит, фурункулез, атопический дерматит доказанный эффективность препарата.
5. Согласно инструкции «Ронколейкин» применяют в комплексной терапии гинекологических заболеваний.
6. В неврологии при лечении рассеянного склероза купирует обострение заболевания, сокращает сроки пребывания в стационаре, удлиняет периоды ремиссии.
7. Отоларингологи назначают своим пациентам «Ронколейкин» при гнойных синуситах и отитах.
8. «Ронколейкин», как основной компонент комплексного лечения, применяют при диагностированном раке почки, мочевого пузыря; меланома, глиобластома, колоректальный рак, опухоль головного мозга, рак молочной железы, вторичный иммунодефицит.
Инструкция: «Ронколейкин» доза
Препарат вводят под кожу или в вену капельно 1 раз в сутки в дозах до 2 мг.
Для приготовления раствора для подкожного введения содержимое ампулы разводят раствором натрия хлорида (до 1,5 - 2,0 мл).
При этом необходимо следить за ними, чтобы полученный раствор был прозрачным, бесцветным, в нем не наблюдалось посторонних включений.
Если препарат вводится внутривенно капельно, порошкообразную массу разводят в растворе натрия хлорида (400 мл) для инъекций.Больной находится под капельницей от 4 до 6 часов.
Троксевазин: инструкция по применению
«Троксевазин» — биофлавоноид, разработанный специально для снижения проницаемости сосудов, ломкости капилляров. Препарат из группы ангиопротекторов «Троксевазин», инструкция по применению объясняет это, укрепляет стенки сосудов, улучшает микроциркуляцию крови. Это лекарство снимает отек, устраняет трофические нарушения, все другие изменения, вызывающие венозную хроническую недостаточность.
Кроме того, «Троксевазин», инструкция по применению подробно объясняет механизм его действия, уменьшает боль.
Лекарственный препарат выпускается в виде трех лекарственных форм.
Капсулы «Троксевазин» состоят из 300 троксерутина (это активное вещество), стеарата магния, желатина, лактозы, нескольких красителей. Сам корпус стандартный.
«Троксевазин» — гель предназначен для наружного применения, в отличие от таблеток. Он представляет собой однородную композицию, в 1 г которой находится 1 мг троксерутина, ЭДТА динария, триатаноламида, карбомера, бензалкония хлорида.
Для внутривенного или внутримышечного введения предназначен раствор «Троксевазин».
«Троксевазин», продолжает инструкция по применению, успешно применяется для лечения следующих заболеваний:
- варикозных вен
- Геморрой
- Геморрой
- Тромбофлебит поверхностных
- хроническая венозная недостаточность, которая сопровождается сильным припуском, болью
- Боли постлибита
- Боли и отек травматического характера: дислокации, растяжения, борьбы
- трофический дерматит, язвы
Где еще применяют «Троксевазин»? Показания к применению этого медикамента не ограничиваются только лечением.
 Используется как вспомогательный препарат
Используется как вспомогательный препарат- перед операциями на вены
- в лечении геморроя
- с ночной парестезией конечностей
- для удаления ночных судорог в конечностях
- для удаления травматических болей или отека
- Лечение ретинопатии
У «Троксевазина» есть противопоказания? Их мало. Препарат не рекомендуется подросткам, людям, страдающим язвенной болезнью или гастритом.Больным с выраженными нарушениями почечной деятельности препарат назначают только под постоянным наблюдением врача.
«Троксевазин», рекомендует инструкция по применению, в начале лечения принимать по 2 капсулы в сутки. Если лечение профилактическое или поддерживающее, дозу снижают до 1 капсулы.
Дозировка увеличивается только при ретинопатии (до 3 капсул).
Одновременно с приемом внутрь применяют «Троксевазин»-гель. Его наносят на пораженный участок два раза в день, массируя до полного впитывания.
Побочные явления при применении препарата «Троксевазин», инструкция по применению успокаивает, возникают очень редко.
 Обычно они проявляются легким раздражением головной боли в местах нанесения геля. Еще менее вероятно возникновение язвы желудка при длительном приеме таблеток.
Обычно они проявляются легким раздражением головной боли в местах нанесения геля. Еще менее вероятно возникновение язвы желудка при длительном приеме таблеток.Препарат можно применять в монотерапии или в составе комплексного лечения. Не рекомендуется наносить гель на открытые кровоточащие раны, слизистые, в глаза.
Нельзя одновременно принимать «Троксевазин» и аскорбиновую кислоту: эти два препарата усиливают действие друг друга.
«Троксевазин» производится в Болгарии. В этой же стране производится препарат, который считает аналогом «Троксевазина» — «Троксерутин».
Применять «Троксевазин», инструкция по применению настаивает на этом, можно только на протяжении 2-4 недель. После этого рекомендуется сделать недельный перерыв, а затем можно возобновить лечение.
Несмотря на то, что лекарство отпускается без рецепта, его нельзя принимать без назначения врача.Более того, после курса лечения рекомендуется сдать анализы, позволяющие контролировать работу почек.

"Ронколейкин" для кошек: описание, применение, отзывы
"Ронколейкин" для кошек получают биотехнологическим методом от производителя (рекомбинантный штамм Saccharomyces cerevisiae). Активным веществом препарата является полипептид (ключевой компонент иммунного ответа), дефицит которого приводит к сбоям в работе иммунной системы.Среди основных действующих веществ — рекомбинантный интерлейкин.
Введение «Ронколейцина» приводит к норме:
- распознавание антигенов;
- производство антител;
- активность моноцитов;
- дифференцировка, пролиферация иммунокомпетентных клеток;
- функциональность гранулоцитов.
Препарат «Ронколейкин» для кошек обладает выраженной иммунокорригирующей активностью, повышает и оптимизирует противогрибковый, противовирусный и противоопухолевый иммунитет.Активизирует процессы восстановления и регенерации тканей.Препарат признан отличным средством для иммунореабилитации. Высокая эффективность лечения множества заболеваний различной этиологии доказана клинической практикой.

Препарат «Ронколейкин» для кошек (цена зависит от формы выпуска и составляет около 4,5-5 у.е. за 50 000 МЕ (1 ампула)) назначают как для лечения, так и для профилактики. Фассоет либо во флаконах по 10 мл, либо в ампулах по 1 мл. Препарат в первой форме можно применять в течение 10 дней при условии набора раствора стерильным шприцем путем прокола резиновой пробки.Хранение и транспортировка вне холодильника не допускается (максимальная температура хранения +10 о С).
Препарат «Ронколейкин» вводят как внутривенно (предпочтительно), так и внутримышечно.Дозировка рассчитывается исходя из массы тела – от 5 до 20 тыс. МЕ на кг. Возможны также сублингвальное, интраназальное, аэрозольное, пероральное введение и даже наружное применение (в некоторых случаях). Препарат прекрасно сочетается со всеми без исключения лекарствами, однако смешивать с глюкозой в одном шприце не рекомендуется.
При введении неразбавленного препарата «Ронколейкин» не наблюдается болевой эффект (непродолжительное жжение).
 Для уменьшения этого явления препарат разводят пятью частями натрия хлорида (0,9%) или водой (инъекции). Полученный раствор при взбалтывании образует относительно устойчивую пену, поэтому манипуляции проводят с осторожностью.
Для уменьшения этого явления препарат разводят пятью частями натрия хлорида (0,9%) или водой (инъекции). Полученный раствор при взбалтывании образует относительно устойчивую пену, поэтому манипуляции проводят с осторожностью.Животные с тяжелыми поражениями проводящей системы и сердца должны получать препарат Ронколейкин малыми фракциями и на фоне кардиостимуляторов.
При терапии, включающей кортикостероидные препараты (как системные, так и местные), описанный препарат вводят после курса гормонотерапии.В большинстве случаев при заболеваниях в острой форме вводят до 10000 МЕ/кг массы тела. При хронической форме количество препарата может быть увеличено до 15 000 МЕ. Между введениями необходимо соблюдать интервал (день-два). В тяжелых случаях заболевания показано 5 инъекций, при комплексной терапии — три. Продолжительность курса, интервалы и дозировку определяет лечащий врач.
Насколько эффективен препарат Ронколейкин для кошек? Отзывы как ветеринаров, так и владельцев однозначны:
- быстрее нормализуются биохимические показатели крови;
- сокращены сроки восстановления;
- Уменьшается отечность;
- снижается локальная гипертермия;
- температура нормализована.

Положительные реакции наблюдаются при лечении инфекционных, респираторных, онкологических, гнойно-воспалительных заболеваний.Препарат показан для лечения инфекционно-деструктивных процессов, протекающих в костной ткани, при заболеваниях кожи и глаз, при проблемах с мочевыделительной системой, при гипотермическом синдроме, поликистозе почек, после операций. В качестве антистрессовой профилактики допустимо применение однократной инъекции Ронколейкина (5000 МЕ).
аналоги, инструкция и отзывы о лечении
Гельминтозы опасная и, к сожалению, достаточно распространенная проблема, которая при отсутствии терапии может привести к осложнениям.Медицина, конечно же, предлагает средства, способные очистить организм от паразитов. Одним из них является препарат «Бильтрицид». Аналоги препарата, отзывы пациентов, механизм действия и возможные побочные эффекты – эти моменты интересуют многих людей, столкнувшихся со столь неприятной проблемой.
Описание состава и формы выпуска
В аптеке препарат «Бильтрицид» можно приобрести в виде продолговатых двояковыпуклых таблеток белого цвета, иногда с легким желтоватым или оранжевым оттенком.
 Таблетки помещены во флаконы из темного стекла по 6 штук. Основным действующим компонентом препарата является празиквантел – в каждой таблетке содержится около 600 мг этого вещества. Что касается вспомогательных компонентов, то в состав препарата входят стеарат магния, макрогол 4000, микрокристаллическая целлюлоза, лаурилсульфат натрия, гипромеллоза, кукурузный крахмал, диоксид титана и повидон.
Таблетки помещены во флаконы из темного стекла по 6 штук. Основным действующим компонентом препарата является празиквантел – в каждой таблетке содержится около 600 мг этого вещества. Что касается вспомогательных компонентов, то в состав препарата входят стеарат магния, макрогол 4000, микрокристаллическая целлюлоза, лаурилсульфат натрия, гипромеллоза, кукурузный крахмал, диоксид титана и повидон.Как действует препарат? Основные свойства
Основное действующее вещество препарата обладает антигельминтными свойствами. В частности, он влияет на мембраны клеток гельминтов, повышая их проницаемость для ионов кальция.Этот эффект приводит к генерализованному сокращению гладкой мускулатуры паразита. Кроме того, наблюдается снижение уровня гликогена, ингибирование захвата глюкозы клетками паразита и увеличение количества выделяемой молочной кислоты. Результатом такого воздействия является гибель паразитов, в частности цестод и трематод.
Показания к приему
Препарат показан для лечения глистных заболеваний, таких как, например, описторхоз.
 Лечение «Бильтрицидом» помогает при заражении организма человека разными видами шистосом.Показаниями к терапии являются заболевания, вызванные печеночным и легочным сосальщиками, а также некоторыми другими видами гельминтов.
Лечение «Бильтрицидом» помогает при заражении организма человека разными видами шистосом.Показаниями к терапии являются заболевания, вызванные печеночным и легочным сосальщиками, а также некоторыми другими видами гельминтов.Препарат «Бильтрицид»: инструкция по применению
Не применять препарат ни в коем случае самовольно. Только врач после тщательной диагностики может назначить препарат «Бильтрицид». Инструкция по применению содержит только общие рекомендации.
Дозировка напрямую зависит от состояния больного и разнообразия паразитов. Например, при описторхозе врачи обычно назначают по 25 мг действующего вещества на килограмм веса три раза в сутки.Продолжительность лечения 1-3 дня. Доза при заражении шистосомами составляет 40 мг/кг один раз в сутки, при однодневном лечении.
Таблетку следует проглотить, не разжевывая, запивая небольшим количеством воды. Рекомендуется принимать препарат до или во время еды. Если лекарство следует пить один раз в день, то лучше всего это делать вечером.

Описание противопоказаний и побочных действий
Многим больным гельминтозами врачи назначают препарат «Бильтрицид».Аналоги его, кстати, более токсичны. Несмотря на то, что препарат действует на организм щадяще, есть некоторые ограничения. В частности, его не назначают детям до четырех лет, а также женщинам в первом триместре беременности. Противопоказания включают цистицеркоз глаз, аллергию на компоненты препарата. Терапию нельзя сочетать с приемом рифампицина. С осторожностью применяют лекарство при наличии нарушений сердечного ритма, декомпенсированной форме печеночной недостаточности, гепатолиенальном шистосомозе.
Что касается побочных эффектов, то они регистрируются редко. Тем не менее некоторые больные иногда жалуются на боли в животе, появление диареи (возможно наличие примеси крови), тошноту и рвоту, снижение аппетита. Возможно развитие лихорадки, появление головных болей и головокружения. Изредка развиваются астения, миалгия, аритмия, генерализованные аллергические реакции.
 Некоторые побочные реакции обусловлены не воздействием препарата на организм, а именно гибелью паразитов, в связи с чем по завершении терапии состояние улучшится.
Некоторые побочные реакции обусловлены не воздействием препарата на организм, а именно гибелью паразитов, в связи с чем по завершении терапии состояние улучшится.Препарат "Бильтрицид": аналоги
Этот препарат достаточно популярен в современной медицинской практике. С другой стороны, не всем больным подходит препарат «Бильтрицид». Аналоги этого средства, безусловно, существуют. Например, в ряде случаев врачи назначают такие препараты, как Медамин, Левамизол, Гельминтокс. В борьбе с гельминтами можно использовать такие средства, как Немозол, Центел, Декарис, Мебендазол и некоторые другие. В любом случае нужно помнить, что аналог может назначить только врач.
Отзывы пациентов о препарате
Естественно, многих интересует мнение пациентов, которые уже лечились Бильтрицидом. Отзывы в основном положительные. Преимущество в том, что лекарство, как правило, принимают не более одного дня. Кроме того, его можно использовать для лечения детей. Побочные эффекты регистрируются очень редко – обычно это быстропроходящие расстройства со стороны пищеварительной системы.
p>> К недостаткам можно отнести не только цену, которая многим пациентам кажется несколько завышенной.С другой стороны, многие аналоги лекарства стоят дороже.
К недостаткам можно отнести не только цену, которая многим пациентам кажется несколько завышенной.С другой стороны, многие аналоги лекарства стоят дороже.результаты клинических испытаний для лечения инфекционных болезней собак и перспективы для человека
Литература
1. Brennan S, Leaper D. Влияние антисептиков на заживление раны: исследование с использованием ушной камеры кролика Br J Surg 1985;72:780–2.Поиск в Google Scholar
2. Baggot J. Выбор противомикробных препаратов, введение и дозировка. J South Afr Vet A 1998; 69: 174–85. Поиск в Google Scholar
3.Ортуньо А., Скорца В., Кастелья Х., Лаппин М. Распространенность кишечных паразитов у приютов и охотничьих собак в Каталонии, на северо-востоке Испании. Vet J 2014;199:465–7.Поиск в Google Scholar
4. Martins C, Barros C, Bier D, Marinho A, Figueiredo J, Hoffmann J, et al. Заболеваемость паразитами у собак и факторы риска по результатам отбора проб после годичного интервала в Пинье.
 Бразилия Rev Bras Parasitol Vet. 2012;21:101–6.Поиск в Google Scholar
Бразилия Rev Bras Parasitol Vet. 2012;21:101–6.Поиск в Google Scholar5. Берсет-Истратеску С., Глардон О., Магурас И., Фрей С., Гобели С., Бургенер И.Последующее наблюдение за 100 собаками с острой диареей в практике первичной медико-санитарной помощи. Vet J. 2014;199:188–90.Поиск в Google Scholar
6. Chatzopoulos D, Athanasiou L, Spyrou V, Fthenakis G, Billinis C. Ротавирусные инфекции у домашних животных. J Hellenic Vet Med Soc 2013;64:145–60.Search in Google Scholar
7. Truszczyński M, Posyniak A, Pejsak Z. Механизмы возникновения резистентности к действию антибиотиков и дезинфицирующих средств у бактерий. Med Wet 2013; 69: 131–5. Поиск в Google Scholar
8.Скотт В. Устойчивость к противомикробным препаратам: время действовать. Vet Rec 2011;169:122–3.Search in Google Scholar
9. Samson-Himmelstjerna G, Blackhall W. Предоставят ли технологии решения для борьбы с лекарственной устойчивостью ветеринарных гельминтов? Vet Parasitol 2005;132:223 – 39.
 Поиск в Google Scholar
Поиск в Google Scholar10. Morley P, Apley M, Besser T, Burney D, Fedorka-Cray P, Papich M, et al. Применение противомикробных препаратов в ветеринарии. J Vet Int Med 2005; 19: 617–29. Поиск в Google Scholar
11.Персонс Д., Хоребеке С., Херманс К., Бутай П., Круиф А., Хазебрук Ф. и др. Метициллин-резистентный золотистый стафилококк у домашней птицы. Emerg Infect Dis 2009;15:452–3.Search in Google Scholar
12. Крутяков Ю., Кудринский А., Оленин А., Лисичкин Г. Синтез и свойства наночастиц серебра: достижения и перспективы. Russ Chem Rev 2008;77:233–57.Поиск в Google Scholar
13. Credé C. Die Verhütung der Augenentzündung der Neugeborenen («Профилактика воспалительных заболеваний глаз у новорожденных»).Arch Gynäkol 1881;17:50–3.Поиск в Google Scholar
14. Баррелл Р. Научный взгляд на использование препаратов серебра для местного применения. Ostomy Wound Manage 2003; 49 (5A Suppl): 19–24. Поиск в Google Scholar
15. Klasen H. Исторический обзор использования серебра при лечении ожогов.
 II. Продлить проценты за серебро. Burns 2000;26:131–8.Поиск в Google Scholar
II. Продлить проценты за серебро. Burns 2000;26:131–8.Поиск в Google Scholar16. Гупта А., Мейнс М., Сильвер С. Влияние галогенидов на опосредованную плазмидами устойчивость к серебру у Escherichia coli.Appl Environ Microbiol 1998;64:5042–5.Поиск в Google Scholar
17. Мацумура Ю., Йошиката К., Кунисаки С., Цучидо Т. Характер бактерицидного действия цеолита серебра и его сравнение с действием нитрата серебра. Appl Environ Microbiol 2003;69:4278–81.Поиск в Google Scholar
18. Morones JR, Elecheguerra JL, Camacho A, Holt K, Kouri JB, Ramirez JT, et al. Бактерицидный эффект наночастиц серебра. Nanotechnology 2005;16:2346–53.Поиск в Google Scholar
19.Раффи М., Хуссейн Ф., Бхатти Т.М., Ахтер Дж.И., Хамид А., Хасан М.М. Антибактериальная характеристика наночастиц серебра против E. coli ATCC-15224. J Mater Sci Technol 2008;24:192–6.Поиск в Google Scholar
20. Де Соуза А., Мехта Д., Ливитт Р.В. Бактерицидная активность комбинаций Silver-Water Dispersion™ с 19 антибиотиками против семи микробных штаммов.
 Curr Sci 2006;91:926–9.Search in Google Scholar
Curr Sci 2006;91:926–9.Search in Google Scholar21. Li P, Wu C, Wu Q, Li J. Синергетические антибактериальные эффекты b-лактамного антибиотика в сочетании с наночастицами серебра.Nanotechnology 2005;16:1912–17.Search in Google Scholar
22. Вертелов Г., Крутяков Ю., Ефременкова О., Оленин А., Лисичкин Г. Универсальный синтез высокобактерицидных наночастиц серебра, стабилизированных мирамистином®. Nanotechnology 2008;19:1–7.Search in Google Scholar
23. Боляхина С.А., Насартдинова Г.Ф., Донченко Н.А., Коробкова Е.А., Денисов А.Н., Крутяков Ю.А. Острая и хроническая токсичность ветеринарного препарата Аргумистин. Sib Bull Agric Sci 2014; 3:95–101. (на русском). Поиск в Google Scholar
24.Коптев ВЮ. Изучение эмбриотоксичности и тератогенности препарата Аргумистин при пероральном введении. Отчет об исследовании. Новосибирск 2014:12. (на русском). Поиск в Google Scholar
25. Кузьмин В.А. Изучение иммунотоксичности ветеринарного препарата Аргумистин при пероральном применении.
 Отчет об исследовании. Санкт-Петербург 2014:20. (in Russ.)Поиск в Google Scholar
Отчет об исследовании. Санкт-Петербург 2014:20. (in Russ.)Поиск в Google Scholar26. Андреева Н.Л. Изучение канцерогенности ветеринарного препарата Аргумистин. Отчет об исследовании. Санкт-Петербург 2014:18. (на русском языке).Поиск в Google Scholar
27. Андреева Н.Л. Изучение фармакокинетики мирамистина в тканях и органах мышей после перорального введения ветеринарного препарата Аргумистин. Отчет об исследовании. Санкт-Петербург 2014:14. (на русском). Поиск в Google Scholar
28. Андреева Н.Л. Оценка остатков мирамистина в тканях и органах кур после перорального введения ветеринарного препарата Аргумистин. Отчет об исследовании. Санкт-Петербург 2014:13. (на русском). Поиск в Google Scholar
29.Андреева НЛ. Оценка остатков мирамистина в коровьем молоке, тканях и органах после интерцистернального и внутриматочного применения ветеринарного препарата Аргумистин. Отчет об исследовании. Санкт-Петербург 2014:19. (на русском). Поиск в Google Scholar
30.
 Демлинг Р.Х., Лесли ДеСанти, доктор медицины. Скорость повторной эпителизации через сетчатые кожные трансплантаты увеличивается при воздействии серебра. Burns 2002; 28:264–6. Поиск в Google Scholar
Демлинг Р.Х., Лесли ДеСанти, доктор медицины. Скорость повторной эпителизации через сетчатые кожные трансплантаты увеличивается при воздействии серебра. Burns 2002; 28:264–6. Поиск в Google Scholar31. Lansdown ABG, Silver 2: токсичность для млекопитающих и то, как ее продукты помогают заживлению ран.J. Wound Care 2002; 11:173–7. Поиск в Google Scholar
32. Lansdown ABG. Металлотионины: потенциальные терапевтические средства для заживления ран на коже. Wound Repair Regen 2002; 10:130–2. Поиск в Google Scholar
33. Nadworny PL, Wang J, Tredget EE, Burrell RE. Противовоспалительная активность нанокристаллического серебра в модели контактного дерматита свиней. Naomed Nanotechnol Biol Med 2008;4:241–251.Поиск в Google Scholar
34. Bhol KC, Schechter PJ. Крем с нанокристаллическим серебром для местного применения подавляет воспалительные цитокины и индуцирует апоптоз воспалительных клеток в мышиной модели аллергического контактного дерматита.Br J Dermatol 2005;152:1235–42.
 Поиск в Google Scholar
Поиск в Google Scholar35. Wright JB, Lam K, Buret AG, Olson ME, Burrell RE. События раннего заживления в свиной модели загрязненных ран: влияние нанокристаллического серебра на металлопротеиназы матрикса, клеточный апоптоз и заживление. Wound Repair Regen 2002;10:141–51.Поиск в Google Scholar
Pharmaceuticals | Бесплатный полнотекстовый | Иммунный патогенез интоксикации COVID-19: буря или молчание?
1. Введение
COVID-19 (коронавирусная болезнь 2019 г.) была впервые официально зарегистрирована в Китае в декабре 2019 г. и является одной из самых распространенных и агрессивных инфекций наряду с SARS (тяжелый острый респираторный синдром) и MERS (ближневосточный респираторный синдром). синдром) [1,2].Согласно открытым наборам данных COVID-19 (например, набору данных Kaggle COVID-19) к июлю 2020 года во всем мире было зарегистрировано более 14,5 миллионов подтвержденных случаев заболевания COVID-19, а уровень смертности составил 608 000 человек. В 2002 году примерно 8000 человек были инфицированы SARS-CoV (коронавирус, связанный с тяжелым острым респираторным синдромом) в провинции Гуандун в Китае, при этом уровень смертности составил 10%. В 2012 г. вторая вспышка инфекции была вызвана БВРС-КоВ [3]. Эти три коронавируса SARS-CoV, MERS-CoV и SARS-CoV-2 вызывали сухой кашель, дистресс, миалгию и головную боль.У пациентов с тяжелым течением заболевания развился выраженный тяжелый острый респираторный синдром и респираторный дистресс-синдром (ОРДС) [4,5,6,7,8]. Иммунная система играет важную роль в борьбе с вирусной инфекцией. Однако чрезмерный иммунный ответ может привести к системной воспалительной реакции, органным нарушениям и полиорганной недостаточности (ПОН) (рис. 1). Чрезмерный или аномальный иммунный ответ может способствовать развитию атипичной пневмонии. Об этой связи свидетельствует тот факт, что степень дыхательной недостаточности увеличивается, несмотря на снижение вирусной нагрузки [9].Кроме того, прогрессирование ОРДС связано с повышением уровня циркулирующих медиаторов воспаления, которые вызывают такие опасные осложнения COVID-19, как системный воспалительный ответ и сепсисоподобные состояния [10,11,12].
В 2002 году примерно 8000 человек были инфицированы SARS-CoV (коронавирус, связанный с тяжелым острым респираторным синдромом) в провинции Гуандун в Китае, при этом уровень смертности составил 10%. В 2012 г. вторая вспышка инфекции была вызвана БВРС-КоВ [3]. Эти три коронавируса SARS-CoV, MERS-CoV и SARS-CoV-2 вызывали сухой кашель, дистресс, миалгию и головную боль.У пациентов с тяжелым течением заболевания развился выраженный тяжелый острый респираторный синдром и респираторный дистресс-синдром (ОРДС) [4,5,6,7,8]. Иммунная система играет важную роль в борьбе с вирусной инфекцией. Однако чрезмерный иммунный ответ может привести к системной воспалительной реакции, органным нарушениям и полиорганной недостаточности (ПОН) (рис. 1). Чрезмерный или аномальный иммунный ответ может способствовать развитию атипичной пневмонии. Об этой связи свидетельствует тот факт, что степень дыхательной недостаточности увеличивается, несмотря на снижение вирусной нагрузки [9].Кроме того, прогрессирование ОРДС связано с повышением уровня циркулирующих медиаторов воспаления, которые вызывают такие опасные осложнения COVID-19, как системный воспалительный ответ и сепсисоподобные состояния [10,11,12]. На поздних стадиях заболевания у больных может развиться легочная недостаточность и ПОН с острой дисфункцией печени и почек, гипоксической энцефалопатией, диссеминированным внутрисосудистым свертыванием крови/тромбоэмболической болезнью (ДВС-синдром) и септическим шоком. Развитие этих осложнений тесно связано с летальными исходами у больных COVID-19.Следовательно, эта инфекция может вызывать как ОРДС, так и системные воспалительные реакции, приводящие к ПОН. «Цитокиновый шторм», который может индуцировать системный воспалительный ответ, вирус-ассоциированный сепсис, воспалительные заболевания легких, такие как пневмонит или ОРДС, шок и органная или ПОН, играет важную роль в патогенезе COVID-19, который аналогичен таковому. показано для SARS и MERS (рис. 1). Еще одним симптомом тяжелого течения коронавирусной инфекции является лимфопения, которая может стать критической на поздних стадиях заболевания [13,14].
На поздних стадиях заболевания у больных может развиться легочная недостаточность и ПОН с острой дисфункцией печени и почек, гипоксической энцефалопатией, диссеминированным внутрисосудистым свертыванием крови/тромбоэмболической болезнью (ДВС-синдром) и септическим шоком. Развитие этих осложнений тесно связано с летальными исходами у больных COVID-19.Следовательно, эта инфекция может вызывать как ОРДС, так и системные воспалительные реакции, приводящие к ПОН. «Цитокиновый шторм», который может индуцировать системный воспалительный ответ, вирус-ассоциированный сепсис, воспалительные заболевания легких, такие как пневмонит или ОРДС, шок и органная или ПОН, играет важную роль в патогенезе COVID-19, который аналогичен таковому. показано для SARS и MERS (рис. 1). Еще одним симптомом тяжелого течения коронавирусной инфекции является лимфопения, которая может стать критической на поздних стадиях заболевания [13,14].До сих пор не было представлено эффективного специфического противовирусного лечения COVID-19.
 Поэтому особенно полезной может быть поддерживающая терапия, облегчающая симптомы и поддерживающая функции многих органов. Противовирусные препараты, такие как осельтамивир, арбидол, лопинавир/ритонавир и интерферон-α, продемонстрировали определенный эффект в моно- или комбинированной терапии. Однако глюкокортикоидная терапия, направленная на сдерживание «цитокинового шторма», не дала зарегистрированного клинического эффекта. Иммуноглобулиновая терапия также показала низкую эффективность.Таким образом, выявление групп высокого риска и/или как можно более раннее начало лечения имеют решающее значение для снижения уровня смертности.
Поэтому особенно полезной может быть поддерживающая терапия, облегчающая симптомы и поддерживающая функции многих органов. Противовирусные препараты, такие как осельтамивир, арбидол, лопинавир/ритонавир и интерферон-α, продемонстрировали определенный эффект в моно- или комбинированной терапии. Однако глюкокортикоидная терапия, направленная на сдерживание «цитокинового шторма», не дала зарегистрированного клинического эффекта. Иммуноглобулиновая терапия также показала низкую эффективность.Таким образом, выявление групп высокого риска и/или как можно более раннее начало лечения имеют решающее значение для снижения уровня смертности.По данным базы данных MEDLINE (PubMed) в 2020 г. (по состоянию на июль 2020 г.) было опубликовано более 150 клинических исследований и обзоров, описывающих нарушения иммунной системы, составляющие основную часть патогенеза коронавируса, при COVID-19 пациенты.
Однако иммунные механизмы, вызывающие системную воспалительную реакцию, недостаточность органов и полиорганную недостаточность у пациентов с COVID-19, до сих пор неизвестны.
 Таким образом, лучшее понимание патогенеза иммунных заболеваний имеет решающее значение для обеспечения научной основы для достижения эффективного лечения инфекции. Мы тематически фокусируемся на иммунопатогенезе COVID-19 и родственных CoV, клинических исследованиях и прогностических иммунологических маркерах, а также текущих и перспективных иммунотерапевтических стратегиях.
Таким образом, лучшее понимание патогенеза иммунных заболеваний имеет решающее значение для обеспечения научной основы для достижения эффективного лечения инфекции. Мы тематически фокусируемся на иммунопатогенезе COVID-19 и родственных CoV, клинических исследованиях и прогностических иммунологических маркерах, а также текущих и перспективных иммунотерапевтических стратегиях.2. COVID-19 у онкологических больных
Предполагается, что заражение COVID-19 подразумевает повышенный риск для онкологических больных, особенно для тех, кто недавно получил химиотерапию, лучевую терапию и иммунотерапию [15].Лян В. и др. [16] показали, что у онкологических больных повышен риск развития тяжелых осложнений коронавирусной инфекции, требующих инвазивной вентиляции, а также более высокая смертность по сравнению с неонкологическими больными. Кроме того, пациенты, получавшие химиотерапию или операцию в течение месяца, имели более высокий риск развития тяжелого заболевания по сравнению с онкологическими больными, не получавшими противоопухолевого лечения. Аналогичные данные были получены в ретроспективном многоцентровом исследовании, в которое были включены 67 онкологических больных с COVID-19 из больниц города Ухань, провинция Хубэй, Китай.Исследование показало, что у большей части онкологических больных с COVID-19 по сравнению с неонкологическими пациентами развилось тяжелое течение заболевания и прогноз был неблагоприятным. Тенденция к неблагоприятному прогнозу была более выражена у пациентов, прошедших курс противоопухолевого лечения [17]. Также было установлено, что госпитализация и повторные визиты в больницу являются потенциальным фактором риска развития COVID-19 [18]. В целом 48-54% онкологических больных были подвержены более высокому риску тяжелых событий и от 5,6% до 29% случаев были подвержены риску смерти [19].Тем не менее, интересно отметить, что у пациентов с раком легких не было более высокого риска тяжелых осложнений по сравнению с другими типами рака. Онкологические больные, получающие иммунотерапию ингибиторами контрольных точек, также могут иметь повышенный риск тяжелых осложнений коронавирусной инфекции в результате иммуноопосредованных событий, вызванных «цитокиновым штормом».
Аналогичные данные были получены в ретроспективном многоцентровом исследовании, в которое были включены 67 онкологических больных с COVID-19 из больниц города Ухань, провинция Хубэй, Китай.Исследование показало, что у большей части онкологических больных с COVID-19 по сравнению с неонкологическими пациентами развилось тяжелое течение заболевания и прогноз был неблагоприятным. Тенденция к неблагоприятному прогнозу была более выражена у пациентов, прошедших курс противоопухолевого лечения [17]. Также было установлено, что госпитализация и повторные визиты в больницу являются потенциальным фактором риска развития COVID-19 [18]. В целом 48-54% онкологических больных были подвержены более высокому риску тяжелых событий и от 5,6% до 29% случаев были подвержены риску смерти [19].Тем не менее, интересно отметить, что у пациентов с раком легких не было более высокого риска тяжелых осложнений по сравнению с другими типами рака. Онкологические больные, получающие иммунотерапию ингибиторами контрольных точек, также могут иметь повышенный риск тяжелых осложнений коронавирусной инфекции в результате иммуноопосредованных событий, вызванных «цитокиновым штормом». Это наблюдение демонстрирует сходство механизмов иммунных дисфункций, возникающих в результате осложнений COVID-19 и противоопухолевой терапии ингибиторами иммунных контрольных точек (ИКИ) [20].Однако восприимчивость к бактериальным или вирусным инфекциям у онкологических больных при терапии ИКИ изучена недостаточно широко. С одной стороны, в отличие от химиотерапии, иммунотерапия ICI может восстановить компетентность клеточного иммунитета [21]. Однако, с другой стороны, существуют опасения по поводу лечения пациентов с COVID-19 с помощью ИКИ, поскольку пневмонит, вызванный ИКИ, может усугубить вирусную пневмонию. Вероятно, суммируются эффекты гиперпродукции индуцированных ИКИ медиаторов воспаления и вирусной инфекции, что может привести к фатальным последствиям [22].Также предполагается, что адоптивная иммунотерапия генетически модифицированными CAR-T-клетками (Т-клетками с химерными антигенными рецепторами) увеличивает риск неблагоприятного исхода у онкологических больных с COVID-19, при этом учитывается тот факт, что «цитокиновый шторм» представляет собой частый неблагоприятный эффект CAR-T-клеточной терапии [23].
Это наблюдение демонстрирует сходство механизмов иммунных дисфункций, возникающих в результате осложнений COVID-19 и противоопухолевой терапии ингибиторами иммунных контрольных точек (ИКИ) [20].Однако восприимчивость к бактериальным или вирусным инфекциям у онкологических больных при терапии ИКИ изучена недостаточно широко. С одной стороны, в отличие от химиотерапии, иммунотерапия ICI может восстановить компетентность клеточного иммунитета [21]. Однако, с другой стороны, существуют опасения по поводу лечения пациентов с COVID-19 с помощью ИКИ, поскольку пневмонит, вызванный ИКИ, может усугубить вирусную пневмонию. Вероятно, суммируются эффекты гиперпродукции индуцированных ИКИ медиаторов воспаления и вирусной инфекции, что может привести к фатальным последствиям [22].Также предполагается, что адоптивная иммунотерапия генетически модифицированными CAR-T-клетками (Т-клетками с химерными антигенными рецепторами) увеличивает риск неблагоприятного исхода у онкологических больных с COVID-19, при этом учитывается тот факт, что «цитокиновый шторм» представляет собой частый неблагоприятный эффект CAR-T-клеточной терапии [23]. Иммунодефицит, возникающий у детей с онкологическими заболеваниями, получающих противоопухолевое лечение, может представлять потенциальный риск тяжелых осложнений COVID-19. Однако несколько зарегистрированных случаев COVID-19 у детей, получающих противоопухолевое лечение, были описаны как бессимптомные или с легкими симптомами [24].Более того, некоторые данные показали, что пациенты, к которым относятся как взрослые, так и дети с угнетением иммунной системы в результате развития злокачественных новообразований, противоопухолевой терапии и трансплантации, достигли благоприятного эффекта в лечении COVID-19 по сравнению с пациентами с другими сопутствующими заболеваниями. Такие результаты можно объяснить отсутствием гиперэкспрессии воспалительных реакций за счет подавления иммунного ответа, что определяет слабое проявление заболевания, вызванного SARS-CoV-2 [25].Несмотря на редкое сочетание рака и COVID-19 у детей, стоит обратить более пристальное внимание на две группы пациентов — детей первого года жизни и детей с острым лимфобластным лейкозом (ОЛЛ), получающих поддерживающую терапию.
Иммунодефицит, возникающий у детей с онкологическими заболеваниями, получающих противоопухолевое лечение, может представлять потенциальный риск тяжелых осложнений COVID-19. Однако несколько зарегистрированных случаев COVID-19 у детей, получающих противоопухолевое лечение, были описаны как бессимптомные или с легкими симптомами [24].Более того, некоторые данные показали, что пациенты, к которым относятся как взрослые, так и дети с угнетением иммунной системы в результате развития злокачественных новообразований, противоопухолевой терапии и трансплантации, достигли благоприятного эффекта в лечении COVID-19 по сравнению с пациентами с другими сопутствующими заболеваниями. Такие результаты можно объяснить отсутствием гиперэкспрессии воспалительных реакций за счет подавления иммунного ответа, что определяет слабое проявление заболевания, вызванного SARS-CoV-2 [25].Несмотря на редкое сочетание рака и COVID-19 у детей, стоит обратить более пристальное внимание на две группы пациентов — детей первого года жизни и детей с острым лимфобластным лейкозом (ОЛЛ), получающих поддерживающую терапию. В ограниченном опыте наблюдения зарегистрированы летальные исходы в обеих группах. Вероятно, эти неудовлетворительные результаты были обусловлены выраженной иммунной дисфункцией, которая была обусловлена, с одной стороны, возрастной незрелостью иммунной системы, а с другой - несостоятельностью лимфоцитарного звена иммунитета.Италия имеет свой особый опыт лечения детей с онкологическими заболеваниями и после трансплантации гемопоэтических стволовых клеток с сопутствующей коронавирусной инфекцией. Так, Balduzzi A. et al. описали относительно легкое течение COVID-19 у детей с острым лимфобластным лейкозом, остеосаркомой и рабдоидной опухолью [26]. Пациенты, включенные в исследование, имели стандартный риск заболевания. Таким образом, авторы сделали вывод о легкой форме инфекции COVID-19 в этой когорте [26]. Исследование Лян В.и другие. проанализировали 18 пациентов с COVID-19 и раком в анамнезе [16]. Авторы продемонстрировали более тяжелое течение COVID-19 у онкологических больных и, как следствие, худший исход заболевания.
В ограниченном опыте наблюдения зарегистрированы летальные исходы в обеих группах. Вероятно, эти неудовлетворительные результаты были обусловлены выраженной иммунной дисфункцией, которая была обусловлена, с одной стороны, возрастной незрелостью иммунной системы, а с другой - несостоятельностью лимфоцитарного звена иммунитета.Италия имеет свой особый опыт лечения детей с онкологическими заболеваниями и после трансплантации гемопоэтических стволовых клеток с сопутствующей коронавирусной инфекцией. Так, Balduzzi A. et al. описали относительно легкое течение COVID-19 у детей с острым лимфобластным лейкозом, остеосаркомой и рабдоидной опухолью [26]. Пациенты, включенные в исследование, имели стандартный риск заболевания. Таким образом, авторы сделали вывод о легкой форме инфекции COVID-19 в этой когорте [26]. Исследование Лян В.и другие. проанализировали 18 пациентов с COVID-19 и раком в анамнезе [16]. Авторы продемонстрировали более тяжелое течение COVID-19 у онкологических больных и, как следствие, худший исход заболевания. В различных научных статьях описаны общие меры профилактики и лечения COVID-19 у детей с онкологическими заболеваниями, которые соответствуют рекомендуемым для противоинфекционного лечения населения в целом [27]. Однако авторы предлагают продолжать терапию как можно полнее, но воздерживаться от интенсивной химиотерапии и особенно иммунотерапии у детей с онкологическими заболеваниями в стадии ремиссии.
В различных научных статьях описаны общие меры профилактики и лечения COVID-19 у детей с онкологическими заболеваниями, которые соответствуют рекомендуемым для противоинфекционного лечения населения в целом [27]. Однако авторы предлагают продолжать терапию как можно полнее, но воздерживаться от интенсивной химиотерапии и особенно иммунотерапии у детей с онкологическими заболеваниями в стадии ремиссии.3. Лимфопения — как прогностический маркер тяжести COVID-19 и иммуносупрессии
Лимфопения указывает на степень прогрессирования заболевания. Он зарегистрирован у 85% больных COVID-19 в критическом состоянии, что обеспечивает наиболее значимую прогностическую ценность в отношении других характеристик лабораторных тестов [28]. Прогностическим параметром можно считать как относительное, так и абсолютное количество лимфоцитов в периферической крови. Относительное количество лимфоцитов у больных с тяжелой вирусной интоксикацией снижалось до 5% в течение двух недель после начала заболевания и увеличивалось примерно до 10% в период выздоровления. Однако у больных с умеренной интоксикацией отклонения этого показателя были незначительными [29]. Снижение относительного количества лимфоцитов до уровня ниже 20% у больных COVID-19 в течение первых 10–12 дней заболевания считается неблагоприятным прогностическим фактором, а снижение лимфоцитов ниже 5% связано с высоким риском летального исхода. и эти больные нуждаются в интенсивной терапии. У пациентов в отделениях интенсивной терапии среднее количество лимфоцитов составляло 800 клеток/мкл. В тяжелых случаях абсолютное число лимфоцитов резко снижалось до 100 клеток/мкл [30,31].Как правило, у умерших больных в отличие от выздоровевших наблюдалась стойкая и тяжелая лимфопения. Эти данные свидетельствуют о том, что интоксикация COVID-19 приводит к нарушениям иммунного статуса пациентов, что вызывает иммуносупрессивные состояния и может привести к иммунному параличу. Хотя у большинства пациентов с коронавирусом была лимфопения, у них не было значительных изменений количества нейтрофилов в крови.
Однако у больных с умеренной интоксикацией отклонения этого показателя были незначительными [29]. Снижение относительного количества лимфоцитов до уровня ниже 20% у больных COVID-19 в течение первых 10–12 дней заболевания считается неблагоприятным прогностическим фактором, а снижение лимфоцитов ниже 5% связано с высоким риском летального исхода. и эти больные нуждаются в интенсивной терапии. У пациентов в отделениях интенсивной терапии среднее количество лимфоцитов составляло 800 клеток/мкл. В тяжелых случаях абсолютное число лимфоцитов резко снижалось до 100 клеток/мкл [30,31].Как правило, у умерших больных в отличие от выздоровевших наблюдалась стойкая и тяжелая лимфопения. Эти данные свидетельствуют о том, что интоксикация COVID-19 приводит к нарушениям иммунного статуса пациентов, что вызывает иммуносупрессивные состояния и может привести к иммунному параличу. Хотя у большинства пациентов с коронавирусом была лимфопения, у них не было значительных изменений количества нейтрофилов в крови. Повышенное отношение нейтрофилов к лимфоцитам (N/L) наблюдалось у больных с тяжелой степенью заболевания и лимфопенией, что считается четким маркером системного воспаления.Так, у больных с сепсисом высокое отношение N/L коррелировало с тяжестью заболевания по шкале APACHE II и 28-дневной летальностью [32]. Эти данные свидетельствуют о том, что повышенное отношение N/L связано с неблагоприятным исходом у пациентов с COVID-19. У пациентов с COVID-19, особенно с тяжелым течением, лимфопения развивалась преимущественно в результате снижения CD4 + Th (T помощник) номер сотового. Однако числа CD8 + Т-клеток и В-клеток не показали значительных изменений.Выраженная лимфопения была связана не только со сниженным числом CD3 + CD 4 + Т-клеток, но и с ингибированием их дифференцировки в эффекторные клетки памяти из наивных CD4 + Т-клеток, которые играют особенно важную роль в адаптивном противоинфекционном иммунитете. Хорошо известно, что баланс между наивными CD4 + Th-клетками и Т-клетками памяти имеет решающее значение для развития эффективного иммунного ответа [33].
Повышенное отношение нейтрофилов к лимфоцитам (N/L) наблюдалось у больных с тяжелой степенью заболевания и лимфопенией, что считается четким маркером системного воспаления.Так, у больных с сепсисом высокое отношение N/L коррелировало с тяжестью заболевания по шкале APACHE II и 28-дневной летальностью [32]. Эти данные свидетельствуют о том, что повышенное отношение N/L связано с неблагоприятным исходом у пациентов с COVID-19. У пациентов с COVID-19, особенно с тяжелым течением, лимфопения развивалась преимущественно в результате снижения CD4 + Th (T помощник) номер сотового. Однако числа CD8 + Т-клеток и В-клеток не показали значительных изменений.Выраженная лимфопения была связана не только со сниженным числом CD3 + CD 4 + Т-клеток, но и с ингибированием их дифференцировки в эффекторные клетки памяти из наивных CD4 + Т-клеток, которые играют особенно важную роль в адаптивном противоинфекционном иммунитете. Хорошо известно, что баланс между наивными CD4 + Th-клетками и Т-клетками памяти имеет решающее значение для развития эффективного иммунного ответа [33]. У пациентов с тяжелой формой COVID-19 было снижено количество Т-регуляторных (Treg) клеток, которые играют ключевую роль в ослаблении чрезмерного воспалительного ответа на вирусную инфекцию [34,35,36].Авторы сообщают, что у пациентов с COVID-19 наблюдали повышенную экспрессию маркеров активации Т-клеток, таких как CD69 и CD38, играющих важную роль в клональной экспансии лимфоцитов и продукции различных цитокинов, в том числе провоспалительных [37]. ,38,39]. В частности, в предыдущих исследованиях было установлено, что активированные Т-лимфоциты имеют повышенную продукцию ИЛ-2, ИФН-γ и высокий уровень внутриклеточных цитокинов, таких как ИЛ-6 и ГМ-КСФ (гранулоцитарно-макрофагальный колониестимулирующий фактор). ), которые играют основную роль в индукции «цитокинового шторма» при коронавирусных инфекциях [40,41,42,43].С другой стороны, некоторые авторы показали, что Treg-клетки, экспрессирующие маркеры активации CD38 и CD69, характеризуются повышенной супрессорной активностью и, следовательно, повышенной продукцией IL-10 по сравнению с наивными Treg [44].
У пациентов с тяжелой формой COVID-19 было снижено количество Т-регуляторных (Treg) клеток, которые играют ключевую роль в ослаблении чрезмерного воспалительного ответа на вирусную инфекцию [34,35,36].Авторы сообщают, что у пациентов с COVID-19 наблюдали повышенную экспрессию маркеров активации Т-клеток, таких как CD69 и CD38, играющих важную роль в клональной экспансии лимфоцитов и продукции различных цитокинов, в том числе провоспалительных [37]. ,38,39]. В частности, в предыдущих исследованиях было установлено, что активированные Т-лимфоциты имеют повышенную продукцию ИЛ-2, ИФН-γ и высокий уровень внутриклеточных цитокинов, таких как ИЛ-6 и ГМ-КСФ (гранулоцитарно-макрофагальный колониестимулирующий фактор). ), которые играют основную роль в индукции «цитокинового шторма» при коронавирусных инфекциях [40,41,42,43].С другой стороны, некоторые авторы показали, что Treg-клетки, экспрессирующие маркеры активации CD38 и CD69, характеризуются повышенной супрессорной активностью и, следовательно, повышенной продукцией IL-10 по сравнению с наивными Treg [44]. Подобно состояниям у пациентов с сепсисом, снижение экспрессии HLA-DR на моноцитах CD14 + , что подавляет их антигенпрезентирующую функцию и предотвращает индукцию адаптивного иммунного ответа, представляет собой показатель тяжелых иммуносупрессивных состояний, которые приводят к иммунный паралич у пациентов с COVID-19 [45].Эти данные демонстрируют дисрегуляцию иммунных реакций у больных COVID-19 в критической стадии, проявляющуюся избыточной продукцией как провоспалительных, так и супрессорных биорегуляторов, во многом определяющих иммунный патогенез инфекции (рис. 1).
Подобно состояниям у пациентов с сепсисом, снижение экспрессии HLA-DR на моноцитах CD14 + , что подавляет их антигенпрезентирующую функцию и предотвращает индукцию адаптивного иммунного ответа, представляет собой показатель тяжелых иммуносупрессивных состояний, которые приводят к иммунный паралич у пациентов с COVID-19 [45].Эти данные демонстрируют дисрегуляцию иммунных реакций у больных COVID-19 в критической стадии, проявляющуюся избыточной продукцией как провоспалительных, так и супрессорных биорегуляторов, во многом определяющих иммунный патогенез инфекции (рис. 1).4. Цитокиновая буря
Цитокины и хемокины являются особенно важными факторами подавления или повышения иммунитета и иммунопатологии при вирусных инфекциях [46]. Хотя прямых доказательств присутствия провоспалительных цитокинов и хемокинов в патологии легких у пациентов с коронавирусной инфекцией нет, изменения в результатах лабораторных исследований, такие как повышенный уровень цитокинов и хемокинов в сыворотке крови у инфицированных пациентов, коррелировали со степенью тяжести заболевания и плохой исход, который раскрывает роль чрезмерных воспалительных реакций в патогенезе COVID-19 [47]. В частности, уровни циркулирующего IL-6 тесно связаны с тяжестью течения COVID-19. Повышенные концентрации ИЛ-6 наблюдались у пациентов с тяжелым респираторным дистресс-синдромом. Ульхак З.С. и соавт. [48] провели метаанализ девяти исследований и показали, что, несмотря на гетерогенность включенных когорт, уровни ИЛ-6 были достоверно выше у пациентов с тяжелыми явлениями по сравнению с пациентами с легкой или средней степенями тяжести заболевания. Избыточная продукция IL-6, как было показано ранее, приводит к ингибированию поверхностной экспрессии HLA-DR (человеческий лейкоцитарный антиген – изотип DR) на моноцитах CD14 + [49].Вероятно, такие же процессы происходят у пациентов с COVID-19, и, таким образом, гиперпродукция ИЛ-6 опосредует низкую экспрессию HLA-DR на моноцитах CD14 + . Повышение концентрации растворимых рецепторов к ИЛ-2, ИЛ-8, ИЛ -10 и ФНО-α (фактор некроза опухоли альфа) регистрировались в дополнение к повышенному уровню ИЛ-6 в сыворотке крови [47], тогда как ИЛ-1β у большинства пациентов не определялся [12].
В частности, уровни циркулирующего IL-6 тесно связаны с тяжестью течения COVID-19. Повышенные концентрации ИЛ-6 наблюдались у пациентов с тяжелым респираторным дистресс-синдромом. Ульхак З.С. и соавт. [48] провели метаанализ девяти исследований и показали, что, несмотря на гетерогенность включенных когорт, уровни ИЛ-6 были достоверно выше у пациентов с тяжелыми явлениями по сравнению с пациентами с легкой или средней степенями тяжести заболевания. Избыточная продукция IL-6, как было показано ранее, приводит к ингибированию поверхностной экспрессии HLA-DR (человеческий лейкоцитарный антиген – изотип DR) на моноцитах CD14 + [49].Вероятно, такие же процессы происходят у пациентов с COVID-19, и, таким образом, гиперпродукция ИЛ-6 опосредует низкую экспрессию HLA-DR на моноцитах CD14 + . Повышение концентрации растворимых рецепторов к ИЛ-2, ИЛ-8, ИЛ -10 и ФНО-α (фактор некроза опухоли альфа) регистрировались в дополнение к повышенному уровню ИЛ-6 в сыворотке крови [47], тогда как ИЛ-1β у большинства пациентов не определялся [12]. К. Хуанг и соавт. изучали цитокины и хемокины у пациентов с COVID-19 и показали, что более высокие концентрации IL-2, IL-7, IL-10, G-CSF (гранулоцитарный колониестимулирующий фактор), IP10 (INF-γ-индуцируемый белок 10), В плазме больных с тяжелой степенью инфекции были зарегистрированы MCP1 (моноцитарный хемоаттрактантный белок 1), MIP1A (макрофагальный воспалительный белок 1 альфа) и TNF-α [50].Чжоу Ю. и соавт. [41] проанализировали иммунные параметры пациентов с COVID-19, особенно пациентов с тяжелой инфекцией и неблагоприятным исходом, и показали, что у них также были повышенные концентрации в сыворотке цитокинов, связанных с воспалением, включая IL-2, IL-7, IL-10, G –CSF, IP10, MCP1, MIP1A и TNF-α. Некоторые авторы упоминали о гиперпродукции других медиаторов воспаления, таких как ИЛ-12, ИЛ-13, ИЛ-17, ИФН-γ, МСР1, фактора роста гепатоцитов (HGF), TNF-α и фактора роста эндотелия сосудов (VEGF). ) [51].Чрезмерно активированный иммунный ответ может быть вызван патогенными клетками GM-CSF+Th2 и индуцированными или воспалительными CD14 + CD16 + моноцитами/макрофагами, которые играют важную роль в легочной иммунопатологии и системной воспалительной реакции у пациентов с COVID -19.
К. Хуанг и соавт. изучали цитокины и хемокины у пациентов с COVID-19 и показали, что более высокие концентрации IL-2, IL-7, IL-10, G-CSF (гранулоцитарный колониестимулирующий фактор), IP10 (INF-γ-индуцируемый белок 10), В плазме больных с тяжелой степенью инфекции были зарегистрированы MCP1 (моноцитарный хемоаттрактантный белок 1), MIP1A (макрофагальный воспалительный белок 1 альфа) и TNF-α [50].Чжоу Ю. и соавт. [41] проанализировали иммунные параметры пациентов с COVID-19, особенно пациентов с тяжелой инфекцией и неблагоприятным исходом, и показали, что у них также были повышенные концентрации в сыворотке цитокинов, связанных с воспалением, включая IL-2, IL-7, IL-10, G –CSF, IP10, MCP1, MIP1A и TNF-α. Некоторые авторы упоминали о гиперпродукции других медиаторов воспаления, таких как ИЛ-12, ИЛ-13, ИЛ-17, ИФН-γ, МСР1, фактора роста гепатоцитов (HGF), TNF-α и фактора роста эндотелия сосудов (VEGF). ) [51].Чрезмерно активированный иммунный ответ может быть вызван патогенными клетками GM-CSF+Th2 и индуцированными или воспалительными CD14 + CD16 + моноцитами/макрофагами, которые играют важную роль в легочной иммунопатологии и системной воспалительной реакции у пациентов с COVID -19. Повышенный уровень провоспалительных биорегуляторов у инфицированных пациентов приводил к активации Th2-пути клеточного иммунного ответа. Однако инфекция COVID-19 также инициировала повышенную секрецию цитокинов Th3, таких как IL-4 и IL-10 [52].Таким образом, эти результаты демонстрируют, что определение уровней циркулирующих цитокинов и, в частности, ИЛ-6 и ГМ-КСФ, может иметь решающее значение для прогноза прогрессирования заболевания у пациентов с COVID-19. Кроме того, медиаторы воспаления являются потенциальными мишенями для противоинфекционной терапии COVID-19.
Повышенный уровень провоспалительных биорегуляторов у инфицированных пациентов приводил к активации Th2-пути клеточного иммунного ответа. Однако инфекция COVID-19 также инициировала повышенную секрецию цитокинов Th3, таких как IL-4 и IL-10 [52].Таким образом, эти результаты демонстрируют, что определение уровней циркулирующих цитокинов и, в частности, ИЛ-6 и ГМ-КСФ, может иметь решающее значение для прогноза прогрессирования заболевания у пациентов с COVID-19. Кроме того, медиаторы воспаления являются потенциальными мишенями для противоинфекционной терапии COVID-19.5. Иммунопатогенез острого респираторного дистресс-синдрома и системного воспалительного ответа, включая синдром активации макрофагов
На первом этапе вирусной инфекции и в течение всего инфекционного процесса в элиминации вируса участвуют эффекторы врожденного иммунитета, NK (естественные киллеры), и γδT-клетки, которые могут распознавать и лизировать инфицированные вирусом клетки, пропуская стадию презентации антигена, а также рекрутируя нейтрофилы, моноциты и макрофаги в участок, связанный с инфекцией, посредством продукции цитокинов и хемокинов (рис. 1).С одной стороны, привлечение различных клеток врожденного иммунитета к очагу инфекции обеспечивает элиминацию вируса и запускает адаптивные иммунные реакции путем презентации антигена. Однако эти иммуноциты могут оказывать вторичное повреждающее действие, при котором высвобождается большое количество активных медиаторов и активных форм кислорода. Активные медиаторы и активные формы кислорода разрушают не только инфицированные вирусом клетки, но и соседние интактные клетки (рис. 1). Чрезмерная продукция биоактивных молекул может вызывать системную воспалительную реакцию, органную недостаточность и ПОН, а также вызывать иммуносупрессию в результате апоптоз лимфоцитов.Наряду с этим развивающаяся лимфопения, в основном в результате активности Th-клеток, препятствует формированию адаптивного иммунного ответа, а элиминация вируса эффекторами врожденного иммунитета малоэффективна из-за неспецифического механизма их действия. Повышенный уровень ИЛ-6 дополнительно нарушает функции естественных киллеров (НК) [53].
1).С одной стороны, привлечение различных клеток врожденного иммунитета к очагу инфекции обеспечивает элиминацию вируса и запускает адаптивные иммунные реакции путем презентации антигена. Однако эти иммуноциты могут оказывать вторичное повреждающее действие, при котором высвобождается большое количество активных медиаторов и активных форм кислорода. Активные медиаторы и активные формы кислорода разрушают не только инфицированные вирусом клетки, но и соседние интактные клетки (рис. 1). Чрезмерная продукция биоактивных молекул может вызывать системную воспалительную реакцию, органную недостаточность и ПОН, а также вызывать иммуносупрессию в результате апоптоз лимфоцитов.Наряду с этим развивающаяся лимфопения, в основном в результате активности Th-клеток, препятствует формированию адаптивного иммунного ответа, а элиминация вируса эффекторами врожденного иммунитета малоэффективна из-за неспецифического механизма их действия. Повышенный уровень ИЛ-6 дополнительно нарушает функции естественных киллеров (НК) [53]. Симптомы COVID-19 у инфицированных пациентов варьируют от лихорадки, головной боли, утомляемости и др. до ДВС-синдрома, шока и ПОН. Развитие болезни от легкой до тяжелой у пациентов с COVID-19 может быть обусловлено «цитокиновым штормом», который в основном определяется активацией макрофагов.Макрофаги являются ключевыми продуцентами цитокинов, в том числе ИЛ-6 и других медиаторов воспаления, в ответ на вирусные инфекции, вызывающие «цитокиновый шторм» и системные воспалительные реакции [54]. Синдром активации макрофагов (MAS) подробно описан у пациентов с аутоиммунными заболеваниями, такими как ювенильный идиопатический артрит и системная красная волчанка [55]. , клиническая картина аналогична интоксикации, вызванной COVID-19.Одним из основных симптомов MAS является гемофагоцитоз, который представляет собой поглощение клеток крови, включая эритроциты, лейкоциты или тромбоциты в костном мозге, печенью и селезенкой CD163 + макрофаги и/или гистиоциты, экспрессирующие высокоаффинный комплекс рецептор-мусорщик гемоглобин-гаптоглобин [56].
Симптомы COVID-19 у инфицированных пациентов варьируют от лихорадки, головной боли, утомляемости и др. до ДВС-синдрома, шока и ПОН. Развитие болезни от легкой до тяжелой у пациентов с COVID-19 может быть обусловлено «цитокиновым штормом», который в основном определяется активацией макрофагов.Макрофаги являются ключевыми продуцентами цитокинов, в том числе ИЛ-6 и других медиаторов воспаления, в ответ на вирусные инфекции, вызывающие «цитокиновый шторм» и системные воспалительные реакции [54]. Синдром активации макрофагов (MAS) подробно описан у пациентов с аутоиммунными заболеваниями, такими как ювенильный идиопатический артрит и системная красная волчанка [55]. , клиническая картина аналогична интоксикации, вызванной COVID-19.Одним из основных симптомов MAS является гемофагоцитоз, который представляет собой поглощение клеток крови, включая эритроциты, лейкоциты или тромбоциты в костном мозге, печенью и селезенкой CD163 + макрофаги и/или гистиоциты, экспрессирующие высокоаффинный комплекс рецептор-мусорщик гемоглобин-гаптоглобин [56]. Растворимая альфа-цепь рецептора ИЛ-2 (sCD25) и sCD163 в сыворотке крови являются симптомами гемофагоцитоза [57]. Одним из проявлений синдрома активации макрофагов является высокий уровень медиаторов воспаления, таких как IL-6, IL-1β, IL-18 и IFN-γ [58,59].При обследовании пациентов с МАС выявлены воспалительные инфильтраты, состоящие в основном из активированных Т-лимфоцитов и макрофагов или гистиоцитов, поглощающих нормальные гемопоэтические клетки [60]. Гемофагоцитарный лимфогистиоцитоз или МАС у пациентов с аутоиммунными заболеваниями является тяжелым осложнением и характеризуется сепсис-подобной клинической картиной [61]. Исторически золотым стандартом лечения МАС были глюкокортикоиды, иммуноглобулины и циклоспорин. Однако, несмотря на интенсивную терапию, летальность этих больных достигает 20% [62].МАС или гемофагоцитарный синдром развивается в случаях тяжелых вирусных инфекций с лихорадкой. В частности, гемофагоцитоз наблюдался при лихорадке Денге с синдромом ПОН и инфекции, вызванной вирусом Эпштейна-Барр.
Растворимая альфа-цепь рецептора ИЛ-2 (sCD25) и sCD163 в сыворотке крови являются симптомами гемофагоцитоза [57]. Одним из проявлений синдрома активации макрофагов является высокий уровень медиаторов воспаления, таких как IL-6, IL-1β, IL-18 и IFN-γ [58,59].При обследовании пациентов с МАС выявлены воспалительные инфильтраты, состоящие в основном из активированных Т-лимфоцитов и макрофагов или гистиоцитов, поглощающих нормальные гемопоэтические клетки [60]. Гемофагоцитарный лимфогистиоцитоз или МАС у пациентов с аутоиммунными заболеваниями является тяжелым осложнением и характеризуется сепсис-подобной клинической картиной [61]. Исторически золотым стандартом лечения МАС были глюкокортикоиды, иммуноглобулины и циклоспорин. Однако, несмотря на интенсивную терапию, летальность этих больных достигает 20% [62].МАС или гемофагоцитарный синдром развивается в случаях тяжелых вирусных инфекций с лихорадкой. В частности, гемофагоцитоз наблюдался при лихорадке Денге с синдромом ПОН и инфекции, вызванной вирусом Эпштейна-Барр. Проявление МАС при вирусных инфекциях выявляют как системную воспалительную реакцию, возникающую в результате избыточной активации лимфоцитов и макрофагов. Неконтролируемая гиперактивация иммунной системы связана с высокой температурой, цитопенией, коагулопатией и повышением уровня sCD25 и sCD163 в сыворотке крови [63,64].Симптомы гемофагоцитоза гигантскими многоядерными макрофагами регистрировались у больных со слабым иммунитетом, предрасположенных к пневмониям, вызванным различными вирусными инфекциями [65]. Гигантские макрофаги и гиперпластические пневмоциты обнаружены у больных ОРВИ и диффузным альвеолярным поражением легких. Такие гигантские клетки не обнаруживались в биоптатах легкого больных на терминальной стадии и выявлялись только при прогрессировании заболевания более восьми дней [66]. У больных ОРВИ выявлены явления гемофагоцитоза макрофагами в легких и атрофия белой пульпы селезенки.Такие же морфологические изменения наблюдались и у больных гриппом H5N1 с неблагоприятным прогнозом в 1997 г.
Проявление МАС при вирусных инфекциях выявляют как системную воспалительную реакцию, возникающую в результате избыточной активации лимфоцитов и макрофагов. Неконтролируемая гиперактивация иммунной системы связана с высокой температурой, цитопенией, коагулопатией и повышением уровня sCD25 и sCD163 в сыворотке крови [63,64].Симптомы гемофагоцитоза гигантскими многоядерными макрофагами регистрировались у больных со слабым иммунитетом, предрасположенных к пневмониям, вызванным различными вирусными инфекциями [65]. Гигантские макрофаги и гиперпластические пневмоциты обнаружены у больных ОРВИ и диффузным альвеолярным поражением легких. Такие гигантские клетки не обнаруживались в биоптатах легкого больных на терминальной стадии и выявлялись только при прогрессировании заболевания более восьми дней [66]. У больных ОРВИ выявлены явления гемофагоцитоза макрофагами в легких и атрофия белой пульпы селезенки.Такие же морфологические изменения наблюдались и у больных гриппом H5N1 с неблагоприятным прогнозом в 1997 г. Исследователи считали, что гемофагоцитоз вызывается нарушением регуляции цитокинов при гриппозной пневмонии H5N1 [4,67,68]. Аналогичные морфологические изменения в легких были обнаружены китайскими исследователями в образцах биопсии пациентов с COVID-19. Авторы отмечают инфильтрацию легочной ткани макрофагами CD 68 + [69]. Росси Ф. и др. сообщили, что у всех пациентов с COVID-19 и симптомами тяжелой дыхательной недостаточности (SRF) развились чрезмерные воспалительные реакции с признаками иммунной дисрегуляции или MAS после активации макрофагов M1 провоспалительными медиаторами [70].Однако для выяснения роли субпопуляций макрофагов М1 и М2 требуется дополнительная информация. Многие врачи рассматривают интоксикацию, ассоциированную с тяжелым течением COVID-19, как сепсисоподобное состояние, сходное с процессом, ассоциированным с бактериальной пневмонией с летальным исходом [71]. ]. Однако некоторые авторы предполагают, что COVID-19 имеет уникальную картину иммунной дисфункции, которая проявляется в виде лимфопении, более высоких уровней С-реактивного белка и повышенных D-димеров, которые отражают дисбаланс между провоспалительными и противовоспалительными цитокинами и, возможно, , это то, что отличает эту инфекцию от классического сепсиса [72].
Исследователи считали, что гемофагоцитоз вызывается нарушением регуляции цитокинов при гриппозной пневмонии H5N1 [4,67,68]. Аналогичные морфологические изменения в легких были обнаружены китайскими исследователями в образцах биопсии пациентов с COVID-19. Авторы отмечают инфильтрацию легочной ткани макрофагами CD 68 + [69]. Росси Ф. и др. сообщили, что у всех пациентов с COVID-19 и симптомами тяжелой дыхательной недостаточности (SRF) развились чрезмерные воспалительные реакции с признаками иммунной дисрегуляции или MAS после активации макрофагов M1 провоспалительными медиаторами [70].Однако для выяснения роли субпопуляций макрофагов М1 и М2 требуется дополнительная информация. Многие врачи рассматривают интоксикацию, ассоциированную с тяжелым течением COVID-19, как сепсисоподобное состояние, сходное с процессом, ассоциированным с бактериальной пневмонией с летальным исходом [71]. ]. Однако некоторые авторы предполагают, что COVID-19 имеет уникальную картину иммунной дисфункции, которая проявляется в виде лимфопении, более высоких уровней С-реактивного белка и повышенных D-димеров, которые отражают дисбаланс между провоспалительными и противовоспалительными цитокинами и, возможно, , это то, что отличает эту инфекцию от классического сепсиса [72]. Однако иммунная дисрегуляция при классическом сепсисе у пациентов в критическом состоянии также проявляется в виде СМА и «цитокинового шторма» [73]. Кроме того, сепсис-индуцированный иммунопаралич характеризуется лимфопенией преимущественно за счет CD4 + Т-лимфоцитов [74,75], что позволяет рассматривать тяжелую интоксикацию COVID-19 как сепсисподобный синдром или вирусный сепсис.
Однако иммунная дисрегуляция при классическом сепсисе у пациентов в критическом состоянии также проявляется в виде СМА и «цитокинового шторма» [73]. Кроме того, сепсис-индуцированный иммунопаралич характеризуется лимфопенией преимущественно за счет CD4 + Т-лимфоцитов [74,75], что позволяет рассматривать тяжелую интоксикацию COVID-19 как сепсисподобный синдром или вирусный сепсис.6. Перспективные подходы к лечению «цитокинового шторма» и иммунодепрессивных состояний
Из-за большого количества цитокинов, индуцируемых инфекциями SARS-CoV (коронавирус тяжелого острого респираторного синдрома) и MERS-CoV (коронавирус ближневосточного респираторного синдрома), кортикостероиды часто используется для лечения пациентов с тяжелыми заболеваниями, чтобы уменьшить повреждение паренхимы легких в результате чрезмерной воспалительной реакции.Однако накопленные данные свидетельствуют о том, что у пациентов с SARS и MERS кортикостероиды не влияли на смертность, а лишь замедляли элиминацию вируса [54]. Пациенты с COVID-19 с ОРДС и ПОН имеют повышенный уровень ИЛ-6 и С-реактивного белка, что является характерным признаком этих тяжелых состояний [53]. Нови Г. и соавт. [76] описали случай COVID-19 у пациента с системной склеродермией, связанной с истощением В-клеток, вызванным терапией окрелизумабом. Серьезных осложнений, связанных с состоянием индуцированной иммуносупрессии, у больного не было.Авторы предположили, что истощение В-клеток могло сыграть положительную роль в результате снижения продукции ИЛ-6, обычно высвобождаемого периферическими В-клетками. Имеющиеся данные показывают потенциальное влияние ИЛ-6 и рецептора ИЛ-6 блокирующие антитела для борьбы с «цитокиновым штормом» [77,78]. Таким образом, тоцилизумаб (TCZ), который представляет собой рекомбинантное гуманизированное моноклональное антитело к рецептору IL-6, был рекомендован для лечения пациентов с COVID-19 с риском «цитокинового шторма». TCZ продемонстрировал эффективность при лечении стероидрезистентного синдрома высвобождения цитокинов у онкологических больных, получавших ингибиторы иммунных контрольных точек [79].
Пациенты с COVID-19 с ОРДС и ПОН имеют повышенный уровень ИЛ-6 и С-реактивного белка, что является характерным признаком этих тяжелых состояний [53]. Нови Г. и соавт. [76] описали случай COVID-19 у пациента с системной склеродермией, связанной с истощением В-клеток, вызванным терапией окрелизумабом. Серьезных осложнений, связанных с состоянием индуцированной иммуносупрессии, у больного не было.Авторы предположили, что истощение В-клеток могло сыграть положительную роль в результате снижения продукции ИЛ-6, обычно высвобождаемого периферическими В-клетками. Имеющиеся данные показывают потенциальное влияние ИЛ-6 и рецептора ИЛ-6 блокирующие антитела для борьбы с «цитокиновым штормом» [77,78]. Таким образом, тоцилизумаб (TCZ), который представляет собой рекомбинантное гуманизированное моноклональное антитело к рецептору IL-6, был рекомендован для лечения пациентов с COVID-19 с риском «цитокинового шторма». TCZ продемонстрировал эффективность при лечении стероидрезистентного синдрома высвобождения цитокинов у онкологических больных, получавших ингибиторы иммунных контрольных точек [79]. ИЛ-6 является одним из наиболее значимых цитокинов, участвующих в вызванном COVID-19 «цитокиновом шторме». По этой причине ТЦЗ рекомендуется для тяжелобольных пациентов, инфицированных новой коронавирусной инфекцией с повышенным уровнем ИЛ-6 [80]. Клинические результаты исследований в небольших когортах показали, что ТЦЗ может быть предложен в качестве перспективной терапевтической стратегии для тяжелобольных и критически больных пациентов с COVID-19. Тем не менее, необходимы более контролируемые исследования для оценки надежной клинической эффективности тоцилизумаба у пациентов с инфекцией COVID-19.Кроме того, следует учитывать, что иммунодепрессанты, такие как кортикостероиды или ингибиторы JAK (ингибиторы янус-киназы), применяемые для подавления чрезмерной воспалительной реакции, могут усугублять состояние иммуносупрессивного больного и приводить к угнетению противовирусного и антимикробного иммунитета. 81,82]. Исследования in vitro показали, что иммуносупрессивный ингибитор JAK тофацитиниб ингибирует продукцию IFN-α [83].
ИЛ-6 является одним из наиболее значимых цитокинов, участвующих в вызванном COVID-19 «цитокиновом шторме». По этой причине ТЦЗ рекомендуется для тяжелобольных пациентов, инфицированных новой коронавирусной инфекцией с повышенным уровнем ИЛ-6 [80]. Клинические результаты исследований в небольших когортах показали, что ТЦЗ может быть предложен в качестве перспективной терапевтической стратегии для тяжелобольных и критически больных пациентов с COVID-19. Тем не менее, необходимы более контролируемые исследования для оценки надежной клинической эффективности тоцилизумаба у пациентов с инфекцией COVID-19.Кроме того, следует учитывать, что иммунодепрессанты, такие как кортикостероиды или ингибиторы JAK (ингибиторы янус-киназы), применяемые для подавления чрезмерной воспалительной реакции, могут усугублять состояние иммуносупрессивного больного и приводить к угнетению противовирусного и антимикробного иммунитета. 81,82]. Исследования in vitro показали, что иммуносупрессивный ингибитор JAK тофацитиниб ингибирует продукцию IFN-α [83]. Подавление интерферона или других медиаторов (например,g., IL-6) также может опосредовать развитие вторичной бактериальной инфекции наряду с иммуносупрессией [84]. Поэтому применение иммунодепрессантов у больных с COVID-19 в критическом состоянии для снижения воспалительных реакций должно быть тщательно проработано с учетом возможного угнетения антимикробного иммунитета. синдром ответа [85].Эффективность этого подхода была продемонстрирована у двух пациентов с COVID-19, которым был проведен плазмаферез и ПЗПТ (непрерывная заместительная почечная терапия) с использованием гемофильтра oXiris ® и модифицированной мембраны с обработанной поверхностью AN69, обладающей адсорбционной способностью. Авторы отмечают снижение ИЛ-6 и С-реактивного белка после процедуры и улучшение общего состояния пациентов [86]. В другом исследовании оценивался эффект ПЗПТ, проведенной у пяти пациентов до того, как они были зарегистрированы как положительные на COVID-19.Авторы предположили, что ПЗПТ сыграла важную роль в лечении COVID-19 с хроническим заболеванием почек.
Подавление интерферона или других медиаторов (например,g., IL-6) также может опосредовать развитие вторичной бактериальной инфекции наряду с иммуносупрессией [84]. Поэтому применение иммунодепрессантов у больных с COVID-19 в критическом состоянии для снижения воспалительных реакций должно быть тщательно проработано с учетом возможного угнетения антимикробного иммунитета. синдром ответа [85].Эффективность этого подхода была продемонстрирована у двух пациентов с COVID-19, которым был проведен плазмаферез и ПЗПТ (непрерывная заместительная почечная терапия) с использованием гемофильтра oXiris ® и модифицированной мембраны с обработанной поверхностью AN69, обладающей адсорбционной способностью. Авторы отмечают снижение ИЛ-6 и С-реактивного белка после процедуры и улучшение общего состояния пациентов [86]. В другом исследовании оценивался эффект ПЗПТ, проведенной у пяти пациентов до того, как они были зарегистрированы как положительные на COVID-19.Авторы предположили, что ПЗПТ сыграла важную роль в лечении COVID-19 с хроническим заболеванием почек. При появлении симптомов острого повреждения почек следует как можно раньше использовать потенциальные вмешательства, включая ПЗПТ, для защиты почечной функции [87]. По мнению исследователей, ПЗПТ может оказывать терапевтическое воздействие на интоксикацию COVID-19 за счет удаления потенциально вредных токсинов и стабилизации метаболического и гемодинамического статуса пациента [88]. Экстракорпоральное очищение крови позволяет устранить медиаторы воспаления и контролировать «цитокиновый шторм» на ранней стадии интоксикации.Однако для доказательства эффективности экстракорпоральной очистки крови необходимы рандомизированные исследования. Мезенхимальные стволовые клетки (МСК) могут изменять профиль секреции цитокинов макрофагами, дендритными клетками, наивными и эффекторными Т-клетками (Th типа 1 и 2) и естественными киллерами. клетки (NK), которые индуцируют противовоспалительный или толерантный фенотип. В частности, МСК ингибировали продукцию зрелыми дендритными клетками (ДК) провоспалительных цитокинов, таких как TNF-α и IFN-γ, и повышали секрецию противовоспалительных цитокинов, таких как IL-10 и IL-4.
При появлении симптомов острого повреждения почек следует как можно раньше использовать потенциальные вмешательства, включая ПЗПТ, для защиты почечной функции [87]. По мнению исследователей, ПЗПТ может оказывать терапевтическое воздействие на интоксикацию COVID-19 за счет удаления потенциально вредных токсинов и стабилизации метаболического и гемодинамического статуса пациента [88]. Экстракорпоральное очищение крови позволяет устранить медиаторы воспаления и контролировать «цитокиновый шторм» на ранней стадии интоксикации.Однако для доказательства эффективности экстракорпоральной очистки крови необходимы рандомизированные исследования. Мезенхимальные стволовые клетки (МСК) могут изменять профиль секреции цитокинов макрофагами, дендритными клетками, наивными и эффекторными Т-клетками (Th типа 1 и 2) и естественными киллерами. клетки (NK), которые индуцируют противовоспалительный или толерантный фенотип. В частности, МСК ингибировали продукцию зрелыми дендритными клетками (ДК) провоспалительных цитокинов, таких как TNF-α и IFN-γ, и повышали секрецию противовоспалительных цитокинов, таких как IL-10 и IL-4. МСК также оказывали влияние на усиление супрессорной субпопуляции Treg в периферической крови [89,90]. МСК продемонстрировали многообещающие эффекты в экспериментальной модели ОРДС, которые нейтрализуют альвеолярный коллапс, накопление коллагена и клеточный апоптоз в легочной ткани. Несколько рандомизированных клинических испытаний фазы 1 подтвердили безопасность МСК, полученных из различных источников, в однократной дозе от 1 млн клеток/кг до 10 млн клеток/кг у пациентов с ОРДС невирусного происхождения [91,92,93].МСК рассматриваются как потенциальная терапевтическая стратегия для лечения пациентов с стероидрезистентным MAS-артритом [94]. Клиническая эффективность МСК периферической крови была показана у больных гриппом A (H7N9) с ОРДС. В частности, было показано, что летальность составила 17,6% в группе больных, получавших МСК, против 54,5% в контрольной группе. Авторы считают, что эти данные продемонстрировали потенциал терапии пациентов с COVID-19 на основе МСК, поскольку осложнения, вызываемые этими вирусами, имеют общие механизмы [95].
МСК также оказывали влияние на усиление супрессорной субпопуляции Treg в периферической крови [89,90]. МСК продемонстрировали многообещающие эффекты в экспериментальной модели ОРДС, которые нейтрализуют альвеолярный коллапс, накопление коллагена и клеточный апоптоз в легочной ткани. Несколько рандомизированных клинических испытаний фазы 1 подтвердили безопасность МСК, полученных из различных источников, в однократной дозе от 1 млн клеток/кг до 10 млн клеток/кг у пациентов с ОРДС невирусного происхождения [91,92,93].МСК рассматриваются как потенциальная терапевтическая стратегия для лечения пациентов с стероидрезистентным MAS-артритом [94]. Клиническая эффективность МСК периферической крови была показана у больных гриппом A (H7N9) с ОРДС. В частности, было показано, что летальность составила 17,6% в группе больных, получавших МСК, против 54,5% в контрольной группе. Авторы считают, что эти данные продемонстрировали потенциал терапии пациентов с COVID-19 на основе МСК, поскольку осложнения, вызываемые этими вирусами, имеют общие механизмы [95]. Другие авторы недавно опубликовали результаты пилотного исследования семи пациентов с пневмонией, связанной с COVID-19, где они показали, что клинические симптомы у всех пациентов значительно улучшились через два дня после трансплантации МСК. Выявлено увеличение количества лимфоцитов в периферической крови и исчезновение активированных субпопуляций CXCR3 + CD4 + Т-клеток, CXCR3 + CD8 + Т-клеток и CXCR3 + NK-клеток, которые секретируют цитокины.CD14 + CD11c + CD11b mid регуляторные популяции ДК также увеличились. Уровни TNF-α значительно снижались, а уровни IL-10 повышались у пациентов, получавших МСК, по сравнению с пациентами, получавшими стандартную терапию. Таким образом, авторы пришли к выводу, что МСК будут безопасны и эффективны для лечения пациентов с пневмонией, вызванной COVID-19, особенно для пациентов с острыми явлениями [96].
Другие авторы недавно опубликовали результаты пилотного исследования семи пациентов с пневмонией, связанной с COVID-19, где они показали, что клинические симптомы у всех пациентов значительно улучшились через два дня после трансплантации МСК. Выявлено увеличение количества лимфоцитов в периферической крови и исчезновение активированных субпопуляций CXCR3 + CD4 + Т-клеток, CXCR3 + CD8 + Т-клеток и CXCR3 + NK-клеток, которые секретируют цитокины.CD14 + CD11c + CD11b mid регуляторные популяции ДК также увеличились. Уровни TNF-α значительно снижались, а уровни IL-10 повышались у пациентов, получавших МСК, по сравнению с пациентами, получавшими стандартную терапию. Таким образом, авторы пришли к выводу, что МСК будут безопасны и эффективны для лечения пациентов с пневмонией, вызванной COVID-19, особенно для пациентов с острыми явлениями [96].На сегодняшний день зарегистрировано более 60 клинических испытаний различных вариантов МСК у пациентов с COVID-19, что свидетельствует о растущем интересе к этой терапевтической стратегии.
Одним из перспективных методов лечения больных COVID-19 является трансплантация реконвалесцентной плазмы. Ранее было показано, что однократное введение реконвалесцентной плазмы улучшает состояние пациентов с такими вирусными инфекциями, как Эбола, атипичная пневмония, MERS и грипп А (h2N9). Переливание реконвалесцентной плазмы приводило к снижению вирусной нагрузки в дыхательных путях, снижению уровня цитокинов в сыворотке и снижению уровня смертности у этих больных [97,98]. Переливание реконвалесцентной плазмы пациентам с COVID-19 привело к снижению вирусной нагрузки и улучшению дыхательной недостаточности.Эти результаты свидетельствуют о том, что переливание реконвалесцентной плазмы может быть полезным у пациентов, инфицированных SARS-CoV-2 [99]. Однако ограниченное число пациентов и дизайн исследования не могут установить потенциальную эффективность этого лечения, и представленные наблюдения требуют дальнейшей оценки в клинических испытаниях. Основные стратегии терапии SARS-CoV-2 сосредоточены на подавлении чрезмерной воспалительной реакции.
 . Однако дополнительным последствием «цитокинового шторма» является развитие иммуносупрессии, проявляющейся прогрессирующей лимфопенией.Поэтому иммунокоррекцию необходимо проводить на определенном этапе развития заболевания для предотвращения иммунопаралича и присоединения вторичных инфекций. Некоторые опасения связаны с предположением, что иммунотерапия у этих пациентов с чрезмерно воспалительной фазой заболевания может способствовать усилению воспалительной реакции и обострению заболевания. Однако сепсисоподобный характер осложнений, вызванных COVID-19, позволяет предположить, что цитокиновая терапия будет способствовать нормализации иммунного статуса и уменьшению числа вторичных инфекций, что сходно с иммунодепрессивными состояниями, развивающимися на фоне системного воспалительного ответа. синдром при серьезной травме и сепсисе [100,101].Аналогичные результаты были получены при лечении ИЛ-7 ВИЧ-инфицированных пациентов с генерализованной инфекцией [102]. ИЛ-15 также обладает потенциальным эффектом иммунной коррекции.
. Однако дополнительным последствием «цитокинового шторма» является развитие иммуносупрессии, проявляющейся прогрессирующей лимфопенией.Поэтому иммунокоррекцию необходимо проводить на определенном этапе развития заболевания для предотвращения иммунопаралича и присоединения вторичных инфекций. Некоторые опасения связаны с предположением, что иммунотерапия у этих пациентов с чрезмерно воспалительной фазой заболевания может способствовать усилению воспалительной реакции и обострению заболевания. Однако сепсисоподобный характер осложнений, вызванных COVID-19, позволяет предположить, что цитокиновая терапия будет способствовать нормализации иммунного статуса и уменьшению числа вторичных инфекций, что сходно с иммунодепрессивными состояниями, развивающимися на фоне системного воспалительного ответа. синдром при серьезной травме и сепсисе [100,101].Аналогичные результаты были получены при лечении ИЛ-7 ВИЧ-инфицированных пациентов с генерализованной инфекцией [102]. ИЛ-15 также обладает потенциальным эффектом иммунной коррекции. Однако модельные эксперименты выявили цитокиновую гепатотоксичность [103], а данные клинических исследований показали активацию NK-клеток и Т-киллеров, а также лихорадку, гипотензию и печеночную недостаточность, что ограничивает перспективы клинического применения ИЛ-15. [104,105]. Принимая во внимание патогенез индуцированной чрезмерной воспалительной иммуносупрессивной реакции у больных SARS-CoV-2, представляется целесообразным включение в комплексную терапию регуляторного цитокина IL-2, который является цитокином, стимулирующим пролиферацию и активацию лимфоцитов. .Важно отметить, что регуляция клеточного и гуморального иммунитета во многом связана с продукцией ИЛ-2. Эти теоретические предположения подтверждаются результатами клинических исследований рекомбинантного ИЛ-2 у больных с иммуносупрессивным статусом, ассоциированным с синдромом системной воспалительной реакции, вызванным сепсисом или тяжелой травмой. Показаниями к иммунокоррекционной терапии могут быть прогрессирующая лимфопения (ниже 900 клеток/мкл) и снижение CD4 + Th клеток [105].
Однако модельные эксперименты выявили цитокиновую гепатотоксичность [103], а данные клинических исследований показали активацию NK-клеток и Т-киллеров, а также лихорадку, гипотензию и печеночную недостаточность, что ограничивает перспективы клинического применения ИЛ-15. [104,105]. Принимая во внимание патогенез индуцированной чрезмерной воспалительной иммуносупрессивной реакции у больных SARS-CoV-2, представляется целесообразным включение в комплексную терапию регуляторного цитокина IL-2, который является цитокином, стимулирующим пролиферацию и активацию лимфоцитов. .Важно отметить, что регуляция клеточного и гуморального иммунитета во многом связана с продукцией ИЛ-2. Эти теоретические предположения подтверждаются результатами клинических исследований рекомбинантного ИЛ-2 у больных с иммуносупрессивным статусом, ассоциированным с синдромом системной воспалительной реакции, вызванным сепсисом или тяжелой травмой. Показаниями к иммунокоррекционной терапии могут быть прогрессирующая лимфопения (ниже 900 клеток/мкл) и снижение CD4 + Th клеток [105].
Поэтому необходимо стратифицировать больных по иммунному статусу и назначать индивидуальную иммунотерапию по показаниям.
Клинические испытания иммуномодулирующих средств не зафиксировали неблагоприятного эффекта у больных с сепсисом. Показана возможность цитокиновой терапии для коррекции иммуносупрессивного статуса, особенно при затяжном течении заболевания [106].7. Выводы
Дисрегуляция иммунной системы играет существенную или даже определяющую роль в патогенезе COVID-19. На начальном этапе инфицированные вирусом клетки легочной ткани распознаются и уничтожаются эффекторами врожденного иммунитета γδT-лимфоцитами и NK (натуральными киллерами) клетками (рис. 1).Эти иммунные клетки экспрессируют Toll-подобные рецепторы (TLR), которые распознают патогены и активируют их эффекторные функции, такие как цитотоксичность и продукция цитокинов. Хорошо известно, что TLR распознают консервативные структуры патогенов, которые инициируют врожденный иммунный ответ, и действуют как сенсоры для вирусной РНК. Они экспрессируются NK-клетками и γδT-клетками, а также антигенпрезентирующими клетками, такими как макрофаги и ДК. Взаимодействие вирусной РНК и TLR запускает сигнальные пути, повышающие продукцию цитокинов, участвующих в Th2-поляризации CD4 + Th-клеток и индукции адаптивного иммунного ответа [107].Экспериментальные исследования на китайских макаках показали, что SARS-CoV-2 проникает в слизистую дыхательных путей и приводит к локальной инфильтрации сначала лимфоцитами, а затем макрофагами CD163 + . Последние мигрируют в лимфоидные органы в течение трех суток, транспортируя не только фрагменты разрушенных инфицированных клеток для презентации антигена, но и вирусные частицы в своих везикулах. Таким образом, макрофаги выполняют свою антигенпрезентирующую функцию, дифференцируясь в ДК, и одновременно способствуют диссеминации вируса и развитию продуктивной инфекции в лимфоидной ткани и системному распространению инфекции [108].Чрезмерная активация клеток врожденного иммунитета и макрофагов приводит к гиперпродукции цитокинов и высвобождению реактивных молекул, которые поражают не только инфицированные вирусом, но и интактные клетки.
Они экспрессируются NK-клетками и γδT-клетками, а также антигенпрезентирующими клетками, такими как макрофаги и ДК. Взаимодействие вирусной РНК и TLR запускает сигнальные пути, повышающие продукцию цитокинов, участвующих в Th2-поляризации CD4 + Th-клеток и индукции адаптивного иммунного ответа [107].Экспериментальные исследования на китайских макаках показали, что SARS-CoV-2 проникает в слизистую дыхательных путей и приводит к локальной инфильтрации сначала лимфоцитами, а затем макрофагами CD163 + . Последние мигрируют в лимфоидные органы в течение трех суток, транспортируя не только фрагменты разрушенных инфицированных клеток для презентации антигена, но и вирусные частицы в своих везикулах. Таким образом, макрофаги выполняют свою антигенпрезентирующую функцию, дифференцируясь в ДК, и одновременно способствуют диссеминации вируса и развитию продуктивной инфекции в лимфоидной ткани и системному распространению инфекции [108].Чрезмерная активация клеток врожденного иммунитета и макрофагов приводит к гиперпродукции цитокинов и высвобождению реактивных молекул, которые поражают не только инфицированные вирусом, но и интактные клетки. MAS — это обычная реакция при тяжелых коронавирусных инфекциях, таких как SARS, MERS и COVID-19, которая проявляется в виде «цитокинового шторма» и симптомов, подобных сепсису. МАС характерен для гемофагоцитоза и повышения уровня ИЛ-6 и рецепторов ИЛ-2, что описано при вышеперечисленных вирусных инфекциях.Поскольку макрофаги играют важную роль в индукции чрезмерной воспалительной реакции, мы можем предположить, что аналогичным образом, после интоксикации COVID-19, ассоциированная с кишечником лимфоидная ткань (GALT), которая содержит самые большие пулы макрофагов и Т-клеток , вносит значительный вклад в развитие «цитокинового шторма». Активация мононуклеарных клеток GALT при вирусных инфекциях связана с повышением уровня LPS (липополисахаридов), что также известно как микробная транслокация. Попадание ЛПС в систему кровообращения усиливает воспалительный каскад, что замыкает порочный круг синдрома системной воспалительной реакции [109,110].Преувеличенный иммунный ответ может привести к генерализованной сосудистой проницаемости.
MAS — это обычная реакция при тяжелых коронавирусных инфекциях, таких как SARS, MERS и COVID-19, которая проявляется в виде «цитокинового шторма» и симптомов, подобных сепсису. МАС характерен для гемофагоцитоза и повышения уровня ИЛ-6 и рецепторов ИЛ-2, что описано при вышеперечисленных вирусных инфекциях.Поскольку макрофаги играют важную роль в индукции чрезмерной воспалительной реакции, мы можем предположить, что аналогичным образом, после интоксикации COVID-19, ассоциированная с кишечником лимфоидная ткань (GALT), которая содержит самые большие пулы макрофагов и Т-клеток , вносит значительный вклад в развитие «цитокинового шторма». Активация мононуклеарных клеток GALT при вирусных инфекциях связана с повышением уровня LPS (липополисахаридов), что также известно как микробная транслокация. Попадание ЛПС в систему кровообращения усиливает воспалительный каскад, что замыкает порочный круг синдрома системной воспалительной реакции [109,110].Преувеличенный иммунный ответ может привести к генерализованной сосудистой проницаемости. Повышенная проницаемость сосудистых стенок приводит к утечке плазмы и, наряду с гиперкоагуляцией крови, может индуцировать ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания/тромбоэмболическая болезнь). Особое внимание следует уделять группам риска, таким как пожилые люди. больных и онкологических больных с первично выраженными симптомами дисфункции иммунной системы. Таким образом, старение связано с нарушением иммунной регуляции, которое проявляется как провоспалительное состояние, характеризующееся высоким уровнем циркулирующих провоспалительных маркеров, таких как ИЛ-1, белок-антагонист рецептора ИЛ-1, ИЛ-6, IL-8, IL-13, IL-18, С-реактивный белок, IFN-α, IFN-β, TGF-β, TNF, его растворимые рецепторы (члены надсемейства рецепторов TNF 1A и 1B) и амилоид A [ 111].Это состояние, называемое «воспалением», может стать стойким и длительным, создавая хроническую воспалительную реакцию [112]. При таком иммунном статусе «цитокиновый шторм», вызванный COVID-19, может привести к фатальным последствиям.
Повышенная проницаемость сосудистых стенок приводит к утечке плазмы и, наряду с гиперкоагуляцией крови, может индуцировать ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания/тромбоэмболическая болезнь). Особое внимание следует уделять группам риска, таким как пожилые люди. больных и онкологических больных с первично выраженными симптомами дисфункции иммунной системы. Таким образом, старение связано с нарушением иммунной регуляции, которое проявляется как провоспалительное состояние, характеризующееся высоким уровнем циркулирующих провоспалительных маркеров, таких как ИЛ-1, белок-антагонист рецептора ИЛ-1, ИЛ-6, IL-8, IL-13, IL-18, С-реактивный белок, IFN-α, IFN-β, TGF-β, TNF, его растворимые рецепторы (члены надсемейства рецепторов TNF 1A и 1B) и амилоид A [ 111].Это состояние, называемое «воспалением», может стать стойким и длительным, создавая хроническую воспалительную реакцию [112]. При таком иммунном статусе «цитокиновый шторм», вызванный COVID-19, может привести к фатальным последствиям. Онкологические больные, в частности в послеоперационном периоде и получающие химио-/лучевую терапию, имеют высокий риск заражения COVID-19. Противоопухолевая иммунотерапия ингибиторами иммунных контрольных точек (ICI) или CAR-T-клетками (химерный антигенный рецептор, CAR), ассоциированная с синдромом высвобождения цитокинов, повышает вероятность гипертрофированного системного воспалительного ответа на интоксикацию COVID-19.Таким образом, существует задача минимизировать риск заражения COVID-19 при достижении желаемой эффективности лечения рака. Следует тщательно проанализировать несколько аспектов, включая риск рецидива или прогрессирования заболевания, предполагаемые конечные точки терапии, сопутствующие заболевания, включая других пациентов, а также влияние передачи коронавируса в местном сообществе [113]. Чтобы выполнить эти требования, можно рассмотреть некоторые предложения, такие как изменение режимов терапии и ограничение посещений пациентов в больнице.В частности, некоторые авторы рекомендуют менее интенсивные схемы лечения, чтобы заменить пембролизумаб в дозе 200 мг три недели на 400 мг шесть недель [114].
Онкологические больные, в частности в послеоперационном периоде и получающие химио-/лучевую терапию, имеют высокий риск заражения COVID-19. Противоопухолевая иммунотерапия ингибиторами иммунных контрольных точек (ICI) или CAR-T-клетками (химерный антигенный рецептор, CAR), ассоциированная с синдромом высвобождения цитокинов, повышает вероятность гипертрофированного системного воспалительного ответа на интоксикацию COVID-19.Таким образом, существует задача минимизировать риск заражения COVID-19 при достижении желаемой эффективности лечения рака. Следует тщательно проанализировать несколько аспектов, включая риск рецидива или прогрессирования заболевания, предполагаемые конечные точки терапии, сопутствующие заболевания, включая других пациентов, а также влияние передачи коронавируса в местном сообществе [113]. Чтобы выполнить эти требования, можно рассмотреть некоторые предложения, такие как изменение режимов терапии и ограничение посещений пациентов в больнице.В частности, некоторые авторы рекомендуют менее интенсивные схемы лечения, чтобы заменить пембролизумаб в дозе 200 мг три недели на 400 мг шесть недель [114]. Основные стратегии терапии COVID-19 направлены на подавление гипервоспалительной реакции. Для достижения эффекта в некоторых исследованиях использовались стероиды, хотя они не дали желаемого результата. Другие включали ингибиторы рецептора IL-6 с определенным клиническим эффектом у небольших групп пациентов. Несмотря на то, что ИЛ-6 является важным фактором для индукции синдрома системной воспалительной реакции, он не единственный, а представляет собой каскад медиаторов воспаления.Поэтому можно рекомендовать некоторые методы элиминации цитокинов и биоактивных молекул непептидной природы, такие как методы экстракорпоральной очистки крови, доказавшие свою эффективность при лечении сепсиса, в том числе современные селективные и неселективные сорбенты. Рациональность такого подхода подтверждается данными о клинической эффективности плазмофереза и непрерывной заместительной почечной терапии (ПЗПТ) гемофильтрами высокой сорбционной емкости. Перспективным подходом для борьбы с «цитокиновым штормом» могут стать аллогенные мезенхимальные стволовые клетки костного мозга или пуповинной крови, обладающие иммунодепрессивной активностью.
Основные стратегии терапии COVID-19 направлены на подавление гипервоспалительной реакции. Для достижения эффекта в некоторых исследованиях использовались стероиды, хотя они не дали желаемого результата. Другие включали ингибиторы рецептора IL-6 с определенным клиническим эффектом у небольших групп пациентов. Несмотря на то, что ИЛ-6 является важным фактором для индукции синдрома системной воспалительной реакции, он не единственный, а представляет собой каскад медиаторов воспаления.Поэтому можно рекомендовать некоторые методы элиминации цитокинов и биоактивных молекул непептидной природы, такие как методы экстракорпоральной очистки крови, доказавшие свою эффективность при лечении сепсиса, в том числе современные селективные и неселективные сорбенты. Рациональность такого подхода подтверждается данными о клинической эффективности плазмофереза и непрерывной заместительной почечной терапии (ПЗПТ) гемофильтрами высокой сорбционной емкости. Перспективным подходом для борьбы с «цитокиновым штормом» могут стать аллогенные мезенхимальные стволовые клетки костного мозга или пуповинной крови, обладающие иммунодепрессивной активностью. Однако иммунодепрессанты могут усугублять иммуносупрессию, вызванную COVID-19, что оказывает угнетающее действие на антимикробный иммунитет. иммуносупрессивные состояния, включая иммунопаралич, которые приводят к вторичной инфекции. Иммуносупрессия развивается в результате апоптоза лимфоцитов и лимфофагоцитоза активированными макрофагами.Это проявляется как прогрессирующая лимфопения, в основном из-за снижения числа Th-клеток (рис. 1). Th-клетки продуцируют ряд регуляторных цитокинов, включая IL-2, и играют важную роль в связывании адаптивного Т- и В-клеточного иммунитета. Таким образом, заместительная цитокиновая терапия с ИЛ-2, стимулирующим пролиферативную активность лимфоцитов, представляется особенно целесообразной у пациентов с COVID-19 при переходе от гипервоспалительной к гиповоспалительной фазе. Показанием к иммунокоррекции в этих случаях является прогрессирующее снижение относительного и абсолютного количества циркулирующих лимфоцитов (ниже 20% и 800 клеток/мкл соответственно).
Однако иммунодепрессанты могут усугублять иммуносупрессию, вызванную COVID-19, что оказывает угнетающее действие на антимикробный иммунитет. иммуносупрессивные состояния, включая иммунопаралич, которые приводят к вторичной инфекции. Иммуносупрессия развивается в результате апоптоза лимфоцитов и лимфофагоцитоза активированными макрофагами.Это проявляется как прогрессирующая лимфопения, в основном из-за снижения числа Th-клеток (рис. 1). Th-клетки продуцируют ряд регуляторных цитокинов, включая IL-2, и играют важную роль в связывании адаптивного Т- и В-клеточного иммунитета. Таким образом, заместительная цитокиновая терапия с ИЛ-2, стимулирующим пролиферативную активность лимфоцитов, представляется особенно целесообразной у пациентов с COVID-19 при переходе от гипервоспалительной к гиповоспалительной фазе. Показанием к иммунокоррекции в этих случаях является прогрессирующее снижение относительного и абсолютного количества циркулирующих лимфоцитов (ниже 20% и 800 клеток/мкл соответственно). Для такой иммунокоррекции следует использовать низкодозную цитокиновую терапию (0,5–1,0 МЕ на дозу ИЛ-2), обладающую иммуностимулирующим действием, как это было показано в более ранних исследованиях по профилактике глубокой иммуносупрессии при лечении сепсиса и тяжелых травма.
Для такой иммунокоррекции следует использовать низкодозную цитокиновую терапию (0,5–1,0 МЕ на дозу ИЛ-2), обладающую иммуностимулирующим действием, как это было показано в более ранних исследованиях по профилактике глубокой иммуносупрессии при лечении сепсиса и тяжелых травма.Таким образом, при выборе тактики лечения иммуноопосредованных осложнений коронавирусной инфекции необходимо пройти между Сциллой и Харибдой, что позволит не упустить момент перехода иммунного молчания в иммунопаралич в борьбе с «цитокиновой буря.
Eurasian Journal of Biosciences - 2020, Vol. 14, выпуск 1
Реферат
Овцеводство в Казахстане является одним из традиционных направлений животноводства. В последние годы тенденция развития овцеводства, независимо от направления продуктивности и специализации отрасли, во всех зонах ориентирована на производство баранины и баранины – основного источника дохода.
 Научно-исследовательская работа проводилась в период 1992-2013 гг. в опытно-базовом хозяйстве «Сералы» Ордабасинского района и внедрена в хозяйствах «Ортай», «Рау», «Сабыр», «Медеу-ата», «Акбастау», « Канат», «Сайрам-Астык», и общества с ограниченной ответственностью «Бек», «Парпата» Южно-Казахстанской области. Объект исследования - казахские курдючные грубошерстные матки и бараны-производители эдильбайской (отечественной) и гиссарской (зарубежной) пород овец, помесей различных поколений, полученных методом трехпородного скрещивания, и новой ордабасинской породы, а также баранина и баранина.Цель исследований - создать новую породу, сочетающую в себе высокую живую массу, скороспелость и адаптивные способности исходных пород, характеризующуюся экономической эффективностью при производстве высококачественной экологически чистой баранины, баранины и обеспечивающей сельхозпроизводителей генетически ценными перспективный племенной материал для устойчивого развития овцеводства Казахстана. Результаты исследования.
Научно-исследовательская работа проводилась в период 1992-2013 гг. в опытно-базовом хозяйстве «Сералы» Ордабасинского района и внедрена в хозяйствах «Ортай», «Рау», «Сабыр», «Медеу-ата», «Акбастау», « Канат», «Сайрам-Астык», и общества с ограниченной ответственностью «Бек», «Парпата» Южно-Казахстанской области. Объект исследования - казахские курдючные грубошерстные матки и бараны-производители эдильбайской (отечественной) и гиссарской (зарубежной) пород овец, помесей различных поколений, полученных методом трехпородного скрещивания, и новой ордабасинской породы, а также баранина и баранина.Цель исследований - создать новую породу, сочетающую в себе высокую живую массу, скороспелость и адаптивные способности исходных пород, характеризующуюся экономической эффективностью при производстве высококачественной экологически чистой баранины, баранины и обеспечивающей сельхозпроизводителей генетически ценными перспективный племенной материал для устойчивого развития овцеводства Казахстана. Результаты исследования. Разработана принципиально новая технология выведения новой ордабасинской породы овец методом трехпородного воспроизводственного скрещивания лучших генотипов отечественных и зарубежных пород мясо-сальных овец, созданных народной селекцией в Казахстане и Средней Азии.Суть технологии выведения новой ордабасинской породы овец заключается в управлении наследственностью и изменчивостью хозяйственно-полезных признаков в новых поколениях при оптимальных генетических сочетаниях.
Разработана принципиально новая технология выведения новой ордабасинской породы овец методом трехпородного воспроизводственного скрещивания лучших генотипов отечественных и зарубежных пород мясо-сальных овец, созданных народной селекцией в Казахстане и Средней Азии.Суть технологии выведения новой ордабасинской породы овец заключается в управлении наследственностью и изменчивостью хозяйственно-полезных признаков в новых поколениях при оптимальных генетических сочетаниях.
Новая технология состоит из отдельных технологических процессов. Первый процесс (1992-1996 гг.) – скрещивание маток казахской курдючной грубошерстной породы с баранами эдильбаевской породы, т.На данном этапе опыта использовали 5718 маток казахской курдючной грубошерстной породы и 17 баранов эдильбайской породы. Второй технологический процесс (1994-2000 гг.) – скрещивание животных первого поколения «Казахская курдючная грубошерстная х Эдильбай» по достижении возраста половой зрелости и взрослых маток этого генотипа с баранами гиссарской породы в течение 7 лет в целях для выбора желаемых видов для разведения. На данном этапе эксперимента помесей первого поколения в количестве 3178 голов скрещивали с гиссарскими овцами и отбирали модельных животных нужного типа.Третий технологический процесс (1996-2003 гг.) - разведение помесей нужного типа «в себе». На этом этапе научной работы разрабатывались методы стабилизации популяции в заданном направлении и в больших масштабах разводились высокопродуктивные линейные животные с целью закрепления хозяйственно-полезных признаков выделенного типа животных.
На данном этапе эксперимента помесей первого поколения в количестве 3178 голов скрещивали с гиссарскими овцами и отбирали модельных животных нужного типа.Третий технологический процесс (1996-2003 гг.) - разведение помесей нужного типа «в себе». На этом этапе научной работы разрабатывались методы стабилизации популяции в заданном направлении и в больших масштабах разводились высокопродуктивные линейные животные с целью закрепления хозяйственно-полезных признаков выделенного типа животных.
Четвертый технологический процесс (2005-2013 гг.) - создание и испытание новой породы ордабасинских овец.Осуществление разведения животных и внедрение новой породы в сельскохозяйственное производство. Новая высокопродуктивная ордабасинская порода характеризуется крупным крепким телосложением, глубокой и широкой, выступающей вперед грудью, округло-бочкообразным телом, подвернутым хвостом, хорошо развитым костяком, средней длиной шеи, крепкими средней длины ногами, комолостью, высокими воспроизводительными качествами и продуктивностью. высококачественная органическая баранина и баранина на круглогодичном пастбищном содержании. Производство ягнятины от баранов новой ордабасинской породы оказалось более рентабельным в производстве конкурентоспособной «молочной» баранины на внутреннем и внешнем рынках, чем другие породы, что свидетельствует об эффективности селекции этой уникальной породы для интенсификации производства. из высококачественной баранины.В сельскохозяйственное производство в больших масштабах внедрена новая ордабасинская порода овец, ее поголовье составляет более 75 тысяч голов, в том числе чистопородных более 36 тысяч голов. Племенные животные новой породы реализованы в 125 субъектов различных форм собственности, в количестве 12388 голов и успешно разводятся в различных регионах Казахстана. Рекомендуемые зоны разведения ордабасинской породы овец – полупустынная, пустынная, степная, сухостепная, предгорная и горная.
высококачественная органическая баранина и баранина на круглогодичном пастбищном содержании. Производство ягнятины от баранов новой ордабасинской породы оказалось более рентабельным в производстве конкурентоспособной «молочной» баранины на внутреннем и внешнем рынках, чем другие породы, что свидетельствует об эффективности селекции этой уникальной породы для интенсификации производства. из высококачественной баранины.В сельскохозяйственное производство в больших масштабах внедрена новая ордабасинская порода овец, ее поголовье составляет более 75 тысяч голов, в том числе чистопородных более 36 тысяч голов. Племенные животные новой породы реализованы в 125 субъектов различных форм собственности, в количестве 12388 голов и успешно разводятся в различных регионах Казахстана. Рекомендуемые зоны разведения ордабасинской породы овец – полупустынная, пустынная, степная, сухостепная, предгорная и горная. Ключевые слова: овцеводство, баранина, баранина, скрещивание, ордабасинская порода
Образец цитирования: Ажиметов Н.


 Повторные курсы проводят через 1-2 мес.,
Повторные курсы проводят через 1-2 мес.,
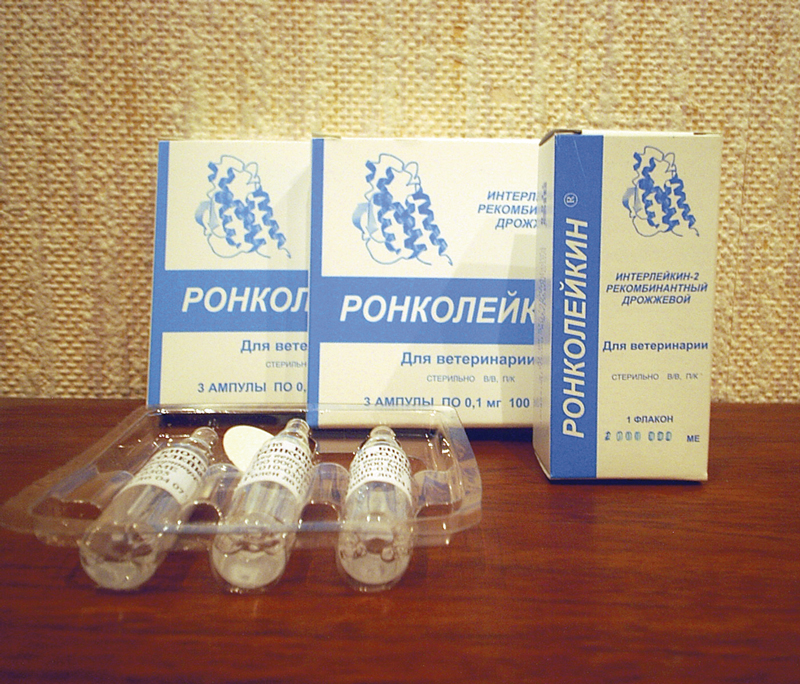 у детей с 0 лет:
обычный вариабельный иммунодефицит;
комбинированный иммунодефицит;
острый перитонит;
острый панкреатит;
остеомиелит;
тяжелая пневмония;
бактериальный сепсис новорожденных;
сепсис;
другие генерализованные и тяжелые локализованные инфекции.
у детей с 0 лет:
обычный вариабельный иммунодефицит;
комбинированный иммунодефицит;
острый перитонит;
острый панкреатит;
остеомиелит;
тяжелая пневмония;
бактериальный сепсис новорожденных;
сепсис;
другие генерализованные и тяжелые локализованные инфекции.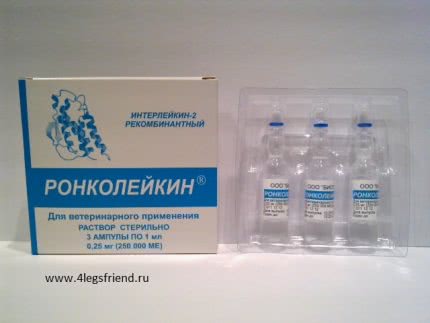 Инфузия всего объема раствора осуществляется капельно в течение 4-6 часов. Раствор препарата должен быть прозрачным, бесцветным и не содержать посторонних включений.
Иммунотерапию Ронколейкином проводят после завершения неотложных и срочных оперативных вмешательств, направленных на устранение жизнеугрожающих последствий основного заболевания/травмы, санации и адекватного дренирования инфекционного очага.
При лечении тяжелого сепсиса проводят от одного до трех курсов Ронколейкина. Курс включает 2 в/в инфузии в дозе 0,5 мг через день. Критерием для назначения второго и третьего курсов Ронколейкина является сохраняющаяся в ходе лечения лимфопения (абсолютная и/или относительная).
При впервые выявленном инфильтративном деструктивном туберкулезе легких - 3 в/в инфузии в дозе 0,5 мг с интервалом 48 часов на фоне специфической полихимиотерапии.
Для предоперационной подготовки при прогрессирующем фиброзно-кавернозном туберкулезе (ФКТ) легких на фоне специфической полихимиотерапии:
при одностороннем ФКТ – 3 в/в введения по 1 мг с интервалом 48 часов;
при распространенном ФКТ легких с двусторонней очаговой диссеминацией – 7 в/в введений: 3 введения в течение первой недели по 1 мг с интервалом 48 часов, далее по 1 мг два раза в неделю в течение двух недель.
Инфузия всего объема раствора осуществляется капельно в течение 4-6 часов. Раствор препарата должен быть прозрачным, бесцветным и не содержать посторонних включений.
Иммунотерапию Ронколейкином проводят после завершения неотложных и срочных оперативных вмешательств, направленных на устранение жизнеугрожающих последствий основного заболевания/травмы, санации и адекватного дренирования инфекционного очага.
При лечении тяжелого сепсиса проводят от одного до трех курсов Ронколейкина. Курс включает 2 в/в инфузии в дозе 0,5 мг через день. Критерием для назначения второго и третьего курсов Ронколейкина является сохраняющаяся в ходе лечения лимфопения (абсолютная и/или относительная).
При впервые выявленном инфильтративном деструктивном туберкулезе легких - 3 в/в инфузии в дозе 0,5 мг с интервалом 48 часов на фоне специфической полихимиотерапии.
Для предоперационной подготовки при прогрессирующем фиброзно-кавернозном туберкулезе (ФКТ) легких на фоне специфической полихимиотерапии:
при одностороннем ФКТ – 3 в/в введения по 1 мг с интервалом 48 часов;
при распространенном ФКТ легких с двусторонней очаговой диссеминацией – 7 в/в введений: 3 введения в течение первой недели по 1 мг с интервалом 48 часов, далее по 1 мг два раза в неделю в течение двух недель. Рекомендуемый курс иммунотерапии должен быть завершен за 7 – 10 дней до оперативного вмешательства.
Назначение препарата при туберкулезе легких нецелесообразно при дефиците массы тела более 30 %.
Курс лечения Ронколейкином диссеминированных и местнораспространенных форм почечноклеточного рака включает:
однократное п/к или в/в введение препарата в дозе 0,5 мг за 24 часа до операции;
в составе 8-недельного курса иммунохимиотерапии по 2,0 мг в/в через день в течение первых четырех недель лечения. Повторные курсы проводят через 1 - 2 мес.
У детей Ронколейкин применяют внутривенно капельно. Схемы применения соответствуют таковым у взрослых. Препарат разводят в натрия хлорида растворе изотоническом 0,9% для инъекций. Разовая доза препарата и объем изотонического раствора у детей зависит от возраста:
от 0 до 1 мес. – 0,1 мг в 30-50 мл раствора;
от 1 мес. до 1 года – 0,125 мг в 100 мл раствора;
от 1 года до 7 лет – 0,25 мг в 200 мл раствора;
старше 7 лет – 0,5 мг в 200 мл раствора;
старше 14 лет – 0,5 мг в 400 мл раствора.
Рекомендуемый курс иммунотерапии должен быть завершен за 7 – 10 дней до оперативного вмешательства.
Назначение препарата при туберкулезе легких нецелесообразно при дефиците массы тела более 30 %.
Курс лечения Ронколейкином диссеминированных и местнораспространенных форм почечноклеточного рака включает:
однократное п/к или в/в введение препарата в дозе 0,5 мг за 24 часа до операции;
в составе 8-недельного курса иммунохимиотерапии по 2,0 мг в/в через день в течение первых четырех недель лечения. Повторные курсы проводят через 1 - 2 мес.
У детей Ронколейкин применяют внутривенно капельно. Схемы применения соответствуют таковым у взрослых. Препарат разводят в натрия хлорида растворе изотоническом 0,9% для инъекций. Разовая доза препарата и объем изотонического раствора у детей зависит от возраста:
от 0 до 1 мес. – 0,1 мг в 30-50 мл раствора;
от 1 мес. до 1 года – 0,125 мг в 100 мл раствора;
от 1 года до 7 лет – 0,25 мг в 200 мл раствора;
старше 7 лет – 0,5 мг в 200 мл раствора;
старше 14 лет – 0,5 мг в 400 мл раствора.
 Синтезированный ИЛ-2 воздействует на Т-лимфоциты, усиливая их пролиферацию и последующий синтез ИЛ-2.
Биологические эффекты ИЛ-2 опосредуются его связыванием со специфическими рецепторами, представленными на различных клеточных мишенях.
ИЛ-2 направленно влияет на рост, дифференцировку и активацию Т- и В-лимфоцитов, моноцитов, макрофагов, олигодендроглиальных клеток, клеток Лангерганса. От его присутствия зависит развитие цитолитической активности натуральных киллеров и цитотоксических
Т-лимфоцитов. ИЛ-2 вызывает образование лимфокин-активированных киллеров и активирует опухоль-инфильтрирующие клетки.
Расширение спектра лизирующего действия эффекторных клеток обусловливает элиминацию разнообразных патогенных микроорганизмов, инфицированных и малигнизированных клеток, что обеспечивает иммунную защиту, направленную против опухолевых клеток, а также возбудителей вирусной, бактериальной и грибковой инфекции.
Синтезированный ИЛ-2 воздействует на Т-лимфоциты, усиливая их пролиферацию и последующий синтез ИЛ-2.
Биологические эффекты ИЛ-2 опосредуются его связыванием со специфическими рецепторами, представленными на различных клеточных мишенях.
ИЛ-2 направленно влияет на рост, дифференцировку и активацию Т- и В-лимфоцитов, моноцитов, макрофагов, олигодендроглиальных клеток, клеток Лангерганса. От его присутствия зависит развитие цитолитической активности натуральных киллеров и цитотоксических
Т-лимфоцитов. ИЛ-2 вызывает образование лимфокин-активированных киллеров и активирует опухоль-инфильтрирующие клетки.
Расширение спектра лизирующего действия эффекторных клеток обусловливает элиминацию разнообразных патогенных микроорганизмов, инфицированных и малигнизированных клеток, что обеспечивает иммунную защиту, направленную против опухолевых клеток, а также возбудителей вирусной, бактериальной и грибковой инфекции.
 При подкожном введении препарата отмечались местные реакции - болезненность, уплотнение, покраснение в месте инъекции.
При подкожном введении препарата отмечались местные реакции - болезненность, уплотнение, покраснение в месте инъекции. При применении Ронколейкина на фоне длительной терапии препаратами глюкокортикостероидов активность действия препарата может снижаться. Препарат нельзя смешивать с другими лекарственными препаратами в одном шприце или флаконе.
При применении Ронколейкина на фоне длительной терапии препаратами глюкокортикостероидов активность действия препарата может снижаться. Препарат нельзя смешивать с другими лекарственными препаратами в одном шприце или флаконе.
 Используется как вспомогательный препарат
Используется как вспомогательный препарат Обычно они проявляются легким раздражением головной боли в местах нанесения геля. Еще менее вероятно возникновение язвы желудка при длительном приеме таблеток.
Обычно они проявляются легким раздражением головной боли в местах нанесения геля. Еще менее вероятно возникновение язвы желудка при длительном приеме таблеток.
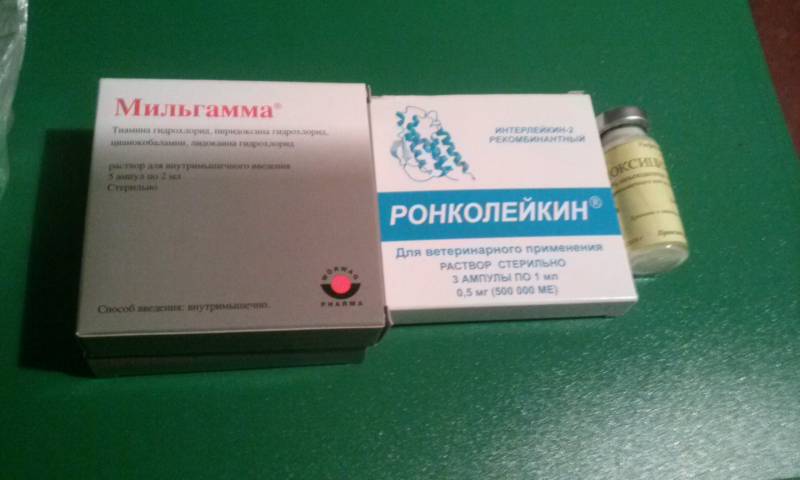
 Для уменьшения этого явления препарат разводят пятью частями натрия хлорида (0,9%) или водой (инъекции). Полученный раствор при взбалтывании образует относительно устойчивую пену, поэтому манипуляции проводят с осторожностью.
Для уменьшения этого явления препарат разводят пятью частями натрия хлорида (0,9%) или водой (инъекции). Полученный раствор при взбалтывании образует относительно устойчивую пену, поэтому манипуляции проводят с осторожностью. Таблетки помещены во флаконы из темного стекла по 6 штук. Основным действующим компонентом препарата является празиквантел – в каждой таблетке содержится около 600 мг этого вещества. Что касается вспомогательных компонентов, то в состав препарата входят стеарат магния, макрогол 4000, микрокристаллическая целлюлоза, лаурилсульфат натрия, гипромеллоза, кукурузный крахмал, диоксид титана и повидон.
Таблетки помещены во флаконы из темного стекла по 6 штук. Основным действующим компонентом препарата является празиквантел – в каждой таблетке содержится около 600 мг этого вещества. Что касается вспомогательных компонентов, то в состав препарата входят стеарат магния, макрогол 4000, микрокристаллическая целлюлоза, лаурилсульфат натрия, гипромеллоза, кукурузный крахмал, диоксид титана и повидон. Лечение «Бильтрицидом» помогает при заражении организма человека разными видами шистосом.Показаниями к терапии являются заболевания, вызванные печеночным и легочным сосальщиками, а также некоторыми другими видами гельминтов.
Лечение «Бильтрицидом» помогает при заражении организма человека разными видами шистосом.Показаниями к терапии являются заболевания, вызванные печеночным и легочным сосальщиками, а также некоторыми другими видами гельминтов.
 Некоторые побочные реакции обусловлены не воздействием препарата на организм, а именно гибелью паразитов, в связи с чем по завершении терапии состояние улучшится.
Некоторые побочные реакции обусловлены не воздействием препарата на организм, а именно гибелью паразитов, в связи с чем по завершении терапии состояние улучшится. К недостаткам можно отнести не только цену, которая многим пациентам кажется несколько завышенной.С другой стороны, многие аналоги лекарства стоят дороже.
К недостаткам можно отнести не только цену, которая многим пациентам кажется несколько завышенной.С другой стороны, многие аналоги лекарства стоят дороже. Бразилия Rev Bras Parasitol Vet. 2012;21:101–6.Поиск в Google Scholar
Бразилия Rev Bras Parasitol Vet. 2012;21:101–6.Поиск в Google Scholar Поиск в Google Scholar
Поиск в Google Scholar II. Продлить проценты за серебро. Burns 2000;26:131–8.Поиск в Google Scholar
II. Продлить проценты за серебро. Burns 2000;26:131–8.Поиск в Google Scholar Curr Sci 2006;91:926–9.Search in Google Scholar
Curr Sci 2006;91:926–9.Search in Google Scholar Отчет об исследовании. Санкт-Петербург 2014:20. (in Russ.)Поиск в Google Scholar
Отчет об исследовании. Санкт-Петербург 2014:20. (in Russ.)Поиск в Google Scholar Демлинг Р.Х., Лесли ДеСанти, доктор медицины. Скорость повторной эпителизации через сетчатые кожные трансплантаты увеличивается при воздействии серебра. Burns 2002; 28:264–6. Поиск в Google Scholar
Демлинг Р.Х., Лесли ДеСанти, доктор медицины. Скорость повторной эпителизации через сетчатые кожные трансплантаты увеличивается при воздействии серебра. Burns 2002; 28:264–6. Поиск в Google Scholar Поиск в Google Scholar
Поиск в Google Scholar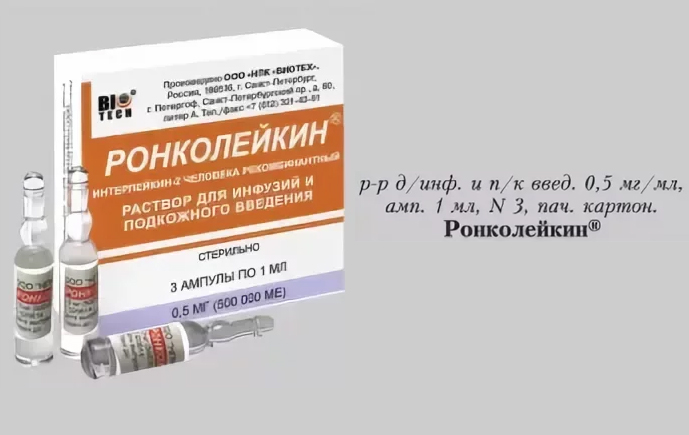 В 2002 году примерно 8000 человек были инфицированы SARS-CoV (коронавирус, связанный с тяжелым острым респираторным синдромом) в провинции Гуандун в Китае, при этом уровень смертности составил 10%. В 2012 г. вторая вспышка инфекции была вызвана БВРС-КоВ [3]. Эти три коронавируса SARS-CoV, MERS-CoV и SARS-CoV-2 вызывали сухой кашель, дистресс, миалгию и головную боль.У пациентов с тяжелым течением заболевания развился выраженный тяжелый острый респираторный синдром и респираторный дистресс-синдром (ОРДС) [4,5,6,7,8]. Иммунная система играет важную роль в борьбе с вирусной инфекцией. Однако чрезмерный иммунный ответ может привести к системной воспалительной реакции, органным нарушениям и полиорганной недостаточности (ПОН) (рис. 1). Чрезмерный или аномальный иммунный ответ может способствовать развитию атипичной пневмонии. Об этой связи свидетельствует тот факт, что степень дыхательной недостаточности увеличивается, несмотря на снижение вирусной нагрузки [9].Кроме того, прогрессирование ОРДС связано с повышением уровня циркулирующих медиаторов воспаления, которые вызывают такие опасные осложнения COVID-19, как системный воспалительный ответ и сепсисоподобные состояния [10,11,12].
В 2002 году примерно 8000 человек были инфицированы SARS-CoV (коронавирус, связанный с тяжелым острым респираторным синдромом) в провинции Гуандун в Китае, при этом уровень смертности составил 10%. В 2012 г. вторая вспышка инфекции была вызвана БВРС-КоВ [3]. Эти три коронавируса SARS-CoV, MERS-CoV и SARS-CoV-2 вызывали сухой кашель, дистресс, миалгию и головную боль.У пациентов с тяжелым течением заболевания развился выраженный тяжелый острый респираторный синдром и респираторный дистресс-синдром (ОРДС) [4,5,6,7,8]. Иммунная система играет важную роль в борьбе с вирусной инфекцией. Однако чрезмерный иммунный ответ может привести к системной воспалительной реакции, органным нарушениям и полиорганной недостаточности (ПОН) (рис. 1). Чрезмерный или аномальный иммунный ответ может способствовать развитию атипичной пневмонии. Об этой связи свидетельствует тот факт, что степень дыхательной недостаточности увеличивается, несмотря на снижение вирусной нагрузки [9].Кроме того, прогрессирование ОРДС связано с повышением уровня циркулирующих медиаторов воспаления, которые вызывают такие опасные осложнения COVID-19, как системный воспалительный ответ и сепсисоподобные состояния [10,11,12]. На поздних стадиях заболевания у больных может развиться легочная недостаточность и ПОН с острой дисфункцией печени и почек, гипоксической энцефалопатией, диссеминированным внутрисосудистым свертыванием крови/тромбоэмболической болезнью (ДВС-синдром) и септическим шоком. Развитие этих осложнений тесно связано с летальными исходами у больных COVID-19.Следовательно, эта инфекция может вызывать как ОРДС, так и системные воспалительные реакции, приводящие к ПОН. «Цитокиновый шторм», который может индуцировать системный воспалительный ответ, вирус-ассоциированный сепсис, воспалительные заболевания легких, такие как пневмонит или ОРДС, шок и органная или ПОН, играет важную роль в патогенезе COVID-19, который аналогичен таковому. показано для SARS и MERS (рис. 1). Еще одним симптомом тяжелого течения коронавирусной инфекции является лимфопения, которая может стать критической на поздних стадиях заболевания [13,14].
На поздних стадиях заболевания у больных может развиться легочная недостаточность и ПОН с острой дисфункцией печени и почек, гипоксической энцефалопатией, диссеминированным внутрисосудистым свертыванием крови/тромбоэмболической болезнью (ДВС-синдром) и септическим шоком. Развитие этих осложнений тесно связано с летальными исходами у больных COVID-19.Следовательно, эта инфекция может вызывать как ОРДС, так и системные воспалительные реакции, приводящие к ПОН. «Цитокиновый шторм», который может индуцировать системный воспалительный ответ, вирус-ассоциированный сепсис, воспалительные заболевания легких, такие как пневмонит или ОРДС, шок и органная или ПОН, играет важную роль в патогенезе COVID-19, который аналогичен таковому. показано для SARS и MERS (рис. 1). Еще одним симптомом тяжелого течения коронавирусной инфекции является лимфопения, которая может стать критической на поздних стадиях заболевания [13,14]. Поэтому особенно полезной может быть поддерживающая терапия, облегчающая симптомы и поддерживающая функции многих органов. Противовирусные препараты, такие как осельтамивир, арбидол, лопинавир/ритонавир и интерферон-α, продемонстрировали определенный эффект в моно- или комбинированной терапии. Однако глюкокортикоидная терапия, направленная на сдерживание «цитокинового шторма», не дала зарегистрированного клинического эффекта. Иммуноглобулиновая терапия также показала низкую эффективность.Таким образом, выявление групп высокого риска и/или как можно более раннее начало лечения имеют решающее значение для снижения уровня смертности.
Поэтому особенно полезной может быть поддерживающая терапия, облегчающая симптомы и поддерживающая функции многих органов. Противовирусные препараты, такие как осельтамивир, арбидол, лопинавир/ритонавир и интерферон-α, продемонстрировали определенный эффект в моно- или комбинированной терапии. Однако глюкокортикоидная терапия, направленная на сдерживание «цитокинового шторма», не дала зарегистрированного клинического эффекта. Иммуноглобулиновая терапия также показала низкую эффективность.Таким образом, выявление групп высокого риска и/или как можно более раннее начало лечения имеют решающее значение для снижения уровня смертности. Таким образом, лучшее понимание патогенеза иммунных заболеваний имеет решающее значение для обеспечения научной основы для достижения эффективного лечения инфекции. Мы тематически фокусируемся на иммунопатогенезе COVID-19 и родственных CoV, клинических исследованиях и прогностических иммунологических маркерах, а также текущих и перспективных иммунотерапевтических стратегиях.
Таким образом, лучшее понимание патогенеза иммунных заболеваний имеет решающее значение для обеспечения научной основы для достижения эффективного лечения инфекции. Мы тематически фокусируемся на иммунопатогенезе COVID-19 и родственных CoV, клинических исследованиях и прогностических иммунологических маркерах, а также текущих и перспективных иммунотерапевтических стратегиях. Аналогичные данные были получены в ретроспективном многоцентровом исследовании, в которое были включены 67 онкологических больных с COVID-19 из больниц города Ухань, провинция Хубэй, Китай.Исследование показало, что у большей части онкологических больных с COVID-19 по сравнению с неонкологическими пациентами развилось тяжелое течение заболевания и прогноз был неблагоприятным. Тенденция к неблагоприятному прогнозу была более выражена у пациентов, прошедших курс противоопухолевого лечения [17]. Также было установлено, что госпитализация и повторные визиты в больницу являются потенциальным фактором риска развития COVID-19 [18]. В целом 48-54% онкологических больных были подвержены более высокому риску тяжелых событий и от 5,6% до 29% случаев были подвержены риску смерти [19].Тем не менее, интересно отметить, что у пациентов с раком легких не было более высокого риска тяжелых осложнений по сравнению с другими типами рака. Онкологические больные, получающие иммунотерапию ингибиторами контрольных точек, также могут иметь повышенный риск тяжелых осложнений коронавирусной инфекции в результате иммуноопосредованных событий, вызванных «цитокиновым штормом».
Аналогичные данные были получены в ретроспективном многоцентровом исследовании, в которое были включены 67 онкологических больных с COVID-19 из больниц города Ухань, провинция Хубэй, Китай.Исследование показало, что у большей части онкологических больных с COVID-19 по сравнению с неонкологическими пациентами развилось тяжелое течение заболевания и прогноз был неблагоприятным. Тенденция к неблагоприятному прогнозу была более выражена у пациентов, прошедших курс противоопухолевого лечения [17]. Также было установлено, что госпитализация и повторные визиты в больницу являются потенциальным фактором риска развития COVID-19 [18]. В целом 48-54% онкологических больных были подвержены более высокому риску тяжелых событий и от 5,6% до 29% случаев были подвержены риску смерти [19].Тем не менее, интересно отметить, что у пациентов с раком легких не было более высокого риска тяжелых осложнений по сравнению с другими типами рака. Онкологические больные, получающие иммунотерапию ингибиторами контрольных точек, также могут иметь повышенный риск тяжелых осложнений коронавирусной инфекции в результате иммуноопосредованных событий, вызванных «цитокиновым штормом». Это наблюдение демонстрирует сходство механизмов иммунных дисфункций, возникающих в результате осложнений COVID-19 и противоопухолевой терапии ингибиторами иммунных контрольных точек (ИКИ) [20].Однако восприимчивость к бактериальным или вирусным инфекциям у онкологических больных при терапии ИКИ изучена недостаточно широко. С одной стороны, в отличие от химиотерапии, иммунотерапия ICI может восстановить компетентность клеточного иммунитета [21]. Однако, с другой стороны, существуют опасения по поводу лечения пациентов с COVID-19 с помощью ИКИ, поскольку пневмонит, вызванный ИКИ, может усугубить вирусную пневмонию. Вероятно, суммируются эффекты гиперпродукции индуцированных ИКИ медиаторов воспаления и вирусной инфекции, что может привести к фатальным последствиям [22].Также предполагается, что адоптивная иммунотерапия генетически модифицированными CAR-T-клетками (Т-клетками с химерными антигенными рецепторами) увеличивает риск неблагоприятного исхода у онкологических больных с COVID-19, при этом учитывается тот факт, что «цитокиновый шторм» представляет собой частый неблагоприятный эффект CAR-T-клеточной терапии [23].
Это наблюдение демонстрирует сходство механизмов иммунных дисфункций, возникающих в результате осложнений COVID-19 и противоопухолевой терапии ингибиторами иммунных контрольных точек (ИКИ) [20].Однако восприимчивость к бактериальным или вирусным инфекциям у онкологических больных при терапии ИКИ изучена недостаточно широко. С одной стороны, в отличие от химиотерапии, иммунотерапия ICI может восстановить компетентность клеточного иммунитета [21]. Однако, с другой стороны, существуют опасения по поводу лечения пациентов с COVID-19 с помощью ИКИ, поскольку пневмонит, вызванный ИКИ, может усугубить вирусную пневмонию. Вероятно, суммируются эффекты гиперпродукции индуцированных ИКИ медиаторов воспаления и вирусной инфекции, что может привести к фатальным последствиям [22].Также предполагается, что адоптивная иммунотерапия генетически модифицированными CAR-T-клетками (Т-клетками с химерными антигенными рецепторами) увеличивает риск неблагоприятного исхода у онкологических больных с COVID-19, при этом учитывается тот факт, что «цитокиновый шторм» представляет собой частый неблагоприятный эффект CAR-T-клеточной терапии [23]. Иммунодефицит, возникающий у детей с онкологическими заболеваниями, получающих противоопухолевое лечение, может представлять потенциальный риск тяжелых осложнений COVID-19. Однако несколько зарегистрированных случаев COVID-19 у детей, получающих противоопухолевое лечение, были описаны как бессимптомные или с легкими симптомами [24].Более того, некоторые данные показали, что пациенты, к которым относятся как взрослые, так и дети с угнетением иммунной системы в результате развития злокачественных новообразований, противоопухолевой терапии и трансплантации, достигли благоприятного эффекта в лечении COVID-19 по сравнению с пациентами с другими сопутствующими заболеваниями. Такие результаты можно объяснить отсутствием гиперэкспрессии воспалительных реакций за счет подавления иммунного ответа, что определяет слабое проявление заболевания, вызванного SARS-CoV-2 [25].Несмотря на редкое сочетание рака и COVID-19 у детей, стоит обратить более пристальное внимание на две группы пациентов — детей первого года жизни и детей с острым лимфобластным лейкозом (ОЛЛ), получающих поддерживающую терапию.
Иммунодефицит, возникающий у детей с онкологическими заболеваниями, получающих противоопухолевое лечение, может представлять потенциальный риск тяжелых осложнений COVID-19. Однако несколько зарегистрированных случаев COVID-19 у детей, получающих противоопухолевое лечение, были описаны как бессимптомные или с легкими симптомами [24].Более того, некоторые данные показали, что пациенты, к которым относятся как взрослые, так и дети с угнетением иммунной системы в результате развития злокачественных новообразований, противоопухолевой терапии и трансплантации, достигли благоприятного эффекта в лечении COVID-19 по сравнению с пациентами с другими сопутствующими заболеваниями. Такие результаты можно объяснить отсутствием гиперэкспрессии воспалительных реакций за счет подавления иммунного ответа, что определяет слабое проявление заболевания, вызванного SARS-CoV-2 [25].Несмотря на редкое сочетание рака и COVID-19 у детей, стоит обратить более пристальное внимание на две группы пациентов — детей первого года жизни и детей с острым лимфобластным лейкозом (ОЛЛ), получающих поддерживающую терапию. В ограниченном опыте наблюдения зарегистрированы летальные исходы в обеих группах. Вероятно, эти неудовлетворительные результаты были обусловлены выраженной иммунной дисфункцией, которая была обусловлена, с одной стороны, возрастной незрелостью иммунной системы, а с другой - несостоятельностью лимфоцитарного звена иммунитета.Италия имеет свой особый опыт лечения детей с онкологическими заболеваниями и после трансплантации гемопоэтических стволовых клеток с сопутствующей коронавирусной инфекцией. Так, Balduzzi A. et al. описали относительно легкое течение COVID-19 у детей с острым лимфобластным лейкозом, остеосаркомой и рабдоидной опухолью [26]. Пациенты, включенные в исследование, имели стандартный риск заболевания. Таким образом, авторы сделали вывод о легкой форме инфекции COVID-19 в этой когорте [26]. Исследование Лян В.и другие. проанализировали 18 пациентов с COVID-19 и раком в анамнезе [16]. Авторы продемонстрировали более тяжелое течение COVID-19 у онкологических больных и, как следствие, худший исход заболевания.
В ограниченном опыте наблюдения зарегистрированы летальные исходы в обеих группах. Вероятно, эти неудовлетворительные результаты были обусловлены выраженной иммунной дисфункцией, которая была обусловлена, с одной стороны, возрастной незрелостью иммунной системы, а с другой - несостоятельностью лимфоцитарного звена иммунитета.Италия имеет свой особый опыт лечения детей с онкологическими заболеваниями и после трансплантации гемопоэтических стволовых клеток с сопутствующей коронавирусной инфекцией. Так, Balduzzi A. et al. описали относительно легкое течение COVID-19 у детей с острым лимфобластным лейкозом, остеосаркомой и рабдоидной опухолью [26]. Пациенты, включенные в исследование, имели стандартный риск заболевания. Таким образом, авторы сделали вывод о легкой форме инфекции COVID-19 в этой когорте [26]. Исследование Лян В.и другие. проанализировали 18 пациентов с COVID-19 и раком в анамнезе [16]. Авторы продемонстрировали более тяжелое течение COVID-19 у онкологических больных и, как следствие, худший исход заболевания. В различных научных статьях описаны общие меры профилактики и лечения COVID-19 у детей с онкологическими заболеваниями, которые соответствуют рекомендуемым для противоинфекционного лечения населения в целом [27]. Однако авторы предлагают продолжать терапию как можно полнее, но воздерживаться от интенсивной химиотерапии и особенно иммунотерапии у детей с онкологическими заболеваниями в стадии ремиссии.
В различных научных статьях описаны общие меры профилактики и лечения COVID-19 у детей с онкологическими заболеваниями, которые соответствуют рекомендуемым для противоинфекционного лечения населения в целом [27]. Однако авторы предлагают продолжать терапию как можно полнее, но воздерживаться от интенсивной химиотерапии и особенно иммунотерапии у детей с онкологическими заболеваниями в стадии ремиссии. Однако у больных с умеренной интоксикацией отклонения этого показателя были незначительными [29]. Снижение относительного количества лимфоцитов до уровня ниже 20% у больных COVID-19 в течение первых 10–12 дней заболевания считается неблагоприятным прогностическим фактором, а снижение лимфоцитов ниже 5% связано с высоким риском летального исхода. и эти больные нуждаются в интенсивной терапии. У пациентов в отделениях интенсивной терапии среднее количество лимфоцитов составляло 800 клеток/мкл. В тяжелых случаях абсолютное число лимфоцитов резко снижалось до 100 клеток/мкл [30,31].Как правило, у умерших больных в отличие от выздоровевших наблюдалась стойкая и тяжелая лимфопения. Эти данные свидетельствуют о том, что интоксикация COVID-19 приводит к нарушениям иммунного статуса пациентов, что вызывает иммуносупрессивные состояния и может привести к иммунному параличу. Хотя у большинства пациентов с коронавирусом была лимфопения, у них не было значительных изменений количества нейтрофилов в крови.
Однако у больных с умеренной интоксикацией отклонения этого показателя были незначительными [29]. Снижение относительного количества лимфоцитов до уровня ниже 20% у больных COVID-19 в течение первых 10–12 дней заболевания считается неблагоприятным прогностическим фактором, а снижение лимфоцитов ниже 5% связано с высоким риском летального исхода. и эти больные нуждаются в интенсивной терапии. У пациентов в отделениях интенсивной терапии среднее количество лимфоцитов составляло 800 клеток/мкл. В тяжелых случаях абсолютное число лимфоцитов резко снижалось до 100 клеток/мкл [30,31].Как правило, у умерших больных в отличие от выздоровевших наблюдалась стойкая и тяжелая лимфопения. Эти данные свидетельствуют о том, что интоксикация COVID-19 приводит к нарушениям иммунного статуса пациентов, что вызывает иммуносупрессивные состояния и может привести к иммунному параличу. Хотя у большинства пациентов с коронавирусом была лимфопения, у них не было значительных изменений количества нейтрофилов в крови. Повышенное отношение нейтрофилов к лимфоцитам (N/L) наблюдалось у больных с тяжелой степенью заболевания и лимфопенией, что считается четким маркером системного воспаления.Так, у больных с сепсисом высокое отношение N/L коррелировало с тяжестью заболевания по шкале APACHE II и 28-дневной летальностью [32]. Эти данные свидетельствуют о том, что повышенное отношение N/L связано с неблагоприятным исходом у пациентов с COVID-19. У пациентов с COVID-19, особенно с тяжелым течением, лимфопения развивалась преимущественно в результате снижения CD4 + Th (T помощник) номер сотового. Однако числа CD8 + Т-клеток и В-клеток не показали значительных изменений.Выраженная лимфопения была связана не только со сниженным числом CD3 + CD 4 + Т-клеток, но и с ингибированием их дифференцировки в эффекторные клетки памяти из наивных CD4 + Т-клеток, которые играют особенно важную роль в адаптивном противоинфекционном иммунитете. Хорошо известно, что баланс между наивными CD4 + Th-клетками и Т-клетками памяти имеет решающее значение для развития эффективного иммунного ответа [33].
Повышенное отношение нейтрофилов к лимфоцитам (N/L) наблюдалось у больных с тяжелой степенью заболевания и лимфопенией, что считается четким маркером системного воспаления.Так, у больных с сепсисом высокое отношение N/L коррелировало с тяжестью заболевания по шкале APACHE II и 28-дневной летальностью [32]. Эти данные свидетельствуют о том, что повышенное отношение N/L связано с неблагоприятным исходом у пациентов с COVID-19. У пациентов с COVID-19, особенно с тяжелым течением, лимфопения развивалась преимущественно в результате снижения CD4 + Th (T помощник) номер сотового. Однако числа CD8 + Т-клеток и В-клеток не показали значительных изменений.Выраженная лимфопения была связана не только со сниженным числом CD3 + CD 4 + Т-клеток, но и с ингибированием их дифференцировки в эффекторные клетки памяти из наивных CD4 + Т-клеток, которые играют особенно важную роль в адаптивном противоинфекционном иммунитете. Хорошо известно, что баланс между наивными CD4 + Th-клетками и Т-клетками памяти имеет решающее значение для развития эффективного иммунного ответа [33]. У пациентов с тяжелой формой COVID-19 было снижено количество Т-регуляторных (Treg) клеток, которые играют ключевую роль в ослаблении чрезмерного воспалительного ответа на вирусную инфекцию [34,35,36].Авторы сообщают, что у пациентов с COVID-19 наблюдали повышенную экспрессию маркеров активации Т-клеток, таких как CD69 и CD38, играющих важную роль в клональной экспансии лимфоцитов и продукции различных цитокинов, в том числе провоспалительных [37]. ,38,39]. В частности, в предыдущих исследованиях было установлено, что активированные Т-лимфоциты имеют повышенную продукцию ИЛ-2, ИФН-γ и высокий уровень внутриклеточных цитокинов, таких как ИЛ-6 и ГМ-КСФ (гранулоцитарно-макрофагальный колониестимулирующий фактор). ), которые играют основную роль в индукции «цитокинового шторма» при коронавирусных инфекциях [40,41,42,43].С другой стороны, некоторые авторы показали, что Treg-клетки, экспрессирующие маркеры активации CD38 и CD69, характеризуются повышенной супрессорной активностью и, следовательно, повышенной продукцией IL-10 по сравнению с наивными Treg [44].
У пациентов с тяжелой формой COVID-19 было снижено количество Т-регуляторных (Treg) клеток, которые играют ключевую роль в ослаблении чрезмерного воспалительного ответа на вирусную инфекцию [34,35,36].Авторы сообщают, что у пациентов с COVID-19 наблюдали повышенную экспрессию маркеров активации Т-клеток, таких как CD69 и CD38, играющих важную роль в клональной экспансии лимфоцитов и продукции различных цитокинов, в том числе провоспалительных [37]. ,38,39]. В частности, в предыдущих исследованиях было установлено, что активированные Т-лимфоциты имеют повышенную продукцию ИЛ-2, ИФН-γ и высокий уровень внутриклеточных цитокинов, таких как ИЛ-6 и ГМ-КСФ (гранулоцитарно-макрофагальный колониестимулирующий фактор). ), которые играют основную роль в индукции «цитокинового шторма» при коронавирусных инфекциях [40,41,42,43].С другой стороны, некоторые авторы показали, что Treg-клетки, экспрессирующие маркеры активации CD38 и CD69, характеризуются повышенной супрессорной активностью и, следовательно, повышенной продукцией IL-10 по сравнению с наивными Treg [44]. Подобно состояниям у пациентов с сепсисом, снижение экспрессии HLA-DR на моноцитах CD14 + , что подавляет их антигенпрезентирующую функцию и предотвращает индукцию адаптивного иммунного ответа, представляет собой показатель тяжелых иммуносупрессивных состояний, которые приводят к иммунный паралич у пациентов с COVID-19 [45].Эти данные демонстрируют дисрегуляцию иммунных реакций у больных COVID-19 в критической стадии, проявляющуюся избыточной продукцией как провоспалительных, так и супрессорных биорегуляторов, во многом определяющих иммунный патогенез инфекции (рис. 1).
Подобно состояниям у пациентов с сепсисом, снижение экспрессии HLA-DR на моноцитах CD14 + , что подавляет их антигенпрезентирующую функцию и предотвращает индукцию адаптивного иммунного ответа, представляет собой показатель тяжелых иммуносупрессивных состояний, которые приводят к иммунный паралич у пациентов с COVID-19 [45].Эти данные демонстрируют дисрегуляцию иммунных реакций у больных COVID-19 в критической стадии, проявляющуюся избыточной продукцией как провоспалительных, так и супрессорных биорегуляторов, во многом определяющих иммунный патогенез инфекции (рис. 1).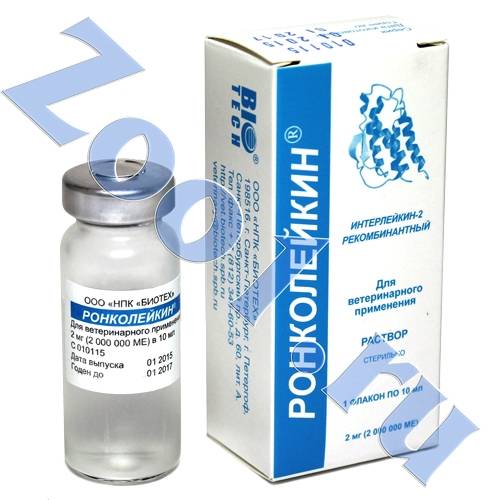 В частности, уровни циркулирующего IL-6 тесно связаны с тяжестью течения COVID-19. Повышенные концентрации ИЛ-6 наблюдались у пациентов с тяжелым респираторным дистресс-синдромом. Ульхак З.С. и соавт. [48] провели метаанализ девяти исследований и показали, что, несмотря на гетерогенность включенных когорт, уровни ИЛ-6 были достоверно выше у пациентов с тяжелыми явлениями по сравнению с пациентами с легкой или средней степенями тяжести заболевания. Избыточная продукция IL-6, как было показано ранее, приводит к ингибированию поверхностной экспрессии HLA-DR (человеческий лейкоцитарный антиген – изотип DR) на моноцитах CD14 + [49].Вероятно, такие же процессы происходят у пациентов с COVID-19, и, таким образом, гиперпродукция ИЛ-6 опосредует низкую экспрессию HLA-DR на моноцитах CD14 + . Повышение концентрации растворимых рецепторов к ИЛ-2, ИЛ-8, ИЛ -10 и ФНО-α (фактор некроза опухоли альфа) регистрировались в дополнение к повышенному уровню ИЛ-6 в сыворотке крови [47], тогда как ИЛ-1β у большинства пациентов не определялся [12].
В частности, уровни циркулирующего IL-6 тесно связаны с тяжестью течения COVID-19. Повышенные концентрации ИЛ-6 наблюдались у пациентов с тяжелым респираторным дистресс-синдромом. Ульхак З.С. и соавт. [48] провели метаанализ девяти исследований и показали, что, несмотря на гетерогенность включенных когорт, уровни ИЛ-6 были достоверно выше у пациентов с тяжелыми явлениями по сравнению с пациентами с легкой или средней степенями тяжести заболевания. Избыточная продукция IL-6, как было показано ранее, приводит к ингибированию поверхностной экспрессии HLA-DR (человеческий лейкоцитарный антиген – изотип DR) на моноцитах CD14 + [49].Вероятно, такие же процессы происходят у пациентов с COVID-19, и, таким образом, гиперпродукция ИЛ-6 опосредует низкую экспрессию HLA-DR на моноцитах CD14 + . Повышение концентрации растворимых рецепторов к ИЛ-2, ИЛ-8, ИЛ -10 и ФНО-α (фактор некроза опухоли альфа) регистрировались в дополнение к повышенному уровню ИЛ-6 в сыворотке крови [47], тогда как ИЛ-1β у большинства пациентов не определялся [12]. К. Хуанг и соавт. изучали цитокины и хемокины у пациентов с COVID-19 и показали, что более высокие концентрации IL-2, IL-7, IL-10, G-CSF (гранулоцитарный колониестимулирующий фактор), IP10 (INF-γ-индуцируемый белок 10), В плазме больных с тяжелой степенью инфекции были зарегистрированы MCP1 (моноцитарный хемоаттрактантный белок 1), MIP1A (макрофагальный воспалительный белок 1 альфа) и TNF-α [50].Чжоу Ю. и соавт. [41] проанализировали иммунные параметры пациентов с COVID-19, особенно пациентов с тяжелой инфекцией и неблагоприятным исходом, и показали, что у них также были повышенные концентрации в сыворотке цитокинов, связанных с воспалением, включая IL-2, IL-7, IL-10, G –CSF, IP10, MCP1, MIP1A и TNF-α. Некоторые авторы упоминали о гиперпродукции других медиаторов воспаления, таких как ИЛ-12, ИЛ-13, ИЛ-17, ИФН-γ, МСР1, фактора роста гепатоцитов (HGF), TNF-α и фактора роста эндотелия сосудов (VEGF). ) [51].Чрезмерно активированный иммунный ответ может быть вызван патогенными клетками GM-CSF+Th2 и индуцированными или воспалительными CD14 + CD16 + моноцитами/макрофагами, которые играют важную роль в легочной иммунопатологии и системной воспалительной реакции у пациентов с COVID -19.
К. Хуанг и соавт. изучали цитокины и хемокины у пациентов с COVID-19 и показали, что более высокие концентрации IL-2, IL-7, IL-10, G-CSF (гранулоцитарный колониестимулирующий фактор), IP10 (INF-γ-индуцируемый белок 10), В плазме больных с тяжелой степенью инфекции были зарегистрированы MCP1 (моноцитарный хемоаттрактантный белок 1), MIP1A (макрофагальный воспалительный белок 1 альфа) и TNF-α [50].Чжоу Ю. и соавт. [41] проанализировали иммунные параметры пациентов с COVID-19, особенно пациентов с тяжелой инфекцией и неблагоприятным исходом, и показали, что у них также были повышенные концентрации в сыворотке цитокинов, связанных с воспалением, включая IL-2, IL-7, IL-10, G –CSF, IP10, MCP1, MIP1A и TNF-α. Некоторые авторы упоминали о гиперпродукции других медиаторов воспаления, таких как ИЛ-12, ИЛ-13, ИЛ-17, ИФН-γ, МСР1, фактора роста гепатоцитов (HGF), TNF-α и фактора роста эндотелия сосудов (VEGF). ) [51].Чрезмерно активированный иммунный ответ может быть вызван патогенными клетками GM-CSF+Th2 и индуцированными или воспалительными CD14 + CD16 + моноцитами/макрофагами, которые играют важную роль в легочной иммунопатологии и системной воспалительной реакции у пациентов с COVID -19. Повышенный уровень провоспалительных биорегуляторов у инфицированных пациентов приводил к активации Th2-пути клеточного иммунного ответа. Однако инфекция COVID-19 также инициировала повышенную секрецию цитокинов Th3, таких как IL-4 и IL-10 [52].Таким образом, эти результаты демонстрируют, что определение уровней циркулирующих цитокинов и, в частности, ИЛ-6 и ГМ-КСФ, может иметь решающее значение для прогноза прогрессирования заболевания у пациентов с COVID-19. Кроме того, медиаторы воспаления являются потенциальными мишенями для противоинфекционной терапии COVID-19.
Повышенный уровень провоспалительных биорегуляторов у инфицированных пациентов приводил к активации Th2-пути клеточного иммунного ответа. Однако инфекция COVID-19 также инициировала повышенную секрецию цитокинов Th3, таких как IL-4 и IL-10 [52].Таким образом, эти результаты демонстрируют, что определение уровней циркулирующих цитокинов и, в частности, ИЛ-6 и ГМ-КСФ, может иметь решающее значение для прогноза прогрессирования заболевания у пациентов с COVID-19. Кроме того, медиаторы воспаления являются потенциальными мишенями для противоинфекционной терапии COVID-19. 1).С одной стороны, привлечение различных клеток врожденного иммунитета к очагу инфекции обеспечивает элиминацию вируса и запускает адаптивные иммунные реакции путем презентации антигена. Однако эти иммуноциты могут оказывать вторичное повреждающее действие, при котором высвобождается большое количество активных медиаторов и активных форм кислорода. Активные медиаторы и активные формы кислорода разрушают не только инфицированные вирусом клетки, но и соседние интактные клетки (рис. 1). Чрезмерная продукция биоактивных молекул может вызывать системную воспалительную реакцию, органную недостаточность и ПОН, а также вызывать иммуносупрессию в результате апоптоз лимфоцитов.Наряду с этим развивающаяся лимфопения, в основном в результате активности Th-клеток, препятствует формированию адаптивного иммунного ответа, а элиминация вируса эффекторами врожденного иммунитета малоэффективна из-за неспецифического механизма их действия. Повышенный уровень ИЛ-6 дополнительно нарушает функции естественных киллеров (НК) [53].
1).С одной стороны, привлечение различных клеток врожденного иммунитета к очагу инфекции обеспечивает элиминацию вируса и запускает адаптивные иммунные реакции путем презентации антигена. Однако эти иммуноциты могут оказывать вторичное повреждающее действие, при котором высвобождается большое количество активных медиаторов и активных форм кислорода. Активные медиаторы и активные формы кислорода разрушают не только инфицированные вирусом клетки, но и соседние интактные клетки (рис. 1). Чрезмерная продукция биоактивных молекул может вызывать системную воспалительную реакцию, органную недостаточность и ПОН, а также вызывать иммуносупрессию в результате апоптоз лимфоцитов.Наряду с этим развивающаяся лимфопения, в основном в результате активности Th-клеток, препятствует формированию адаптивного иммунного ответа, а элиминация вируса эффекторами врожденного иммунитета малоэффективна из-за неспецифического механизма их действия. Повышенный уровень ИЛ-6 дополнительно нарушает функции естественных киллеров (НК) [53]. Симптомы COVID-19 у инфицированных пациентов варьируют от лихорадки, головной боли, утомляемости и др. до ДВС-синдрома, шока и ПОН. Развитие болезни от легкой до тяжелой у пациентов с COVID-19 может быть обусловлено «цитокиновым штормом», который в основном определяется активацией макрофагов.Макрофаги являются ключевыми продуцентами цитокинов, в том числе ИЛ-6 и других медиаторов воспаления, в ответ на вирусные инфекции, вызывающие «цитокиновый шторм» и системные воспалительные реакции [54]. Синдром активации макрофагов (MAS) подробно описан у пациентов с аутоиммунными заболеваниями, такими как ювенильный идиопатический артрит и системная красная волчанка [55]. , клиническая картина аналогична интоксикации, вызванной COVID-19.Одним из основных симптомов MAS является гемофагоцитоз, который представляет собой поглощение клеток крови, включая эритроциты, лейкоциты или тромбоциты в костном мозге, печенью и селезенкой CD163 + макрофаги и/или гистиоциты, экспрессирующие высокоаффинный комплекс рецептор-мусорщик гемоглобин-гаптоглобин [56].
Симптомы COVID-19 у инфицированных пациентов варьируют от лихорадки, головной боли, утомляемости и др. до ДВС-синдрома, шока и ПОН. Развитие болезни от легкой до тяжелой у пациентов с COVID-19 может быть обусловлено «цитокиновым штормом», который в основном определяется активацией макрофагов.Макрофаги являются ключевыми продуцентами цитокинов, в том числе ИЛ-6 и других медиаторов воспаления, в ответ на вирусные инфекции, вызывающие «цитокиновый шторм» и системные воспалительные реакции [54]. Синдром активации макрофагов (MAS) подробно описан у пациентов с аутоиммунными заболеваниями, такими как ювенильный идиопатический артрит и системная красная волчанка [55]. , клиническая картина аналогична интоксикации, вызванной COVID-19.Одним из основных симптомов MAS является гемофагоцитоз, который представляет собой поглощение клеток крови, включая эритроциты, лейкоциты или тромбоциты в костном мозге, печенью и селезенкой CD163 + макрофаги и/или гистиоциты, экспрессирующие высокоаффинный комплекс рецептор-мусорщик гемоглобин-гаптоглобин [56]. Растворимая альфа-цепь рецептора ИЛ-2 (sCD25) и sCD163 в сыворотке крови являются симптомами гемофагоцитоза [57]. Одним из проявлений синдрома активации макрофагов является высокий уровень медиаторов воспаления, таких как IL-6, IL-1β, IL-18 и IFN-γ [58,59].При обследовании пациентов с МАС выявлены воспалительные инфильтраты, состоящие в основном из активированных Т-лимфоцитов и макрофагов или гистиоцитов, поглощающих нормальные гемопоэтические клетки [60]. Гемофагоцитарный лимфогистиоцитоз или МАС у пациентов с аутоиммунными заболеваниями является тяжелым осложнением и характеризуется сепсис-подобной клинической картиной [61]. Исторически золотым стандартом лечения МАС были глюкокортикоиды, иммуноглобулины и циклоспорин. Однако, несмотря на интенсивную терапию, летальность этих больных достигает 20% [62].МАС или гемофагоцитарный синдром развивается в случаях тяжелых вирусных инфекций с лихорадкой. В частности, гемофагоцитоз наблюдался при лихорадке Денге с синдромом ПОН и инфекции, вызванной вирусом Эпштейна-Барр.
Растворимая альфа-цепь рецептора ИЛ-2 (sCD25) и sCD163 в сыворотке крови являются симптомами гемофагоцитоза [57]. Одним из проявлений синдрома активации макрофагов является высокий уровень медиаторов воспаления, таких как IL-6, IL-1β, IL-18 и IFN-γ [58,59].При обследовании пациентов с МАС выявлены воспалительные инфильтраты, состоящие в основном из активированных Т-лимфоцитов и макрофагов или гистиоцитов, поглощающих нормальные гемопоэтические клетки [60]. Гемофагоцитарный лимфогистиоцитоз или МАС у пациентов с аутоиммунными заболеваниями является тяжелым осложнением и характеризуется сепсис-подобной клинической картиной [61]. Исторически золотым стандартом лечения МАС были глюкокортикоиды, иммуноглобулины и циклоспорин. Однако, несмотря на интенсивную терапию, летальность этих больных достигает 20% [62].МАС или гемофагоцитарный синдром развивается в случаях тяжелых вирусных инфекций с лихорадкой. В частности, гемофагоцитоз наблюдался при лихорадке Денге с синдромом ПОН и инфекции, вызванной вирусом Эпштейна-Барр. Проявление МАС при вирусных инфекциях выявляют как системную воспалительную реакцию, возникающую в результате избыточной активации лимфоцитов и макрофагов. Неконтролируемая гиперактивация иммунной системы связана с высокой температурой, цитопенией, коагулопатией и повышением уровня sCD25 и sCD163 в сыворотке крови [63,64].Симптомы гемофагоцитоза гигантскими многоядерными макрофагами регистрировались у больных со слабым иммунитетом, предрасположенных к пневмониям, вызванным различными вирусными инфекциями [65]. Гигантские макрофаги и гиперпластические пневмоциты обнаружены у больных ОРВИ и диффузным альвеолярным поражением легких. Такие гигантские клетки не обнаруживались в биоптатах легкого больных на терминальной стадии и выявлялись только при прогрессировании заболевания более восьми дней [66]. У больных ОРВИ выявлены явления гемофагоцитоза макрофагами в легких и атрофия белой пульпы селезенки.Такие же морфологические изменения наблюдались и у больных гриппом H5N1 с неблагоприятным прогнозом в 1997 г.
Проявление МАС при вирусных инфекциях выявляют как системную воспалительную реакцию, возникающую в результате избыточной активации лимфоцитов и макрофагов. Неконтролируемая гиперактивация иммунной системы связана с высокой температурой, цитопенией, коагулопатией и повышением уровня sCD25 и sCD163 в сыворотке крови [63,64].Симптомы гемофагоцитоза гигантскими многоядерными макрофагами регистрировались у больных со слабым иммунитетом, предрасположенных к пневмониям, вызванным различными вирусными инфекциями [65]. Гигантские макрофаги и гиперпластические пневмоциты обнаружены у больных ОРВИ и диффузным альвеолярным поражением легких. Такие гигантские клетки не обнаруживались в биоптатах легкого больных на терминальной стадии и выявлялись только при прогрессировании заболевания более восьми дней [66]. У больных ОРВИ выявлены явления гемофагоцитоза макрофагами в легких и атрофия белой пульпы селезенки.Такие же морфологические изменения наблюдались и у больных гриппом H5N1 с неблагоприятным прогнозом в 1997 г. Исследователи считали, что гемофагоцитоз вызывается нарушением регуляции цитокинов при гриппозной пневмонии H5N1 [4,67,68]. Аналогичные морфологические изменения в легких были обнаружены китайскими исследователями в образцах биопсии пациентов с COVID-19. Авторы отмечают инфильтрацию легочной ткани макрофагами CD 68 + [69]. Росси Ф. и др. сообщили, что у всех пациентов с COVID-19 и симптомами тяжелой дыхательной недостаточности (SRF) развились чрезмерные воспалительные реакции с признаками иммунной дисрегуляции или MAS после активации макрофагов M1 провоспалительными медиаторами [70].Однако для выяснения роли субпопуляций макрофагов М1 и М2 требуется дополнительная информация. Многие врачи рассматривают интоксикацию, ассоциированную с тяжелым течением COVID-19, как сепсисоподобное состояние, сходное с процессом, ассоциированным с бактериальной пневмонией с летальным исходом [71]. ]. Однако некоторые авторы предполагают, что COVID-19 имеет уникальную картину иммунной дисфункции, которая проявляется в виде лимфопении, более высоких уровней С-реактивного белка и повышенных D-димеров, которые отражают дисбаланс между провоспалительными и противовоспалительными цитокинами и, возможно, , это то, что отличает эту инфекцию от классического сепсиса [72].
Исследователи считали, что гемофагоцитоз вызывается нарушением регуляции цитокинов при гриппозной пневмонии H5N1 [4,67,68]. Аналогичные морфологические изменения в легких были обнаружены китайскими исследователями в образцах биопсии пациентов с COVID-19. Авторы отмечают инфильтрацию легочной ткани макрофагами CD 68 + [69]. Росси Ф. и др. сообщили, что у всех пациентов с COVID-19 и симптомами тяжелой дыхательной недостаточности (SRF) развились чрезмерные воспалительные реакции с признаками иммунной дисрегуляции или MAS после активации макрофагов M1 провоспалительными медиаторами [70].Однако для выяснения роли субпопуляций макрофагов М1 и М2 требуется дополнительная информация. Многие врачи рассматривают интоксикацию, ассоциированную с тяжелым течением COVID-19, как сепсисоподобное состояние, сходное с процессом, ассоциированным с бактериальной пневмонией с летальным исходом [71]. ]. Однако некоторые авторы предполагают, что COVID-19 имеет уникальную картину иммунной дисфункции, которая проявляется в виде лимфопении, более высоких уровней С-реактивного белка и повышенных D-димеров, которые отражают дисбаланс между провоспалительными и противовоспалительными цитокинами и, возможно, , это то, что отличает эту инфекцию от классического сепсиса [72].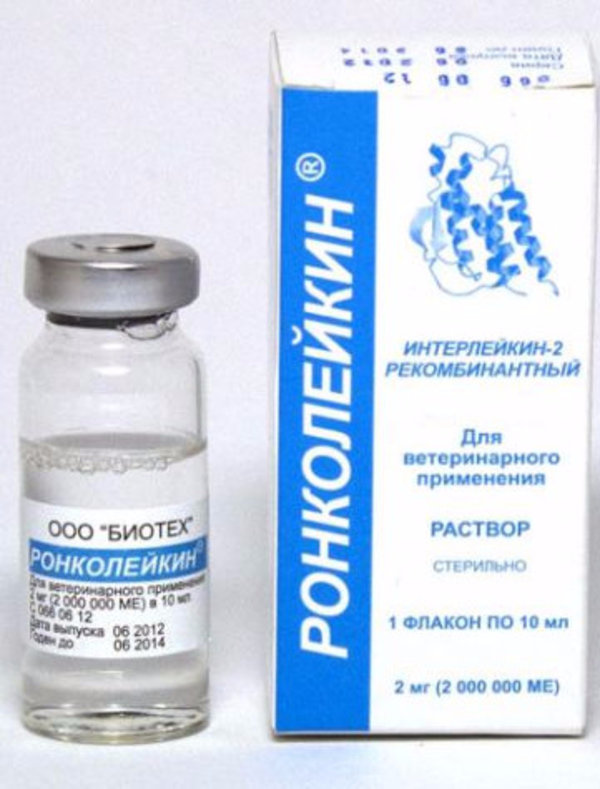 Однако иммунная дисрегуляция при классическом сепсисе у пациентов в критическом состоянии также проявляется в виде СМА и «цитокинового шторма» [73]. Кроме того, сепсис-индуцированный иммунопаралич характеризуется лимфопенией преимущественно за счет CD4 + Т-лимфоцитов [74,75], что позволяет рассматривать тяжелую интоксикацию COVID-19 как сепсисподобный синдром или вирусный сепсис.
Однако иммунная дисрегуляция при классическом сепсисе у пациентов в критическом состоянии также проявляется в виде СМА и «цитокинового шторма» [73]. Кроме того, сепсис-индуцированный иммунопаралич характеризуется лимфопенией преимущественно за счет CD4 + Т-лимфоцитов [74,75], что позволяет рассматривать тяжелую интоксикацию COVID-19 как сепсисподобный синдром или вирусный сепсис. Пациенты с COVID-19 с ОРДС и ПОН имеют повышенный уровень ИЛ-6 и С-реактивного белка, что является характерным признаком этих тяжелых состояний [53]. Нови Г. и соавт. [76] описали случай COVID-19 у пациента с системной склеродермией, связанной с истощением В-клеток, вызванным терапией окрелизумабом. Серьезных осложнений, связанных с состоянием индуцированной иммуносупрессии, у больного не было.Авторы предположили, что истощение В-клеток могло сыграть положительную роль в результате снижения продукции ИЛ-6, обычно высвобождаемого периферическими В-клетками. Имеющиеся данные показывают потенциальное влияние ИЛ-6 и рецептора ИЛ-6 блокирующие антитела для борьбы с «цитокиновым штормом» [77,78]. Таким образом, тоцилизумаб (TCZ), который представляет собой рекомбинантное гуманизированное моноклональное антитело к рецептору IL-6, был рекомендован для лечения пациентов с COVID-19 с риском «цитокинового шторма». TCZ продемонстрировал эффективность при лечении стероидрезистентного синдрома высвобождения цитокинов у онкологических больных, получавших ингибиторы иммунных контрольных точек [79].
Пациенты с COVID-19 с ОРДС и ПОН имеют повышенный уровень ИЛ-6 и С-реактивного белка, что является характерным признаком этих тяжелых состояний [53]. Нови Г. и соавт. [76] описали случай COVID-19 у пациента с системной склеродермией, связанной с истощением В-клеток, вызванным терапией окрелизумабом. Серьезных осложнений, связанных с состоянием индуцированной иммуносупрессии, у больного не было.Авторы предположили, что истощение В-клеток могло сыграть положительную роль в результате снижения продукции ИЛ-6, обычно высвобождаемого периферическими В-клетками. Имеющиеся данные показывают потенциальное влияние ИЛ-6 и рецептора ИЛ-6 блокирующие антитела для борьбы с «цитокиновым штормом» [77,78]. Таким образом, тоцилизумаб (TCZ), который представляет собой рекомбинантное гуманизированное моноклональное антитело к рецептору IL-6, был рекомендован для лечения пациентов с COVID-19 с риском «цитокинового шторма». TCZ продемонстрировал эффективность при лечении стероидрезистентного синдрома высвобождения цитокинов у онкологических больных, получавших ингибиторы иммунных контрольных точек [79]. ИЛ-6 является одним из наиболее значимых цитокинов, участвующих в вызванном COVID-19 «цитокиновом шторме». По этой причине ТЦЗ рекомендуется для тяжелобольных пациентов, инфицированных новой коронавирусной инфекцией с повышенным уровнем ИЛ-6 [80]. Клинические результаты исследований в небольших когортах показали, что ТЦЗ может быть предложен в качестве перспективной терапевтической стратегии для тяжелобольных и критически больных пациентов с COVID-19. Тем не менее, необходимы более контролируемые исследования для оценки надежной клинической эффективности тоцилизумаба у пациентов с инфекцией COVID-19.Кроме того, следует учитывать, что иммунодепрессанты, такие как кортикостероиды или ингибиторы JAK (ингибиторы янус-киназы), применяемые для подавления чрезмерной воспалительной реакции, могут усугублять состояние иммуносупрессивного больного и приводить к угнетению противовирусного и антимикробного иммунитета. 81,82]. Исследования in vitro показали, что иммуносупрессивный ингибитор JAK тофацитиниб ингибирует продукцию IFN-α [83].
ИЛ-6 является одним из наиболее значимых цитокинов, участвующих в вызванном COVID-19 «цитокиновом шторме». По этой причине ТЦЗ рекомендуется для тяжелобольных пациентов, инфицированных новой коронавирусной инфекцией с повышенным уровнем ИЛ-6 [80]. Клинические результаты исследований в небольших когортах показали, что ТЦЗ может быть предложен в качестве перспективной терапевтической стратегии для тяжелобольных и критически больных пациентов с COVID-19. Тем не менее, необходимы более контролируемые исследования для оценки надежной клинической эффективности тоцилизумаба у пациентов с инфекцией COVID-19.Кроме того, следует учитывать, что иммунодепрессанты, такие как кортикостероиды или ингибиторы JAK (ингибиторы янус-киназы), применяемые для подавления чрезмерной воспалительной реакции, могут усугублять состояние иммуносупрессивного больного и приводить к угнетению противовирусного и антимикробного иммунитета. 81,82]. Исследования in vitro показали, что иммуносупрессивный ингибитор JAK тофацитиниб ингибирует продукцию IFN-α [83].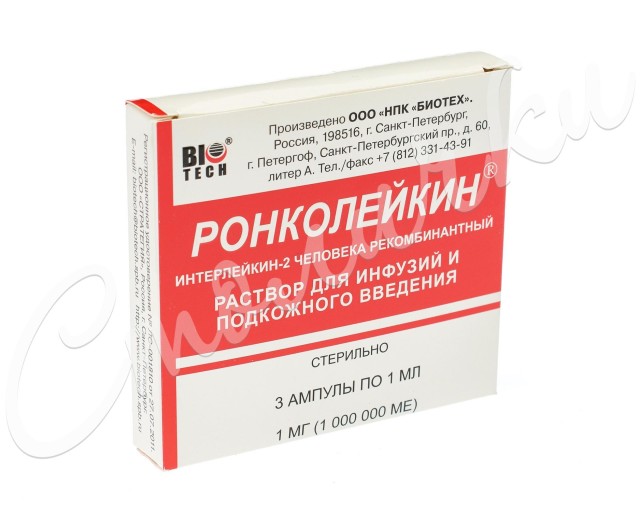 Подавление интерферона или других медиаторов (например,g., IL-6) также может опосредовать развитие вторичной бактериальной инфекции наряду с иммуносупрессией [84]. Поэтому применение иммунодепрессантов у больных с COVID-19 в критическом состоянии для снижения воспалительных реакций должно быть тщательно проработано с учетом возможного угнетения антимикробного иммунитета. синдром ответа [85].Эффективность этого подхода была продемонстрирована у двух пациентов с COVID-19, которым был проведен плазмаферез и ПЗПТ (непрерывная заместительная почечная терапия) с использованием гемофильтра oXiris ® и модифицированной мембраны с обработанной поверхностью AN69, обладающей адсорбционной способностью. Авторы отмечают снижение ИЛ-6 и С-реактивного белка после процедуры и улучшение общего состояния пациентов [86]. В другом исследовании оценивался эффект ПЗПТ, проведенной у пяти пациентов до того, как они были зарегистрированы как положительные на COVID-19.Авторы предположили, что ПЗПТ сыграла важную роль в лечении COVID-19 с хроническим заболеванием почек.
Подавление интерферона или других медиаторов (например,g., IL-6) также может опосредовать развитие вторичной бактериальной инфекции наряду с иммуносупрессией [84]. Поэтому применение иммунодепрессантов у больных с COVID-19 в критическом состоянии для снижения воспалительных реакций должно быть тщательно проработано с учетом возможного угнетения антимикробного иммунитета. синдром ответа [85].Эффективность этого подхода была продемонстрирована у двух пациентов с COVID-19, которым был проведен плазмаферез и ПЗПТ (непрерывная заместительная почечная терапия) с использованием гемофильтра oXiris ® и модифицированной мембраны с обработанной поверхностью AN69, обладающей адсорбционной способностью. Авторы отмечают снижение ИЛ-6 и С-реактивного белка после процедуры и улучшение общего состояния пациентов [86]. В другом исследовании оценивался эффект ПЗПТ, проведенной у пяти пациентов до того, как они были зарегистрированы как положительные на COVID-19.Авторы предположили, что ПЗПТ сыграла важную роль в лечении COVID-19 с хроническим заболеванием почек. При появлении симптомов острого повреждения почек следует как можно раньше использовать потенциальные вмешательства, включая ПЗПТ, для защиты почечной функции [87]. По мнению исследователей, ПЗПТ может оказывать терапевтическое воздействие на интоксикацию COVID-19 за счет удаления потенциально вредных токсинов и стабилизации метаболического и гемодинамического статуса пациента [88]. Экстракорпоральное очищение крови позволяет устранить медиаторы воспаления и контролировать «цитокиновый шторм» на ранней стадии интоксикации.Однако для доказательства эффективности экстракорпоральной очистки крови необходимы рандомизированные исследования. Мезенхимальные стволовые клетки (МСК) могут изменять профиль секреции цитокинов макрофагами, дендритными клетками, наивными и эффекторными Т-клетками (Th типа 1 и 2) и естественными киллерами. клетки (NK), которые индуцируют противовоспалительный или толерантный фенотип. В частности, МСК ингибировали продукцию зрелыми дендритными клетками (ДК) провоспалительных цитокинов, таких как TNF-α и IFN-γ, и повышали секрецию противовоспалительных цитокинов, таких как IL-10 и IL-4.
При появлении симптомов острого повреждения почек следует как можно раньше использовать потенциальные вмешательства, включая ПЗПТ, для защиты почечной функции [87]. По мнению исследователей, ПЗПТ может оказывать терапевтическое воздействие на интоксикацию COVID-19 за счет удаления потенциально вредных токсинов и стабилизации метаболического и гемодинамического статуса пациента [88]. Экстракорпоральное очищение крови позволяет устранить медиаторы воспаления и контролировать «цитокиновый шторм» на ранней стадии интоксикации.Однако для доказательства эффективности экстракорпоральной очистки крови необходимы рандомизированные исследования. Мезенхимальные стволовые клетки (МСК) могут изменять профиль секреции цитокинов макрофагами, дендритными клетками, наивными и эффекторными Т-клетками (Th типа 1 и 2) и естественными киллерами. клетки (NK), которые индуцируют противовоспалительный или толерантный фенотип. В частности, МСК ингибировали продукцию зрелыми дендритными клетками (ДК) провоспалительных цитокинов, таких как TNF-α и IFN-γ, и повышали секрецию противовоспалительных цитокинов, таких как IL-10 и IL-4. МСК также оказывали влияние на усиление супрессорной субпопуляции Treg в периферической крови [89,90]. МСК продемонстрировали многообещающие эффекты в экспериментальной модели ОРДС, которые нейтрализуют альвеолярный коллапс, накопление коллагена и клеточный апоптоз в легочной ткани. Несколько рандомизированных клинических испытаний фазы 1 подтвердили безопасность МСК, полученных из различных источников, в однократной дозе от 1 млн клеток/кг до 10 млн клеток/кг у пациентов с ОРДС невирусного происхождения [91,92,93].МСК рассматриваются как потенциальная терапевтическая стратегия для лечения пациентов с стероидрезистентным MAS-артритом [94]. Клиническая эффективность МСК периферической крови была показана у больных гриппом A (H7N9) с ОРДС. В частности, было показано, что летальность составила 17,6% в группе больных, получавших МСК, против 54,5% в контрольной группе. Авторы считают, что эти данные продемонстрировали потенциал терапии пациентов с COVID-19 на основе МСК, поскольку осложнения, вызываемые этими вирусами, имеют общие механизмы [95].
МСК также оказывали влияние на усиление супрессорной субпопуляции Treg в периферической крови [89,90]. МСК продемонстрировали многообещающие эффекты в экспериментальной модели ОРДС, которые нейтрализуют альвеолярный коллапс, накопление коллагена и клеточный апоптоз в легочной ткани. Несколько рандомизированных клинических испытаний фазы 1 подтвердили безопасность МСК, полученных из различных источников, в однократной дозе от 1 млн клеток/кг до 10 млн клеток/кг у пациентов с ОРДС невирусного происхождения [91,92,93].МСК рассматриваются как потенциальная терапевтическая стратегия для лечения пациентов с стероидрезистентным MAS-артритом [94]. Клиническая эффективность МСК периферической крови была показана у больных гриппом A (H7N9) с ОРДС. В частности, было показано, что летальность составила 17,6% в группе больных, получавших МСК, против 54,5% в контрольной группе. Авторы считают, что эти данные продемонстрировали потенциал терапии пациентов с COVID-19 на основе МСК, поскольку осложнения, вызываемые этими вирусами, имеют общие механизмы [95]. Другие авторы недавно опубликовали результаты пилотного исследования семи пациентов с пневмонией, связанной с COVID-19, где они показали, что клинические симптомы у всех пациентов значительно улучшились через два дня после трансплантации МСК. Выявлено увеличение количества лимфоцитов в периферической крови и исчезновение активированных субпопуляций CXCR3 + CD4 + Т-клеток, CXCR3 + CD8 + Т-клеток и CXCR3 + NK-клеток, которые секретируют цитокины.CD14 + CD11c + CD11b mid регуляторные популяции ДК также увеличились. Уровни TNF-α значительно снижались, а уровни IL-10 повышались у пациентов, получавших МСК, по сравнению с пациентами, получавшими стандартную терапию. Таким образом, авторы пришли к выводу, что МСК будут безопасны и эффективны для лечения пациентов с пневмонией, вызванной COVID-19, особенно для пациентов с острыми явлениями [96].
Другие авторы недавно опубликовали результаты пилотного исследования семи пациентов с пневмонией, связанной с COVID-19, где они показали, что клинические симптомы у всех пациентов значительно улучшились через два дня после трансплантации МСК. Выявлено увеличение количества лимфоцитов в периферической крови и исчезновение активированных субпопуляций CXCR3 + CD4 + Т-клеток, CXCR3 + CD8 + Т-клеток и CXCR3 + NK-клеток, которые секретируют цитокины.CD14 + CD11c + CD11b mid регуляторные популяции ДК также увеличились. Уровни TNF-α значительно снижались, а уровни IL-10 повышались у пациентов, получавших МСК, по сравнению с пациентами, получавшими стандартную терапию. Таким образом, авторы пришли к выводу, что МСК будут безопасны и эффективны для лечения пациентов с пневмонией, вызванной COVID-19, особенно для пациентов с острыми явлениями [96].
 . Однако дополнительным последствием «цитокинового шторма» является развитие иммуносупрессии, проявляющейся прогрессирующей лимфопенией.Поэтому иммунокоррекцию необходимо проводить на определенном этапе развития заболевания для предотвращения иммунопаралича и присоединения вторичных инфекций. Некоторые опасения связаны с предположением, что иммунотерапия у этих пациентов с чрезмерно воспалительной фазой заболевания может способствовать усилению воспалительной реакции и обострению заболевания. Однако сепсисоподобный характер осложнений, вызванных COVID-19, позволяет предположить, что цитокиновая терапия будет способствовать нормализации иммунного статуса и уменьшению числа вторичных инфекций, что сходно с иммунодепрессивными состояниями, развивающимися на фоне системного воспалительного ответа. синдром при серьезной травме и сепсисе [100,101].Аналогичные результаты были получены при лечении ИЛ-7 ВИЧ-инфицированных пациентов с генерализованной инфекцией [102]. ИЛ-15 также обладает потенциальным эффектом иммунной коррекции.
. Однако дополнительным последствием «цитокинового шторма» является развитие иммуносупрессии, проявляющейся прогрессирующей лимфопенией.Поэтому иммунокоррекцию необходимо проводить на определенном этапе развития заболевания для предотвращения иммунопаралича и присоединения вторичных инфекций. Некоторые опасения связаны с предположением, что иммунотерапия у этих пациентов с чрезмерно воспалительной фазой заболевания может способствовать усилению воспалительной реакции и обострению заболевания. Однако сепсисоподобный характер осложнений, вызванных COVID-19, позволяет предположить, что цитокиновая терапия будет способствовать нормализации иммунного статуса и уменьшению числа вторичных инфекций, что сходно с иммунодепрессивными состояниями, развивающимися на фоне системного воспалительного ответа. синдром при серьезной травме и сепсисе [100,101].Аналогичные результаты были получены при лечении ИЛ-7 ВИЧ-инфицированных пациентов с генерализованной инфекцией [102]. ИЛ-15 также обладает потенциальным эффектом иммунной коррекции. Однако модельные эксперименты выявили цитокиновую гепатотоксичность [103], а данные клинических исследований показали активацию NK-клеток и Т-киллеров, а также лихорадку, гипотензию и печеночную недостаточность, что ограничивает перспективы клинического применения ИЛ-15. [104,105]. Принимая во внимание патогенез индуцированной чрезмерной воспалительной иммуносупрессивной реакции у больных SARS-CoV-2, представляется целесообразным включение в комплексную терапию регуляторного цитокина IL-2, который является цитокином, стимулирующим пролиферацию и активацию лимфоцитов. .Важно отметить, что регуляция клеточного и гуморального иммунитета во многом связана с продукцией ИЛ-2. Эти теоретические предположения подтверждаются результатами клинических исследований рекомбинантного ИЛ-2 у больных с иммуносупрессивным статусом, ассоциированным с синдромом системной воспалительной реакции, вызванным сепсисом или тяжелой травмой. Показаниями к иммунокоррекционной терапии могут быть прогрессирующая лимфопения (ниже 900 клеток/мкл) и снижение CD4 + Th клеток [105].
Однако модельные эксперименты выявили цитокиновую гепатотоксичность [103], а данные клинических исследований показали активацию NK-клеток и Т-киллеров, а также лихорадку, гипотензию и печеночную недостаточность, что ограничивает перспективы клинического применения ИЛ-15. [104,105]. Принимая во внимание патогенез индуцированной чрезмерной воспалительной иммуносупрессивной реакции у больных SARS-CoV-2, представляется целесообразным включение в комплексную терапию регуляторного цитокина IL-2, который является цитокином, стимулирующим пролиферацию и активацию лимфоцитов. .Важно отметить, что регуляция клеточного и гуморального иммунитета во многом связана с продукцией ИЛ-2. Эти теоретические предположения подтверждаются результатами клинических исследований рекомбинантного ИЛ-2 у больных с иммуносупрессивным статусом, ассоциированным с синдромом системной воспалительной реакции, вызванным сепсисом или тяжелой травмой. Показаниями к иммунокоррекционной терапии могут быть прогрессирующая лимфопения (ниже 900 клеток/мкл) и снижение CD4 + Th клеток [105].
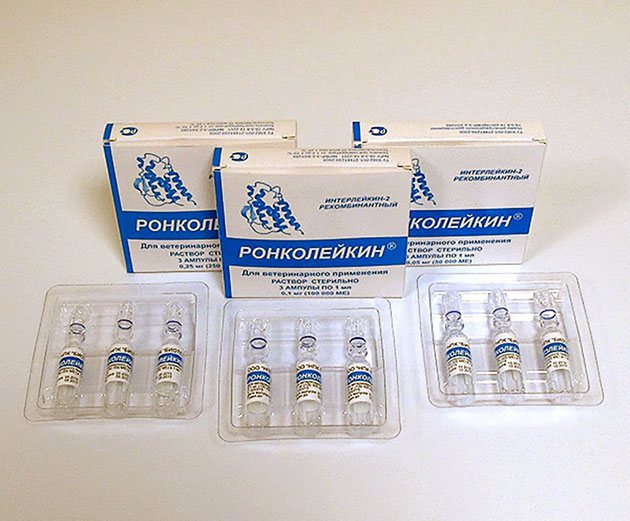 Они экспрессируются NK-клетками и γδT-клетками, а также антигенпрезентирующими клетками, такими как макрофаги и ДК. Взаимодействие вирусной РНК и TLR запускает сигнальные пути, повышающие продукцию цитокинов, участвующих в Th2-поляризации CD4 + Th-клеток и индукции адаптивного иммунного ответа [107].Экспериментальные исследования на китайских макаках показали, что SARS-CoV-2 проникает в слизистую дыхательных путей и приводит к локальной инфильтрации сначала лимфоцитами, а затем макрофагами CD163 + . Последние мигрируют в лимфоидные органы в течение трех суток, транспортируя не только фрагменты разрушенных инфицированных клеток для презентации антигена, но и вирусные частицы в своих везикулах. Таким образом, макрофаги выполняют свою антигенпрезентирующую функцию, дифференцируясь в ДК, и одновременно способствуют диссеминации вируса и развитию продуктивной инфекции в лимфоидной ткани и системному распространению инфекции [108].Чрезмерная активация клеток врожденного иммунитета и макрофагов приводит к гиперпродукции цитокинов и высвобождению реактивных молекул, которые поражают не только инфицированные вирусом, но и интактные клетки.
Они экспрессируются NK-клетками и γδT-клетками, а также антигенпрезентирующими клетками, такими как макрофаги и ДК. Взаимодействие вирусной РНК и TLR запускает сигнальные пути, повышающие продукцию цитокинов, участвующих в Th2-поляризации CD4 + Th-клеток и индукции адаптивного иммунного ответа [107].Экспериментальные исследования на китайских макаках показали, что SARS-CoV-2 проникает в слизистую дыхательных путей и приводит к локальной инфильтрации сначала лимфоцитами, а затем макрофагами CD163 + . Последние мигрируют в лимфоидные органы в течение трех суток, транспортируя не только фрагменты разрушенных инфицированных клеток для презентации антигена, но и вирусные частицы в своих везикулах. Таким образом, макрофаги выполняют свою антигенпрезентирующую функцию, дифференцируясь в ДК, и одновременно способствуют диссеминации вируса и развитию продуктивной инфекции в лимфоидной ткани и системному распространению инфекции [108].Чрезмерная активация клеток врожденного иммунитета и макрофагов приводит к гиперпродукции цитокинов и высвобождению реактивных молекул, которые поражают не только инфицированные вирусом, но и интактные клетки.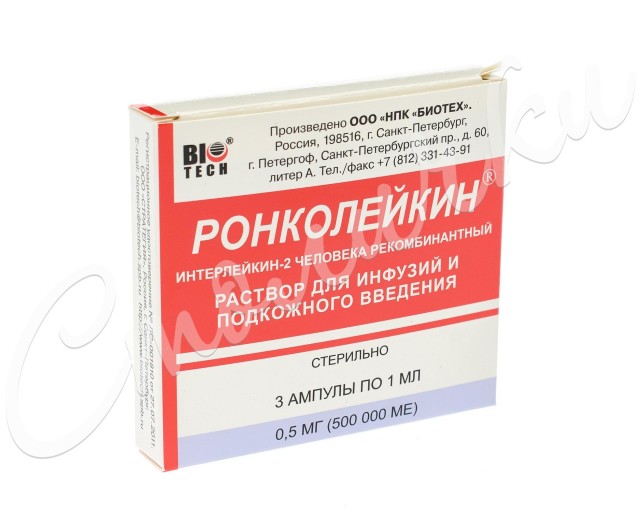 MAS — это обычная реакция при тяжелых коронавирусных инфекциях, таких как SARS, MERS и COVID-19, которая проявляется в виде «цитокинового шторма» и симптомов, подобных сепсису. МАС характерен для гемофагоцитоза и повышения уровня ИЛ-6 и рецепторов ИЛ-2, что описано при вышеперечисленных вирусных инфекциях.Поскольку макрофаги играют важную роль в индукции чрезмерной воспалительной реакции, мы можем предположить, что аналогичным образом, после интоксикации COVID-19, ассоциированная с кишечником лимфоидная ткань (GALT), которая содержит самые большие пулы макрофагов и Т-клеток , вносит значительный вклад в развитие «цитокинового шторма». Активация мононуклеарных клеток GALT при вирусных инфекциях связана с повышением уровня LPS (липополисахаридов), что также известно как микробная транслокация. Попадание ЛПС в систему кровообращения усиливает воспалительный каскад, что замыкает порочный круг синдрома системной воспалительной реакции [109,110].Преувеличенный иммунный ответ может привести к генерализованной сосудистой проницаемости.
MAS — это обычная реакция при тяжелых коронавирусных инфекциях, таких как SARS, MERS и COVID-19, которая проявляется в виде «цитокинового шторма» и симптомов, подобных сепсису. МАС характерен для гемофагоцитоза и повышения уровня ИЛ-6 и рецепторов ИЛ-2, что описано при вышеперечисленных вирусных инфекциях.Поскольку макрофаги играют важную роль в индукции чрезмерной воспалительной реакции, мы можем предположить, что аналогичным образом, после интоксикации COVID-19, ассоциированная с кишечником лимфоидная ткань (GALT), которая содержит самые большие пулы макрофагов и Т-клеток , вносит значительный вклад в развитие «цитокинового шторма». Активация мононуклеарных клеток GALT при вирусных инфекциях связана с повышением уровня LPS (липополисахаридов), что также известно как микробная транслокация. Попадание ЛПС в систему кровообращения усиливает воспалительный каскад, что замыкает порочный круг синдрома системной воспалительной реакции [109,110].Преувеличенный иммунный ответ может привести к генерализованной сосудистой проницаемости. Повышенная проницаемость сосудистых стенок приводит к утечке плазмы и, наряду с гиперкоагуляцией крови, может индуцировать ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания/тромбоэмболическая болезнь). Особое внимание следует уделять группам риска, таким как пожилые люди. больных и онкологических больных с первично выраженными симптомами дисфункции иммунной системы. Таким образом, старение связано с нарушением иммунной регуляции, которое проявляется как провоспалительное состояние, характеризующееся высоким уровнем циркулирующих провоспалительных маркеров, таких как ИЛ-1, белок-антагонист рецептора ИЛ-1, ИЛ-6, IL-8, IL-13, IL-18, С-реактивный белок, IFN-α, IFN-β, TGF-β, TNF, его растворимые рецепторы (члены надсемейства рецепторов TNF 1A и 1B) и амилоид A [ 111].Это состояние, называемое «воспалением», может стать стойким и длительным, создавая хроническую воспалительную реакцию [112]. При таком иммунном статусе «цитокиновый шторм», вызванный COVID-19, может привести к фатальным последствиям.
Повышенная проницаемость сосудистых стенок приводит к утечке плазмы и, наряду с гиперкоагуляцией крови, может индуцировать ДВС-синдром (синдром диссеминированного внутрисосудистого свертывания/тромбоэмболическая болезнь). Особое внимание следует уделять группам риска, таким как пожилые люди. больных и онкологических больных с первично выраженными симптомами дисфункции иммунной системы. Таким образом, старение связано с нарушением иммунной регуляции, которое проявляется как провоспалительное состояние, характеризующееся высоким уровнем циркулирующих провоспалительных маркеров, таких как ИЛ-1, белок-антагонист рецептора ИЛ-1, ИЛ-6, IL-8, IL-13, IL-18, С-реактивный белок, IFN-α, IFN-β, TGF-β, TNF, его растворимые рецепторы (члены надсемейства рецепторов TNF 1A и 1B) и амилоид A [ 111].Это состояние, называемое «воспалением», может стать стойким и длительным, создавая хроническую воспалительную реакцию [112]. При таком иммунном статусе «цитокиновый шторм», вызванный COVID-19, может привести к фатальным последствиям. Онкологические больные, в частности в послеоперационном периоде и получающие химио-/лучевую терапию, имеют высокий риск заражения COVID-19. Противоопухолевая иммунотерапия ингибиторами иммунных контрольных точек (ICI) или CAR-T-клетками (химерный антигенный рецептор, CAR), ассоциированная с синдромом высвобождения цитокинов, повышает вероятность гипертрофированного системного воспалительного ответа на интоксикацию COVID-19.Таким образом, существует задача минимизировать риск заражения COVID-19 при достижении желаемой эффективности лечения рака. Следует тщательно проанализировать несколько аспектов, включая риск рецидива или прогрессирования заболевания, предполагаемые конечные точки терапии, сопутствующие заболевания, включая других пациентов, а также влияние передачи коронавируса в местном сообществе [113]. Чтобы выполнить эти требования, можно рассмотреть некоторые предложения, такие как изменение режимов терапии и ограничение посещений пациентов в больнице.В частности, некоторые авторы рекомендуют менее интенсивные схемы лечения, чтобы заменить пембролизумаб в дозе 200 мг три недели на 400 мг шесть недель [114].
Онкологические больные, в частности в послеоперационном периоде и получающие химио-/лучевую терапию, имеют высокий риск заражения COVID-19. Противоопухолевая иммунотерапия ингибиторами иммунных контрольных точек (ICI) или CAR-T-клетками (химерный антигенный рецептор, CAR), ассоциированная с синдромом высвобождения цитокинов, повышает вероятность гипертрофированного системного воспалительного ответа на интоксикацию COVID-19.Таким образом, существует задача минимизировать риск заражения COVID-19 при достижении желаемой эффективности лечения рака. Следует тщательно проанализировать несколько аспектов, включая риск рецидива или прогрессирования заболевания, предполагаемые конечные точки терапии, сопутствующие заболевания, включая других пациентов, а также влияние передачи коронавируса в местном сообществе [113]. Чтобы выполнить эти требования, можно рассмотреть некоторые предложения, такие как изменение режимов терапии и ограничение посещений пациентов в больнице.В частности, некоторые авторы рекомендуют менее интенсивные схемы лечения, чтобы заменить пембролизумаб в дозе 200 мг три недели на 400 мг шесть недель [114]. Основные стратегии терапии COVID-19 направлены на подавление гипервоспалительной реакции. Для достижения эффекта в некоторых исследованиях использовались стероиды, хотя они не дали желаемого результата. Другие включали ингибиторы рецептора IL-6 с определенным клиническим эффектом у небольших групп пациентов. Несмотря на то, что ИЛ-6 является важным фактором для индукции синдрома системной воспалительной реакции, он не единственный, а представляет собой каскад медиаторов воспаления.Поэтому можно рекомендовать некоторые методы элиминации цитокинов и биоактивных молекул непептидной природы, такие как методы экстракорпоральной очистки крови, доказавшие свою эффективность при лечении сепсиса, в том числе современные селективные и неселективные сорбенты. Рациональность такого подхода подтверждается данными о клинической эффективности плазмофереза и непрерывной заместительной почечной терапии (ПЗПТ) гемофильтрами высокой сорбционной емкости. Перспективным подходом для борьбы с «цитокиновым штормом» могут стать аллогенные мезенхимальные стволовые клетки костного мозга или пуповинной крови, обладающие иммунодепрессивной активностью.
Основные стратегии терапии COVID-19 направлены на подавление гипервоспалительной реакции. Для достижения эффекта в некоторых исследованиях использовались стероиды, хотя они не дали желаемого результата. Другие включали ингибиторы рецептора IL-6 с определенным клиническим эффектом у небольших групп пациентов. Несмотря на то, что ИЛ-6 является важным фактором для индукции синдрома системной воспалительной реакции, он не единственный, а представляет собой каскад медиаторов воспаления.Поэтому можно рекомендовать некоторые методы элиминации цитокинов и биоактивных молекул непептидной природы, такие как методы экстракорпоральной очистки крови, доказавшие свою эффективность при лечении сепсиса, в том числе современные селективные и неселективные сорбенты. Рациональность такого подхода подтверждается данными о клинической эффективности плазмофереза и непрерывной заместительной почечной терапии (ПЗПТ) гемофильтрами высокой сорбционной емкости. Перспективным подходом для борьбы с «цитокиновым штормом» могут стать аллогенные мезенхимальные стволовые клетки костного мозга или пуповинной крови, обладающие иммунодепрессивной активностью. Однако иммунодепрессанты могут усугублять иммуносупрессию, вызванную COVID-19, что оказывает угнетающее действие на антимикробный иммунитет. иммуносупрессивные состояния, включая иммунопаралич, которые приводят к вторичной инфекции. Иммуносупрессия развивается в результате апоптоза лимфоцитов и лимфофагоцитоза активированными макрофагами.Это проявляется как прогрессирующая лимфопения, в основном из-за снижения числа Th-клеток (рис. 1). Th-клетки продуцируют ряд регуляторных цитокинов, включая IL-2, и играют важную роль в связывании адаптивного Т- и В-клеточного иммунитета. Таким образом, заместительная цитокиновая терапия с ИЛ-2, стимулирующим пролиферативную активность лимфоцитов, представляется особенно целесообразной у пациентов с COVID-19 при переходе от гипервоспалительной к гиповоспалительной фазе. Показанием к иммунокоррекции в этих случаях является прогрессирующее снижение относительного и абсолютного количества циркулирующих лимфоцитов (ниже 20% и 800 клеток/мкл соответственно).
Однако иммунодепрессанты могут усугублять иммуносупрессию, вызванную COVID-19, что оказывает угнетающее действие на антимикробный иммунитет. иммуносупрессивные состояния, включая иммунопаралич, которые приводят к вторичной инфекции. Иммуносупрессия развивается в результате апоптоза лимфоцитов и лимфофагоцитоза активированными макрофагами.Это проявляется как прогрессирующая лимфопения, в основном из-за снижения числа Th-клеток (рис. 1). Th-клетки продуцируют ряд регуляторных цитокинов, включая IL-2, и играют важную роль в связывании адаптивного Т- и В-клеточного иммунитета. Таким образом, заместительная цитокиновая терапия с ИЛ-2, стимулирующим пролиферативную активность лимфоцитов, представляется особенно целесообразной у пациентов с COVID-19 при переходе от гипервоспалительной к гиповоспалительной фазе. Показанием к иммунокоррекции в этих случаях является прогрессирующее снижение относительного и абсолютного количества циркулирующих лимфоцитов (ниже 20% и 800 клеток/мкл соответственно). Для такой иммунокоррекции следует использовать низкодозную цитокиновую терапию (0,5–1,0 МЕ на дозу ИЛ-2), обладающую иммуностимулирующим действием, как это было показано в более ранних исследованиях по профилактике глубокой иммуносупрессии при лечении сепсиса и тяжелых травма.
Для такой иммунокоррекции следует использовать низкодозную цитокиновую терапию (0,5–1,0 МЕ на дозу ИЛ-2), обладающую иммуностимулирующим действием, как это было показано в более ранних исследованиях по профилактике глубокой иммуносупрессии при лечении сепсиса и тяжелых травма. Научно-исследовательская работа проводилась в период 1992-2013 гг. в опытно-базовом хозяйстве «Сералы» Ордабасинского района и внедрена в хозяйствах «Ортай», «Рау», «Сабыр», «Медеу-ата», «Акбастау», « Канат», «Сайрам-Астык», и общества с ограниченной ответственностью «Бек», «Парпата» Южно-Казахстанской области. Объект исследования - казахские курдючные грубошерстные матки и бараны-производители эдильбайской (отечественной) и гиссарской (зарубежной) пород овец, помесей различных поколений, полученных методом трехпородного скрещивания, и новой ордабасинской породы, а также баранина и баранина.Цель исследований - создать новую породу, сочетающую в себе высокую живую массу, скороспелость и адаптивные способности исходных пород, характеризующуюся экономической эффективностью при производстве высококачественной экологически чистой баранины, баранины и обеспечивающей сельхозпроизводителей генетически ценными перспективный племенной материал для устойчивого развития овцеводства Казахстана. Результаты исследования.
Научно-исследовательская работа проводилась в период 1992-2013 гг. в опытно-базовом хозяйстве «Сералы» Ордабасинского района и внедрена в хозяйствах «Ортай», «Рау», «Сабыр», «Медеу-ата», «Акбастау», « Канат», «Сайрам-Астык», и общества с ограниченной ответственностью «Бек», «Парпата» Южно-Казахстанской области. Объект исследования - казахские курдючные грубошерстные матки и бараны-производители эдильбайской (отечественной) и гиссарской (зарубежной) пород овец, помесей различных поколений, полученных методом трехпородного скрещивания, и новой ордабасинской породы, а также баранина и баранина.Цель исследований - создать новую породу, сочетающую в себе высокую живую массу, скороспелость и адаптивные способности исходных пород, характеризующуюся экономической эффективностью при производстве высококачественной экологически чистой баранины, баранины и обеспечивающей сельхозпроизводителей генетически ценными перспективный племенной материал для устойчивого развития овцеводства Казахстана. Результаты исследования. Разработана принципиально новая технология выведения новой ордабасинской породы овец методом трехпородного воспроизводственного скрещивания лучших генотипов отечественных и зарубежных пород мясо-сальных овец, созданных народной селекцией в Казахстане и Средней Азии.Суть технологии выведения новой ордабасинской породы овец заключается в управлении наследственностью и изменчивостью хозяйственно-полезных признаков в новых поколениях при оптимальных генетических сочетаниях.
Разработана принципиально новая технология выведения новой ордабасинской породы овец методом трехпородного воспроизводственного скрещивания лучших генотипов отечественных и зарубежных пород мясо-сальных овец, созданных народной селекцией в Казахстане и Средней Азии.Суть технологии выведения новой ордабасинской породы овец заключается в управлении наследственностью и изменчивостью хозяйственно-полезных признаков в новых поколениях при оптимальных генетических сочетаниях.  На данном этапе эксперимента помесей первого поколения в количестве 3178 голов скрещивали с гиссарскими овцами и отбирали модельных животных нужного типа.Третий технологический процесс (1996-2003 гг.) - разведение помесей нужного типа «в себе». На этом этапе научной работы разрабатывались методы стабилизации популяции в заданном направлении и в больших масштабах разводились высокопродуктивные линейные животные с целью закрепления хозяйственно-полезных признаков выделенного типа животных.
На данном этапе эксперимента помесей первого поколения в количестве 3178 голов скрещивали с гиссарскими овцами и отбирали модельных животных нужного типа.Третий технологический процесс (1996-2003 гг.) - разведение помесей нужного типа «в себе». На этом этапе научной работы разрабатывались методы стабилизации популяции в заданном направлении и в больших масштабах разводились высокопродуктивные линейные животные с целью закрепления хозяйственно-полезных признаков выделенного типа животных.  высококачественная органическая баранина и баранина на круглогодичном пастбищном содержании. Производство ягнятины от баранов новой ордабасинской породы оказалось более рентабельным в производстве конкурентоспособной «молочной» баранины на внутреннем и внешнем рынках, чем другие породы, что свидетельствует об эффективности селекции этой уникальной породы для интенсификации производства. из высококачественной баранины.В сельскохозяйственное производство в больших масштабах внедрена новая ордабасинская порода овец, ее поголовье составляет более 75 тысяч голов, в том числе чистопородных более 36 тысяч голов. Племенные животные новой породы реализованы в 125 субъектов различных форм собственности, в количестве 12388 голов и успешно разводятся в различных регионах Казахстана. Рекомендуемые зоны разведения ордабасинской породы овец – полупустынная, пустынная, степная, сухостепная, предгорная и горная.
высококачественная органическая баранина и баранина на круглогодичном пастбищном содержании. Производство ягнятины от баранов новой ордабасинской породы оказалось более рентабельным в производстве конкурентоспособной «молочной» баранины на внутреннем и внешнем рынках, чем другие породы, что свидетельствует об эффективности селекции этой уникальной породы для интенсификации производства. из высококачественной баранины.В сельскохозяйственное производство в больших масштабах внедрена новая ордабасинская порода овец, ее поголовье составляет более 75 тысяч голов, в том числе чистопородных более 36 тысяч голов. Племенные животные новой породы реализованы в 125 субъектов различных форм собственности, в количестве 12388 голов и успешно разводятся в различных регионах Казахстана. Рекомендуемые зоны разведения ордабасинской породы овец – полупустынная, пустынная, степная, сухостепная, предгорная и горная. 