Ветстанция: вакцина от бешенства защищает человека на 100% в течение года
Вакцина от бешенства, введенная человеку после укуса зараженным животным, на 100% защищает от заболевания и действует в течение года. Об этом в пятницу корреспонденту «Нового Калининграда.Ru» рассказал заведующий отделом противоэпизоотических мероприятий областной ветеринарной станции Сергей Фомичев.
«Ситуация с бешенством всегда серьезная, потому что на сегодняшний день это одно из наиболее опасных заболеваний. Если у зараженного человека или животного появились клинические признаки (как правило, они появляются на 7-10 день после заражения, - прим. «Нового Калининграда.Ru»), то смерть наступает практически в 100% случаев, - отмечает собеседник. – Чтобы это предотвратить, нужно как можно быстрее после укуса обратиться к хирургу и пройти курс лечения. Вакцинация помогает на 100%».
В настоящее время укушенному бешеным животным человеку делается 3-6 уколов в руку. Животному в течение 48 часов после заражения также вводят вакцину.
Как отметил Фомичев, бешенство у человека проявляется примерно также, как и у животного. Повышается температура, поражается центральная нервная система, развивается светобоязнь, появляется обильное слюнотечение. «Самое страшное, что человек умирает от бешенства в агонии, находясь при этом в полном сознании», - заявил завотделом ветстанции.
Самое действенное, что может сделать человек для профилактики бешенства – это привить свое домашнее животное. Прививки кошке или собаке делаются раз в год или раз в два года в зависимости от предыдущей вакцинации.
«Бешенство – это природно-очаговое инфекционное заболевание. Основными источниками и переносчиками инфекции являются дикие лисы, енотовидные собаки, грызуны. Уже 3 года действует совместная с Евросоюзом программа по искоренению бешенства. В лесах разбрасывается вакцина в виде брикетиков из кормовых добавок, внутри которых капсулы с вакциной», - отметил Сергей Фомичев.
Напомним, что в центре Калининграда был объявлен карантин по бешенству. Это связано с подтверждением у кошки, доставленной из торгового центра, диагноза «бешенство». До снятия карантина запрещается перемещение и продажа восприимчивых к бешенству животных на территории карантинной зоны и за её пределы, а также проведение выставок кошек и собак в карантинной зоне.
В целом, за прошедшую неделю в Калининградской области было выявлено 5 случаев бешенства у домашних животных. Как отметил Сергей Фомичев, в этом году нет никакой «сверхъестественной вспышки заболеваемости домашних животных». «Ежегодно в регионе регистрируется 25-30 подобных случаев», - заключил собеседник.
Нашли ошибку? Cообщить об ошибке можно, выделив ее и нажав
Ctrl+Enter
Поговорим о прививках: зачем нужно вакцинировать питомцев?
Поговорим о прививках: зачем нужно вакцинировать питомцев?Б
- Балашиха
- Быково
Ж
- Железнодорожный
- Жуковский
К
- Королёв
- Красково
- Красногорск
- Курск
Л
- Лобня
- Лыткарино
- Люберцы
М
- Москва
- Московский
Р
- Раменское
- Реутов
- Ростов-на-Дону
С
- Санкт-Петербург
Единственная защита от бешенства — вакцинация!
Бешенство одно из немногих непобежденных заболеваний, сохранившихся от глубокой древности до наших дней, которым болеют не только домашние животные, но и человек.
Бешенство (гидрофобия, Rabies) – это особо опасное общее для человека и животных заболевание вирусной природы, возникающее в результате укуса зараженным животным, характеризующееся тяжелыми поражениями нервной системы и приводящее к летальному исходу.
Вирус бешенства устойчив к низким температурам, но неустойчив к высоким. Чувствителен к ультрафиолетовым и прямым солнечным лучам, а также ко многим дезинфицирующим средствам.
В природе болеют, прежде всего, дикие животные (лисицы, волки и т.д.). Домашние животные (собаки, кошки, хорьки) заражаются от укуса дикого животного или попадания слюны заражённого животного на поврежденный участок кожи.
Вирус некоторое время находится в месте внедрения, затем проникает в спинной и головной мозг. Симптомы начинают проявляться только после распространения вируса по всему организму. Распространение в ЦНС и лимфатических узлах дает возможность ему проникать в слюнные железы, отсюда вирус бешенства может активно выделяться во внешнюю среду и таким образом распространяться, перемещаясь между организмами. Вирус бешенства в большом количестве содержится в слюне больного животного, в то время как кровь, моча и фекалии практически незаразны, также заражение бешенством невозможно при употреблении в пищу мяса больного животного. После укуса заболевшим животным возбудитель бешенства переходит к другому носителю вируса. Так и происходит заражение других особей животных или людей.
Проявлению клинической картины предшествует скрытый (инкубационный) период. Животное в это время также опасно. Чаще всего инкубационный период длится 10 — 14 дней, а у человека может протекать до года.
Ветеринарными врачами выделяются три формы проявления бешенства – буйная, тихая и атипичная.
Буйная форма протекает в несколько стадий:
1. На первой стадии животное избегает людей, прячется в темном месте или наоборот очень дружелюбное. При этом возможно проявление зуда на месте укуса.
2. На второй стадии появляется агрессия. Продолжается такая стадия до 3 суток. Нарастает беспокойство, хриплый лай, склонность к поеданию инородных предметов, нападение на других животных и даже на хозяина. Животное не может глотать воду.
3. На третьей стадии появляются судороги, и прогрессирует паралич. Животное почти постоянно лежит и в итоге погибает в коматозном состоянии.
Тихая форма характеризуется развитием паралича, слюнотечением, неспособностью принимать пищу. Через 2 – 4 дня животное гибнет.
Атипичная форма (сложная в диагностике) – может длиться до 3-х месяцев или даже больше. Вначале может проявляться диареей или наоборот атонией кишечника, депрессией, после чего могут наступать временные улучшения. В последнее время такая форма болезни стала проявляться сравнительно часто.
В последнее время такая форма болезни стала проявляться сравнительно часто.
В связи с этим, владельцам домашних животных следует знать и помнить следующее:
- Единственной защитой от бешенства является своевременная и регулярная профилактическая вакцинациядомашних питомцев антирабической вакциной.
- Если, у вашего питомца, после пребывания за городом или даже гуляния по паркам и лесам резко изменилось поведение, то в целях вашей безопасности и ваших близких, надо немедленно показать животное ветеринарному врачу.
- Если вас, или ваших близких укусила чужая, бездомная собака, или кошка на улице или в общественных местах (подъездах, переходах) постарайтесь сразу же: установить хозяина данного животного; попросить хозяина предъявить ветеринарный паспорт животного и проверить наличие отметки о действующей вакцинации против бешенства. Обратите внимание, что срок действия вакцины 1 год. Рядом с отметкой должна стоять печать ветеринарной клиники о проведении вакцинации.

- Если не удалось установить хозяина животного, или, нападавшее животное не вакцинировано против бешенства, то вам следует незамедлительно обратиться в травматологический пункт по месту жительства для проведения лечебной вакцинации против бешенства.
- Карантин животного не отменяет проведение лечебной вакцинации пострадавшего человека и служит для установления факта заболевания животного бешенством в случае развития у него клинической картины заболевания.
- Помните, что точно диагностировать бешенство можно только после смерти животного, исследования его головного мозга и проведения биопробы на мышах (искусственное их заражение клетками подозреваемого по бешенству животного).
Почему необходимо вакцинировать животное против бешенства?
Согласно законодательным предписаниям щенки и котята должны быть привиты против бешенства с 2-х месячного возраста.
Бешенство не лечится, исход болезни – смерть животного или человека, поэтому уберечься от данного заболевания можно только с помощью вакцинации.
Вирус безалаберности. Почему в регионах нет доступных вакцин от бешенства? | Здравоохранение | Общество
В Волгограде очередная смерть от бешенства: женщина скончалась после укуса бешеной кошки. Единственное спасение для людей, которые пострадали от укуса бешеного животного, — вакцинация. Но всегда ли её можно быстро получить?
За 3 месяца 2021 года в области выявлено 20 случаев бешенства. Для сравнения: за весь 2020 год было зарегистрировано 42 случая.
Бешеная кошка
Погибшая 30 марта жительница Волгоградской области проживала в Новоаннинском районе. Неделю назад она обратилась к врачу с жалобами на симптомы, характерные для коронавируса. 60-летней женщине было тяжело дышать, поднялась температура. Её госпитализировали. При поступлении в больницу пациентка рассказала, что вместе с ней жила кошка и в последнее время животное вело себя странно. Кошка была агрессивной, даже полтора месяца назад укусила хозяйку. Что странно, собака, которая тоже жила в доме, умерла. А кошку из-за агрессивного поведения усыпили. Об укусах женщина никому не сообщала, бешенство у животных не подозревала.
А кошку из-за агрессивного поведения усыпили. Об укусах женщина никому не сообщала, бешенство у животных не подозревала.
К сожалению, врачи не смогли помочь женщине и она умерла. Проведённое обследование наличие вируса COVID-19 исключило. Причиной смерти стал вирус бешенства.
Квест из жизни
Моего сына тоже не так давно укусила соседская собака. Случилось это в субботу после обеда. И вроде бы не так уж сильно укусила: спасли толстые зимние брюки. Но повреждения на коже есть: огромная гематома (пёс прищемил мышцы словно клещами). Первым делом мы обработали рану перекисью и повезли его на ближайшую станцию скорой помощи.
Ответ местного фельдшера удивил. Медработник не увидел повреждения кожного покрова, но на всякий случай посоветовал обратиться в детскую больницу № 7 в Волгограде. Мы живём в области, и от нашего посёлка до неё около 40 километров. Если ехать перекладными на общественном транспорте, выйдет больше полутора часов.
Агрессивная собака оказалась не бродячей, а «с пропиской». Её владелица работает в поселковой амбулатории медицинским регистратором. Но по иронии судьбы её медицинских познаний не хватило на то, чтобы завести на животное ветеринарный паспорт и сделать необходимые прививки.
Её владелица работает в поселковой амбулатории медицинским регистратором. Но по иронии судьбы её медицинских познаний не хватило на то, чтобы завести на животное ветеринарный паспорт и сделать необходимые прививки.
Поэтому после укуса бездомной собаки необходимо вколоть вакцину. Но на деле получить её — тот ещё квест.
Мы столкнулись не только с наглухо закрытыми воротами и дверями детской больницы, но и с банальным перекидыванием пациентов с одной клиники на другую, хотя, казалось бы, ситуация не терпит отлагательств.
«Травматолог не принимает, — отрезал сторож, перегородив проход к приёмному покою больницы. — Езжайте в травмпукт взрослой больницы».
— Езжайте в травмпукт взрослой больницы».
Из детской больницы пришлось ехать во взрослую «травму».
Огромная очередь во взрослую «травму», и — удача — адекватный медик заключил: даже ослюнение собакой, если она вдруг заражена бешенством, может быть опасно. Поэтому только вакцина.
К счастью, весь курс уколов проходить не пришлось. Хозяева собаки спохватились и вовремя доставили её к ветеринару, а по истечении карантинного периода предоставили справку о том, что животное здорово. Врач отменил уколы.
Справка об отсутствии бешенства. Фото: АиФ/ Светлана Белодорожкина«Вирус регистрируется во всех регионах России»
«Вакцина против бешенства вводится в первый день обращения в травматологический пункт, — говорит Елена Эсауленко, доктор медицинских наук, профессор, заведующая кафедрой инфекционных болезней взрослых и эпидемиологии СПбГПМУ. — Схема вакцинации включает в себя шесть внутримышечных инъекций: в день обращения, на 3-й, 7-й, 14-й, 30-й и 90-й дни с момента начала курса. Но следует помнить, что вакцинация максимально эффективна лишь при начале курса не позднее 14-го дня с момента укуса.
Но следует помнить, что вакцинация максимально эффективна лишь при начале курса не позднее 14-го дня с момента укуса.
Защитные антитела появляются через 2 недели после первой прививки, достигая максимума через 30-40 дней. В связи с этим там, где можно думать о коротком инкубационном периоде (укусы в голову, шею, кисти и пальцы рук, гениталии, множественные укусы), вводят антирабический иммуноглобулин, который получают из сыворотки крови человека или лошади. Иммуноглобулин вводят в течение 24 часов после возможного инфицирования, но не позднее 3 суток после контакта и до введения третьей дозы вакцины на 7-й день. Вводится иммуноглобулин однократно».
За последние 20 лет, по словам Елены Эсауленко, в России было зарегистрировано более 60 000 случаев бешенства у животных, ещё почти 200 человек заболели. При этом вирус регистрируется практически во всех регионах России, но чаще всего в Центральном, Приволжском и Южном федеральных округах.
Клиникам невыгодно
Вакцина от бешенства бесплатная и для людей, и для животных. Своих питомцев хозяева могут привить в государственных ветлечебницах. В национальный календарь прививок она не входит, так как профилактическая иммунизация проводится только для работников служб, занимающихся отловом животных, ветврачей и сотрудников других учреждений, которые имеют высокий риск заражения бешенством. Но и тут, казалось бы, когда у человека есть реальный риск каждый день быть укушенным бешеной кошкой или псом, не всё бывает так просто.
Своих питомцев хозяева могут привить в государственных ветлечебницах. В национальный календарь прививок она не входит, так как профилактическая иммунизация проводится только для работников служб, занимающихся отловом животных, ветврачей и сотрудников других учреждений, которые имеют высокий риск заражения бешенством. Но и тут, казалось бы, когда у человека есть реальный риск каждый день быть укушенным бешеной кошкой или псом, не всё бывает так просто.
Так, Сергею Лундбергу (имя изменено, — прим. ред.), руководителю ветеринарной клиники в Ростове-на-Дону, отказали в проведении профилактической вакцинации против бешенства.
«Отказали все. Никто не держит эту вакцину. Только по покусам: получили травму, идёте в травмпункт и прививаетесь», — говорит Лундберг.
По его словам, на практике прививок нет ни у ветеринаров, ни даже у работников службы отлова, которые по работе контактируют с дикими животными. Одна из причин — невостребованность. «Клинике невыгодно закупать партию без должного объёма пациентов, — объясняет Сергей. — Кроме денег это ещё отчетность и необходимость ежегодного повторения этой программы, так как уже начали».
Одна из причин — невостребованность. «Клинике невыгодно закупать партию без должного объёма пациентов, — объясняет Сергей. — Кроме денег это ещё отчетность и необходимость ежегодного повторения этой программы, так как уже начали».В итоге проще не начинать. Мы позвонили в три поликлиники Ростова-на-Дону, и нигде вакцины не оказалось.
Получается, как у той собаки Павлова: все всё понимают, но сделать ничего не могут.
Закон о безответственном отношении
И это несмотря на то, что с 2020 года ситуация с бродячими животными не улучшилась. И вроде принят закон «Об ответственном обращении с животными». Он не только регулирует добросовестность хозяев, но и, например, запрещает отлов бродячих собак и кошек. Теперь у бездомных кошек и собак два пути: улица или приют. Но бродячие животные, как правило, остаются на улице, так как приютов для всех в стране не хватает. А в маленьких городах они просто не строятся.
На этот раз собака укусила за руку — выхватила еду. Фото: АиФ/ Светлана Белодорожкина
Фото: АиФ/ Светлана БелодорожкинаПоэтому бездомных бродяжек часто свозят на окраины, чтобы не переполнять приюты. Вешают им на уши бирки о том, что собаки прошли стерилизацию и вакцинацию от бешенства. Только вот бездомная собака на улице постоянно хочет есть, этот естественный инстинкт никто не отменял.
Так моего сына опять укусила собака. На этот раз — бродячая. Выхватила пирожок из рук. А укус в руку — это уже введение иммуноглобулина. Так как первый курс прививок был прерван по справке, мы проходим всё заново, и это несмотря на то, что собака была с зелёной биркой.
«А вы уверены в том, что там у неё под биркой? — спросил нас травматолог, который уже стал нам чуть ли не близким другом. — Вакцинацию от бешенства у собак нужно периодически повторять. А делает ли это кто? Большой вопрос».
Российские ученые разработали новые вакцины против бешенства
Юлия Макеева
Еще летом покусанные собаками люди обзванивали медучреждения и выясняли, где можно пройти курс прививок. Найти вакцину было непросто. В Федеральном научном центре исследований и разработки иммунобиологических препаратов им. М. П. Чумакова РАН корреспонденту издания «Ветеринария и жизнь» пояснили, что дефицит антирабической вакцины был связан с затянувшимся процессом сертификации препарата. Сейчас он отгружается по графику.
Найти вакцину было непросто. В Федеральном научном центре исследований и разработки иммунобиологических препаратов им. М. П. Чумакова РАН корреспонденту издания «Ветеринария и жизнь» пояснили, что дефицит антирабической вакцины был связан с затянувшимся процессом сертификации препарата. Сейчас он отгружается по графику.
Но, как известно, болезнь лучше предупредить, чем лечить. Тем более когда ситуация с распространением вируса бешенства в России и в мире остается напряженной.
Бешенством болеют и еноты, и коровы
В 2018 году в нашей стране было выявлено почти 2,3 тысячи очага бешенства, от вируса погибло 2,5 тысячи животных, сообщили в Федеральном центре охраны здоровья животных (ФГБУ «ВНИИЗЖ»).
Во втором квартале этого года зарегистрировано 247 очагов бешенства. Наиболее сложная ситуация в Московской области, где зафиксировано 49 неблагополучных пунктов. Свободных от смертельного вируса территорий немного. В первых числах ноября карантин из-за выявленного в личном подворье больного животного был объявлен в Орловской области. Зараженного бешенством енота поймали на улице в городе Кашино Тверской области. В Тамбовской области обнаружили инфицированную корову, а в Мордовии – бешеную собаку.
Зараженного бешенством енота поймали на улице в городе Кашино Тверской области. В Тамбовской области обнаружили инфицированную корову, а в Мордовии – бешеную собаку.
Одним из наиболее действенных методов борьбы с бешенством ученые называют вакцинацию домашних и сельскохозяйственных животных.
Вместе с тем очень важно вакцинировать потенциальных носителей вируса в дикой природе, желательно поголовно, считает завлабораторией Института биологии гена РАН Алексей Дейкин. Ученый называет целевые группы: лисицы, енотовидные собаки, песцы, шакалы, корсаки.
Для профилактики заражения вирусом диких животных используют специальные кормовые брикеты, начиненные вакциной. Приманки с препаратом разбрасывают в том числе и с помощью авиации, на неблагополучных территориях. Вакцина – оральная. Животное раскусывает саше с вакциной, и препарат попадает в организм. «Иммунный ответ к вирусу бешенства формируется через 21 сутки», – рассказывает ученый.
В 2019 году, по информации подведомственного Россельхознадзору ФГБУ «ВНИИЗЖ», вакцинация против бешенства среди диких животных проведена в 54 регионах России, и процесс продолжается.
По мнению замдиректора по науке другого института Россельхознадзора – Всероссийского государственного Центра качества и стандартизации лекарственных средств для животных и кормов (ФГБУ «ВГНКИ») – Артема Метлина, вакцинация диких животных даст результат при соблюдении трех правил. Во-первых, процесс должен быть долговременным – не менее шести лет. Во-вторых, широкомасштабным – на один квадратный километр необходимо раскладывать 20–25 приманок, при этом территория одной зоны вакцинации должна занимать не менее 5 тысяч квадратных километров. В-третьих, необходимо научное обоснование. Стратегия должна быть скорректирована с учетом климатических и географических особенностей региона, видового состава обитающих там животных.
О результативности метода можно судить по опыту Франции. На территории в 120 тысяч квадратных километров было разбросано более 4 миллионов приманок с вакцинами. Случаи выявления бешенства во Франции снизились на 99,7%.
Термостабильная вакцина от бешенства может появиться в 2020 году
Российские ученые продолжают совершенствовать вакцины против бешенства. Так, во ВНИИЗЖ сейчас работают над новым препаратом, предназначенным для профилактики опасного вируса среди диких плотоядных животных.
Так, во ВНИИЗЖ сейчас работают над новым препаратом, предназначенным для профилактики опасного вируса среди диких плотоядных животных.
«Живые вакцины для орального применения содержат активный, но ослабленный вирус, – рассказывает доктор биологических наук, профессор, главный научный сотрудник ВНИИЗЖ Константин Груздев. – Вирус бешенства постепенно инактивируется при высокой температуре, поэтому для приготовления оральных вакцин используют только термостабильные штаммы.
Исследования показали, что большую часть приманок с вакциной животные съедают в первые несколько дней, поэтому задача разработчиков – сохранить активность вакцинного вируса в течение недели.
Вакцинация в России проводится весной и осенью, то есть при невысоких температурах. Поэтому для нашей страны более актуальна изначальная активность вируса в вакцинных приманках.
Тем не менее ученые ВНИИЗЖ работают над термостабильными препаратами, которые могут применяться в странах с жарким климатом. «Термостабильная вакцина проходит заключительные испытания на целевых видах животных. В случае получения положительных результатов данный препарат может появиться на российском рынке в 2020 году», – сообщил «ВиЖ» Константин Груздев.
«Термостабильная вакцина проходит заключительные испытания на целевых видах животных. В случае получения положительных результатов данный препарат может появиться на российском рынке в 2020 году», – сообщил «ВиЖ» Константин Груздев.
Защита домашних животных
Еще одна новая разработка ученых ФГБУ «ВНИИЗЖ» предназначена для домашних животных. Это новая антирабическая инактивированная эмульсионная культуральная вакцина «АРРИАХ-Рабивак».
«При исследовании иммунобиологических свойств было установлено, что иммунитет, индуцируемый при применении данной вакцины, на порядок выше гуморального (способного бороться с вирусами. – Прим. ред.), формируемого после применения традиционных препаратов», – говорит Константин Груздев. Вакцина обладает низкой реактогенностью, то есть не вызывает побочных эффектов. После введения препарата у кошек и собак не было выявлено признаков общей или местной реакции. Животные на год приобретали стойкий иммунитет к бешенству.
«Уровень вируснейтрализующих антител при введении разработанной вакцины в два-три раза превышает уровень антител, индуцируемых сорбированными антирабическими вакцинами», – подчеркнул Константин Груздев.
Стоит отметить, что вакцину «АРРИАХ-Рабивак» можно применять для профилактики бешенства у сельскохозяйственных животных. Ученые подчеркивают, что мясо и молоко вакцинированных животных можно использовать без ограничений. Еще один важный момент: рекомендуемая доза при применении новой вакцины меньше по сравнению с сорбированными препаратами.
Знания для жизни
С 2014 года, по информации Всемирной организации здравоохранения, от бешенства погибло минимум 30 жителей России. И это только официальные данные.
Как правило, дикие животные, чаще лисы, заражают бешенством собак и кошек, а те уже кусают людей.
Жителям России порой не хватает элементарных знаний о профилактике бешенства. Например, мало кто знает, что после укуса животного рану нельзя прижигать спиртом, это только способствует распространению инфекции. Лучше промыть с мылом и обязательно пройти курс антирабической вакцинации.
Лучше промыть с мылом и обязательно пройти курс антирабической вакцинации.
Просветительскую роль решили взять на себя сотрудники Россельхознадзора и ВНИИЗЖ. Они работают над созданием фильма, посвященного проблеме бешенства в России.
«В фильме эксперты Россельхознадзора, ВНИИЗЖ, Минздрава, Всемирной организации по охране здоровья животных (МЭБ), Продовольственной и сельскохозяйственной организации ООН (ФАО), Всемирной организации здравоохранения и других структур рассказывают, какой должна быть программа по ликвидации бешенства в России и почему сегодня сложилась неблагополучная обстановка», – говорит Анастасия Мазнева, автор фильма, научный журналист.
В ряде европейских стран бешенство смогли победить в том числе за счет масштабной вакцинации диких животных, а также благодаря культуре ответственного отношения к домашним животным. Об опыте этих государств также пойдет речь в новом проекте «Бешенство: укрощение вируса».
Фильм будет демонстрироваться на видеохостинге YouTube. com, а также на сайтах Россельхознадзора и ВНИИЗЖ
com, а также на сайтах Россельхознадзора и ВНИИЗЖ
Почему в России возник дефицит лекарств для людей
Несмотря на частичную стабилизацию ситуации с дефицитом лекарств, серьезных проблем остается немало, они могут возобновиться в начале 2020 года, предупреждают эксперты.
По многочисленным экспертным оценкам, звучащим в СМИ, основная причина возникшего дефицита – в новой методике формирования Минздравом максимальной (предельной) цены контрактов при госзакупках лекарств. По российскому законодательству стоимость жизненно важных лекарств жестко регулируется. Однако, как показала практика, это привело к тому, что производство многих препаратов оказалось на грани рентабельности, а в отдельных случаях даже убыточным. То есть максимальная цена, которую могут заплатить за препараты покупатели, государством установлена такая мизерная, что производить их стало просто невыгодно. И в первую очередь стали вымываться с рынка лекарства низшего ценового сегмента.
Кроме того, из-за сложной процедуры регистрации западных препаратов зарубежные компании стали отказываться участвовать в торгах и уходить с российского рынка. Ситуация усугубляется тем, что часть исчезающих лекарств сменяют недорогие дженерики, качество которых вызывает вопросы. Субстанции для них приобретаются в Индии и Китае.
Ситуация усугубляется тем, что часть исчезающих лекарств сменяют недорогие дженерики, качество которых вызывает вопросы. Субстанции для них приобретаются в Индии и Китае.
Вакцинация животных — цены и запись на приём в ветеринарную клинику Amicus VET
Многие считают, что если не выводить животное на улицу, ему вакцинация не нужна. Но на самом деле это ошибочное мнение. Стоит подумать о вакцинации животного, даже если оно домашнее и никуда не выходит.
Вакцинация не защищает на 100% от заражения, она стимулирует выработку специфического иммунитета, который позволит животному при встрече с вирусом переболеть в легкой или в бессимптомной форме. Вакцины используются поливалентные, то есть в своем они составе содержат несколько видов возбудителей.
Взрослым животным инъекция делаются только по необходимости. Сначала проводится исследование, проверяется состояние животного. Затем пролечиваются глисты и только после этого специалист делает заключение о том, нужна ли животному прививка или нет.
Вакцинация домашних животных не проводится, если:
- животное испытывает сильный стресс, нервничает;
- во время течки;
- при беременности и лактации;
- больным, травмированным или старым животным (старше 7 лет).
Перед вакцинированием нельзя травмировать животное, мыть, подвергать стрессу. Важно постараться создать максимально доброжелательную и комфортную для него обстановку. Стоит приготовиться к тому, что питомец может повести себя агрессивно после прививки. У многих это естественная реакция на стресс, которая является особенностью характера.
Признаки, что вакцинация прошла благополучно, и как ухаживать за животным после прививок
После того, как сделана прививка, нужно оберегать животное от резких перемен температур, холода или жары. Некоторое время нельзя мыть его целиком, за исключением лап. В первые дни после прививки важно следить за состоянием здоровья питомца, за тем, чтобы не поднялась температура, не пропал аппетит.
Повод обратиться к специалисту, если наблюдается:
- температура;
- рвота;
- вялость;
- диарея;
- одышка.
Лучше всего пойти к врачу, которому вы доверяете или обратиться в клинику, где делалась прививка.
Любое отклонение от обычного состояния, например, вялость, температура, выделения из глаз и ушей – повод насторожиться и обратиться к специалисту. Он назначит лечение и поможет справиться с последствиями неправильной вакцинации или аллергии. Обычно иммунитет вырабатывается у животного в течение 2-х недель. После этого необходимость в прививках отпадает.
Перед вакцинированием важно тщательно проверить здоровье питомца. Тогда негативные последствия будут сведены к нулю. Обязательно поинтересуйтесь качеством, сроком годности вакцины, прочтите отзывы в интернете. Таким образом вы сможете свести на «нет» негативные последствия прививок, хотя они возникают нечасто.
Видео нашей клиники
youtube.com/embed/cMcbSDG5Qlo?rel=0" frameborder="0"/>
Об актуальности профилактики бешенства - Официальный сайт Тазовского района
Бешенство — особо опасное острое инфекционное заболевание, которое передается человеку больным животным через укус или ослюнение поврежденных кожных покровов и слизистых с последующим тяжелым поражением центральной нервной системы, в 100 % заканчивается летально (смертью). Одним из основных признаков развивающегося заболевания является водобоязнь, когда у больного затруднено глотание жидкости, появляются судороги при попытке пить воду. Поэтому бешенство называют еще и гидрофобией.
Основным источником инфекции для человека являются собаки, в первую очередь безнадзорные, а из диких животных - лисы, енотовидные собаки, волки. Возможно заражение человека и от других животных - коров, овец, коз, свиней, лошадей, крыс, и др. Основным резервуаром вируса в природе являются волки, лисицы, шакалы, среди которых возникают эпизоотии бешенства. Заражение человека наступает при укусе больным животным, а также вследствие ослюнения свежих ранений кожи или слизистых оболочек. Особенно опасны укусы в голову, лицо, кисти рук. Животные становятся заразными для людей уже в конце инкубационного периода (до начала проявлений признаков болезни).
Заражение человека наступает при укусе больным животным, а также вследствие ослюнения свежих ранений кожи или слизистых оболочек. Особенно опасны укусы в голову, лицо, кисти рук. Животные становятся заразными для людей уже в конце инкубационного периода (до начала проявлений признаков болезни).
В 2018 году на территории Тазовского района обращаемость за медицинской помощью по поводу укусов животными выросла на 22,7 % в сравнении с 2017 г.
В целях профилактики бешенства проводится профилактическая иммунизация против данной инфекции лиц, относящихся к категории профессионального риска заражения (ветеринарные работники, лица, выполняющие работы по отлову безнадзорных животных). В 2018 г. с профилактической целью привито 13 человек.
Благодаря проводимой профилактической работе случаи заболевания бешенством среди людей не регистрируются.
Что нужно делать чтобы не заболеть бешенством?
Чтобы не заболеть бешенством необходимо:
В случаях, когда контакта с животным избежать не удалось, а именно после укуса, оцарапывания, ослюнения, нанесенных любым, даже внешне здоровым, животным:
• провести первичную обработку места контакта — тщательно промыть струей воды с
мылом;
• при наличии раны, после промывания с мылом, обработать края раны 5-процентной
настойкой йода;
• наложить стерильную повязку и немедленно обратиться в медицинское учреждение,
где врачом будет решен вопрос о назначении курса прививок от бешенства, который
состоит из 6 инъекций в верхнюю треть плеча — это единственное эффективное средство
профилактики, которое гарантирует защиту от заболевания только при своевременном
обращении за медицинской помощью!
Следует помнить: чем раньше начата иммунизация против бешенства, тем вероятнее благополучный исход. Ни в коем случае не следует отказываться от вакцинации и самовольно прерывать ее — это может привести к трагическим последствиям.
Ни в коем случае не следует отказываться от вакцинации и самовольно прерывать ее — это может привести к трагическим последствиям.
Бешенство можно предупредить, зная и выполняя так же простые правила поведения:
- избегать контактов с бездомными (бродячими) и дикими животными, особенно в тех
случаях когда у них наблюдаются такие признаки, как агрессия, обильное
слюноотделение, заторможенная реакция;
- не оказывать помощь неизвестным животным, не разнимать и не вмешиваться в борьбу
между животными, не приносить домой диких животных;
- строго соблюдать установленные правила содержания домашних животных (собак, кошек) и ежегодно в обязательном порядке вакцинировать своих любимцев против бешенства;
- при заболевании домашнего животного, либо при появлении симптомов, не исключающих бешенство, обращаться к ветеринарному специалисту;
- от укусов животных часто страдают дети, поэтому необходимо постоянно проводить с ними разъяснительную работу о последствиях контактов с животными, особенно дикими или безнадзорными. Следует напомнить ребенку о необходимости информирования взрослых в случае даже незначительных повреждений, нанесенных животными.
Следует напомнить ребенку о необходимости информирования взрослых в случае даже незначительных повреждений, нанесенных животными.
Филиал ФБУЗ «Центр гигиены и эпидемиологии в ЯНАО в г. Новый Уренгой, Тазовском районе» призывает быть предельно осторожными и внимательными к своему здоровью!
381
Вакцина против бешенства (внутримышечно) Описание и торговые марки
Описание и торговые марки
Информация о лекарствах предоставлена: IBM Micromedex
Торговая марка США
- Имовакс от бешенства
- Рабаверт
Описание
Вакцина против бешенства является активным иммунизирующим средством, используемым для предотвращения инфекции, вызванной вирусом бешенства. Вакцина работает, заставляя ваш организм вырабатывать собственную защиту (антитела) против вируса бешенства.
Вакцина против бешенства используется двумя способами. Вакцину против бешенства вводят лицам, подвергшимся воздействию (например, в результате укуса, царапины или облизывания) животного, о котором известно или предполагается, что оно заражено бешенством. Это называется постконтактной профилактикой. Вакцину от бешенства также можно сделать заблаговременно лицам с высоким риском заражения вирусом бешенства. К таким лицам относятся ветеринары, дрессировщики животных или путешественники, которые проведут более 1 месяца в странах с высоким уровнем заражения бешенством, а также лица, которые живут, работают или отдыхают в диких районах страны, где они могут попасть в контакт с дикими животными.Это называется доконтактной профилактикой.
Вакцину против бешенства вводят лицам, подвергшимся воздействию (например, в результате укуса, царапины или облизывания) животного, о котором известно или предполагается, что оно заражено бешенством. Это называется постконтактной профилактикой. Вакцину от бешенства также можно сделать заблаговременно лицам с высоким риском заражения вирусом бешенства. К таким лицам относятся ветеринары, дрессировщики животных или путешественники, которые проведут более 1 месяца в странах с высоким уровнем заражения бешенством, а также лица, которые живут, работают или отдыхают в диких районах страны, где они могут попасть в контакт с дикими животными.Это называется доконтактной профилактикой.
Инфекция бешенства является серьезной и часто смертельной инфекцией. В США бешенство диких животных, особенно енотов, скунсов, лис и летучих мышей, является причиной большинства случаев передачи бешенства людям, домашним животным и другим домашним животным. В Канаде бешенством чаще всего заражаются лисы, скунсы, летучие мыши, собаки и кошки. Известно также, что лошади, свиньи и крупный рогатый скот заражаются бешенством. В большей части остального мира, включая Латинскую Америку, Африку и Азию, на собак приходится большинство случаев заражения людей бешенством.
Известно также, что лошади, свиньи и крупный рогатый скот заражаются бешенством. В большей части остального мира, включая Латинскую Америку, Африку и Азию, на собак приходится большинство случаев заражения людей бешенством.
Если вы проходите (или будете проходить) лечение от возможной инфекции бешенства во время поездки за пределы США или Канады, свяжитесь со своим врачом, как только вы вернетесь в США или Канаду, поскольку вам может потребоваться дополнительное лечение. .
Эта вакцина должна вводиться только вашим врачом или другим медицинским работником или под его наблюдением.
Этот продукт доступен в следующих лекарственных формах:
Получите самую свежую медицинскую информацию от экспертов Mayo Clinic.
Зарегистрируйтесь бесплатно и будьте в курсе последних научных достижений, советов по здоровью и актуальных тем, связанных со здоровьем, таких как COVID-19, а также экспертных знаний по управлению здоровьем.
Чтобы предоставить вам наиболее актуальную и полезную информацию, а также понять, какие
информация полезна, мы можем объединить вашу электронную почту и информацию об использовании веб-сайта с
другая информация о вас, которой мы располагаем.Если вы пациент клиники Майо, это может
включать защищенную информацию о здоровье. Если мы объединим эту информацию с вашей защищенной
медицинской информации, мы будем рассматривать всю эту информацию как
информацию и будет использовать или раскрывать эту информацию только так, как указано в нашем уведомлении о
практики конфиденциальности. Вы можете отказаться от получения сообщений по электронной почте в любое время, нажав на
ссылка для отписки в письме.
Подписаться!
Спасибо за подписку
Наш электронный информационный бюллетень Housecall будет держать вас в курсе последней медицинской информации.
Извините, что-то пошло не так с вашей подпиской
Повторите попытку через пару минут
Повторить попытку
Части этого документа последний раз обновлялись: сентябрь.01, 2021
Copyright © 2022 IBM Watson Health. Все права защищены. Информация предназначена только для использования Конечным пользователем и не может быть продана, перераспределена или иным образом использована в коммерческих целях.
Информация предназначена только для использования Конечным пользователем и не может быть продана, перераспределена или иным образом использована в коммерческих целях.
.
Лечение вакциной против бешенства
Бешенство — серьезное заболевание, вызываемое вирусом, поражающим нервы и головной мозг теплокровных животных (млекопитающих). В Соединенных Штатах такие дикие животные, как еноты, скунсы, лисы и летучие мыши, чаще всего являются переносчиками бешенства.Хотя редко, домашние собаки и кошки, которые не были вакцинированы, могут заболеть.
Вирус переносится со слюной (слюной) инфицированного животного. Если это животное укусит или поцарапает человека, вирус может распространиться на человека. Когда бешенство переносится летучей мышью, достаточно контакта со слюной летучей мыши, чтобы заразиться. Для заражения человека не обязательно должен быть настоящий укус.
Чтобы узнать, есть ли у животного бешенство, его необходимо подвергнуть эвтаназии (усыпить) для проверки его мозговой ткани. Вы должны рассматривать любой укус дикого животного как риск заражения бешенством, пока не доказано обратное. После всех укусов животных важно позвонить своему лечащему врачу или обратиться в отделение неотложной помощи.
Вы должны рассматривать любой укус дикого животного как риск заражения бешенством, пока не доказано обратное. После всех укусов животных важно позвонить своему лечащему врачу или обратиться в отделение неотложной помощи.
После укуса или царапины от животного
Если неизвестное животное укусит или поцарапает вашего ребенка, вымойте это место водой с мылом. Затем немедленно позвоните или посетите врача. Медицинский работник примет решение о необходимости лечения против бешенства.
Не ждите, пока у вашего ребенка появятся симптомы.Невылеченное бешенство почти всегда смертельно.
Если ваш ребенок никогда ранее не получал вакцины против бешенства и поставщик медицинских услуг считает, что его необходимо лечить, ему потребуется 5 инъекций (уколов). Детям с ослабленным иммунитетом может потребоваться 6.
- Иммунный глобулин против бешенства (RIG) вводят людям, которые никогда ранее его не получали. Его делают одновременно с первой из 4 прививок от бешенства.

- Людям, ранее перенесшим РИГ, сделают только 4 прививки от бешенства.
- Все вакцины против бешенства должны быть введены в течение 2 недель (если только у вашего ребенка нет иммунодефицита).
Ваш ребенок должен получить все прививки , чтобы вакцина была эффективной и не заразилась бешенством.
Лечащий врач вашего ребенка решил, что вашему ребенку необходимо лечение от бешенства.
Сегодня получили РИГ и первую вакцину от бешенства.
Очень важно сделать еще 3 прививки в течение следующих 2 недель.
Мы запланировали возвращение вашего ребенка в Национальную детскую больницу неотложной помощи
в следующие даты:
№3 в 3-й день ____________ №4 в 7-й день _____________ №5 в 14-й день ______________
Отделение неотложной помощи в главном кампусе больницы открыто с 8:00 до 23:00. ежедневно, кроме праздников. При необходимости позвоните по телефону (614) 722-4334, чтобы уточнить часы работы в праздничные дни.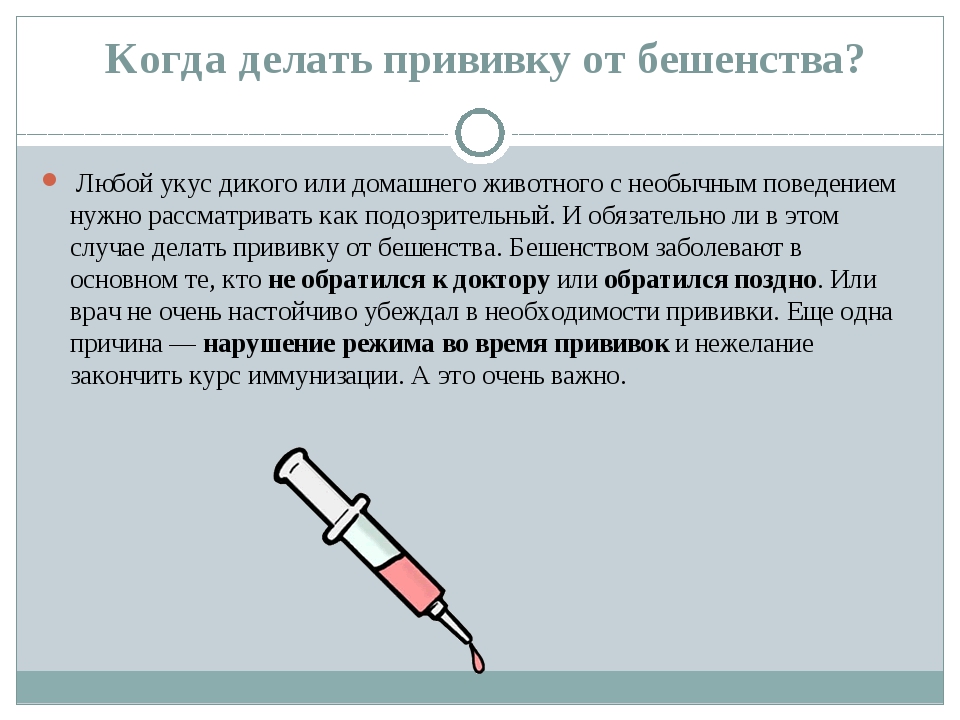
Если вы не можете вернуться в Национальную детскую больницу неотложной помощи в запланированные дни
, сообщите нам об этом заранее.Звоните (614) 722-4300. Возможно, мы сможем организовать для
вашего ребенка прививки в кабинете врача или в Департаменте здравоохранения.
Реакция на лечение бешенства
Реакции (побочные эффекты) на лечение бешенства встречаются редко. Они могут включать следующее:
- легкая лихорадка, озноб
- боль, покраснение, отек или зуд в месте инъекции
- легкая головная боль или головокружение • слабость или утомляемость
- мышечные боли
- боль в животе, тошнота, рвота
Взаимодействия
В вакцине против бешенства RIG используется живой вирус.Это может повлиять на эффективность других живых вакцин. Сообщите лечащему врачу вашего ребенка, если он получает вакцину против бешенства. Вашему ребенку может потребоваться бустерная вакцина для недавно полученной вакцины или ему придется подождать 4 месяца, прежде чем делать другие вакцины, такие как MMR (корь, эпидемический паротит, краснуха).
Как избежать укусов животных
Научите ребенка, как избежать укусов животных. При приближении животного, которое может атаковать:
- Никогда не кричи и не беги.
- Стой неподвижно , руки вдоль туловища. Избегайте зрительного контакта с собакой.
- Как только животное потеряет к вам интерес, медленно отступайте, пока оно не исчезнет из виду.
- Если животное нападет, отдайте ему свою куртку или положите что-нибудь между собой и животным, например сумку для книг.
- Если вы упадете или будете сбиты с ног, свернитесь в клубок, заткните уши руками и не двигайтесь. Притворись мертвым и постарайся не кричать и не двигаться.
- Никогда не дразните и не преследуйте животное, не тяните его за уши, хвост или лапы, даже если вы знаете животное.
- Всегда уходите если животное рычит или начинает рычать при приближении.
 Никогда не беги!
Никогда не беги! - Не беспокоить животное во время еды.
- Не ешьте и не носите еду, если поблизости находится незнакомое животное.
- Никогда не пытайтесь погладить или поймать дикое животное.
- Не приближайтесь к бездомным или незнакомым животным.
Способы предотвращения бешенства
- Вакцинируйте свою собаку, кошку или хорька от бешенства.Наденьте на животное бирку от бешенства.
- Держите кошек и собак подальше от диких животных. Выгуливать собак на поводке.
- Если вы видите, что какое-либо животное ведет себя странно, попросите родителей или другого взрослого позвонить в Службу защиты животных.
- Если вы видите летучую мышь в своем доме, лучше всего оставить ее в покое и рассказать об этом родителям. Они могут позвонить в Службу здравоохранения округа Франклин по телефону (614) 525-3160, чтобы забрать мертвую летучую мышь, или вызвать специалиста по дикой природе, чтобы поймать ее.

- Никогда не принимайте диких животных и не пытайтесь вылечить больных диких животных.Если вы обнаружите больное или раненое дикое животное, позвоните в Службу защиты животных, своему местному ветеринару или в Центральный Огайо на горячую линию Центра дикой природы Огайо по телефону (614) 793-9453.
- Обо всех укусах животных необходимо сообщать в отдел здравоохранения округа Франклин в течение 24 часов. Позвоните по телефону (614) 525-3160 или найдите форму заявления о приеме укусов животных на сайте: www.myfcph.org. Форма запросит:
- имя владельца, адрес и номер телефона
- вид животного, окрас и порода
- доказательство вакцины против бешенства или бирка против бешенства
Лечение вакциной против бешенства (PDF)
HH-I-177 © 1993 г., редакция 2020 г., Национальная детская больница
Разработка иммунопрофилактики бешенства у животных и людей
Avicenna J Med Biotechnol. январь-март 2010 г.; 2(1): 3–21.
январь-март 2010 г.; 2(1): 3–21.
Вирусологическая лаборатория, Центр исследований и диагностики болезней животных (CADRAD), Индийский институт ветеринарных исследований (IVRI), Изатнагар, штат Юта, Индия
* Автор, ответственный за переписку: Сукдеб Нанди, доктор философии, вирусологическая лаборатория, Центр для исследования и диагностики болезней животных (CADRAD), Индийский институт ветеринарных исследований (IVRI), Изатнагар, UP, Индия. E-mail: moc.oohay@1091idnansПоступила в редакцию 7 февраля 2010 г.; Принято 17 марта 2010 г.
Copyright © 2010 Исследовательский институт АвиценныЭта работа находится под лицензией Creative Commons Attribution-NonCommercial 3.0 Unported License, которая позволяет пользователям читать, копировать, распространять и создавать производные работы для некоммерческих целей на основе материала, если автор оригинальная работа цитируется правильно.
Эта статья была процитирована другими статьями в PMC.
Abstract
Бешенство — смертельное неврологическое заболевание и постоянная глобальная проблема. Он распространяется в основном домашними собаками, но другие виды псовых, виверровых (скунсы и еноты) и рукокрылые считаются наиболее эффективными переносчиками болезни.Поскольку собаки являются основными распространителями бешенства, необходимо уделить особое внимание иммунизации всех собак, в том числе несанкционированных бездомных, для борьбы с бешенством. Вакцинация — единственный способ борьбы с болезнью до и после воздействия или заражения, поскольку после появления симптомов лечения не существует. После первой сырой вакцины из нервной ткани, разработанной Пастером в 1885 году, за прошедшие годы был разработан ряд вакцин против бешенства для животных и человека с различной степенью безопасности и эффективности.В настоящее время инактивированные антирабические вакцины на основе клеточных культур широко используются в большинстве частей мира. Однако эти вакцины слишком дороги и недоступны для вакцинации людей и животных в развивающихся странах. Сравнительно более дешевые вакцины из инактивированных нервных тканей могут вызывать серьезные побочные эффекты, такие как аутоиммунный энцефаломиелит у привитых животных, и их производство было прекращено в нескольких странах. Хотя аттенуированные живые вакцины могут эффективно вызывать защитный иммунный ответ с меньшим количеством вируса, они иногда могут вызывать бешенство у привитых животных за счет остаточной вирулентности или патогенной мутации при размножении вируса в организме.Вакцины против бешенства нового поколения, полученные с помощью генных манипуляций, хотя и находятся на экспериментальной стадии, могут быть подходящей альтернативой для преодоления недостатков живых аттенуированных вакцин. Таким образом, необходимо повысить осведомленность широкой общественности об этом заболевании, а имеющиеся на рынке вакцины на основе клеточных культур следует рекомендовать для широкомасштабного использования для предотвращения и контроля этого возникающего и вновь возникающего инфекционного заболевания в обозримом будущем.
Сравнительно более дешевые вакцины из инактивированных нервных тканей могут вызывать серьезные побочные эффекты, такие как аутоиммунный энцефаломиелит у привитых животных, и их производство было прекращено в нескольких странах. Хотя аттенуированные живые вакцины могут эффективно вызывать защитный иммунный ответ с меньшим количеством вируса, они иногда могут вызывать бешенство у привитых животных за счет остаточной вирулентности или патогенной мутации при размножении вируса в организме.Вакцины против бешенства нового поколения, полученные с помощью генных манипуляций, хотя и находятся на экспериментальной стадии, могут быть подходящей альтернативой для преодоления недостатков живых аттенуированных вакцин. Таким образом, необходимо повысить осведомленность широкой общественности об этом заболевании, а имеющиеся на рынке вакцины на основе клеточных культур следует рекомендовать для широкомасштабного использования для предотвращения и контроля этого возникающего и вновь возникающего инфекционного заболевания в обозримом будущем.
Ключевые слова: Лиссавирус, Вирус бешенства, Бешенство, Вакцинация, Зоонозы
Введение
Бешенство, острый фатальный энцефаломиелит, остается одним из самых опасных и опасных зоонозных заболеваний в мире.Это самый важный вирусный зооноз, признанный сегодня, из-за его глобального распространения, заболеваемости, затрат на ветеринарию и здоровье человека и чрезвычайно высокого уровня летальности. Болезнью заражены все млекопитающие от маленькой мыши до огромного слона. Бешенство является энзоотическим заболеванием как диких, так и домашних животных и представляет потенциальную угрозу для человека. В странах-членах Региона Юго-Восточной Азии (ЮВАР) бешенство представляет собой серьезную проблему и является причиной приблизительно 80% смертей людей в мире (1–3).Заболеваемость бешенством особенно высока в Бангладеш, Пакистане и Индии, затем следует умеренная заболеваемость в Непале и Мьянме и легкая в Бутане, Таиланде и Индонезии (4–6).
Бешенство эндемично в странах, где проживает более 2,5 миллиардов человек.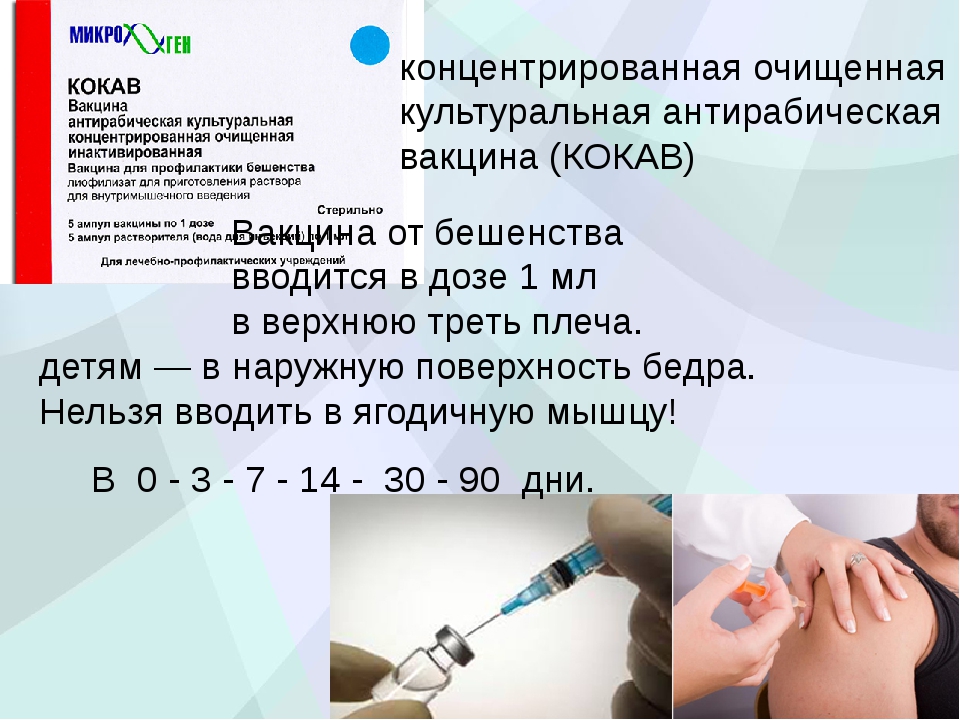 По оценкам, каждый год от бешенства умирает не менее 55 000 человек, и более 10–12 миллионов человек получают постэкспозиционную вакцинацию против этого заболевания (7).
По оценкам, каждый год от бешенства умирает не менее 55 000 человек, и более 10–12 миллионов человек получают постэкспозиционную вакцинацию против этого заболевания (7).
Дети в возрасте 5-15 лет подвергаются особому риску.Более 99% всех случаев смерти людей от бешенства приходится на Африку, Азию и Южную Америку (8). Только в Индии ежегодно регистрируется 30 000 смертей. Болезнь обычно передается через укусы бешеных животных, обычно плотоядных. У людей 90 % случаев возникают из-за укусов бешеных собак и 10 % из-за укусов других животных, воздушно-капельной передачи и трансплантации роговицы и других органов.
Предполагается, что собаки являются основным переносчиком инфекции в Индии из-за высокой плотности популяции собак.Подсчитано, что популяция собак в Индии составляет около 25 миллионов, и 3/4 th всех случаев бешенства среди людей происходят в деревнях, а заболеваемость среди самцов примерно в пять раз выше, чем среди самок (9, 10). животные, такие как кошка, крупный рогатый скот, лошадь, овца, коза и т. д., могут стать жертвами бешенства и передать его человеку (6). В Индии Андаманские и Никобарские острова и Лакшадип свободны от бешенства. Распределение случаев бешенства неравномерно, и в таких штатах, как Нагаленд, Манипур и Сикким, заболеваемость водобоязнью очень низкая из-за большого соотношения собак и людей (11–13).В Индии бешенством также преобладают дикие животные, такие как волк, лиса, мангуст, шакал, гиены и т. д. (9).
д., могут стать жертвами бешенства и передать его человеку (6). В Индии Андаманские и Никобарские острова и Лакшадип свободны от бешенства. Распределение случаев бешенства неравномерно, и в таких штатах, как Нагаленд, Манипур и Сикким, заболеваемость водобоязнью очень низкая из-за большого соотношения собак и людей (11–13).В Индии бешенством также преобладают дикие животные, такие как волк, лиса, мангуст, шакал, гиены и т. д. (9).
Плодоядные, насекомоядные и летучие мыши-вампиры могут питаться кровью человека и животных и являются переносчиками болезни в некоторых частях Латинской Америки (Бразилия, Мексика, Венесуэла, Тринидад и Тобаго) и США.
Годовой ущерб от бешенства оценивается в 583,5 миллионов долларов США , а потери скота составляют долларов США 12,3 миллионов в Азии и Африке.Бешенство собак встречается в 87 странах и является основной причиной всех случаев бешенства среди людей. Однако многие страны, такие как Япония, Великобритания, Дания, Швеция, Греция, Ирландия, Исландия, Португалия, Новая Зеландия, Австралия, Швейцария, Финляндия, Норвегия, Франция, Бельгия и т. д., свободны от бешенства (14, 15).
д., свободны от бешенства (14, 15).
Бешенство имеет сомнительную особенность, поскольку имеет самый высокий уровень летальности среди всех известных инфекционных заболеваний. Бешенство можно предотвратить введением сильнодействующих и эффективных антирабических вакцин как до, так и после контакта (16).Очевидно, что использование вакцин против бешенства на основе клеточных культур до и после контакта значительно снизило заболеваемость в некоторых странах (7). В Таиланде применение постконтактной профилактики (ПКП) за 15 лет снизило число случаев бешенства среди людей на 80% (17). Другие развивающиеся страны, такие как Индия, Шри-Ланка и Филиппины, внедрили и продвигают использование экономичной низкодозовой схемы внутрикожной антирабической вакцинации с использованием клеточной культуры антирабической вакцины (18). В настоящее время большинство домашних собак и кошек привиты от бешенства, но заражение бешенством может произойти из-за неэффективности вакцин, животных с ослабленным иммунитетом и наличия интеркуррентных заболеваний, а иногда и от бессимптомных носителей из-за тесной связи между домашними животными и владельцами. 9).
9).
Несмотря на то, что ряд стран в мире свободны от болезни или добились успеха в искоренении болезни путем строгого соблюдения стратегии профилактики и контроля и запрета на ввоз животных из стран, подверженных заболеванию, болезнь по-прежнему эндемична во многих странах. развивающихся странах, включая Индию, несмотря на наличие ряда сильнодействующих и эффективных иммунопрофилактических средств (13). Причины могут быть связаны с невозможностью провести иммунизацию всех восприимчивых животных, отсутствием ограничений на передвижение животных, частым распространением вируса от диких животных, использованием нервной ткани или низкокачественной вакциной, неправильной иммунизацией, несоблюдением холодовая цепь, наличие материнских антител и наличие родственных вирусов бешенства (19, 20).
Хотя вакцина из нервной ткани использовалась как у животных, так и у людей против бешенства, производство этих вакцин было прекращено, поскольку у некоторых людей она вызывает нервно-паралитические осложнения (21). Вакцины против бешенства на основе клеточных культур уже давно доступны с повышенным уровнем активности и безопасности. Однако его использование было исключено из-за высокой стоимости и ограниченной доступности. Эти вакцины более высокого качества и практически не вызывают побочных эффектов (6, 22).Аттенуированные вирусные вакцины эффективно вызывают защитный иммунный ответ и широко использовались в прошлом для иммунизации домашних животных. Тем не менее, все они все еще обладали некоторой остаточной патогенностью, вызывая вызываемое вакциной бешенство у некоторых видов, особенно у кошек.
Вакцины против бешенства на основе клеточных культур уже давно доступны с повышенным уровнем активности и безопасности. Однако его использование было исключено из-за высокой стоимости и ограниченной доступности. Эти вакцины более высокого качества и практически не вызывают побочных эффектов (6, 22).Аттенуированные вирусные вакцины эффективно вызывают защитный иммунный ответ и широко использовались в прошлом для иммунизации домашних животных. Тем не менее, все они все еще обладали некоторой остаточной патогенностью, вызывая вызываемое вакциной бешенство у некоторых видов, особенно у кошек.
Вакцины против бешенства нового поколения, полученные в результате манипуляций с генами, разработанные в последние годы, показали многообещающие и обнадеживающие результаты и вызвали защитный иммунный ответ у мышей, и в ближайшем будущем они могут стать лучшей вакциной-кандидатом для надлежащего лечения и контроля бешенства у людей и животных.
Этиология
Бешенство вызывается рядом различных штаммов крупной пулевидной формы с одним концом закругленным или коническим, а другим плоским или вогнутым; одноцепочечные отрицательный смысл РНК-вирусы рода Lyssavirus семейства Rhabdoviridae . Геном РНК вируса бешенства кодирует 5 белков: гликопротеин G является основным структурным компонентом поверхностных шипов, встроенных в оболочку вируса, и связан с меньшим белком М.Оболочка, полученная из клетки-хозяина, окружена инфекционным вирусным ядром из нуклеокапсидных (N) белков, инкапсулируя, таким образом, вирусный геном и РНК-полимеразы. Белок NS связан с нуклеокапсидом (23–25).
Геном РНК вируса бешенства кодирует 5 белков: гликопротеин G является основным структурным компонентом поверхностных шипов, встроенных в оболочку вируса, и связан с меньшим белком М.Оболочка, полученная из клетки-хозяина, окружена инфекционным вирусным ядром из нуклеокапсидных (N) белков, инкапсулируя, таким образом, вирусный геном и РНК-полимеразы. Белок NS связан с нуклеокапсидом (23–25).
После открытия родственных вирусов бешенства перекрестная реактивность внутренних антигенов (рибонуклеопротеиновый комплекс) была использована для идентификации новых вирусов рода Lyssavirus в семействе Rhabdoviridae . Вируснейтрализующие антитела (VNAb), которые распознают мембранный гликопротеин (G) или MAbs, подразделяют род на шесть серотипов, тогда как последовательности вирусного нуклеопротеинового гена (N) определяют 7 генотипов (26, 27).Генетическое разнообразие представителей рода Lyssavirus ( вирусов бешенства и родственных вирусов бешенства ) с использованием последовательности гена, кодирующего трансмембранный гликопротеин, выявило две основные филогруппы. Филогруппа I включает всемирный серотип 1 [классический вирус бешенства и лиссавирус австралийских летучих мышей ( ABL )] (28, 29), серотип 4 ( вирус Дювенхажа ), серотип 5 [ европейский лиссавирус летучих мышей19 0 ( EBL-1 )] и серотип 6 [ European Bat Lyssavirus 2 ( EBL-2 )] (30, 31).Филогруппа II включает расходящиеся африканские серотип 2 ( вирус летучих мышей Лагос ) и серотип 3 ( вирус Мокола ) (32).
Филогруппа I включает всемирный серотип 1 [классический вирус бешенства и лиссавирус австралийских летучих мышей ( ABL )] (28, 29), серотип 4 ( вирус Дювенхажа ), серотип 5 [ европейский лиссавирус летучих мышей19 0 ( EBL-1 )] и серотип 6 [ European Bat Lyssavirus 2 ( EBL-2 )] (30, 31).Филогруппа II включает расходящиеся африканские серотип 2 ( вирус летучих мышей Лагос ) и серотип 3 ( вирус Мокола ) (32).
Молекулярная эпидемиология изолятов вируса бешенства из Индии показала их принадлежность к генотипу 1, что указывает на отсутствие вирусов бешенства и родственных вирусов бешенства (RRV) у домашних животных, включая собак (33). Среди изолятов индийского вируса бешенства существовало сходство нуклеотидов >95%, даже несмотря на то, что они были из разных географических регионов и получены от разных хозяев, включая домашних животных и собак.В Индии вирус бешенства специфичен для региона, но не специфичен для хозяина (33).
Наличие ряда генотипов может иметь важное значение для производства вакцин. Вирус бешенства был далее сгруппирован в уличный вирус бешенства и фиксированный вирус бешенства . Уличный вирус бешенства происходит от того, что существует в природе в естественных случаях, а фиксированный вирус бешенства обозначает штаммы вируса, которые были адаптированы путем серийного внутримозгового пассажа у кроликов в лаборатории.В производстве вакцин используются фиксированные штаммы вируса бешенства . Фиксированный вирус бешенства вызывает паралитическую болезнь с относительно коротким инкубационным периодом после интрацеребральной инокуляции и отсутствием телец Негри и отсутствием вируса в слюне и слюнных железах (34).
Вирус бешенства стабилен при pH = 3,0 и pH = 11,0 и может выживать в течение многих лет при температуре -70 ° C или при лиофилизации и хранении при температуре от 0 до 4 ° C . Он быстро инактивируется при высыхании, воздействии УФ и рентгеновских лучей, солнечного света, трипсина, β-роприолактона, эфира и детергентов. Соединение четвертичного аммония (1:5000), 45-70% спирт, 1% мыло, 5-7% раствор йода убивает вирус бешенства в течение одной минут (35).
Он быстро инактивируется при высыхании, воздействии УФ и рентгеновских лучей, солнечного света, трипсина, β-роприолактона, эфира и детергентов. Соединение четвертичного аммония (1:5000), 45-70% спирт, 1% мыло, 5-7% раствор йода убивает вирус бешенства в течение одной минут (35).
Вакцинация
Борьба с бешенством в значительной степени зависит от профилактики заражения собак и кошек путем вакцинации в эндемичных районах и контроля за их перемещением, включая меры карантина и вакцинации (36).Вакцинация является наиболее эффективным и экономичным способом борьбы с болезнью (37). Хотя основной угрозой для людей и домашних животных является классический вирус бешенства, также важно учитывать других представителей рода Lyssavirus , которые могут инфицировать животных (38). Обычные вакцины, используемые в настоящее время для вакцинации людей, домашних и свободно живущих животных, получены из вируса фиксированного типа генотипа 1 и серотипа 1. Эти вакцины обеспечивают превосходную защиту от классического вируса бешенства , но могут не обеспечивать хорошей защиты от серотипа 2, 3, 4 и 6 (5). Уровень защиты, определенный у мышей, которые выжили через 28 дней, по-видимому, зависит от штамма вируса, используемого в вакцине, т.е. Штамм Pasteur Virus ( PV ) или Pitman-Moore ( PM ) и генотип контрольного вируса. Как правило, антирабические вакцины на основе штаммов PM и LEP индуцировали более слабую защиту от EBLV-1 , чем штамм PV , и для EBLV-2 имеется мало данных.
(39).Как правило, уровень защиты обратно пропорционален генетической дистанции между новыми изолятами и используемым вакцинным штаммом (5).
Уровень защиты, определенный у мышей, которые выжили через 28 дней, по-видимому, зависит от штамма вируса, используемого в вакцине, т.е. Штамм Pasteur Virus ( PV ) или Pitman-Moore ( PM ) и генотип контрольного вируса. Как правило, антирабические вакцины на основе штаммов PM и LEP индуцировали более слабую защиту от EBLV-1 , чем штамм PV , и для EBLV-2 имеется мало данных.
(39).Как правило, уровень защиты обратно пропорционален генетической дистанции между новыми изолятами и используемым вакцинным штаммом (5).
Массовая вакцинация собак остается основной стратегией борьбы с городским бешенством в эндемичных районах. Чтобы избежать материнского иммунитета, вакцины лучше вводить, когда животное молодое, но не менее 3 месяцев в случае собак (35). Первичная вакцинация может быть однократной (живые аттенуированные вакцины) или двумя прививками с интервалом в 1 месяц.После этого вакцины вводятся ежегодно, раз в два года или три года для повышения их иммунитета в зависимости от эффективности вакцины (40). Комитет экспертов ВОЗ по борьбе с бешенством рекомендует как можно скорее заменить вакцины из нервной ткани вакцинами, приготовленными из клеточных культур. BHK21 — наиболее часто используемые перевиваемые клеточные линии для производства вакцин для животных (41).
Комитет экспертов ВОЗ по борьбе с бешенством рекомендует как можно скорее заменить вакцины из нервной ткани вакцинами, приготовленными из клеточных культур. BHK21 — наиболее часто используемые перевиваемые клеточные линии для производства вакцин для животных (41).
Вакцина против бешенства для животных
Вакцина против бешенства для животных первого поколения
В 1885 г. Луи Пастер продемонстрировал, что вирус бешенства может быть ослаблен путем последовательного интракраниального введения кроликам.6 th июля 1885 года первый человек был вылечен путем введения 13 последовательных и все более и более опасных доз высушенной суспензии спинного мозга бешеного животного, и мальчик Джозеф Мейстер выжил. Неочищенная вакцина Пастера была позже модифицирована Ферми и Семплем. В 1927 г. Первая международная конференция по бешенству рекомендовала, чтобы фиксированный вирус для вакцин против бешенства собак был полностью инактивирован или аттенуирован, чтобы он не вызывал заболевания у собак, вакцинированных S/C или I/M (19). В течение следующих нескольких десятилетий все вакцины против бешенства для нервной ткани инактивировались фенолом, описанным Semple (42). Вакцины для нервной ткани, используемые в настоящее время для кампании массовой вакцинации в Африке, Латинской Америке и Карибском бассейне, производятся из инфицированных вирусом бешенства мозгов мышей-сосунков или мозгов ягнят. Однако вакцины из нервной ткани для собак и других животных часто вызывали поствакцинальные нервные симптомы и смерть у некоторых вакцинированных животных (8).
В течение следующих нескольких десятилетий все вакцины против бешенства для нервной ткани инактивировались фенолом, описанным Semple (42). Вакцины для нервной ткани, используемые в настоящее время для кампании массовой вакцинации в Африке, Латинской Америке и Карибском бассейне, производятся из инфицированных вирусом бешенства мозгов мышей-сосунков или мозгов ягнят. Однако вакцины из нервной ткани для собак и других животных часто вызывали поствакцинальные нервные симптомы и смерть у некоторых вакцинированных животных (8).
Куриные яйца с эмбрионами использовали Копровски и Кокс для серийного пассирования штамма Flury.Вирус первоначально пассировали 136 раз на 1-дневных цыплятах с последующим пассированием в оплодотворенных куриных яйцах. В период от 40 го до 50 го пассажа куриного эмбриона вирус бешенства утратил свои висцеротропные свойства, но сохранил некоторые нейротропные свойства и получил название LEP. Его можно было безопасно использовать у собак, но иногда он вызывал бешенство у молодых щенков, кошек и крупного рогатого скота. LEP был дополнительно пассирован в куриных яйцах с эмбрионами для повышения безопасности Копровски и его коллегами, и на уровне пассажей 205 th было обнаружено, что он безопасен для внутримышечного использования у кошек, крупного рогатого скота, а также у щенков в возрасте 3 месяцев лет. (43).
LEP был дополнительно пассирован в куриных яйцах с эмбрионами для повышения безопасности Копровски и его коллегами, и на уровне пассажей 205 th было обнаружено, что он безопасен для внутримышечного использования у кошек, крупного рогатого скота, а также у щенков в возрасте 3 месяцев лет. (43).
Парентеральная модифицированная живая вирусная вакцина
Штаммы Flury и Kelev вируса бешенства использовали для получения вакцин модифицированного живого вируса куриного эмбриона ( MLV ). Штаммы Street Alabama Dufferin ( SAD ), адаптированные в клетках почек хомяков, и штаммы Evelyn Rokitnicki Abelseth ( ERA ), выращенные на клетках почек свиней, были использованы для получения модифицированной живой вакцины на основе культур тканей для парентерального введения животным против бешенства. .Эти вакцины используются у плотоядных, включая собак и кошек, в Азии, Африке и некоторых частях Европы (4, 44). Эти неадъювантные вакцины дешевы и используют небольшое количество вируса, но вызывают более длительный иммунитет и хороший клеточно-опосредованный иммунный ответ. Однако существует вероятность восстановления свойства вирулентности вакцинным вирусом при длительном использовании. Кроме того, вакцинный вирус может иметь остаточную патогенность по отношению к другим нецелевым видам животных (10).
Эти неадъювантные вакцины дешевы и используют небольшое количество вируса, но вызывают более длительный иммунитет и хороший клеточно-опосредованный иммунный ответ. Однако существует вероятность восстановления свойства вирулентности вакцинным вирусом при длительном использовании. Кроме того, вакцинный вирус может иметь остаточную патогенность по отношению к другим нецелевым видам животных (10).
Пероральная модифицированная живая вирусная вакцина
Вакцины Modified Live Virus ( MLV ) не рекомендуются для парентеральной иммунизации против бешенства у животных, поскольку заражение бешенством может произойти в результате вакцинного штамма.Было произведено несколько типов пероральных антирабических вакцин MLV для использования в качестве приманок для свободноживущих животных, которые служат переносчиками для поддержания и передачи болезни в дикой природе (45). Вакцины SAD B19 и SAD P5/88 получают путем нескольких пассажей клеточной культуры штамма SAD Berne , который представляет собой адаптированное к клеточной культуре производное штамма ERA , который широко использовался в Европе с 1977 года и в Канаде.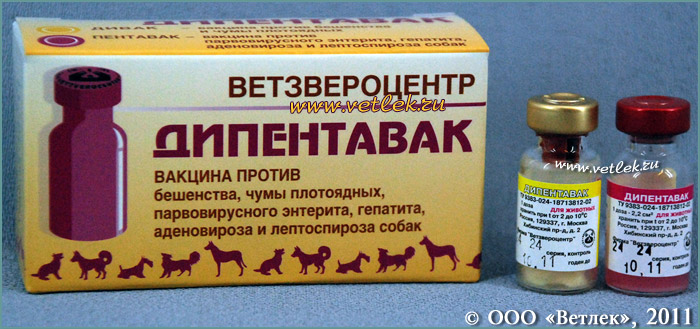 с 1989 года со значительным успехом (46).К сожалению, живые вирусные вакцины SAD содержали некоторую степень остаточной патогенности для диких грызунов и приводили к частичному нарушению иммунного ответа у лисят младше 8 лет недель лет, рожденных от вакцинированных лисиц штаммом SAD , что приводило к недостаточной защите от бешенства (47). ). Штамм SAD , используемый в вакцине, был заменен штаммами SAG-1 и SAG2 ( SAD авирулентный Gif ) при разработке вакцин.Штамм SAG ( Street Alabama Gif ) 2 был выбран из штамма SAD Berne . SAG-2 , штамм выбора, является двойным мутантным и авирулентным после инокуляции I/C иммунокомпетентных мышей и защищает мышей от заражения CVS (48). Никаких побочных эффектов после перорального введения 10-кратной полевой дозы SAG2 не было зарегистрировано у целевых видов (рыжая лисица, собака, енотовидная собака и песец) или у нецелевых видов, включая бабуинов, различные виды грызунов, два вида оленьи, кабаны, барсуки, козы, хорьки, ежи, а также дневные и ночные птицы (49).
с 1989 года со значительным успехом (46).К сожалению, живые вирусные вакцины SAD содержали некоторую степень остаточной патогенности для диких грызунов и приводили к частичному нарушению иммунного ответа у лисят младше 8 лет недель лет, рожденных от вакцинированных лисиц штаммом SAD , что приводило к недостаточной защите от бешенства (47). ). Штамм SAD , используемый в вакцине, был заменен штаммами SAG-1 и SAG2 ( SAD авирулентный Gif ) при разработке вакцин.Штамм SAG ( Street Alabama Gif ) 2 был выбран из штамма SAD Berne . SAG-2 , штамм выбора, является двойным мутантным и авирулентным после инокуляции I/C иммунокомпетентных мышей и защищает мышей от заражения CVS (48). Никаких побочных эффектов после перорального введения 10-кратной полевой дозы SAG2 не было зарегистрировано у целевых видов (рыжая лисица, собака, енотовидная собака и песец) или у нецелевых видов, включая бабуинов, различные виды грызунов, два вида оленьи, кабаны, барсуки, козы, хорьки, ежи, а также дневные и ночные птицы (49). Рыжие лисицы, енотовидные собаки и собаки были защищены от вирулентного заражения после иммунизации одной приманкой SAG2 . Выделения со слюной инфекционного вируса SAG2 штамма у собак после вакцинации не обнаружено. В приманке SAG2 содержится либо в капсуле в виде вирусной суспензии, либо в матрице приманки в виде лиофилизированной суспензии. Штамм вируса бешенства SAG2 , упакованный в приманку для куриных голов, также успешно защитил африканских диких собак, содержащихся в неволе, от заражения вирусом бешенства (49, 50).
Рыжие лисицы, енотовидные собаки и собаки были защищены от вирулентного заражения после иммунизации одной приманкой SAG2 . Выделения со слюной инфекционного вируса SAG2 штамма у собак после вакцинации не обнаружено. В приманке SAG2 содержится либо в капсуле в виде вирусной суспензии, либо в матрице приманки в виде лиофилизированной суспензии. Штамм вируса бешенства SAG2 , упакованный в приманку для куриных голов, также успешно защитил африканских диких собак, содержащихся в неволе, от заражения вирусом бешенства (49, 50).
Пероральная живая рекомбинантная векторная вакцина против бешенства вируса осповакцины
Рекомбинантный вектор вируса осповакцины, в котором ген G штамма Evelyn-Rokitniki-Abelseth (ERA) вируса бешенства был вставлен в тимидинкиназную область осповакцины Геном вируса был разработан для иммунизации против бешенства (51). Рекомбинантный вирус гликопротеина коровьей оспы и бешенства (V-RG) индуцировал быструю реакцию вируснейтрализующих антител (VNA) у мышей, как при подкожной инокуляции, так и при пероральном введении, и животные были защищены от летального заражения вирусом бешенства (52). .Аналогично, другие вирусы оспы , включая ортопоксвирус енота и вирусы оспы птиц , такие как вирусы оспы кур и вирусы оспы канареек , были исследованы в качестве возможных альтернативных векторов для экспрессии антигенов вируса бешенства (53). В некоторых из этих исследований сообщается о роли нуклеопротеина (N) вируса бешенства в защитных клеточных иммунных реакциях в дополнение к белку G вируса бешенства в индукции ВНА.Рекомбинантный вирус коровьей оспы, экспрессирующий ген гликопротеина вируса бешенства (V-RG), был разработан путем вставки кДНК гена гликопротеина штамма ERA в ген тимидинкиназы штамма Copenhagen вируса коровьей оспы (54). ). При пероральном введении путем прямого закапывания в ротовую полость или в приманку доза 10 8 TCID 50 VRG вырабатывает вируснейтрализующие антитела и обеспечивает защитный иммунный ответ против заражения вирусом бешенства у ряда плотоядных видов ( рыжая лиса, песец, койот, енот, енотовидная собака, домашняя собака и золотой шакал) (55).
.Аналогично, другие вирусы оспы , включая ортопоксвирус енота и вирусы оспы птиц , такие как вирусы оспы кур и вирусы оспы канареек , были исследованы в качестве возможных альтернативных векторов для экспрессии антигенов вируса бешенства (53). В некоторых из этих исследований сообщается о роли нуклеопротеина (N) вируса бешенства в защитных клеточных иммунных реакциях в дополнение к белку G вируса бешенства в индукции ВНА.Рекомбинантный вирус коровьей оспы, экспрессирующий ген гликопротеина вируса бешенства (V-RG), был разработан путем вставки кДНК гена гликопротеина штамма ERA в ген тимидинкиназы штамма Copenhagen вируса коровьей оспы (54). ). При пероральном введении путем прямого закапывания в ротовую полость или в приманку доза 10 8 TCID 50 VRG вырабатывает вируснейтрализующие антитела и обеспечивает защитный иммунный ответ против заражения вирусом бешенства у ряда плотоядных видов ( рыжая лиса, песец, койот, енот, енотовидная собака, домашняя собака и золотой шакал) (55). В полевых условиях вакцинный штамм VRG стабилен при температуре выше 56°C, тогда как температура плавления контейнера-приманки составляет >60°C. Исследования безопасности, проведенные на более чем 50 видах млекопитающих и 10 видах птиц (большинство из которых являются переносчиками бешенства), не выявили какой-либо остаточной патогенности. Более 75 миллионов доз VRG было использовано для успешного контроля или снижения заболеваемости бешенством диких животных или собак среди различных видов животных, таких как рыжие лисы (Бельгия, Франция, Израиль, Люксембург и Украина), енотовидные собаки (Республика Корея), койоты. , енотов и серых лисиц (Канада и США) и домашних собак (Шри-Ланка) (43, 49, 54, 56, 57).Рекомбинантный вирус гликопротеина коровьей бешенства (V-RG) индуцировал быструю реакцию вируснейтрализующих антител (VNA) у мышей как при подкожной инокуляции, так и при пероральном введении, и животные были защищены от летального заражения вирусом бешенства (52).
В полевых условиях вакцинный штамм VRG стабилен при температуре выше 56°C, тогда как температура плавления контейнера-приманки составляет >60°C. Исследования безопасности, проведенные на более чем 50 видах млекопитающих и 10 видах птиц (большинство из которых являются переносчиками бешенства), не выявили какой-либо остаточной патогенности. Более 75 миллионов доз VRG было использовано для успешного контроля или снижения заболеваемости бешенством диких животных или собак среди различных видов животных, таких как рыжие лисы (Бельгия, Франция, Израиль, Люксембург и Украина), енотовидные собаки (Республика Корея), койоты. , енотов и серых лисиц (Канада и США) и домашних собак (Шри-Ланка) (43, 49, 54, 56, 57).Рекомбинантный вирус гликопротеина коровьей бешенства (V-RG) индуцировал быструю реакцию вируснейтрализующих антител (VNA) у мышей как при подкожной инокуляции, так и при пероральном введении, и животные были защищены от летального заражения вирусом бешенства (52). Аналогично, другие поксвирусы , в том числе ортопоксвирус енота и вирусы птичьей оспы , такие как вирусы оспы кур и вирусы оспы канареек , были исследованы в качестве возможных альтернативных векторов для экспрессии вирусов бешенства0 90 ( 53).Вакцина соответствовала всем критериям, таким как легкость принятия целевыми видами, отсутствие вируса бешенства , термостабильность и обеспечение защиты от бешенства, но отсутствие риска развития бешенства при проглатывании и безопасность при контакте с людьми. Вакцина использовалась в США и Франции для иммунизации енотов, койотов, диких собак, лисиц, шакалов и т. д. с большим успехом, и к 1995 г. вакцина была условно лицензирована в США для использования в программах пероральной вакцинации против бешенства (ОРВ) (43, 49, 58). Вакцину можно вводить в виде рыбной муки или приманки на основе птицы, которая содержит 150 мг тетрациклина гидрохлорида в качестве костного биомаркера, и в пластиковом пакетике, содержащем 1.
Аналогично, другие поксвирусы , в том числе ортопоксвирус енота и вирусы птичьей оспы , такие как вирусы оспы кур и вирусы оспы канареек , были исследованы в качестве возможных альтернативных векторов для экспрессии вирусов бешенства0 90 ( 53).Вакцина соответствовала всем критериям, таким как легкость принятия целевыми видами, отсутствие вируса бешенства , термостабильность и обеспечение защиты от бешенства, но отсутствие риска развития бешенства при проглатывании и безопасность при контакте с людьми. Вакцина использовалась в США и Франции для иммунизации енотов, койотов, диких собак, лисиц, шакалов и т. д. с большим успехом, и к 1995 г. вакцина была условно лицензирована в США для использования в программах пероральной вакцинации против бешенства (ОРВ) (43, 49, 58). Вакцину можно вводить в виде рыбной муки или приманки на основе птицы, которая содержит 150 мг тетрациклина гидрохлорида в качестве костного биомаркера, и в пластиковом пакетике, содержащем 1. 8 мл вакцины. Идея о том, что живой рекомбинантный вирусный вектор может удовлетворить требования вакцины против бешенства для следующего поколения, быстро завоевала доверие (59, 60).
8 мл вакцины. Идея о том, что живой рекомбинантный вирусный вектор может удовлетворить требования вакцины против бешенства для следующего поколения, быстро завоевала доверие (59, 60).
Парентеральная живая рекомбинантная векторная вакцина против оспы/аденовируса
Рекомбинантная вакцина против бешенства против оспы канареек была разработана и оказалась эффективной, как и другие рекомбинантные белки поксвируса против бешенства. Живой вирус оспы канареек , экспрессирующий гликопротеин вируса бешенства , был лицензирован в США в качестве парентеральной моновалентной вакцины для кошек и в качестве комбинированной вакцины против бешенства для кошек с вирусом панлейкопении кошек , парвовирусом кошек , калицивирусом кошек . вакцины, входящие в состав продукта (51).Было показано, что рекомбинантная аденовирусная векторная вакцина, экспрессирующая гликопротеин вируса бешенства , способна индуцировать ответ антител у борзых собак, иммунизированных S/C или I/M. Эта вакцина перспективна как вакцина против вируса бешенства для собак (61, 62).
Эта вакцина перспективна как вакцина против вируса бешенства для собак (61, 62).
Парентеральная инактивированная клеточная культуральная вакцина
Для приготовления инактивированных вакцин штамм вируса бешенства ( CVS, PM или PV ) выращивают в фибробластах куриных эмбрионов, клетках BHK-21 или Vero (63, 64).У новорожденных мышей отсутствует белок миелин, который иногда вызывает аллергические реакции у животных, ранее вакцинированных убитыми вакцинами из ткани головного мозга овцы. С другой стороны, вакцины против бешенства на основе культур тканей менее аллергенны, но более иммуногенны (57). Хотя для инактивации вируса бешенства использовался ряд инактивирующих агентов, а именно фенол, HCHO, ультрафиолетовый свет, AEI или другие амины, чаще всего используется BPL. После инактивации для улучшения иммуногенности вакцины используют адъюванты, а именно Al(OH) 3 , AlPO 4 , сапонин (вакцины для крупного рогатого скота) и редко масляный адъювант (42). Вакцина против бешенства также доступна вместе с собачьей чумой, собачьим аденовирусом , кошачьим парвовирусом и кошачьим калицивирусом для использования у кошек или ящуром для использования у крупного рогатого скота, овец и коз (10).
Вакцина против бешенства также доступна вместе с собачьей чумой, собачьим аденовирусом , кошачьим парвовирусом и кошачьим калицивирусом для использования у кошек или ящуром для использования у крупного рогатого скота, овец и коз (10).
Поствакцинальные осложнения
Из-за более высокой антигенной массы и использования адъювантов инактивированные вакцины иногда могут вызывать местные и системные реакции. Наиболее частыми симптомами являются болезненность, хромота, регионарная лимфаденопатия в инъецированной конечности, очаговый васкулит, гранулемы и саркомы.Однако векторные рекомбинантные вакцины нового поколения вызывают меньше аллергических или неопластических реакций (21, 65).
Требования к эффективности для вакцин для животных
Активность инактивированных вакцин против бешенства для животных должна составлять 1,0 МЕ/доза по результатам испытаний, проведенных Национальным институтом здравоохранения (NIH) или другими признанными фармакопеями (66). Тест на эффективность вакцины против бешенства NIH используется во всем мире для оценки эффективности инактивированной вакцины против бешенства, который проводится in vivo .В тесте NIH эффективность вакцины против бешенства сравнивается с международной эталонной вакциной при тестировании в группах не менее десяти швейцарских мышей-альбиносов в возрасте 3–4 недель , привитых двумя дозами с интервалом в одну неделю. Инокулируют различные 5-кратные разведения обеих вакцин и сравнивают их для определения разведения, при котором 50% мышей защищены от внутримозгового заражения через 14 дней. Доза заражения должна быть в диапазоне 12–50 внутричерепных LD 50 мыши (MIC LD 50 ) в 0.03 мл суспензии. PD 50 и МЕ рассчитывают в тестируемой вакцине путем наблюдения и сравнения уровня защиты эталонной вакцины. Продолжительность иммунитета должна быть не менее 1 года.
(66).
Тест на эффективность вакцины против бешенства NIH используется во всем мире для оценки эффективности инактивированной вакцины против бешенства, который проводится in vivo .В тесте NIH эффективность вакцины против бешенства сравнивается с международной эталонной вакциной при тестировании в группах не менее десяти швейцарских мышей-альбиносов в возрасте 3–4 недель , привитых двумя дозами с интервалом в одну неделю. Инокулируют различные 5-кратные разведения обеих вакцин и сравнивают их для определения разведения, при котором 50% мышей защищены от внутримозгового заражения через 14 дней. Доза заражения должна быть в диапазоне 12–50 внутричерепных LD 50 мыши (MIC LD 50 ) в 0.03 мл суспензии. PD 50 и МЕ рассчитывают в тестируемой вакцине путем наблюдения и сравнения уровня защиты эталонной вакцины. Продолжительность иммунитета должна быть не менее 1 года.
(66).
Вакцина против бешенства для человека
Вакцина для нервной ткани
Производство вакцины против бешенства резко изменилось со времен Пастера, который производил и лечил пациента с помощью серийных инъекций все более вирулентного вируса бешенства, инфицированных нервных тканей путем высушивания через различные промежутки времени. В 1900-х годах Ферми и Семпл использовали фенол для инактивации вируса бешенства в нервной ткани и использовали одну и ту же суспензию для всех инъекций. Однако использование вакцин Ферми было прекращено из-за наличия остаточного живого фиксированного вируса бешенства . Вакцина для нервной ткани (Semple), которая в настоящее время производится и применяется в Африке, Азии и Латинской Америке, включает вакцины, полученные из вируса бешенства, инфицированного мозговой тканью овец, коз и мышей (67).Хотя производство вакцины Semple было недавно прекращено в Индии, она по-прежнему производится и используется в некоторых странах Азии и Африки, несмотря на то, что доступны более безопасные и эффективные вакцины на основе клеточных культур (7, 9).
В 1900-х годах Ферми и Семпл использовали фенол для инактивации вируса бешенства в нервной ткани и использовали одну и ту же суспензию для всех инъекций. Однако использование вакцин Ферми было прекращено из-за наличия остаточного живого фиксированного вируса бешенства . Вакцина для нервной ткани (Semple), которая в настоящее время производится и применяется в Африке, Азии и Латинской Америке, включает вакцины, полученные из вируса бешенства, инфицированного мозговой тканью овец, коз и мышей (67).Хотя производство вакцины Semple было недавно прекращено в Индии, она по-прежнему производится и используется в некоторых странах Азии и Африки, несмотря на то, что доступны более безопасные и эффективные вакцины на основе клеточных культур (7, 9).
Из-за поствакцинальных реакций, связанных с вакциной Semple против бешенства, возникла потребность в более безопасной и эффективной антирабической вакцине для защиты людей от бешенства. Следующей разработкой вакцины против бешенства была вакцина, полученная из мышей-сосунков, обладающая меньшими реактогенными свойствами и широко используемая в 1950-х годах в странах Латинской Америки (19, 68). Вакцина для головного мозга грудных мышей менее аллергенна, поскольку ткань мозга не миелинизирована и производится из фиксированных штаммов вируса бешенства , первоначально выделенных в Чили (штаммы 51 и 91 собачьего и человеческого происхождения, соответственно) (69). Мышам не старше 1 90 189 дней 90 190 интрацеребрально вводят и мозговую ткань собирают приблизительно через 4 90 189 дней 90 190. Ткань головного мозга, инфицированную вирусом бешенства , разбавляют до 10% суспензии и инактивируют УФ-светом или BPL.Вакцина имеет конечную активность 1,3 МЕ/доза . Вакцина поставляется в 1-2 флаконах по мл со сроком годности 1 год при температуре 4° С (70). Побочные реакции, связанные с вакциной против бешенства у грудных мышей, меньше (1:8000), чем у вакцин Семпла против бешенства (от 1:142 до 1:7000), но уровень летальности у пораженных пациентов выше (22% для вакцины против мозга мышей-сосунов и 4,8%). % для вакцин Semple) (21).
Вакцина для головного мозга грудных мышей менее аллергенна, поскольку ткань мозга не миелинизирована и производится из фиксированных штаммов вируса бешенства , первоначально выделенных в Чили (штаммы 51 и 91 собачьего и человеческого происхождения, соответственно) (69). Мышам не старше 1 90 189 дней 90 190 интрацеребрально вводят и мозговую ткань собирают приблизительно через 4 90 189 дней 90 190. Ткань головного мозга, инфицированную вирусом бешенства , разбавляют до 10% суспензии и инактивируют УФ-светом или BPL.Вакцина имеет конечную активность 1,3 МЕ/доза . Вакцина поставляется в 1-2 флаконах по мл со сроком годности 1 год при температуре 4° С (70). Побочные реакции, связанные с вакциной против бешенства у грудных мышей, меньше (1:8000), чем у вакцин Семпла против бешенства (от 1:142 до 1:7000), но уровень летальности у пораженных пациентов выше (22% для вакцины против мозга мышей-сосунов и 4,8%). % для вакцин Semple) (21). ВОЗ рекомендовала прекратить производство всех вакцин для нервной ткани и заменить их антирабической вакциной на основе клеточных культур.
ВОЗ рекомендовала прекратить производство всех вакцин для нервной ткани и заменить их антирабической вакциной на основе клеточных культур.
Вакцины на основе клеточных культур
Первой вакциной против бешенства на культурах ненервных тканей, которая стала доступной в Северной Америке, была Duck Embryo Vaccine (DEV).
В 1978 году в США вакцина была заменена первой современной вакциной против бешенства на культуре клеток, вакциной из штамма диплоидных клеток человека (HDCV). HDCV был безопасен благодаря высокой иммуногенности и незначительным аллергическим реакциям по сравнению с предыдущими вакцинами (71). Кроме того, две другие вакцины на основе клеточных культур, а именно вакцина против бешенства на основе очищенной культуры клеток Vero (PVRV) и вакцина на основе очищенных клеток куриного эмбриона (PCECV), были разработаны почти одновременно и стали доступны по всему миру международными фармацевтическими компаниями (18).
В настоящее время PVRV и PCECV являются наиболее широко используемыми вакцинами на основе клеточных культур у миллионов пациентов во всем мире. Более очищенная версия клеточной вакцины Vero, известная как хроматографически очищенная клеточная вакцина против бешенства Vero, прошла клинические испытания в США и нескольких азиатских странах, но не продается ни в одной стране (72).
Более очищенная версия клеточной вакцины Vero, известная как хроматографически очищенная клеточная вакцина против бешенства Vero, прошла клинические испытания в США и нескольких азиатских странах, но не продается ни в одной стране (72).
Существует множество различных типов клеточных субстратов, а именно первичные клеточные, диплоидные клеточные и непрерывные клеточные культуры, используемые для производства антирабической вакцины на клеточных культурах.В Китае и бывшем СССР первичные клетки почек детенышей хомячков используются для производства вакцины против бешенства (41). Эмбрионированные яйца представляют собой субстрат для первичной клеточной культуры, используемый для производства 3 различных типов вакцин против бешенства в Европе, Японии и Индии. Вакцины против бешенства также могут быть получены из штаммов диплоидных клеток человека (WI-38 и MRC-5). Вакцины против бешенства, полученные из клеточной линии Vero, доступны в Азии, Европе и Латинской Америке (73).
Первая широко используемая вакцина против бешенства на культуре клеток была разработана на клеточной линии диплоидных фибробластов легких плода человека WI-38 с использованием штамма Pitman Moore вируса бешенства Виктором и его сотрудниками из Института Вистар в Филадельфии. Диплоидные клетки человека имеют более высокую, но конечную продолжительность жизни, чем первичные клетки, тогда как непрерывные клеточные линии обладают способностью размножаться бесконечно in vitro (71). Клетки, используемые для получения вакцины из перевиваемых клеточных линий, могут отличаться по кариотипу от исходной клеточной линии и могут быть получены из здоровых или опухолевых тканей. Центр оценки и исследований биологических препаратов (CBER) FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) в США разработал руководство для производителей, использующих непрерывную клеточную линию, в котором упоминается, что Vero должен содержать менее или равно 10 нг клеточной ДНК на дозу для парентерального введения. введенная вакцина (63, 73).
Диплоидные клетки человека имеют более высокую, но конечную продолжительность жизни, чем первичные клетки, тогда как непрерывные клеточные линии обладают способностью размножаться бесконечно in vitro (71). Клетки, используемые для получения вакцины из перевиваемых клеточных линий, могут отличаться по кариотипу от исходной клеточной линии и могут быть получены из здоровых или опухолевых тканей. Центр оценки и исследований биологических препаратов (CBER) FDA (Управление по санитарному надзору за качеством пищевых продуктов и медикаментов) в США разработал руководство для производителей, использующих непрерывную клеточную линию, в котором упоминается, что Vero должен содержать менее или равно 10 нг клеточной ДНК на дозу для парентерального введения. введенная вакцина (63, 73).
HDCV была первой вакциной против бешенства, разработанной на клеточной культуре, и эта вакцина резко изменила представление о профилактике бешенства среди людей и концепцию вакцинации против бешенства.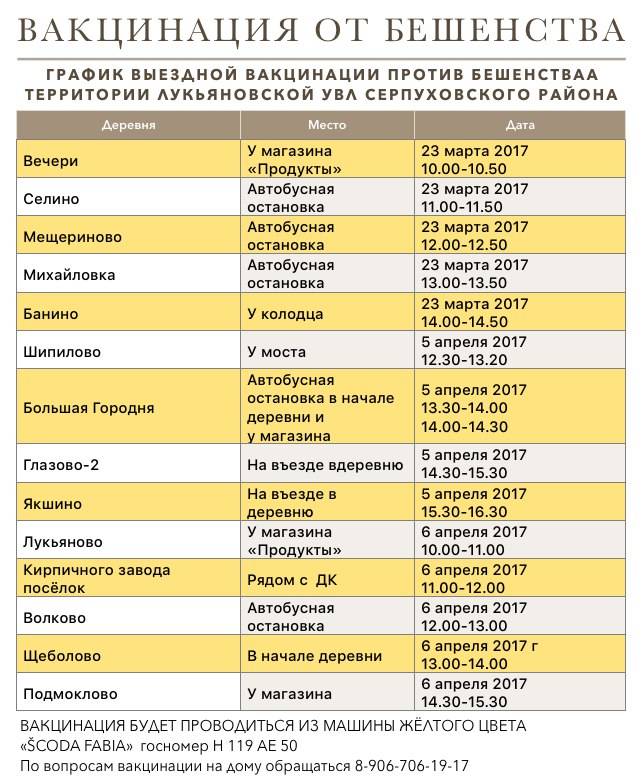 Эта вакцина представляла собой безопасное и иммуногенное средство защиты от бешенства как до, так и после заражения. Людям с постоянным риском заражения бешенством рекомендуется делать ревакцинацию каждые 2 года. Хотя HDCS дает высокие серологические титры, выход вируса низкий. Опять же, из-за высокой стоимости производства эта вакцина недоступна для людей в большинстве развивающихся стран мира, где происходит более 90% случаев смерти людей (71, 72).
Эта вакцина представляла собой безопасное и иммуногенное средство защиты от бешенства как до, так и после заражения. Людям с постоянным риском заражения бешенством рекомендуется делать ревакцинацию каждые 2 года. Хотя HDCS дает высокие серологические титры, выход вируса низкий. Опять же, из-за высокой стоимости производства эта вакцина недоступна для людей в большинстве развивающихся стран мира, где происходит более 90% случаев смерти людей (71, 72).
Чтобы преодолеть высокую стоимость HDCV и сделать вакцину против бешенства более доступной для обычных людей, были разработаны другие вакцины против бешенства на основе клеточных культур, которые менее дороги в производстве и вызывают меньше побочных реакций. Эти вакцины представляют собой PCECV, разработанные Бартом и его сотрудниками с использованием штамма Flury LEP вируса бешенства , размноженного в первичных куриных фибробластах. Вирус инактивируется с помощью BPL и очищается зональным центрифугированием (74). Производство PCECV на фибробластах куриных эмбрионов позволяет получить высокий выход вируса по сравнению с диплоидными клетками человека.
Производство PCECV на фибробластах куриных эмбрионов позволяет получить высокий выход вируса по сравнению с диплоидными клетками человека.
Эта вакцинная технология была перенесена из Марбурга, Германия, в Анклешвар, Индия, в конце 1980-х годов, и стоимость производства была существенно снижена при сохранении производственного стандарта, рекомендованного ВОЗ. Недавно из Швейцарии в Индию была осуществлена еще одна передача очищенной вакцины из клеток утиных эмбрионов (11). PVRV представляет собой вакцину против бешенства второго поколения, которая производится на клетках Vero (происхождение верветок). PVRV культивируется на микроносителях в крупномасштабных биоферментаторах, что снижает стоимость производства по сравнению с HDCV, который производится на монослойной клеточной культуре.PVRV, инактивированный BPL и концентрированный ультрацентрифугированием, широко используется во всем мире, включая Европу и Латинскую Америку, но не лицензирован для использования в Северной Америке (18, 75).
Производственный стандарт
Вакцины против бешенства на основе клеточных культур и яичных эмбрионов имеют более высокое качество по сравнению с вакцинами из нервной ткани взрослых и молодых животных с точки зрения как безопасности, так и эффективности и спасли жизни миллионов людей, пострадавших от укусов животных (ВОЗ , 2001).ВОЗ рекомендует, чтобы все вакцины против бешенства на клеточных культурах содержали не менее 2,5 МЕ / дозы для внутримышечного введения (в/м) для введения людям. Вакцины инактивированы с помощью BPL и прошли испытания на безопасность, стерильность, активность и стабильность. Вакцины очень эффективны при использовании против бешенства как до, так и после контакта (72).
Внутрикожное введение
В настоящее время не существует вакцины против бешенства на клеточной культуре, расфасованной для внутрикожного введения до или после контакта с вакциной.Имеющиеся в настоящее время вакцины против бешенства на основе клеточных культур, предназначенные для внутримышечного введения, не содержат консервантов, и риск заражения увеличивается, если они используются в виде «многоразового» флакона, как в случае внутрикожного введения.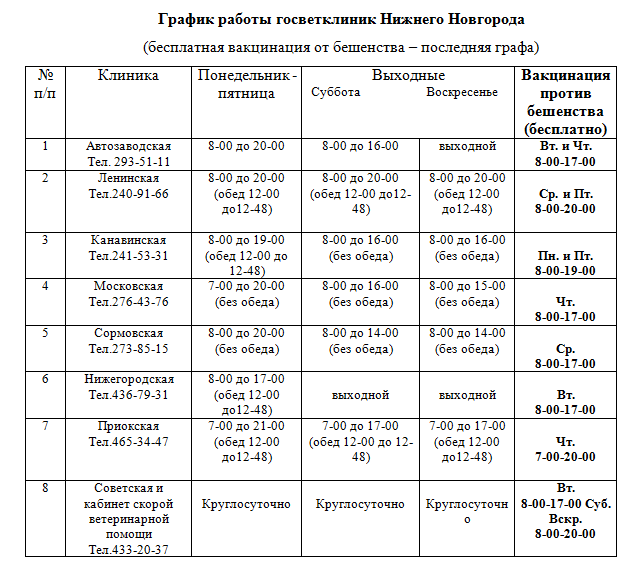 ВОЗ рекомендует, чтобы при внутрикожном введении антирабических вакцин (I/D) их хранили при температуре 2–8° C и использовали в течение 6–8 часов (17). В Северной Америке внутрикожное введение вакцины против бешенства иногда используется в качестве доконтактной иммунизации, но никогда не применялось для вакцинации после контакта.Однако внутривенное введение вакцин против бешенства широко использовалось в течение последних двух десятилетий в Азии для постконтактной вакцинации и в Европе для предэкспозиционной вакцинации. В настоящее время ВОЗ рекомендует только три вакцины (HDCS, PCECV и PVRV) для постконтактной профилактики I/D (18, 63). Хотя ВОЗ рекомендует эффективность 2,5 МЕ/человеческая доза для внутримышечного введения вакцин против бешенства, не существует аналогичных конкретных требований к эффективности для I/D дозы антирабических вакцин на основе клеточных культур.Ту же самую вакцину, предназначенную для в/м, можно безопасно вводить в дозе 0,1 мл в/д из флакона PCECV на 1 мл , содержащего 2,5 МЕ/мл .
ВОЗ рекомендует, чтобы при внутрикожном введении антирабических вакцин (I/D) их хранили при температуре 2–8° C и использовали в течение 6–8 часов (17). В Северной Америке внутрикожное введение вакцины против бешенства иногда используется в качестве доконтактной иммунизации, но никогда не применялось для вакцинации после контакта.Однако внутривенное введение вакцин против бешенства широко использовалось в течение последних двух десятилетий в Азии для постконтактной вакцинации и в Европе для предэкспозиционной вакцинации. В настоящее время ВОЗ рекомендует только три вакцины (HDCS, PCECV и PVRV) для постконтактной профилактики I/D (18, 63). Хотя ВОЗ рекомендует эффективность 2,5 МЕ/человеческая доза для внутримышечного введения вакцин против бешенства, не существует аналогичных конкретных требований к эффективности для I/D дозы антирабических вакцин на основе клеточных культур.Ту же самую вакцину, предназначенную для в/м, можно безопасно вводить в дозе 0,1 мл в/д из флакона PCECV на 1 мл , содержащего 2,5 МЕ/мл . Все вакцины дали хороший ответ с приемлемым титром к 14-му дню. Нет необходимости повышать требования к эффективности для внутривенного введения антирабической вакцины на основе клеточной культуры (64, 76, 77).
Все вакцины дали хороший ответ с приемлемым титром к 14-му дню. Нет необходимости повышать требования к эффективности для внутривенного введения антирабической вакцины на основе клеточной культуры (64, 76, 77).
Стандартный (Essen) пятидозовый в/м режим для ПЭТ недоступен в развивающихся странах. Таким образом, с 1997 г. ВОЗ рекомендовала к использованию две экономичные схемы ИД ПЭТ: схему с восемью и двумя точками.Схема восьми мест используется для PCECV и HDCV (1,0 мл / ампула) и состоит из восьми доз примерно 0,1 мл I/D в день 0 (с использованием целой ампулы) на руках, бедрах, надлопаточной и нижней области живота; четыре дозы I/D на 7-й день на руки и бедра и одну дозу на 28-й и 91-й дни также на дельтовидную мышцу. Требуется четыре визита в клинику () (64, 77).
Подробная информация о схеме постконтактной внутрикожной вакцинации против бешенства в восьми местах (PCECV и HDCS)
Схема в двух местах состоит из двух I/D доз 02 мл в день 0, 3, 7 и одна доза 0,2 мл в/д в день 28 и 91 для PCEV и HDCV, тогда как в случае PVRV доза составляет 0,1 мл в каждом случае () (76 ). Требуется 5 посещений клиник. Ампулы с вакцинами используются совместно каждый раз, в то время как совместное использование необходимо при трех из четырех посещений при схеме восьми мест. Сравнение этих схем I/D показывает, что метод с восемью сайтами индуцирует значительно более высокие уровни антител, чем режим с двумя сайтами, с 7-го дня до 1 года.Для двух схем используется одинаковое количество антигена, всего менее двух ампул (64).
Требуется 5 посещений клиник. Ампулы с вакцинами используются совместно каждый раз, в то время как совместное использование необходимо при трех из четырех посещений при схеме восьми мест. Сравнение этих схем I/D показывает, что метод с восемью сайтами индуцирует значительно более высокие уровни антител, чем режим с двумя сайтами, с 7-го дня до 1 года.Для двух схем используется одинаковое количество антигена, всего менее двух ампул (64).
Детали двухместной внутрикожной постконтактной вакцинации против бешенства (PCECV и HDCV)
Гликопротеин вируса бешенства как иммуногенная субъединица
для практических целей, чтобы быть довольно футуристическим восприятием предельной безопасности (т.е. бесгеномные) противовирусные вакцины. Твердо установлено, что белок вируса бешенства G образует шиповидные выступы на внешней поверхности мембраны вируса и является основным антигеном, ответственным за индукцию антител к ВН и за создание иммунитета против летальной инфекции вирусом бешенства . (78). Розеточные структуры G-белка (препарат гемагглютинина), состоящие исключительно из полипептидных цепей G-белка, полностью защищали от летального заражения вирусом бешенства у мышей.Доконтактные защитные и антигенные свойства этого препарата гемагглютинина были такими же, как у инактивированной вирусной вакцины, и, по крайней мере, в десять раз выше, чем у мономерной формы G-белка, приготовленной с использованием Triton X-100 (78).
(78). Розеточные структуры G-белка (препарат гемагглютинина), состоящие исключительно из полипептидных цепей G-белка, полностью защищали от летального заражения вирусом бешенства у мышей.Доконтактные защитные и антигенные свойства этого препарата гемагглютинина были такими же, как у инактивированной вирусной вакцины, и, по крайней мере, в десять раз выше, чем у мономерной формы G-белка, приготовленной с использованием Triton X-100 (78).Рекомбинантные аденовирусные векторные вакцины
Ген G, кодирующий гликопротеин G вируса бешенства , был вставлен в неосновной для репликации локус E3 генома аденовируса человека серотипа 5 (AdHu5) и использован в качестве рекомбинантного 90 векторная вакцина аденовируса .Локус гена E3 был делетирован для снижения экспрессии антигенов главного комплекса гистосовместимости и защиты инфицированных аденовирусом клеток от разрушения, опосредованного Т-клетками (79). Этот прототип вакцины, протестированный путем парентеральной или пероральной вакцинации на нескольких видах животных, включая мышей, собак, лисиц и скунсов, обеспечил защиту от заражения вирусом бешенства . Однако возможность репликации in vivo этого рекомбинантного аденовируса с делецией E3 и склонность вызывать случайное заболевание у вакцинированного хозяина поставили вопрос о его безопасности.Рекомбинантная аденовирусная векторная вакцина против бешенства (рекомбинантная Ad-RG) также способна индуцировать высокий уровень нейтрализующих антител против вируса бешенства (VNA) у собак, ранее иммунизированных обычными вакцинами против бешенства. Сообщалось, что уровень ВНА, индуцированный после бустерной иммунизации рекомбинантной Ad-RG, был выше, чем у обычных вакцин против бешенства, что свидетельствует о том, что рекомбинантная вакцина Ad-RG способна индуцировать сильный анамнестический ответ у собак (62). Кроме того, активность рекомбинантной вакцины Ad-RG не нарушалась ранее существовавшим иммунитетом при интраназальном или пероральном введении.В связи с растущим в настоящее время интересом к использованию аденовирусов для генной терапии, а также для вакцинации, дефектные по репликации векторные конструкции аденовируса были исследованы в качестве возможных вакцин следующего поколения против бешенства (61, 79, 80).
Однако возможность репликации in vivo этого рекомбинантного аденовируса с делецией E3 и склонность вызывать случайное заболевание у вакцинированного хозяина поставили вопрос о его безопасности.Рекомбинантная аденовирусная векторная вакцина против бешенства (рекомбинантная Ad-RG) также способна индуцировать высокий уровень нейтрализующих антител против вируса бешенства (VNA) у собак, ранее иммунизированных обычными вакцинами против бешенства. Сообщалось, что уровень ВНА, индуцированный после бустерной иммунизации рекомбинантной Ad-RG, был выше, чем у обычных вакцин против бешенства, что свидетельствует о том, что рекомбинантная вакцина Ad-RG способна индуцировать сильный анамнестический ответ у собак (62). Кроме того, активность рекомбинантной вакцины Ad-RG не нарушалась ранее существовавшим иммунитетом при интраназальном или пероральном введении.В связи с растущим в настоящее время интересом к использованию аденовирусов для генной терапии, а также для вакцинации, дефектные по репликации векторные конструкции аденовируса были исследованы в качестве возможных вакцин следующего поколения против бешенства (61, 79, 80).
Вакцины против бешенства на основе ДНК
Другой областью инновационных разработок вакцин против бешенства является ДНК или генная вакцина. Вакцины на основе ДНК предлагают новые подходы и уникальные стратегии как для профилактики, так и для постэкспозиционной терапии против бешенства.Вакцины на основе ДНК изначально разрабатывались как простой и универсальный способ вызвать широкий спектр иммунных реакций (как клеточно-опосредованных, так и гуморальных) при непосредственном введении хозяину по сравнению с обычными вакцинами. Наиболее привлекательной и убедительной причиной для разработки вакцин против бешенства на основе ДНК является то, что плазмиды (ДНК, кодирующая ген G вируса бешенства ) легко сконструировать и их можно производить в больших количествах с небольшими затратами. ДНК-плазмиды, которые несут более одного компонента вирусного гена, т.е.г. Гены G и N различных штаммов вируса бешенства или множественные плазмиды, кодирующие отдельные экспрессируемые гены, объединенные в «коктейль плазмидных вакцин», обеспечивают подход поливалентной вакцины для одновременной индукции иммунитета более чем к «одному вирусному патогену» (81, 82). ).
).
Несколько генов G бешенства и родственных бешенству вирусов в одной вакцинной смеси защитят людей не только от бешенства , но и от родственных бешенству вирусов одновременно.Кроме того, ДНК-вакцины индуцируют не только ВНА и CD 4 + Т-клетки, но и цитотоксические CD 8 + Т-клетки. Индукция CD 8 + Т-клеток обычно не индуцируется рекомбинантными и синтетическими пептидами. Первая ДНК-вакцина против бешенства, разработанная в Институте Вистар, индуцировала длительный иммунитет после в/м инъекции, но индукция ВНА обычно происходит медленнее, чем HDCV. Различные параметры, такие как дозы плазмид, способ введения, вид хозяина, вирусная нагрузка, а также первичный и бустерный способы инокуляции, изучались как в формате до, так и после воздействия.Тем не менее, результаты были обнадеживающими у мышей и некоторых крупных млекопитающих, но не привели к полной защите приматов, отличных от человека, после вакцинации до и после контакта. Таким образом, необходимо провести дальнейшую работу, чтобы использовать весь потенциал ДНК-вакцин, чтобы обеспечить полностью защитные и очень желательные вакцины для животных и людей по низкой цене (81, 83).
Таким образом, необходимо провести дальнейшую работу, чтобы использовать весь потенциал ДНК-вакцин, чтобы обеспечить полностью защитные и очень желательные вакцины для животных и людей по низкой цене (81, 83).
Пероральные вакцины против бешенства, полученные из растений
Растения также открыли новые и многообещающие перспективы в процессе разработки эффективных, недорогих и безопасных систем производства и доставки следующего поколения вакцин против бешенства.Вирусы растений, такие как томатный кустоподобный вирус и вирус табачной мозаики (TMV), служащие в качестве векторов для экспрессии чужеродных антигенов в растениях, обеспечили множество генетически изготовленных вакцин из томатов и листьев табака, соответственно. Среди ключевых преимуществ растений и растительных культур для экспрессии белка, в частности растения табака как подходящего хозяина для экспрессии белка, переносимого растительным вирусом, является то, что они представляют собой биомассу в больших пропорциях для продукции рекомбинантного (чужеродного) белка.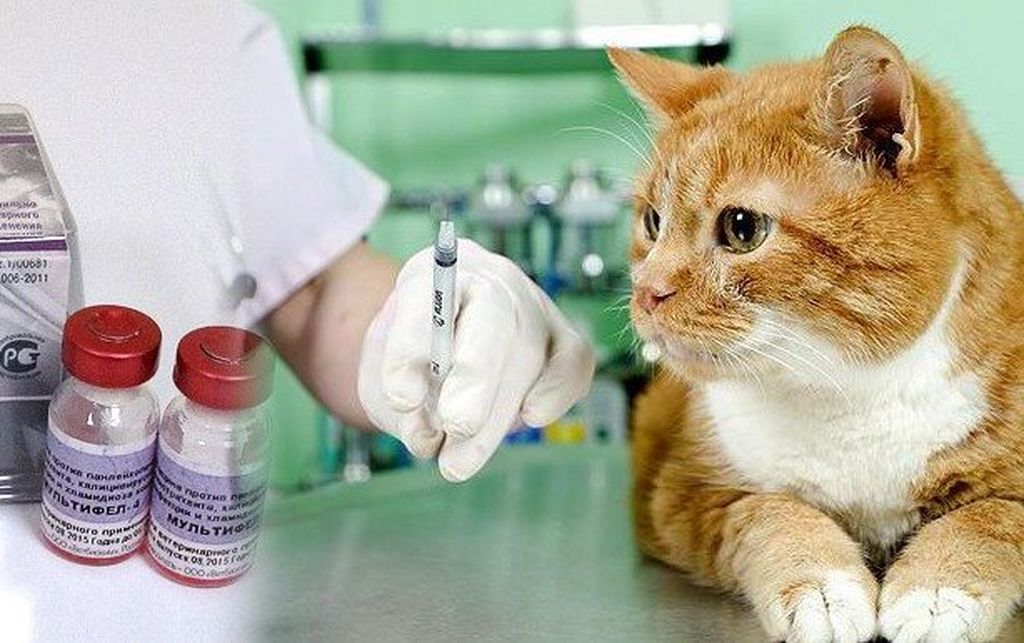 Мыши, иммунизированные перорально или путем кормления антиген-продуцирующими листьями шпината или парентерально специфическим антигеном вируса бешенства растительного происхождения, могли быть защищены от летального заражения вирусом бешенства . Он предлагает преимущества безопасности, низкой стоимости, правильного гликозилирования антигена, легкого перорального введения и отсутствия нескольких болезненных инъекций. Он также может генерировать локальный и систематический иммунный ответ и защищать от вируса бешенства .
(84).
Мыши, иммунизированные перорально или путем кормления антиген-продуцирующими листьями шпината или парентерально специфическим антигеном вируса бешенства растительного происхождения, могли быть защищены от летального заражения вирусом бешенства . Он предлагает преимущества безопасности, низкой стоимости, правильного гликозилирования антигена, легкого перорального введения и отсутствия нескольких болезненных инъекций. Он также может генерировать локальный и систематический иммунный ответ и защищать от вируса бешенства .
(84).
График предэкспозиционной вакцинации человека
Лабораторный персонал, работающий с вирусом бешенства , ветеринары, дрессировщики животных, вспомогательный персонал, работающий в человеческих и ветеринарных больницах, а также персонал, занимающийся дикой природой, подвергается высокому риску и должен пройти доконтактную вакцинацию против бешенство.Как правило, в дни 0, 7 и 28 используют клеточную культуральную вакцину 1 мл I/M или 0,1 мл I/D. 0,5 МЕ/мл , рекомендуется бустерная доза, в противном случае бустерные дозы вводят с интервалом в 2 года (7).
0,5 МЕ/мл , рекомендуется бустерная доза, в противном случае бустерные дозы вводят с интервалом в 2 года (7).
График постконтактной вакцинации человека
Очищенная клеточная вакцина Vero, очищенные куриные эмбриональные клеточные вакцины и вакцины HDCS обычно используются в качестве профилактических средств против бешенства.Вакцина на основе клеток Vero используется в дозе 0,5 мл в/м, а две другие вакцины используются в дозе 1 мл в/м.
Существуют две схемы постконтактной вакцинации против бешенства, рекомендованные ВОЗ как безопасные и эффективные. Схемы включают схему Эссена, при которой одна доза вакцины вводится внутримышечно в дельтовидную мышцу в каждый из дней 0, 3, 7, 14 и 28. Схема Загреба, при которой одна доза вакцины вводится в два места в день 0 и на одном сайте в дни 7 и 21.Схема 2-1-1 индуцирует ранний ответ антител и может быть особенно эффективна, когда лечение после контакта не включает введение антирабического иммуноглобулина () (7).
Таблица 1
Рекомендации ВОЗ по иммунизации людей против бешенства
| Вакцина | Доконтактная иммунизация | Послеконтактная иммунизация | 01 |
|---|---|---|---|
| Да | Схема лечения по Эссену (в/м) Схема по Загребу (в/м) Схема в 8 мест (в/д) | ||
| PCECV | |||
| Да | Схема лечения по Эссену (в/м) Схема по Загребу (в/м) Схема в 8 мест (в/д) | ||
| ПВРВ | |||
| Да | Схема Эссена (В/М) Схема Загреба (В/М) Схема в 2 места (В/Д) |
Пассивная иммунизация бешенство.
 Высокий уровень нейтрализующих антител в сыворотке вакцинированных животных и человека может защитить их от летальных инфекций, так как антителам требуется не менее 7–10 дней , чтобы они стали эффективными для нейтрализации вируса. Это время покрывается пассивной иммунизацией антирабическим иммуноглобулином. Комбинированная терапия сывороточной вакциной всегда рекомендуется лицам, подвергшимся воздействию, особенно при тяжелых укушенных ранах. Очищенный лошадиный антирабический иммуноглобулин, который иногда вызывает побочные реакции, используется в большинстве развивающихся стран в дозе 40 МЕ/кг массы тела, тогда как человеческий антирабический иммуноглобулин вводится в дозе 20 МЕ/кг массы тела (85).
Высокий уровень нейтрализующих антител в сыворотке вакцинированных животных и человека может защитить их от летальных инфекций, так как антителам требуется не менее 7–10 дней , чтобы они стали эффективными для нейтрализации вируса. Это время покрывается пассивной иммунизацией антирабическим иммуноглобулином. Комбинированная терапия сывороточной вакциной всегда рекомендуется лицам, подвергшимся воздействию, особенно при тяжелых укушенных ранах. Очищенный лошадиный антирабический иммуноглобулин, который иногда вызывает побочные реакции, используется в большинстве развивающихся стран в дозе 40 МЕ/кг массы тела, тогда как человеческий антирабический иммуноглобулин вводится в дозе 20 МЕ/кг массы тела (85).Последние разработки в области иммунопрофилактики
Система обратной генетики для получения инфекционной к-ДНК
В этом методе плазмида, экспрессирующая полноразмерную антигеномную РНК (геномная плазмида), и три плазмиды, экспрессирующие N, P и L белки вируса (хелперные плазмиды) трансфицировали в клетку. Антигеномная РНК и белки образуют антигеномный рибонуклеопротеиновый (РНП) комплекс. Комплекс антигеномных РНП обладает той же биологической активностью, что и в инфицированных вирусом клетках, геномная РНК синтезируется с использованием этого антигеномного РНП в качестве матрицы с последующим синтезом мРНК из геномных РНП и экспрессией вирусного белка.Сборка геномного RNP и других вирусных белков в виде белков M и G приводит к образованию инфекционного рекомбинантного вируса бешенства . Используя эту систему манипуляций с вирусом бешенства , вакцина с аттенуированным живым вирусом может быть получена быстрее, чем обычная вакцина на культуре клеток, с изменением биологических характеристик, таких как повышенная безопасность и иммуногенность (84).
Антигеномная РНК и белки образуют антигеномный рибонуклеопротеиновый (РНП) комплекс. Комплекс антигеномных РНП обладает той же биологической активностью, что и в инфицированных вирусом клетках, геномная РНК синтезируется с использованием этого антигеномного РНП в качестве матрицы с последующим синтезом мРНК из геномных РНП и экспрессией вирусного белка.Сборка геномного RNP и других вирусных белков в виде белков M и G приводит к образованию инфекционного рекомбинантного вируса бешенства . Используя эту систему манипуляций с вирусом бешенства , вакцина с аттенуированным живым вирусом может быть получена быстрее, чем обычная вакцина на культуре клеток, с изменением биологических характеристик, таких как повышенная безопасность и иммуногенность (84).
Вставка чужеродного гена в геном вируса
Рекомбинантный вирус бешенства , экспрессирующий проапоптотический белок цитохром с (штамм SPBN-Cyto c(+)), сильно индуцировал апоптоз в инфицированных клетках, который оказался более ослабленным, чем вирус отрицательного контроля несущий инактивированный ген цитохрома с (штамм SPBN-Cyto c(-)) и индуцирующий защитный иммунный ответ у мышей (86).
Мутация вируса бешенства в положении 333 G-белка
В вирусе бешенства наличие остатка аргинина или лизина в положении 333 G-белка хорошо известно как патогенное (87, 88). Было обнаружено, что многие рекомбинантные вирусы, несущие ген G из различных штаммов вируса бешенства с аминокислотой, отличной от аргинина или лизина, являются аттенуированными (55). Делеция сайта связывания легкой цепи динеина в белке Р, который необходим для аксонального транспорта вируса, снижает периферическую инфекционность рекомбинантного вируса у мышей-сосунков (89).
Вставка дополнительного гена G в геном
Для повышения иммуногенности аттенуированного вакцинного вируса уровень экспрессии белка G в инфицированных клетках был увеличен за счет вставки в геном дополнительного гена G (90). Оба гена G содержат изменение аминокислоты в положении 333, и рекомбинантный вирус бешенства (штамм SPBNGA-GA ) продуцирует вдвое большее количество белка G в культивируемых клетках по сравнению с вирусом, несущим только один ген G, и что рекомбинантный вирус индуцировал апоптоз сильнее и эффективнее защитного иммунитета по сравнению с контролем (90).
Рекомбинантный вирус бешенства без гена P
Рекомбинантный вирус без гена P ( def-P ) был извлечен из геномной плазмиды с добавлением белка P из хелперной плазмиды. Вирус def-P может быть получен в клеточных линиях, стабильно экспрессирующих белок P. С другой стороны, вирус def-P не рос эффективно в нормальных клетках, которые не экспрессировали белок P. Вирус def-P оказался полностью апатогенным для взрослых мышей и мышей-сосунков, которым вводили интрацеребрально.Вирус def-P индуцировал высокий уровень ВНА и защитный иммунитет, достаточный для того, чтобы выдерживать вирусную инфекцию у мышей. Белок P блокирует выработку интерферона типа I и сигнальный путь, который ингибирует врожденный иммунитет хозяина. Потеря этих функций indef-P может способствовать высокой иммуногенности (91).
Рекомбинантный вирус бешенства без гена М
С дефицитом гена М Вирус бешенства ( RCHLΔ M ) был разработан с использованием системы манипуляции генами штамма RC-HL, используемого при производстве вакцин в Японии (92, 93). Белок М необходим для сборки и почкования вируса (94). Штамм RCHLΔ M был выделен из геномной плазмиды в присутствии хелперной плазмиды, кодирующей белок М. Инфекционное потомство вируса не было обнаружено в культуральном супернатанте клеток, инфицированных штаммом RCHLΔ M , тогда как инфекционный вирус эффективно продуцировался в супернатанте клеток, инфицированных штаммом RC-HL. Клеточная линия BHK21, экспрессирующая белок М штамма RC-HL, может быть использована для размножения штамма RCHLΔ M .Штамм RCHL∆ M полностью апатогенен как для взрослых мышей, так и для мышей-сосунков, привитых интрацеребрально. RCHLΔ M индуцировал ВНА у взрослых мышей после в/м введения или интраназального введения (95).
Белок М необходим для сборки и почкования вируса (94). Штамм RCHLΔ M был выделен из геномной плазмиды в присутствии хелперной плазмиды, кодирующей белок М. Инфекционное потомство вируса не было обнаружено в культуральном супернатанте клеток, инфицированных штаммом RCHLΔ M , тогда как инфекционный вирус эффективно продуцировался в супернатанте клеток, инфицированных штаммом RC-HL. Клеточная линия BHK21, экспрессирующая белок М штамма RC-HL, может быть использована для размножения штамма RCHLΔ M .Штамм RCHL∆ M полностью апатогенен как для взрослых мышей, так и для мышей-сосунков, привитых интрацеребрально. RCHLΔ M индуцировал ВНА у взрослых мышей после в/м введения или интраназального введения (95).
Система манипулирования генами вируса бешенства открыла возможность разработки антирабических вакцин нового поколения. Тем не менее, необходимо тщательно исследовать эти вакцины, поскольку безопасность рекомбинантного вируса с чужеродным геном может вызвать серьезные побочные эффекты у привитых животных и людей. Например, рекомбинантный вирус с чужеродным геном или мутацией, связанной с аттенуацией, существует вероятность того, что вирус станет патогенным при размножении вируса в организме привитого животного из-за определенной мутации.
Например, рекомбинантный вирус с чужеродным геном или мутацией, связанной с аттенуацией, существует вероятность того, что вирус станет патогенным при размножении вируса в организме привитого животного из-за определенной мутации.
Руководство по постконтактной вакцинации/лечению
Бешенство является смертельным заболеванием, и для него не существует специального лечения, кроме лечения. Пациент должен находиться в спокойной, тихой и изолированной комнате. Анальгетики (морфин) и миорелаксанты назначают для облегчения боли и мышечного спазма.
Бешеные животные являются потенциальным источником инфекции, поскольку их слюна, рвотные массы, слезы, моча и другие биологические жидкости содержат вирус. У лечащих лиц должна быть предэкспозиционная вакцинация и защитная одежда, такая как маски для лица, перчатки, защитные очки, фартуки и т. д. Немедленная обработка укушенной раны включает тщательное мытье или промывание раны или области водой с мылом, предпочтительно проточной водой в течение 15 90–189 мин. . Следующим шагом является обработка раны вирулицидными средствами, такими как спирт, настойка или повидон-йод.Пациент может находиться под прикрытием антибиотиками и противостолбнячной терапией. Рекомендация по прохождению постэкспозиционного лечения показана в () (96).
. Следующим шагом является обработка раны вирулицидными средствами, такими как спирт, настойка или повидон-йод.Пациент может находиться под прикрытием антибиотиками и противостолбнячной терапией. Рекомендация по прохождению постэкспозиционного лечения показана в () (96).
Таблица 2
Кто рекомендация для пост-экспозиции Вакцинация / лечение
| категория | ||
|---|---|---|
| Тип контакта с подозреваемым или подтвержденным Rabid White или дикое животное или животное недоступно для наблюдения | Рекомендации | Прикосновение к животным или кормление ими, облизывание неповрежденной кожи | Нет, если имеется надежный анамнез. |
| II | Покусывание непокрытой кожи, незначительных царапин или ссадин без кровотечения. Лижет поврежденную кожу Лижет поврежденную кожу | Немедленно введите вакцину. Прекратить лечение, если животное остается здоровым в течение 10-дневного периода наблюдения, или если животное умерщвлено гуманными методами и с помощью соответствующих лабораторных методов было обнаружено отсутствие бешенства |
| III | Одиночные или множественные трансдермальные укусы или царапины.Загрязнение слизистых оболочек слюной (например, облизывание) | Немедленно ввести антирабический иммуноглобулин и вакцину. Прекратить лечение, если животное остается здоровым в течение 10-дневного периода наблюдения, или если животное умерщвлено гуманным способом и с помощью соответствующих лабораторных методов получен отрицательный результат на бешенство |
Иммунитет
широко изучался на экспериментально инфицированных мышах, вакцинированных собаках и людях, получивших постэкспозиционную вакцинацию.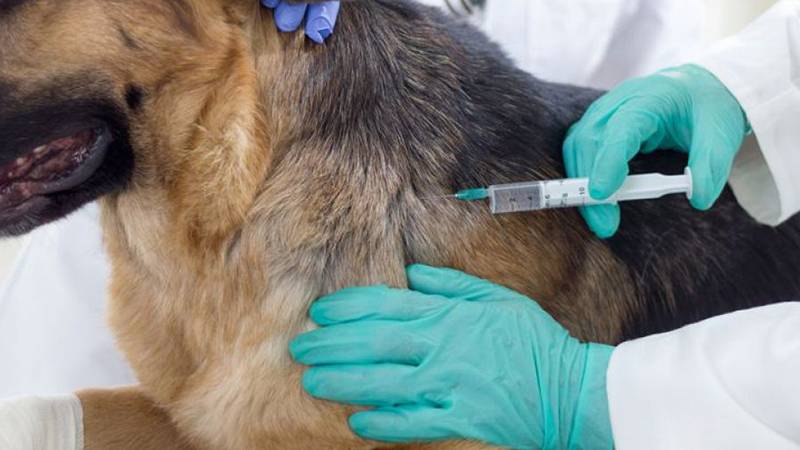 Но имеется очень мало информации об иммунных реакциях у естественно инфицированных животных (97). Неясно, играет ли слюна бешеного животного иммуномодулирующую роль, позволяя вирусу ускользать от иммунного ответа хозяина, но было показано, что гомогенаты слюнных желез и мозга обладают иммуносупрессивным действием. Экспериментальные исследования показали, что на иммунный ответ и возможную иммуносупрессию в значительной степени влияют штамм, доза и способ введения. У мышей, устойчивых к заражению, вирусспецифические антитела были впервые обнаружены через 4-6 дней после экспериментального заражения, достигнув пиковых уровней через 2 недель после заражения (70).У животных, переживших инфекцию, титры антител остаются высокими, тогда как у мышей, погибших от летальной экспериментальной инфекции, отмечается истощение В- и Т-клеток в селезенке и тимусе. Антиген-специфическое подавление CMI опосредовано патогенными Lyssavius , но не непатогенными родственными вирусами бешенства или инактивированными патогенными вирусами бешенства (48).
Но имеется очень мало информации об иммунных реакциях у естественно инфицированных животных (97). Неясно, играет ли слюна бешеного животного иммуномодулирующую роль, позволяя вирусу ускользать от иммунного ответа хозяина, но было показано, что гомогенаты слюнных желез и мозга обладают иммуносупрессивным действием. Экспериментальные исследования показали, что на иммунный ответ и возможную иммуносупрессию в значительной степени влияют штамм, доза и способ введения. У мышей, устойчивых к заражению, вирусспецифические антитела были впервые обнаружены через 4-6 дней после экспериментального заражения, достигнув пиковых уровней через 2 недель после заражения (70).У животных, переживших инфекцию, титры антител остаются высокими, тогда как у мышей, погибших от летальной экспериментальной инфекции, отмечается истощение В- и Т-клеток в селезенке и тимусе. Антиген-специфическое подавление CMI опосредовано патогенными Lyssavius , но не непатогенными родственными вирусами бешенства или инактивированными патогенными вирусами бешенства (48).
Для количественного анализа гуморального иммунного ответа обычно используются два типа тестов: тест на нейтрализацию вируса (VNT) и тест на ингибирование быстрого флуоресцентного фокуса (RFFIT), в котором используется культура клеток (98, 99).Высокие титры антител VNT или RFFIT указывают на защитный гуморальный иммунный ответ, но было показано, что несколько животных с очень низкими титрами сопротивляются заражению, что позволяет предположить, что клеточные иммунные ответы могут играть важную роль в защите от заражения (88). Экспериментальное заражение голых мышей (с дефицитом Т-клеток) показало, что клеточное звено иммунной системы очень важно. Иммунизация человека вакциной против бешенства показала, что клеточно-опосредованный иммунный ответ, измеряемый анализом пролиферации лимфоцитов, также играет жизненно важную роль (57).Опосредованный клетками иммунный ответ можно обнаружить в течение длительного времени после вакцинации. Цитотоксические Т-лимфоциты и Т-хелперные клетки, специфичные к эпитопам вирусного гликопротеина или рибонуклеопротеина вируса бешенства , были обнаружены в периферической крови инфицированных вирусом животных и у вакцинированных людей.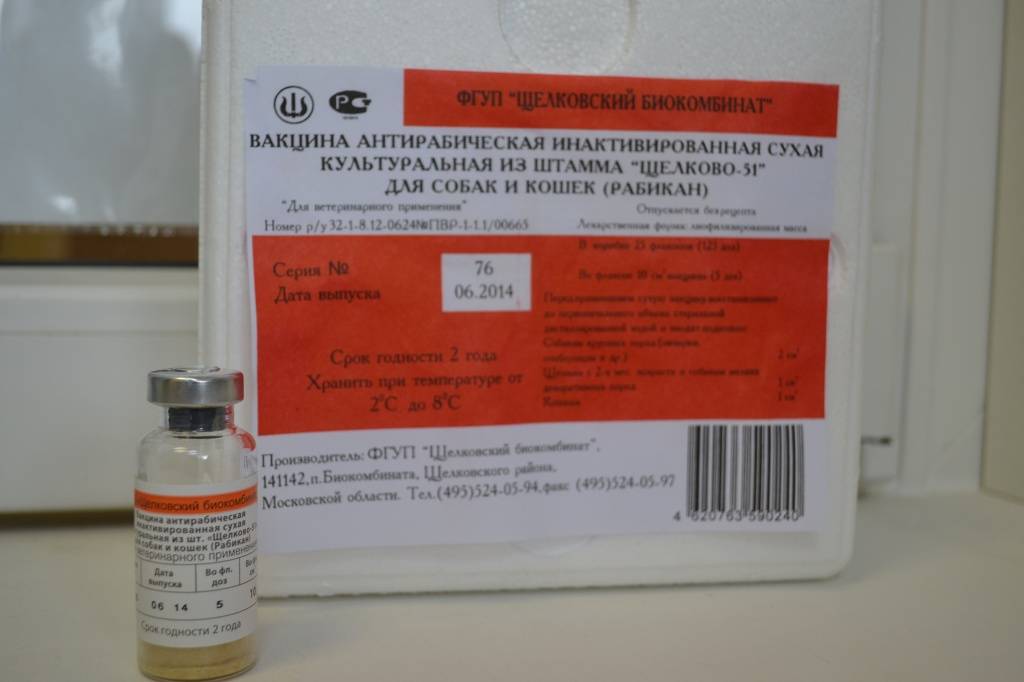 Мыши, обладающие естественной устойчивостью к вирусу бешенства , становятся восприимчивыми из-за истощения CD4+, но клетки CD8+ не оказывают никакого действия (100).
Мыши, обладающие естественной устойчивостью к вирусу бешенства , становятся восприимчивыми из-за истощения CD4+, но клетки CD8+ не оказывают никакого действия (100).
Заключение
Бешенство, страшное и устрашающее заболевание, вызывающее неврологические симптомы с высокой смертностью, является не только национальной, но и глобальной проблемой.Значительные успехи были достигнуты междисциплинарными секторами иммунологии, вакцинологии, молекулярной вирусологии и эпидемиологии, что позволило лучше понять циркуляцию вируса бешенства. Бешенство — это заболевание, для которого существуют все необходимые средства, в отличие от многих других заболеваний, таких как лихорадка денге, чикунгунья и т. д. Можно предотвратить, контролировать и лечить бешенство с помощью безопасных и эффективных вакцин против бешенства, произведенных культурой клеток, или антирабических глобулинов. Несмотря на это, ВОЗ ежегодно регистрирует более 55 000 случаев смерти людей от бешенства, в основном из-за заражения классическим вирусом бешенства (генотип 1, серотип 1) от собак. Число случаев заболевания людей и животных до сих пор считается заниженным из-за плохой или заниженной отчетности во многих странах мира. Продолжение молекулярно-эпидемиологических и эпиднадзорных исследований необходимо для отслеживания побочной передачи от видов-резервуаров к животным и людям, не являющимся резервуарами, а также для наблюдения за появлением специфических штаммов бешенства среди новых видов и географических районов, что в значительной степени часто вызвано человеческим фактором. деятельность, а именно., перемещение диких животных и ввоз животных.
Число случаев заболевания людей и животных до сих пор считается заниженным из-за плохой или заниженной отчетности во многих странах мира. Продолжение молекулярно-эпидемиологических и эпиднадзорных исследований необходимо для отслеживания побочной передачи от видов-резервуаров к животным и людям, не являющимся резервуарами, а также для наблюдения за появлением специфических штаммов бешенства среди новых видов и географических районов, что в значительной степени часто вызвано человеческим фактором. деятельность, а именно., перемещение диких животных и ввоз животных.
Эпидемиология бешенства летучих мышей должна быть изучена более всесторонне, чтобы можно было точно определить риски для здоровья человека и домашних плотоядных животных и применить эффективные и действенные меры профилактики заболеваний к тем, кто имеет дело с летучими мышами. Еще одна более амбициозная цель состоит в том, чтобы координировать все усилия всех секторов по расширению программ эпиднадзора за бешенством, особенно в Африке и Азии, и, таким образом, в конечном итоге снизить заболеваемость бешенством на континентах.
В идеале должна быть национальная референс-лаборатория по диагностике бешенства с филиалами в каждом штате страны.Уничтожение всех бродячих и диких собак, которое обычно очень непопулярно среди широкой публики и вызывает сильную оппозицию со стороны зоозащитников и комитета по этике животных, в долгосрочной перспективе не является реалистичным методом борьбы с болезнями. Этот метод потерпел неудачу в некоторых странах мира. Домашние собаки обычно получают прививки от бешенства в возрасте 3 месяцев , но очень часто они заражаются до достижения этого возраста. Бродячие и неразрешенные собаки, которые часто не участвуют в кампании иммунизации, являются носителями вируса бешенства .Они действуют как переносчики и передают вирус бешенства другим восприимчивым животным и людям. Сообщалось, что вакцинация в возрасте до 3 90–189 месяцев 90–190 эффективна даже у животных с материнскими антителами. Щенков следует прививать вместе со взрослыми собаками во время любой кампании массовой парентеральной вакцинации. Это поможет расширить охват вакцинацией и снизить заболеваемость бешенством среди детей.
Это поможет расширить охват вакцинацией и снизить заболеваемость бешенством среди детей.
В Индии бешенство среди животных и людей представляет собой реальную проблему, и было предпринято много усилий для борьбы с этим заболеванием.До сих пор регистрируется большое количество случаев с определенным процентом жертв. Имеющиеся в настоящее время вакцины против бешенства на основе клеточных культур доказали свою безопасность, иммуногенность, действенность и эффективность при производстве и применении в соответствии с рекомендациями ВОЗ. Разработка и правильное использование вакцин, несомненно, позволили спасти миллионы человеческих жизней от ужасной болезни. Однако высокая стоимость вакцин, недостаточная информированность общественности о полезности введения этих вакцин в случаях до и после контакта и ограниченная доступность во многих регионах мира — все это факторы, препятствующие использованию вакцин против бешенства на клеточных культурах. весь потенциал на благо человечества.Однако с развитием времени и производством вакцин многими компаниями-производителями, а также с использованием внутривенного введения вакцин против бешенства стоимость вакцин будет разумной и доступной для простых людей, а профилактика и борьба с бешенством - для в значительной степени в ближайшем будущем станет реальностью.
Ссылки
1. Knobel DL, Cleaveland S, Coleman PG, Fevre EM, Meltzer MI, Miranda ME, et al. Переоценка бремени бешенства в Африке и Азии. Бык ВОЗ.2005;83(5):360–368. [Бесплатная статья PMC] [PubMed] [Google Scholar]2. Уайлд Х., Хавплод П., Хамолтам Т., Хемачудха Т., Тепсуметанон В., Лумлердача Б. и др. Борьба с бешенством в Южной и Юго-Восточной Азии. вакцина. 2005;23(17-18):2284–2289. [PubMed] [Google Scholar]3. Хэмпсон К., Душофф Дж., Бингхэм Дж., Брукнер Г., Али Ю.Х., Энди Д. Синхронные циклы бешенства домашних собак в странах Африки к югу от Сахары и влияние усилий по борьбе. Proc Nat Acad Sci. 2007;104(18):7717–7722. [Бесплатная статья PMC] [PubMed] [Google Scholar]4.Kamoltham T, Singhsa J, Promsaranee U, Sonthon P, Mathean P, Thinyounyong W. Ликвидация человеческого бешенства в собачьей эндемичной провинции Таиланда: пятилетняя программа. Бык ВОЗ. 2003;81(5):375–381. [Бесплатная статья PMC] [PubMed] [Google Scholar]5. Хэнлон К.А., Кузьмин И.В., Блэнтон Д.Д., Велдон В.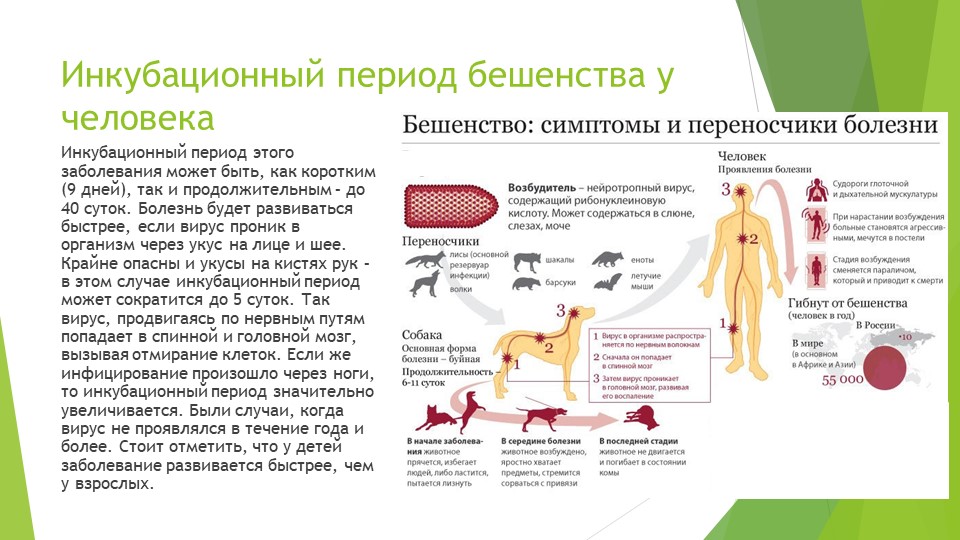 К., Мананган Д.С., Рупрехт К.Е. Эффективность антирабических препаратов против новых лиссавирусов из Евразии. Вирус Рез. 2005;111(1):44–54. [PubMed] [Google Scholar]6. Сударшан М.К., Мадхусудана С.Н., Махендра Б.Дж., Рао Н.С., Ашват Н.Д.Х., Абдул Рахман С.Оценка бремени бешенства среди людей в Индии: результаты национального многоцентрового эпидемиологического исследования. Intl J Infect Dis. 2007;11(1):29–35. [PubMed] [Google Scholar]7. Всемирная организация здравоохранения (ВОЗ) Женева: ВОЗ; 2001. Стратегии контроля и ликвидации бешенства в Азии. Отчет межрегиональной консультации ВОЗ. Отчет семинара по борьбе с бешенством в странах Азии; п. 32. [Google Академия]8. Клике Ф., Пикард-Мейер Э. Бешенство и вирусы, связанные с бешенством: современный взгляд на древнюю болезнь.Rev Sci Tech Off Int Epiz. 2004;23(2):625–642. [PubMed] [Google Scholar]9. Чаудхури С. Эколлаж; 2005. Профилактика бешенства и управление популяцией собак. Официальная политика Индии по контролю за собаками в контексте рекомендаций ВОЗ.
К., Мананган Д.С., Рупрехт К.Е. Эффективность антирабических препаратов против новых лиссавирусов из Евразии. Вирус Рез. 2005;111(1):44–54. [PubMed] [Google Scholar]6. Сударшан М.К., Мадхусудана С.Н., Махендра Б.Дж., Рао Н.С., Ашват Н.Д.Х., Абдул Рахман С.Оценка бремени бешенства среди людей в Индии: результаты национального многоцентрового эпидемиологического исследования. Intl J Infect Dis. 2007;11(1):29–35. [PubMed] [Google Scholar]7. Всемирная организация здравоохранения (ВОЗ) Женева: ВОЗ; 2001. Стратегии контроля и ликвидации бешенства в Азии. Отчет межрегиональной консультации ВОЗ. Отчет семинара по борьбе с бешенством в странах Азии; п. 32. [Google Академия]8. Клике Ф., Пикард-Мейер Э. Бешенство и вирусы, связанные с бешенством: современный взгляд на древнюю болезнь.Rev Sci Tech Off Int Epiz. 2004;23(2):625–642. [PubMed] [Google Scholar]9. Чаудхури С. Эколлаж; 2005. Профилактика бешенства и управление популяцией собак. Официальная политика Индии по контролю за собаками в контексте рекомендаций ВОЗ. [Google Академия] 10. Хоке М., Ислам Т., Дас С.К., Джабин Н., Ислам Т. Обзор бешенства у человека и животных. Интас Поливет. 2006; 7: 388–398. [Google Академия] 11. Сударшан МК. Оценка бремени бешенства в Индии. ВОЗ спонсировала национальное многоцентровое обследование по бешенству. Ассоциация по профилактике и борьбе с бешенством в Индии.2004; 6: 44–45. [Google Академия] 12. Шаям С., Дуггал А.К., Камбл У., Агарвал А.К. Постконтактная профилактика бешенства. J Индийская академия Clin Med. 2006;7(1):39–46. [Google Академия] 13. Сингх К.К., Сандху Б.С. Эпидемиологическое расследование бешенства в Пенджабе. Индийский J Anim Sci. 2007; 77: 653–658. [Google Академия] 14. МЭБ (Всемирная организация по охране здоровья животных) МЭБ. Руководство по стандартам на диагностические тесты и вакцины. 5-е изд. Париж: МЭБ; 2004. Бешенство; стр. 276–291. [Google Академия] 15. Пасторе П.П., Каппелер А., Обер М.Европейский контроль бешенства и его история. В: Кинг А.А., Фукс А.Р., Обер М., Ванделер А.И., редакторы.
[Google Академия] 10. Хоке М., Ислам Т., Дас С.К., Джабин Н., Ислам Т. Обзор бешенства у человека и животных. Интас Поливет. 2006; 7: 388–398. [Google Академия] 11. Сударшан МК. Оценка бремени бешенства в Индии. ВОЗ спонсировала национальное многоцентровое обследование по бешенству. Ассоциация по профилактике и борьбе с бешенством в Индии.2004; 6: 44–45. [Google Академия] 12. Шаям С., Дуггал А.К., Камбл У., Агарвал А.К. Постконтактная профилактика бешенства. J Индийская академия Clin Med. 2006;7(1):39–46. [Google Академия] 13. Сингх К.К., Сандху Б.С. Эпидемиологическое расследование бешенства в Пенджабе. Индийский J Anim Sci. 2007; 77: 653–658. [Google Академия] 14. МЭБ (Всемирная организация по охране здоровья животных) МЭБ. Руководство по стандартам на диагностические тесты и вакцины. 5-е изд. Париж: МЭБ; 2004. Бешенство; стр. 276–291. [Google Академия] 15. Пасторе П.П., Каппелер А., Обер М.Европейский контроль бешенства и его история. В: Кинг А.А., Фукс А.Р., Обер М., Ванделер А.И., редакторы. Историческая перспектива бешенства в Европе и Средиземноморском бассейне. Париж: МЭБ; 2004. стр. 337–347. [Google Академия] 16. Chulasugandha P, Khawplod P, Havanond P, Wilde H. Сравнение стоимости доконтактной вакцинации против бешенства с постконтактным лечением у тайских детей. вакцина. 2006;24(9):1478–1482. [PubMed] [Google Scholar] 17. Kamoltham T, Khawplod P, Wilde H. Внутрикожная постконтактная вакцинация людей против бешенства с использованием восстановленной и сохраненной вакцины.вакцина. 2002;20(27-28):3272–3276. [PubMed] [Google Scholar] 18. Kamoltham T, Thinyounyong W, Phongchamnaphai P, Phraisuwan P, Khawplod P, Banzhoff A, et al. Предэкспозиционная вакцинация против бешенства с использованием очищенной вакцины против бешенства из клеток куриного эмбриона внутрикожно является иммуногенной и безопасной. Дж. Педиат. 2007;151(2):173–177. [PubMed] [Google Scholar] 19. Джон ТДж. Этическая дилемма иммунизации против бешенства. вакцина. 1997; 15 (Приложение 1): S12–15. [PubMed] [Google Scholar] 20.
Историческая перспектива бешенства в Европе и Средиземноморском бассейне. Париж: МЭБ; 2004. стр. 337–347. [Google Академия] 16. Chulasugandha P, Khawplod P, Havanond P, Wilde H. Сравнение стоимости доконтактной вакцинации против бешенства с постконтактным лечением у тайских детей. вакцина. 2006;24(9):1478–1482. [PubMed] [Google Scholar] 17. Kamoltham T, Khawplod P, Wilde H. Внутрикожная постконтактная вакцинация людей против бешенства с использованием восстановленной и сохраненной вакцины.вакцина. 2002;20(27-28):3272–3276. [PubMed] [Google Scholar] 18. Kamoltham T, Thinyounyong W, Phongchamnaphai P, Phraisuwan P, Khawplod P, Banzhoff A, et al. Предэкспозиционная вакцинация против бешенства с использованием очищенной вакцины против бешенства из клеток куриного эмбриона внутрикожно является иммуногенной и безопасной. Дж. Педиат. 2007;151(2):173–177. [PubMed] [Google Scholar] 19. Джон ТДж. Этическая дилемма иммунизации против бешенства. вакцина. 1997; 15 (Приложение 1): S12–15. [PubMed] [Google Scholar] 20. Гоша ТК. Бешенство, Материалы IX Национальной конференции детских инфекционных болезней; Ченнаи, Индия: 2006 г.[Google Академия] 21. Фишбейн Д.Б., Йенне К.М., Дрисен Д.В., Теплис С.Ф., Мехта Н., Бриггс Д.Дж. Факторы риска системных реакций гиперчувствительности после ревакцинации человеческой диплоидно-клеточной вакциной против бешенства — общенациональное проспективное исследование. вакцина. 1993; 11:1390–1394. [PubMed] [Google Scholar] 22. Дицшольд Б., Фабер М., Шнелл М.Дж. Новые подходы к профилактике и ликвидации бешенства. Exp Rev Vac. 2003;2(3):399–406. [PubMed] [Google Scholar] 23. Мерфи Ф.А., Гиббс Э.П.Дж., Хорзинек М.С., Стаддерт М.Дж. Ветеринарная вирусология.3-е изд. Нью-Йорк: Академическая пресса; 1999. [Google Scholar]24. Прингл КР. Отряд Mononegavirales. Арх Вирол. 1991; 117: 137–140. [PubMed] [Google Scholar] 25. Нанди С. Молекулярная основа вирулентности вируса бешенства с особой ссылкой на дикую природу; Глобальное совещание по ветеринарному здравоохранению и симпозиум «Новые горизонты в области продовольственной безопасности с особым упором на стратегии развития ветеринарного здравоохранения и гигиены с глобальными перспективами» и 8-я конвенция APHV, состоявшаяся в Лакхнау; 2008.
Гоша ТК. Бешенство, Материалы IX Национальной конференции детских инфекционных болезней; Ченнаи, Индия: 2006 г.[Google Академия] 21. Фишбейн Д.Б., Йенне К.М., Дрисен Д.В., Теплис С.Ф., Мехта Н., Бриггс Д.Дж. Факторы риска системных реакций гиперчувствительности после ревакцинации человеческой диплоидно-клеточной вакциной против бешенства — общенациональное проспективное исследование. вакцина. 1993; 11:1390–1394. [PubMed] [Google Scholar] 22. Дицшольд Б., Фабер М., Шнелл М.Дж. Новые подходы к профилактике и ликвидации бешенства. Exp Rev Vac. 2003;2(3):399–406. [PubMed] [Google Scholar] 23. Мерфи Ф.А., Гиббс Э.П.Дж., Хорзинек М.С., Стаддерт М.Дж. Ветеринарная вирусология.3-е изд. Нью-Йорк: Академическая пресса; 1999. [Google Scholar]24. Прингл КР. Отряд Mononegavirales. Арх Вирол. 1991; 117: 137–140. [PubMed] [Google Scholar] 25. Нанди С. Молекулярная основа вирулентности вируса бешенства с особой ссылкой на дикую природу; Глобальное совещание по ветеринарному здравоохранению и симпозиум «Новые горизонты в области продовольственной безопасности с особым упором на стратегии развития ветеринарного здравоохранения и гигиены с глобальными перспективами» и 8-я конвенция APHV, состоявшаяся в Лакхнау; 2008. 19-21 ноября, с.196–204. [Google Академия] 26. Amengual B, Whitby JE, King A, Cobo S, Bourhy H. Эволюция европейского лиссавируса летучих мышей. Джей Ген Вирол. 1997; 78: 2319–2328. [PubMed] [Google Scholar] 27. Луо М., Грин Т.Дж., Чжан С., Цао Дж., Цю Ш. Консервативные характеристики нуклеопротеина рабдовируса. Вирус Рез. 2007;129(2):246–251. [Бесплатная статья PMC] [PubMed] [Google Scholar]28. Гулд А.Р., Каттенбелт Дж.А., Гамли С.Г., Лант Р.А. Характеристика варианта лиссавируса австралийских летучих мышей, выделенного от насекомоядной летучей мыши. Вирус Рез.2002;89(1):1–28. [PubMed] [Google Scholar] 29. Guyatt KJ, Twin J, Davis P, Holmes EC, Smith GA, Smith IL, et al. Молекулярно-эпидемиологическое исследование лиссавируса австралийских летучих мышей. Джей Ген Вирол. 2003;84(2):485–496. [PubMed] [Google Scholar] 30. Фекаду М., Несби С.Л., Шеддок Х., Шумахер К.Л., Линхарт С.Б., Сандерлин Д.В. Иммуногенность, эффективность и безопасность пероральной вакцины против бешенства (SAG-2) у собак.
19-21 ноября, с.196–204. [Google Академия] 26. Amengual B, Whitby JE, King A, Cobo S, Bourhy H. Эволюция европейского лиссавируса летучих мышей. Джей Ген Вирол. 1997; 78: 2319–2328. [PubMed] [Google Scholar] 27. Луо М., Грин Т.Дж., Чжан С., Цао Дж., Цю Ш. Консервативные характеристики нуклеопротеина рабдовируса. Вирус Рез. 2007;129(2):246–251. [Бесплатная статья PMC] [PubMed] [Google Scholar]28. Гулд А.Р., Каттенбелт Дж.А., Гамли С.Г., Лант Р.А. Характеристика варианта лиссавируса австралийских летучих мышей, выделенного от насекомоядной летучей мыши. Вирус Рез.2002;89(1):1–28. [PubMed] [Google Scholar] 29. Guyatt KJ, Twin J, Davis P, Holmes EC, Smith GA, Smith IL, et al. Молекулярно-эпидемиологическое исследование лиссавируса австралийских летучих мышей. Джей Ген Вирол. 2003;84(2):485–496. [PubMed] [Google Scholar] 30. Фекаду М., Несби С.Л., Шеддок Х., Шумахер К.Л., Линхарт С.Б., Сандерлин Д.В. Иммуногенность, эффективность и безопасность пероральной вакцины против бешенства (SAG-2) у собак..png) вакцина. 1996;14(6):465–468. [PubMed] [Google Scholar] 31. Фукс А.Р., Брукс С.М., Джонсон Н., Мак Элхинни Л.М., Хатсон А.М.Европейские лиссавирусы летучих мышей: новый зооноз. Эпидемия инфекции. 2003;131(3):1029–1039. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Нанди С., Аударья С.Д., Суреш И., Чаухан Р.С. Появление вирусов бешенства и связанных с бешенством вирусов – реальная проблема. Национальный симпозиум «Перспективная роль ветеринарного здравоохранения в интегрированном развитии сельских районов; Бхубанешвар, Орисса: Колледж ветеринарии и животноводства; 2006. 7–8 декабря, стр. 83–89. [Google Академия] 33. Нагараджан Т., Моханасубраманян Б., Сешагири Э.В., Нагендракумар С.Б., Сасиндранатх М.Р., Сатьянараяна М.Л. и др.Молекулярная эпидемиология изолятов вируса бешенства в Индии. Дж. Клин Микробиол. 2006;44(9):3218–3224. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Burton EC, Burns DK, Opatowsky MJ, El-Feky WH, Fischbach B, Melton L, et al. Энцефаломиелит бешенства: клинические, нейрорадиологические и патологические данные у 4 реципиентов трансплантата.
вакцина. 1996;14(6):465–468. [PubMed] [Google Scholar] 31. Фукс А.Р., Брукс С.М., Джонсон Н., Мак Элхинни Л.М., Хатсон А.М.Европейские лиссавирусы летучих мышей: новый зооноз. Эпидемия инфекции. 2003;131(3):1029–1039. [Бесплатная статья PMC] [PubMed] [Google Scholar]32. Нанди С., Аударья С.Д., Суреш И., Чаухан Р.С. Появление вирусов бешенства и связанных с бешенством вирусов – реальная проблема. Национальный симпозиум «Перспективная роль ветеринарного здравоохранения в интегрированном развитии сельских районов; Бхубанешвар, Орисса: Колледж ветеринарии и животноводства; 2006. 7–8 декабря, стр. 83–89. [Google Академия] 33. Нагараджан Т., Моханасубраманян Б., Сешагири Э.В., Нагендракумар С.Б., Сасиндранатх М.Р., Сатьянараяна М.Л. и др.Молекулярная эпидемиология изолятов вируса бешенства в Индии. Дж. Клин Микробиол. 2006;44(9):3218–3224. [Бесплатная статья PMC] [PubMed] [Google Scholar]34. Burton EC, Burns DK, Opatowsky MJ, El-Feky WH, Fischbach B, Melton L, et al. Энцефаломиелит бешенства: клинические, нейрорадиологические и патологические данные у 4 реципиентов трансплантата. Арх Нейрол. 2005;62(6):873–882. [PubMed] [Google Scholar] 35. Нанди С., Маити СК. Когда вашим питомцам делать прививку от бешенства. Азиатское животноводство (ФАО) 1995;20(4):46–48.[Google Академия] 36. Слейтер МР. Роль ветеринарной эпидемиологии в изучении бродячих собак и кошек. Пред. Вет. мед. 2001;48(4):273–286. [PubMed] [Google Scholar] 37. Schneider MC, Belotto A, Ade MP, Hendrickx S, Leanes LF, de Freitas Rodrigues MJ, et al. Текущее состояние бешенства человека, передаваемого собаками в Латинской Америке. Кэд Саде Пблика. 2007;23(9):2049–2063. [PubMed] [Google Scholar] 38. Кумар М., Нанди С., Манохар М., Чаухан Р.С. Эпидемиология и иммунопрофилактика бешенства у собак. Домашняя Индия.2009;15(8):18–22. [Google Академия] 39. Вундерли П.С., Дризен Д.В., Миллер Т.Дж., Баер Г.М. Влияние гетерогенности штамма вируса бешенства и пути заражения на эффективность инактивированных вакцин против бешенства у мышей. Американский J Vet Res. 2003;64(4):499–505. [PubMed] [Google Scholar]40. Хэнлон К.
Арх Нейрол. 2005;62(6):873–882. [PubMed] [Google Scholar] 35. Нанди С., Маити СК. Когда вашим питомцам делать прививку от бешенства. Азиатское животноводство (ФАО) 1995;20(4):46–48.[Google Академия] 36. Слейтер МР. Роль ветеринарной эпидемиологии в изучении бродячих собак и кошек. Пред. Вет. мед. 2001;48(4):273–286. [PubMed] [Google Scholar] 37. Schneider MC, Belotto A, Ade MP, Hendrickx S, Leanes LF, de Freitas Rodrigues MJ, et al. Текущее состояние бешенства человека, передаваемого собаками в Латинской Америке. Кэд Саде Пблика. 2007;23(9):2049–2063. [PubMed] [Google Scholar] 38. Кумар М., Нанди С., Манохар М., Чаухан Р.С. Эпидемиология и иммунопрофилактика бешенства у собак. Домашняя Индия.2009;15(8):18–22. [Google Академия] 39. Вундерли П.С., Дризен Д.В., Миллер Т.Дж., Баер Г.М. Влияние гетерогенности штамма вируса бешенства и пути заражения на эффективность инактивированных вакцин против бешенства у мышей. Американский J Vet Res. 2003;64(4):499–505. [PubMed] [Google Scholar]40. Хэнлон К. А., Кузьмин И., Блэнтон Дж., Мананган Дж., Мерфи С.М., Рупрехт К.Е. Материалы 14-й -й -й Международной конференции по бешенству в Америке. 2003. Эффективность биологических препаратов против недавно описанных лиссавирусов; стр. 55–56.[Google Академия] 41. Kalll H, Jouini A, Majoul S, Rourou S. Оценка различных сред, не содержащих сыворотку и животные белки, для производства ветеринарной вакцины против бешенства в клетках BHK-21. Дж Биотехнолог. 2002;95(3):195–204. [PubMed] [Google Scholar]42. Нанди С., Гоэл А.С., Пандей К.Д. Иммуногенный ответ на частично очищенный вирус бешенства, измеренный с помощью ELISA. Индиан Джей Вирол. 1990;6(1-2):89–92. [Google Академия]43. Пасторе И.П., Брошье Б. Эпидемиология и ликвидация бешенства в Западной Европе. Вет Дж. 1998;156(2):83–90.[PubMed] [Google Scholar]44. Мадхусудана С.Н., Ананд Н.П., Шамсундар Р. Экономичный многоцелевой внутрикожный режим с вакциной из очищенных клеток куриного эмбриона (Rabipur) предотвращает бешенство у людей, укушенных подтвержденными бешеными животными.
А., Кузьмин И., Блэнтон Дж., Мананган Дж., Мерфи С.М., Рупрехт К.Е. Материалы 14-й -й -й Международной конференции по бешенству в Америке. 2003. Эффективность биологических препаратов против недавно описанных лиссавирусов; стр. 55–56.[Google Академия] 41. Kalll H, Jouini A, Majoul S, Rourou S. Оценка различных сред, не содержащих сыворотку и животные белки, для производства ветеринарной вакцины против бешенства в клетках BHK-21. Дж Биотехнолог. 2002;95(3):195–204. [PubMed] [Google Scholar]42. Нанди С., Гоэл А.С., Пандей К.Д. Иммуногенный ответ на частично очищенный вирус бешенства, измеренный с помощью ELISA. Индиан Джей Вирол. 1990;6(1-2):89–92. [Google Академия]43. Пасторе И.П., Брошье Б. Эпидемиология и ликвидация бешенства в Западной Европе. Вет Дж. 1998;156(2):83–90.[PubMed] [Google Scholar]44. Мадхусудана С.Н., Ананд Н.П., Шамсундар Р. Экономичный многоцелевой внутрикожный режим с вакциной из очищенных клеток куриного эмбриона (Rabipur) предотвращает бешенство у людей, укушенных подтвержденными бешеными животными. Intl J Infect Dis. 2002;6(3):210–214. [PubMed] [Google Scholar]45. Артуа М., Клике Ф., Баррат Дж., Шумахер К.Л. Эффективность пероральной вакцины SAG1 для долгосрочной защиты рыжих лисиц (Vulpes vulpes) от бешенства. Ветеринар Рек. 1997;140(3):57–59. [PubMed] [Google Scholar]46.Дицшольд Б., Шнелл М.Дж. Новые подходы к разработке живых аттенуированных антирабических вакцин. Гибридная гибридомика. 2002;21(2):129–134. [PubMed] [Google Scholar]47. Вос А., Нойберт А., Айлан О., Шустер П., Поммеренинг Э., Мюллер Т. и др. Обновленная информация об исследованиях безопасности вакцины против вируса бешенства SAD B19 у целевых и нецелевых видов. Эпидемиол инфекции. 1999; 123:165–175. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Tuffereau C, Leblois H, Benejean J, Coulon P, Lafay F, Flamand A. Аргинин или лизин в положении 333 гликопротеина ERA и CVS необходимы для вирулентности бешенства у взрослых мышей.Вирусология. 1989;172(1):206–212. [PubMed] [Google Scholar]49. Кликет Ф., Гурбуксами Дж.
Intl J Infect Dis. 2002;6(3):210–214. [PubMed] [Google Scholar]45. Артуа М., Клике Ф., Баррат Дж., Шумахер К.Л. Эффективность пероральной вакцины SAG1 для долгосрочной защиты рыжих лисиц (Vulpes vulpes) от бешенства. Ветеринар Рек. 1997;140(3):57–59. [PubMed] [Google Scholar]46.Дицшольд Б., Шнелл М.Дж. Новые подходы к разработке живых аттенуированных антирабических вакцин. Гибридная гибридомика. 2002;21(2):129–134. [PubMed] [Google Scholar]47. Вос А., Нойберт А., Айлан О., Шустер П., Поммеренинг Э., Мюллер Т. и др. Обновленная информация об исследованиях безопасности вакцины против вируса бешенства SAD B19 у целевых и нецелевых видов. Эпидемиол инфекции. 1999; 123:165–175. [Бесплатная статья PMC] [PubMed] [Google Scholar]48. Tuffereau C, Leblois H, Benejean J, Coulon P, Lafay F, Flamand A. Аргинин или лизин в положении 333 гликопротеина ERA и CVS необходимы для вирулентности бешенства у взрослых мышей.Вирусология. 1989;172(1):206–212. [PubMed] [Google Scholar]49. Кликет Ф., Гурбуксами Дж. П., Прадхан Х. К., Паттнаик Б., Патил С. С., Рено А. и др. Безопасность и эффективность пероральной вакцины против бешенства SAG2 у индийских бездомных собак. вакцина. 2007;25(17):3409–3418. [PubMed] [Google Scholar]50. Hammami S, Schumacher C, Cliquet F, Tlatli A, Aubert A, Aubert M. Вакцинация тунисских собак лиофилизированной оральной вакциной против бешенства SAG 2, включенной в приманку для собак DBL 2. Вет рез. 1999;30(6):607–613. [PubMed] [Google Scholar]51.Kieny MP, Lathe R, Drillien R, Spehner D, Skory S, Schmitt D, et al. Экспрессия гликопротеина вируса бешенства из рекомбинантного вируса осповакцины. Природа. 1990; 312: 163–166. [PubMed] [Google Scholar]52. Рупрехт К.Э., Гиббонс Р.В. Профилактика бешенства. Новая Англия J Med. 2004;351(25):2626–2635. [PubMed] [Google Scholar]53. Лодмелл Д.Л., Эвальт Л.С. Вакцинация против бешенства: сравнение ответов нейтрализующих антител после примирования и повторной иммунизации различными комбинациями вакцин ДНК, инактивированного вируса или рекомбинантного вируса коровьей оспы.
П., Прадхан Х. К., Паттнаик Б., Патил С. С., Рено А. и др. Безопасность и эффективность пероральной вакцины против бешенства SAG2 у индийских бездомных собак. вакцина. 2007;25(17):3409–3418. [PubMed] [Google Scholar]50. Hammami S, Schumacher C, Cliquet F, Tlatli A, Aubert A, Aubert M. Вакцинация тунисских собак лиофилизированной оральной вакциной против бешенства SAG 2, включенной в приманку для собак DBL 2. Вет рез. 1999;30(6):607–613. [PubMed] [Google Scholar]51.Kieny MP, Lathe R, Drillien R, Spehner D, Skory S, Schmitt D, et al. Экспрессия гликопротеина вируса бешенства из рекомбинантного вируса осповакцины. Природа. 1990; 312: 163–166. [PubMed] [Google Scholar]52. Рупрехт К.Э., Гиббонс Р.В. Профилактика бешенства. Новая Англия J Med. 2004;351(25):2626–2635. [PubMed] [Google Scholar]53. Лодмелл Д.Л., Эвальт Л.С. Вакцинация против бешенства: сравнение ответов нейтрализующих антител после примирования и повторной иммунизации различными комбинациями вакцин ДНК, инактивированного вируса или рекомбинантного вируса коровьей оспы. вакцина. 2000;18(22):2394–2398. [PubMed] [Google Scholar]54. Хэнлон К.А., Низгода М., Хамир А.Н., Шумахер К., Копровски Х., Рупрехт К.Э. Первый полевой выпуск рекомбинантного вируса коровьей оспы и бешенства на основе гликольпротеина в Северной Америке. J Дис. дикой природы. 1998;34(2):228–239. [PubMed] [Google Scholar]55. Моримото К., МакГеттиган Дж. П., Фоули Х. Д., Хупер Д. С., Дицшольд Б., Шнелл М. Дж. Генная инженерия живых вакцин против бешенства. вакцина. 2001;19(25-26):3543–3551. [PubMed] [Google Scholar]56. Кливленд С. Эпидемиология и борьба с бешенством.Растущая проблема бешенства в Африке. Transact Royal Soc Trop Med Hyg. 1998;92(2):131–134. [PubMed] [Google Scholar]57. Woldehiwet Z. Бешенство: последние события. рез. вет. 2002;73(1):17–25. [PubMed] [Google Scholar]58. Блэнтон Д.Д., Хэнлон К.А., Рупрехт К.Э. Надзор за бешенством в США в 2006 г. J American Vet Med Assoc. 2007;231(4):540–556. [PubMed] [Google Scholar]59. Лодмелл Д.Л., Рэй Н.Б., Эвальт Л.С. Опосредованная частицами генная пушка вакцинация плазмидной ДНК обеспечивает защитный иммунитет против заражения вирусом бешенства.
вакцина. 2000;18(22):2394–2398. [PubMed] [Google Scholar]54. Хэнлон К.А., Низгода М., Хамир А.Н., Шумахер К., Копровски Х., Рупрехт К.Э. Первый полевой выпуск рекомбинантного вируса коровьей оспы и бешенства на основе гликольпротеина в Северной Америке. J Дис. дикой природы. 1998;34(2):228–239. [PubMed] [Google Scholar]55. Моримото К., МакГеттиган Дж. П., Фоули Х. Д., Хупер Д. С., Дицшольд Б., Шнелл М. Дж. Генная инженерия живых вакцин против бешенства. вакцина. 2001;19(25-26):3543–3551. [PubMed] [Google Scholar]56. Кливленд С. Эпидемиология и борьба с бешенством.Растущая проблема бешенства в Африке. Transact Royal Soc Trop Med Hyg. 1998;92(2):131–134. [PubMed] [Google Scholar]57. Woldehiwet Z. Бешенство: последние события. рез. вет. 2002;73(1):17–25. [PubMed] [Google Scholar]58. Блэнтон Д.Д., Хэнлон К.А., Рупрехт К.Э. Надзор за бешенством в США в 2006 г. J American Vet Med Assoc. 2007;231(4):540–556. [PubMed] [Google Scholar]59. Лодмелл Д.Л., Рэй Н.Б., Эвальт Л.С. Опосредованная частицами генная пушка вакцинация плазмидной ДНК обеспечивает защитный иммунитет против заражения вирусом бешенства. вакцина. 1998;16(2-3):115–118. [PubMed] [Google Scholar] 60. Массон Э., Брюйер-Массон В., Вийом П., Лемойн С., Обер М. Пероральная вакцинация лисиц против бешенства летом с помощью вакцинной приманки VRG. Вет рез. 1999;30(6):595–605. [PubMed] [Google Scholar]61. Вос А., Нойберт А., Поммеренинг Э., Мюллер Т., Донер Л., Нойберт Л. и др. Иммуногенность рекомбинантного аденовируса человека с делецией Е1 против бешенства при различных путях введения. Джей Ген Вирол. 2001; 82: 2191–2197. [PubMed] [Google Scholar]62.Ху Р.Л., Чжан С.Ф., Фукс А.Р., Юань Х., Лю Ю., Ли Х. и др. Профилактика вирусной инфекции бешенства у собак с помощью рекомбинантного собачьего аденовируса типа 2, кодирующего гликопротеин вируса бешенства. Заражение микробами. 2006;8(4):1090–1097. [PubMed] [Google Scholar]63. Бриггс Д.Дж., Банжофф А., Николай Ю., Сириквин С., Думавибхат Б., Тонгсвас С. и др. Реакция антител у пациентов после постконтактной вакцинации против бешенства небольшими внутрикожными дозами очищенной вакцины из клеток куриного эмбриона или очищенной вакцины против бешенства из клеток веро.
вакцина. 1998;16(2-3):115–118. [PubMed] [Google Scholar] 60. Массон Э., Брюйер-Массон В., Вийом П., Лемойн С., Обер М. Пероральная вакцинация лисиц против бешенства летом с помощью вакцинной приманки VRG. Вет рез. 1999;30(6):595–605. [PubMed] [Google Scholar]61. Вос А., Нойберт А., Поммеренинг Э., Мюллер Т., Донер Л., Нойберт Л. и др. Иммуногенность рекомбинантного аденовируса человека с делецией Е1 против бешенства при различных путях введения. Джей Ген Вирол. 2001; 82: 2191–2197. [PubMed] [Google Scholar]62.Ху Р.Л., Чжан С.Ф., Фукс А.Р., Юань Х., Лю Ю., Ли Х. и др. Профилактика вирусной инфекции бешенства у собак с помощью рекомбинантного собачьего аденовируса типа 2, кодирующего гликопротеин вируса бешенства. Заражение микробами. 2006;8(4):1090–1097. [PubMed] [Google Scholar]63. Бриггс Д.Дж., Банжофф А., Николай Ю., Сириквин С., Думавибхат Б., Тонгсвас С. и др. Реакция антител у пациентов после постконтактной вакцинации против бешенства небольшими внутрикожными дозами очищенной вакцины из клеток куриного эмбриона или очищенной вакцины против бешенства из клеток веро. Бык ВОЗ. 2000;78(5):693–698. [Бесплатная статья PMC] [PubMed] [Google Scholar]64. Мадхусудана С.Н., Санджай Т.В., Махендра Б.Дж., Сударшан М.К., Нараяна Д.Х., Гири А. и др. Сравнение безопасности и иммуногенности очищенной вакцины против бешенства из клеток эмбриона цыпленка (PCECV) и очищенной вакцины против бешенства из вероклеточных клеток (PVRV) при внутрикожном введении Тайским Красным Крестом в дозе 0,1 мл. ГумВакцина. 2006;2(5):200–204. [PubMed] [Google Scholar]65. Дрисен Д.В., Фишбейн Д.Б., Кемп Д.Т., Браун Дж. Двухлетнее сравнительное исследование иммуногенности и побочных эффектов очищенной вакцины против бешенства из клеток куриного эмбриона для доконтактной иммунизации.вакцина. 1989;7(5):379–400. [PubMed] [Google Scholar]66. Meslin FX, Kaplan MM, Koprowski H. Лабораторные методы Всемирной организации здравоохранения при бешенстве. 4-е изд. Женева, Швейцария: ВОЗ; 1996. [Google Академия]67. Дрессен Д.В. Глобальный обзор вакцин против бешенства для человека. вакцина. 1997; 15:С2–6.
Бык ВОЗ. 2000;78(5):693–698. [Бесплатная статья PMC] [PubMed] [Google Scholar]64. Мадхусудана С.Н., Санджай Т.В., Махендра Б.Дж., Сударшан М.К., Нараяна Д.Х., Гири А. и др. Сравнение безопасности и иммуногенности очищенной вакцины против бешенства из клеток эмбриона цыпленка (PCECV) и очищенной вакцины против бешенства из вероклеточных клеток (PVRV) при внутрикожном введении Тайским Красным Крестом в дозе 0,1 мл. ГумВакцина. 2006;2(5):200–204. [PubMed] [Google Scholar]65. Дрисен Д.В., Фишбейн Д.Б., Кемп Д.Т., Браун Дж. Двухлетнее сравнительное исследование иммуногенности и побочных эффектов очищенной вакцины против бешенства из клеток куриного эмбриона для доконтактной иммунизации.вакцина. 1989;7(5):379–400. [PubMed] [Google Scholar]66. Meslin FX, Kaplan MM, Koprowski H. Лабораторные методы Всемирной организации здравоохранения при бешенстве. 4-е изд. Женева, Швейцария: ВОЗ; 1996. [Google Академия]67. Дрессен Д.В. Глобальный обзор вакцин против бешенства для человека. вакцина. 1997; 15:С2–6. [PubMed] [Google Scholar]68. Совет Европы (COR) 6-е изд. Страсбург (Германия): Совет Европы; 2007. Европейская комиссия по фармакопее. Вакцина против бешенства (инактивированная) для ветеринарного применения; стр. 3375–3377.[Google Академия] 69. Дрисен Д.В., Хэнлон, Калифорния. Современные рекомендации по профилактике и лечению бешенства. Наркотики. 1998;56(5):801–809. [PubMed] [Google Scholar]70. Лодмелл Д.Л., Эвальт Л.С. Культуральные вакцины против бешенства, восстановленные и хранящиеся при 40°C в течение 1 года перед использованием, защищают мышей от вируса бешенства. вакцина. 2004;22(25-26):3237–3239. [PubMed] [Google Scholar]71. Warrell MJ, Suntharasamai P, Sinhaseni A, Phanfung R, Vincent-Falquet JC, Bunnag D, et al. Экономичный режим вакцины против бешенства из штамма диплоидных клеток человека для постконтактной профилактики.Ланцет. 1983;2(8345):301–304. [PubMed] [Google Scholar]72. Wilde H, Hemachudha T. Насколько безопасно можно снизить содержание антигена в тканевой культуре вакцины против бешенства? вакцина.
[PubMed] [Google Scholar]68. Совет Европы (COR) 6-е изд. Страсбург (Германия): Совет Европы; 2007. Европейская комиссия по фармакопее. Вакцина против бешенства (инактивированная) для ветеринарного применения; стр. 3375–3377.[Google Академия] 69. Дрисен Д.В., Хэнлон, Калифорния. Современные рекомендации по профилактике и лечению бешенства. Наркотики. 1998;56(5):801–809. [PubMed] [Google Scholar]70. Лодмелл Д.Л., Эвальт Л.С. Культуральные вакцины против бешенства, восстановленные и хранящиеся при 40°C в течение 1 года перед использованием, защищают мышей от вируса бешенства. вакцина. 2004;22(25-26):3237–3239. [PubMed] [Google Scholar]71. Warrell MJ, Suntharasamai P, Sinhaseni A, Phanfung R, Vincent-Falquet JC, Bunnag D, et al. Экономичный режим вакцины против бешенства из штамма диплоидных клеток человека для постконтактной профилактики.Ланцет. 1983;2(8345):301–304. [PubMed] [Google Scholar]72. Wilde H, Hemachudha T. Насколько безопасно можно снизить содержание антигена в тканевой культуре вакцины против бешенства? вакцина. 2006;24(10):1489. [PubMed] [Google Scholar]73. Джаиаронсуп В., Ланг Дж., Типконг П., Вималаратне О., Самранватая П., Сайкасем А. и др. Безопасность и эффективность очищенной вероклеточной антирабической вакцины для внутримышечного и внутрикожного введения (результаты проспективного рандомизированного исследования) Вакцина. 1998;16(16):1559–1562. [PubMed] [Google Scholar]74.Раманна Б.С., Редди Г.С., Шринивассан В.А. Вспышка бешенства среди крупного рогатого скота и использование антирабической вакцины на тканевой культуре во время вспышки. J Comm Дис. 1991;23(4):283–285. [PubMed] [Google Scholar]75. Khawplod P, Wilde H, Tantavichien T, Limu-sanno S, Tantavichien T, Mitmoonpitak C, et al. Эффективность, стерильность и иммуногенность вакцины против бешенства на культуре тканей после восстановления и хранения в холодильнике в течение 1 недели. вакцина. 2002;20(17-18):2240–2242. [PubMed] [Google Scholar]76. Quiambao BP, Dimaano EM, Ambas C, Davis R, Banzhoff A, Malerzcyk C.Снижение затрат на постконтактную профилактику бешенства: эффективность 0,1 мл антирабической вакцины PCEC, вводимой внутрикожно с использованием постконтактного режима Тайского Красного Креста, у пациентов, подвергшихся серьезному контакту с лабораторно подтвержденным бешенством животных.
2006;24(10):1489. [PubMed] [Google Scholar]73. Джаиаронсуп В., Ланг Дж., Типконг П., Вималаратне О., Самранватая П., Сайкасем А. и др. Безопасность и эффективность очищенной вероклеточной антирабической вакцины для внутримышечного и внутрикожного введения (результаты проспективного рандомизированного исследования) Вакцина. 1998;16(16):1559–1562. [PubMed] [Google Scholar]74.Раманна Б.С., Редди Г.С., Шринивассан В.А. Вспышка бешенства среди крупного рогатого скота и использование антирабической вакцины на тканевой культуре во время вспышки. J Comm Дис. 1991;23(4):283–285. [PubMed] [Google Scholar]75. Khawplod P, Wilde H, Tantavichien T, Limu-sanno S, Tantavichien T, Mitmoonpitak C, et al. Эффективность, стерильность и иммуногенность вакцины против бешенства на культуре тканей после восстановления и хранения в холодильнике в течение 1 недели. вакцина. 2002;20(17-18):2240–2242. [PubMed] [Google Scholar]76. Quiambao BP, Dimaano EM, Ambas C, Davis R, Banzhoff A, Malerzcyk C.Снижение затрат на постконтактную профилактику бешенства: эффективность 0,1 мл антирабической вакцины PCEC, вводимой внутрикожно с использованием постконтактного режима Тайского Красного Креста, у пациентов, подвергшихся серьезному контакту с лабораторно подтвержденным бешенством животных. вакцина. 2005;23(14):1709–1714. [PubMed] [Google Scholar]77. Сударшан М.К., Мадхусудана С.Н., Махендра Б.Дж., Нараяна Д.Г.А., Гири М.С.А., Попова О. и др. Оценка новой внутрикожной схемы введения очищенной вакцины против бешенства из клеток эмбриона цыпленка с пятью инъекциями в двух местах: рандомизированное открытое исследование с активным контролем на здоровых взрослых добровольцах в Индии.Curr Ther Res. 2005;66(4):323–334. [Бесплатная статья PMC] [PubMed] [Google Scholar]78. Cox JH, Dietzschold B, Schneider G. Гликопротеин вируса бешенства. II. Биологическая и серологическая характеристика. Заразить иммун. 1977; 16 (3): 754–759. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Xiang ZQ, Spitalnik S, Tran M, Wunner WH, Cheng J, Ertl HC. Вакцинация плазмидным вектором, несущим ген гликопротеина вируса бешенства, вызывает защитный иммунитет против вируса бешенства. Вирусология. 1994;199(1):132–140. [PubMed] [Google Scholar]80.Ху Р., Лю Ю., Чжан С., Чжан Ф., Фукс А.Р. Экспериментальная иммунизация кошек рекомбинантной собачьей аденовирусной вакциной против бешенства вызывает длительную реакцию нейтрализующих антител против бешенства.
вакцина. 2005;23(14):1709–1714. [PubMed] [Google Scholar]77. Сударшан М.К., Мадхусудана С.Н., Махендра Б.Дж., Нараяна Д.Г.А., Гири М.С.А., Попова О. и др. Оценка новой внутрикожной схемы введения очищенной вакцины против бешенства из клеток эмбриона цыпленка с пятью инъекциями в двух местах: рандомизированное открытое исследование с активным контролем на здоровых взрослых добровольцах в Индии.Curr Ther Res. 2005;66(4):323–334. [Бесплатная статья PMC] [PubMed] [Google Scholar]78. Cox JH, Dietzschold B, Schneider G. Гликопротеин вируса бешенства. II. Биологическая и серологическая характеристика. Заразить иммун. 1977; 16 (3): 754–759. [Бесплатная статья PMC] [PubMed] [Google Scholar]79. Xiang ZQ, Spitalnik S, Tran M, Wunner WH, Cheng J, Ertl HC. Вакцинация плазмидным вектором, несущим ген гликопротеина вируса бешенства, вызывает защитный иммунитет против вируса бешенства. Вирусология. 1994;199(1):132–140. [PubMed] [Google Scholar]80.Ху Р., Лю Ю., Чжан С., Чжан Ф., Фукс А.Р. Экспериментальная иммунизация кошек рекомбинантной собачьей аденовирусной вакциной против бешенства вызывает длительную реакцию нейтрализующих антител против бешенства.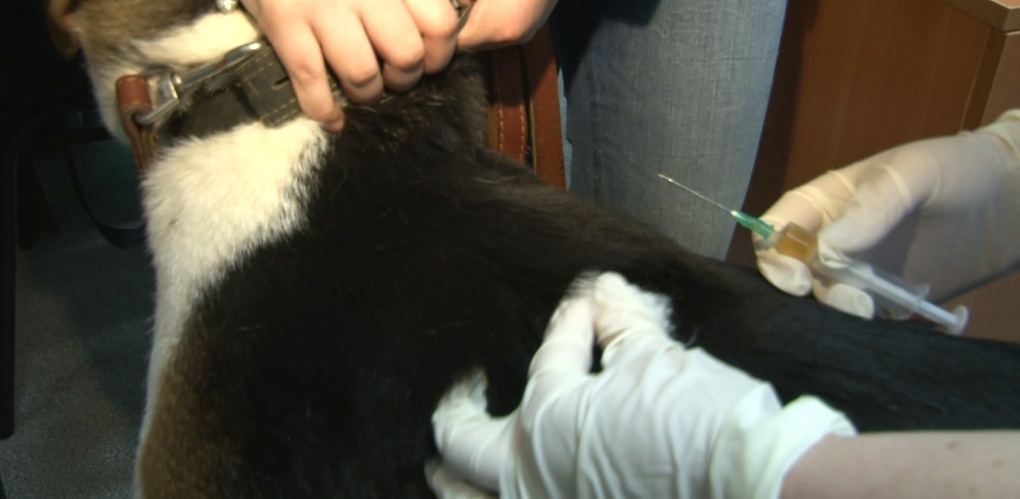 вакцина. 2007;25(29):5301–5307. [PubMed] [Google Scholar]81. Osorio JE, Tomlinson CC, Frank RS, Haanes EJ, Rushlow K, Haynes JR, et al. Иммунизация собак и кошек ДНК-вакциной против вируса бешенства. вакцина. 1999;17(9-10):1109–1116. [PubMed] [Google Scholar]82. Перрин П., Джейкоб Ю., Агилар-Сетьен А., Лоза-Рубио Э., Джаллет С., Демезьер Э. и др.Иммунизация собак ДНК-вакциной индуцирует защиту от вируса бешенства. вакцина. 2000;18(5):479–486. [PubMed] [Google Scholar]83. Bahloul C, Taieb D, Diouani MF, Ahmed SB, Chtourou Y, B'chir BI, et al. Полевые испытания очень мощной ДНК-вакцины против бешенства, которая индуцировала длительные нейтрализующие вирус антитела и защиту у собак в экспериментальных условиях. вакцина. 2006;24(8):1063–1072. [PubMed] [Google Scholar]84. Сугиямаа М., Ито Н. Борьба с бешенством: эпидемиология бешенства в Азии и разработка вакцин против бешенства нового поколения.Comp Immunol Microbiol Infect Dis. 2007;30(5-6):273–286. [PubMed] [Google Scholar]85. Ван И, Сян Зи, Паскиру С, Эртл Х.
вакцина. 2007;25(29):5301–5307. [PubMed] [Google Scholar]81. Osorio JE, Tomlinson CC, Frank RS, Haanes EJ, Rushlow K, Haynes JR, et al. Иммунизация собак и кошек ДНК-вакциной против вируса бешенства. вакцина. 1999;17(9-10):1109–1116. [PubMed] [Google Scholar]82. Перрин П., Джейкоб Ю., Агилар-Сетьен А., Лоза-Рубио Э., Джаллет С., Демезьер Э. и др.Иммунизация собак ДНК-вакциной индуцирует защиту от вируса бешенства. вакцина. 2000;18(5):479–486. [PubMed] [Google Scholar]83. Bahloul C, Taieb D, Diouani MF, Ahmed SB, Chtourou Y, B'chir BI, et al. Полевые испытания очень мощной ДНК-вакцины против бешенства, которая индуцировала длительные нейтрализующие вирус антитела и защиту у собак в экспериментальных условиях. вакцина. 2006;24(8):1063–1072. [PubMed] [Google Scholar]84. Сугиямаа М., Ито Н. Борьба с бешенством: эпидемиология бешенства в Азии и разработка вакцин против бешенства нового поколения.Comp Immunol Microbiol Infect Dis. 2007;30(5-6):273–286. [PubMed] [Google Scholar]85. Ван И, Сян Зи, Паскиру С, Эртл Х. С.Дж. Влияние пассивной иммунизации или материнского иммунитета на гуморальный ответ на генетическую вакцину против вируса бешенства. Дж Вирол. 1998;72(3):1790–1796. [Бесплатная статья PMC] [PubMed] [Google Scholar]86. Faber M, Bette M, Preuss MA, Pulmanausahakul R, Rehnelt J, Schnell MJ, et al. Сверхэкспрессия фактора некроза опухоли альфа рекомбинантным вирусом бешенства ослабляет репликацию в нейронах и предотвращает смертельную инфекцию у мышей.Дж Вирол. 2005;79(24):15405–15416. [Бесплатная статья PMC] [PubMed] [Google Scholar]87. Dietzschold B, Wunner WH, Wiktor TJ, Lopes AD, Lafon M, Smith CL, et al. Характеристика антигенной детерминанты гликопротеина, коррелирующей с патогенностью вируса бешенства. Proc Natl Acad Sci USA. 1983;80(1):70–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]88. Seif I, Coulon P, Rollin PE, Flamand A. Вирулентность бешенства: влияние на патогенность и характеристику последовательности мутаций вируса бешенства, затрагивающих антигенный сайт III гликопротеина.
С.Дж. Влияние пассивной иммунизации или материнского иммунитета на гуморальный ответ на генетическую вакцину против вируса бешенства. Дж Вирол. 1998;72(3):1790–1796. [Бесплатная статья PMC] [PubMed] [Google Scholar]86. Faber M, Bette M, Preuss MA, Pulmanausahakul R, Rehnelt J, Schnell MJ, et al. Сверхэкспрессия фактора некроза опухоли альфа рекомбинантным вирусом бешенства ослабляет репликацию в нейронах и предотвращает смертельную инфекцию у мышей.Дж Вирол. 2005;79(24):15405–15416. [Бесплатная статья PMC] [PubMed] [Google Scholar]87. Dietzschold B, Wunner WH, Wiktor TJ, Lopes AD, Lafon M, Smith CL, et al. Характеристика антигенной детерминанты гликопротеина, коррелирующей с патогенностью вируса бешенства. Proc Natl Acad Sci USA. 1983;80(1):70–74. [Бесплатная статья PMC] [PubMed] [Google Scholar]88. Seif I, Coulon P, Rollin PE, Flamand A. Вирулентность бешенства: влияние на патогенность и характеристику последовательности мутаций вируса бешенства, затрагивающих антигенный сайт III гликопротеина. Дж Вирол. 1985;53(3):926–934. [Бесплатная статья PMC] [PubMed] [Google Scholar]89. Mebatsion T. Обширная аттенуация вируса бешенства путем одновременной модификации сайта связывания легкой цепи динеина в белке P и замены Arg333 в белке G. Дж Вирол. 2001;75(23):11496–11502. [Бесплатная статья PMC] [PubMed] [Google Scholar]90. Faber M, Pulmanausahakul R, Hodawadekar SS, Spitsin S, McGettigan JP, Schnell MJ, et al. Сверхэкспрессия гликопротеина вируса бешенства приводит к усилению апоптоза и противовирусного иммунного ответа.Дж Вирол. 2002;76(7):3374–3381. [Бесплатная статья PMC] [PubMed] [Google Scholar]91. Брзска К., Финке С., Конзельманн К.К. Идентификация антагониста альфа/бета-интерферона вируса бешенства: фосфопротеин Р препятствует фосфорилированию регуляторного фактора интерферона 3. J Virol. 2005;79(12):7673–7681. [Бесплатная статья PMC] [PubMed] [Google Scholar]92. Ито Н., Такаяма М., Ямада К., Хосокава Дж., Сугияма М., Минамото Н. Улучшенное восстановление вируса бешенства из клонированной кДНК с использованием системы обратной генетики без вируса осповакцины.
Дж Вирол. 1985;53(3):926–934. [Бесплатная статья PMC] [PubMed] [Google Scholar]89. Mebatsion T. Обширная аттенуация вируса бешенства путем одновременной модификации сайта связывания легкой цепи динеина в белке P и замены Arg333 в белке G. Дж Вирол. 2001;75(23):11496–11502. [Бесплатная статья PMC] [PubMed] [Google Scholar]90. Faber M, Pulmanausahakul R, Hodawadekar SS, Spitsin S, McGettigan JP, Schnell MJ, et al. Сверхэкспрессия гликопротеина вируса бешенства приводит к усилению апоптоза и противовирусного иммунного ответа.Дж Вирол. 2002;76(7):3374–3381. [Бесплатная статья PMC] [PubMed] [Google Scholar]91. Брзска К., Финке С., Конзельманн К.К. Идентификация антагониста альфа/бета-интерферона вируса бешенства: фосфопротеин Р препятствует фосфорилированию регуляторного фактора интерферона 3. J Virol. 2005;79(12):7673–7681. [Бесплатная статья PMC] [PubMed] [Google Scholar]92. Ито Н., Такаяма М., Ямада К., Хосокава Дж., Сугияма М., Минамото Н. Улучшенное восстановление вируса бешенства из клонированной кДНК с использованием системы обратной генетики без вируса осповакцины. Микробиол Иммунол. 2003; 47: 613–617. [PubMed] [Google Scholar]93. Ито Н., Такаяма М., Ямада К., Сугияма М., Минамото Н. Спасение вируса бешенства из клонированной кДНК и идентификация гена, связанного с патогенностью: ген гликопротеина связан с вирулентностью для взрослых мышей. Дж Вирол. 2001;75(19):9121–9128. [Бесплатная статья PMC] [PubMed] [Google Scholar]94. Мебацион Т., Вейланд Ф., Конзельманн К.К. Белок матрикса вируса бешенства отвечает за сборку и отпочкование пулевидных частиц и взаимодействует с трансмембранным шиповидным гликопротеином G.Дж Вирол. 2007;73(1):242–250. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Ито Н., Сугияма М., Ямада К., Симидзу К., Такаяма М., Хосокава Дж. Характеристика вируса бешенства с дефицитом гена М с преимуществами эффективной иммунизации и безопасности в качестве вакцинного штамма. Микробиол Иммунол. 2005; 49: 971–979. [PubMed] [Google Scholar]96. ВОЗ. Женева; 2004. Консультация экспертов по бешенству. (Серия технических отчетов ВОЗ-931) [Google Scholar]97.
Микробиол Иммунол. 2003; 47: 613–617. [PubMed] [Google Scholar]93. Ито Н., Такаяма М., Ямада К., Сугияма М., Минамото Н. Спасение вируса бешенства из клонированной кДНК и идентификация гена, связанного с патогенностью: ген гликопротеина связан с вирулентностью для взрослых мышей. Дж Вирол. 2001;75(19):9121–9128. [Бесплатная статья PMC] [PubMed] [Google Scholar]94. Мебацион Т., Вейланд Ф., Конзельманн К.К. Белок матрикса вируса бешенства отвечает за сборку и отпочкование пулевидных частиц и взаимодействует с трансмембранным шиповидным гликопротеином G.Дж Вирол. 2007;73(1):242–250. [Бесплатная статья PMC] [PubMed] [Google Scholar]95. Ито Н., Сугияма М., Ямада К., Симидзу К., Такаяма М., Хосокава Дж. Характеристика вируса бешенства с дефицитом гена М с преимуществами эффективной иммунизации и безопасности в качестве вакцинного штамма. Микробиол Иммунол. 2005; 49: 971–979. [PubMed] [Google Scholar]96. ВОЗ. Женева; 2004. Консультация экспертов по бешенству. (Серия технических отчетов ВОЗ-931) [Google Scholar]97. Всемирная организация здравоохранения. Экспресс-тест ингибирования флуоресцентного фокуса (RFFIT) для определения антител, нейтрализующих вирус бешенства.В: Meslin FX, Kaplan MM, Koprowski H, редакторы. Лабораторные методы лечения бешенства. 4-е изд. Женева: ВОЗ; 1996. С. 181–192. [Google Академия]98. Мэнсфилд К.Л., Берр П.Д., Снодграсс Д.Р., Сэйерс Р., Фукс А.Р. Факторы, влияющие на серологический ответ собак и кошек на вакцинацию против бешенства. Ветеринар Рек. 2004;154(14):423–426. [PubMed] [Google Scholar]99. Мур С.М., Рик Т.А., Дэвис Р.Д., Бриггс Д.Дж. Влияние гомологичных и гетерологичных штаммов контрольного вируса на результаты серологических тестов нейтрализации бешенства.Биопрепараты. 2005;33(4):269–276. [PubMed] [Google Scholar]
Всемирная организация здравоохранения. Экспресс-тест ингибирования флуоресцентного фокуса (RFFIT) для определения антител, нейтрализующих вирус бешенства.В: Meslin FX, Kaplan MM, Koprowski H, редакторы. Лабораторные методы лечения бешенства. 4-е изд. Женева: ВОЗ; 1996. С. 181–192. [Google Академия]98. Мэнсфилд К.Л., Берр П.Д., Снодграсс Д.Р., Сэйерс Р., Фукс А.Р. Факторы, влияющие на серологический ответ собак и кошек на вакцинацию против бешенства. Ветеринар Рек. 2004;154(14):423–426. [PubMed] [Google Scholar]99. Мур С.М., Рик Т.А., Дэвис Р.Д., Бриггс Д.Дж. Влияние гомологичных и гетерологичных штаммов контрольного вируса на результаты серологических тестов нейтрализации бешенства.Биопрепараты. 2005;33(4):269–276. [PubMed] [Google Scholar]Режим доконтактной профилактики бешенства: укусы животных и риск бешенства
На этой странице:
Схема доконтактной профилактики бешенства
Кто должен проходить доконтактную профилактику бешенства?
Серия предэкспозиционной вакцинации против бешенства
Титры антител и ревакцинация
Лаборатории, предлагающие RFFIT определение титра антирабических антител
Схема доконтактной профилактики бешенства
Предэкспозиционная вакцинация против бешенства упрощает постэкспозиционное лечение бешенства и может защитить в случаях невыявленного контакта с бешенством или при отсрочке постэкспозиционного лечения. Это не устраняет необходимости в соответствующем лечении после известного контакта с вирусом бешенства.
Это не устраняет необходимости в соответствующем лечении после известного контакта с вирусом бешенства.
Кто должен пройти доконтактную профилактику бешенства?
- Ветеринары, ветеринарные техники, специалисты по контролю за животными, реабилитаторы диких животных, работники зоопарков, некоторые работники лабораторий и другие лица, имеющие регулярный контакт с потенциально опасными для бешенства видами животных.
- Международные путешественники в районы, эндемичные по собачьему бешенству, которые могут контактировать с собаками или дикими животными и где доступ к медицинской помощи и соответствующим биологическим препаратам может быть ограничен.
Серия прививок от бешенства до контакта
- Три дозы вакцины против бешенства по 1,0 мл вводят внутримышечно, одну инъекцию в день, на 0, 7, 21 или 28 дни в дельтовидную область у взрослых или в переднебоковую часть бедра у маленьких детей.
- Можно использовать диплоидно-клеточную вакцину человека (HDVC) или вакцину из очищенных клеток куриного эмбриона (PCEC), хотя рекомендуется начинать и завершать серию вакцин одним и тем же вакцинным продуктом.

- Не следует указывать HRIG.
Титры антител и ревакцинация
- После первоначальной серии прививок от бешенства лицам, занимающимся профессиями высокого риска, следует периодически проверять титры вируснейтрализующих антител против бешенства (Таблица 5: Рекомендации по борьбе с бешенством для лиц, привитых до контакта (PDF)).
- Каждые 6 месяцев у лиц из категории постоянного риска.
- Каждые 2 года для лиц из категории частых рисков.
- Каждые 6 месяцев у лиц из категории постоянного риска.
- RFFIT (ссылка № 7) является единственным рекомендуемым тестом для определения уровней вируснейтрализующих антител против вируса бешенства. Другие доступные тесты на титр (включая тест ELISA) не рекомендуются для этой цели.
- В настоящее время существует два рабочих руководства (или рекомендуемых пороговых значений) для уровней титра антител, ниже которых вакцинированный против бешенства человек должен получить бустерную вакцинацию.

- ACIP (References #1) рекомендует проводить однократную ревакцинацию против бешенства, когда титр падает ниже титра, соответствующего полной нейтрализации при разведении сыворотки ≥ 1:5 с помощью быстрого флуоресцентного теста ингибирования фокуса (RFFIT), вируса тест на нейтрализацию.Полная нейтрализация вируса в разведении 1:5 приблизительно равна титру 0,1-0,2 МЕ/мл, в зависимости от лаборатории.
- MDH обычно рекомендует использовать рекомендации ACIP.
- ВОЗ рекомендует провести однократную ревакцинацию против бешенства, когда титр вакцины RFFIT падает ниже 0,5 МЕ/мл.
- Медицинские работники должны принимать во внимание риск заражения пациента, время до следующего теста на титр, предыдущие результаты титра на бешенство, состояние здоровья и доступность медицинской помощи в случае потенциального контакта при определении того, когда следует вводить бустерную дозу вакцины против бешенства пациенту.
 .
.
- ACIP (References #1) рекомендует проводить однократную ревакцинацию против бешенства, когда титр падает ниже титра, соответствующего полной нейтрализации при разведении сыворотки ≥ 1:5 с помощью быстрого флуоресцентного теста ингибирования фокуса (RFFIT), вируса тест на нейтрализацию.Полная нейтрализация вируса в разведении 1:5 приблизительно равна титру 0,1-0,2 МЕ/мл, в зависимости от лаборатории.
Лаборатории, предлагающие RFFIT определение титра антирабических антител
Для обоих требуется 2,0 мл сыворотки.
Лаборатория бешенства
Канзасский государственный университет
2005 Круг Исследовательского Парка
Манхэттен, Канзас 66502
785-532-4483
Тестирование в KSU также можно запросить через Quest Labs
как титр конечной точки реакции на вакцину против бешенства (заказ № 5789)
Атланта Хелс Ассошиэйтс
309 Пиркл Роуд, офис D-300
Каммингс, Джорджия 30040
1-800-717-5612
Вакцина против SARS-CoV-2 с инактивированным вектором вируса бешенства предотвращает болезнь у модели сирийского хомяка
Abstract
Коронавирус тяжелого острого респираторного синдрома 2 (SARS-CoV-2) — это новый коронавирус, вызвавший всемирную пандемию. Хотя заболевание человека часто протекает бессимптомно, у некоторых развиваются тяжелые заболевания, такие как пневмония, дыхательная недостаточность и смерть. Существует острая необходимость в вакцине для предотвращения его быстрого распространения, поскольку бессимптомные инфекции составляют до 40% случаев передачи. Здесь мы дополнительно оценили инактивированную векторную вакцину против бешенства SARS-CoV-2 S1 CORAVAX на модели сирийского хомяка. CORAVAX с адъювантом MPLA-AddaVax, агонистом TRL4, индуцировал высокие уровни нейтрализующих антител и вызывал сильный иммунный ответ, обусловленный Th2.Вакцинированные хомяки были защищены от потери веса и репликации вируса в легких и носовых раковинах через три дня после заражения SARS-CoV-2. CORAVAX также предотвращал заболевания легких, о чем свидетельствует значительное снижение патологии легких. В этом исследовании CORAVAX подчеркивается как безопасная, иммуногенная и эффективная вакцина, которая требует дальнейшей оценки в испытаниях на людях.
Хотя заболевание человека часто протекает бессимптомно, у некоторых развиваются тяжелые заболевания, такие как пневмония, дыхательная недостаточность и смерть. Существует острая необходимость в вакцине для предотвращения его быстрого распространения, поскольку бессимптомные инфекции составляют до 40% случаев передачи. Здесь мы дополнительно оценили инактивированную векторную вакцину против бешенства SARS-CoV-2 S1 CORAVAX на модели сирийского хомяка. CORAVAX с адъювантом MPLA-AddaVax, агонистом TRL4, индуцировал высокие уровни нейтрализующих антител и вызывал сильный иммунный ответ, обусловленный Th2.Вакцинированные хомяки были защищены от потери веса и репликации вируса в легких и носовых раковинах через три дня после заражения SARS-CoV-2. CORAVAX также предотвращал заболевания легких, о чем свидетельствует значительное снижение патологии легких. В этом исследовании CORAVAX подчеркивается как безопасная, иммуногенная и эффективная вакцина, которая требует дальнейшей оценки в испытаниях на людях.
Резюме автора
Мы разработали векторную платформу инактивированной вакцины против вируса бешенства, которая использовалась для разработки вакцины против SARS-CoV-2 (CORAVAX).CORAVAX индуцировал высокие уровни нейтрализующих антител против SARS-CoV-2. Здесь мы показываем, что вакцинированные хомяки, лучшая модель животных для COVID-19, были защищены от репликации вируса, что указывает на то, что эта вакцина может остановить передачу. CORAVAX также предотвращал заболевания легких. Вакцины против бешенства использовались более чем у 100 миллионов человек во всем мире, они безопасны и применяются у детей и беременных женщин. Таким образом, ожидается, что CORAVAX будет генерировать сильный иммунный ответ против SARS-CoV-2 у людей, который также может имитировать долгосрочную защиту, наблюдаемую в вакцинах против бешенства.
Образец цитирования: Куруп Д., Малерб Д.С., Вирблих С., Ламберт Р., Ронк А.Дж., Забихи Диба Л. и др. (2021) Вакцина против SARS-CoV-2 с вектором инактивированного вируса бешенства предотвращает заболевание на модели сирийского хомяка. PLoS Pathog 17 (3):
е1009383.
https://doi.org/10.1371/journal.ppat.1009383
PLoS Pathog 17 (3):
е1009383.
https://doi.org/10.1371/journal.ppat.1009383
Редактор: Бенхур Ли, Медицинская школа Икана на горе Синай, США
Получено: 21 января 2021 г.; Принято: 12 февраля 2021 г .; Опубликовано: 25 марта 2021 г.
Copyright: © 2021 Kurup et al.Это статья с открытым доступом, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все соответствующие данные содержатся в рукописи и файлах вспомогательной информации.
Финансирование: Этот проект частично финансировался за счет гранта Содружества Пенсильвании, Департамента общественного и экономического развития» и гранта от Bharat Biotech, Индия. Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Спонсоры не участвовали в разработке исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Я ознакомился с политикой журнала, и авторы этой рукописи имеют следующие конкурирующие интересы: «M.J.S., C.W. и D.K. являются соавторами заявки на патент «Вакцина против коронавирусной болезни (COVID-19)». А.Б., Д.К.М., А.Дж.Р., Р.Л. и Л.З.Б. не иметь конкурирующих интересов».
Введение
Более 150 вакцин против SARS-CoV-2 проходят доклинические испытания, и более 51 вакцины-кандидата проходят испытания на людях [1].К ним относятся вакцины на основе аденовирусов и других вирусных векторов, а также вакцины на основе белков, ДНК и мРНК [2]. Эти подходы к вакцинам имеют различные преимущества и недостатки. мРНК-вакцины, в том числе 2 вакцины против коронавируса, одобренные FDA США от Moderna и Pfizer-BioNTech, могут производиться эффективно, но их производство может быть дорогостоящим и чувствительным к температуре [3]; кроме того, остаются без ответа вопросы о продолжительности иммунного ответа на мРНК-вакцины и блокируют ли они передачу инфекции. Между тем вакцины на основе ДНК выигрывают от температурной стабильности и низких производственных затрат, но их иммуногенность вызывает озабоченность, а необходимость многократной вакцинации ставит под сомнение их осуществимость [4]. Вакцины на основе вирусоподобных частиц (VLP) и рекомбинантных белков обладают превосходным преимуществом в плане безопасности, поскольку они не реплицируются в организме хозяина, и часто их также можно сделать более стабильными к температуре. Однако вакцины на основе VLP не всегда столь же иммуногенны, как вирусные векторные вакцины, способные к репликации или дефицитные по репликации, и часто требуют адъюванта для повышения их иммуногенности до адекватного защитного уровня [5,6].Наконец, преимущество вакцин на основе вирусных векторов заключается в том, что они обычно дешевле в производстве, эффективны после однократной вакцинации и часто обладают высокой иммуногенностью [1,7–9], но вакцины на основе живых вирусных вакцин иногда терпят неудачу из-за соображений безопасности и масштабируемости производства.
Между тем вакцины на основе ДНК выигрывают от температурной стабильности и низких производственных затрат, но их иммуногенность вызывает озабоченность, а необходимость многократной вакцинации ставит под сомнение их осуществимость [4]. Вакцины на основе вирусоподобных частиц (VLP) и рекомбинантных белков обладают превосходным преимуществом в плане безопасности, поскольку они не реплицируются в организме хозяина, и часто их также можно сделать более стабильными к температуре. Однако вакцины на основе VLP не всегда столь же иммуногенны, как вирусные векторные вакцины, способные к репликации или дефицитные по репликации, и часто требуют адъюванта для повышения их иммуногенности до адекватного защитного уровня [5,6].Наконец, преимущество вакцин на основе вирусных векторов заключается в том, что они обычно дешевле в производстве, эффективны после однократной вакцинации и часто обладают высокой иммуногенностью [1,7–9], но вакцины на основе живых вирусных вакцин иногда терпят неудачу из-за соображений безопасности и масштабируемости производства. , и они обычно требуют низкой температуры хранения [8]. Однако недостатки вирусных векторных вакцин в значительной степени преодолеваются, когда они основаны на инактивированном вирусе.
, и они обычно требуют низкой температуры хранения [8]. Однако недостатки вирусных векторных вакцин в значительной степени преодолеваются, когда они основаны на инактивированном вирусе.
Используя этот подход, мы разработали инактивированную вирусную векторную вакцину против SARS-CoV-2 на основе вируса бешенства (RABV).Ранее мы использовали этот подход для разработки инактивированных вакцин на основе RABV для ряда других патогенов человека (например, вируса Эбола, вируса Марбург, вируса лихорадки Ласса и других) [10–27]. Было доказано, что эти вакцины на основе вируса бешенства обладают высокой иммуногенностью и защищают от нескольких возникающих вирусных инфекций и бактериальных токсинов, а также безопасны и стабильны при температуре [28]. Сама вакцина RABV безопасно использовалась в течение десятилетий у более чем 100 миллионов человек, включая детей, беременных женщин и пожилых людей, и доказано, что она приводит к длительному иммунитету [29].
CORAVAX, наша антирабическая векторная вакцина против SARS COV-2, экспрессирует S1-домен шиповидного (S) белка SARS-CoV-2, слитого с частью N-концевого домена гликопротеина RABV (G), и включается в частицы RABV. У мышей, иммунизированных адъювантом CORAVAX, вырабатывались мощные нейтрализующие антитела примерно в 5–10 раз выше, чем вируснейтрализующие антитела (VNA), обнаруженные в сыворотке реконвалесцентов от людей, инфицированных SARS-CoV-2 [30]. Здесь, чтобы узнать больше, мы оценили эффективность CORAVAX на модели сирийского хомяка для SARS-CoV-2, которая в настоящее время считается лучшей моделью для изучения методов лечения COVID-19.Наши результаты показали, что две иммунизации вакциной CORAVAX с адъювантом индуцировали высокий уровень VNA и элиминировали инфекционный SARS-CoV-2 из легких и носовых раковин на 3-й день после заражения. Более того, патология, вызванная SARS-CoV-2, была уменьшена лишь за счет некоторой ранней инфильтрации клеток в легочную ткань. В совокупности это исследование показывает, что CORAVAX требует дальнейшего развития в качестве профилактической вакцины для человека.
У мышей, иммунизированных адъювантом CORAVAX, вырабатывались мощные нейтрализующие антитела примерно в 5–10 раз выше, чем вируснейтрализующие антитела (VNA), обнаруженные в сыворотке реконвалесцентов от людей, инфицированных SARS-CoV-2 [30]. Здесь, чтобы узнать больше, мы оценили эффективность CORAVAX на модели сирийского хомяка для SARS-CoV-2, которая в настоящее время считается лучшей моделью для изучения методов лечения COVID-19.Наши результаты показали, что две иммунизации вакциной CORAVAX с адъювантом индуцировали высокий уровень VNA и элиминировали инфекционный SARS-CoV-2 из легких и носовых раковин на 3-й день после заражения. Более того, патология, вызванная SARS-CoV-2, была уменьшена лишь за счет некоторой ранней инфильтрации клеток в легочную ткань. В совокупности это исследование показывает, что CORAVAX требует дальнейшего развития в качестве профилактической вакцины для человека.
Результаты
Иммуногенность CORAVAX у сирийских хомячков
Вакцина против бешенства CORAVAX с вектором SARS COV-2 была получена путем вставки субъединицы S1 спайка SARS-CoV-2 в штамм вакцины против бешенства SAD-B19.Чтобы способствовать включению домена S1, мы подготовили слитый белок между SARS-CoV-2 S1 и RABV G. Для этого подхода N-концевые 682 а.о. SARS-CoV-2 S1 были слиты с укороченным гликопротеином RABV, который включает 31 а.о. эктодомена (ED) RABV G и полный цитоплазматический домен (CD) и трансмембранный домен RABV G, чтобы обеспечить включение химерного гликопротеина в вирионы RABV. Ранее мы показали, что CORAVAX индуцирует высокие вируснейтрализующие антитела в виде живой или инактивированной вакцины у мышей [30].Здесь мы расширяем эти исследования на более актуальной модели тяжелого заболевания сирийского хомяка SARS CoV-2.
Для оценки иммуногенности и эффективности вакцины CORAVAX у золотистых сирийских хомяков мы вакцинировали каждую группу, состоящую из 12 животных, либо 10 мкг инактивированного CORAVAX, либо контрольной вакциной FILORAB1 (вакцина против бешенства, векторизованная Эбола), с адъювантом MPLA-AddaVax в виде инъекции 100 мкл. объем внутримышечно (рис. 1А). Животные получали примирование на 0-й день и бустер на 28-й день.Кровь собирали в дни -2, 26 и 56 (рис. 1В). На 60-й день вакцинированных и контрольных хомяков интраназально заражали дозой 10 5 БОЕ изолята SARS-CoV-2 USA_WA1/2020 [31].
Рис. 1. Вакцинные конструкции и схема вакцинации.
A) Схематическое изображение CORAVAX, конструкции вакцины против SARS-CoV-2 на основе вируса бешенства, в которой кДНК химерного белка G SARS-CoV-2 S1 RABV была встроена между генами N и P RABV, полученного из SAD-B19. вектор вирусной вакцины BNSP333 и контрольная вакцина FILORAB1, вакцина Эбола на основе вируса бешенства, используемая в этом исследовании.B) Сирийских хомяков иммунизировали на 0-й и 28-й день 10 мкг химически инактивированного CORAVAX или FILORAB1 с адъювантом MPLA-AddaVax. На 60-й день животных заражали дозой 10 5 БОЕ изолята SARS-CoV-2 USA_WA1/2020. Сыворотку собирали у каждого хомяка на -2, 26, 56, 63 и 75 дни для анализа. Животных подвергали некропсии на 63-й день (3-й день ПК) и 75 день (15-й день ПК).
https://doi.org/10.1371/journal.ppat.1009383.g001
На следующем этапе сыворотки иммунизированных хомяков и контрольных животных были проанализированы на специфические ответы антител против SARS CoV-2 с помощью ИФА, специфичного для SARS-CoV-2 S1. и сайт связывания рецептора (RBD) (рис. 2).Высокие титры специфических IgG-ответов SARS-COV-2 S1 были обнаружены у хомяков, вакцинированных CORAVAX, на 26-й день без существенных различий в титрах антител на 56-й день (рис. 2А). Как и ожидалось, у контрольных животных, вакцинированных вакциной против EBOV FILORAB1, не было обнаружено иммунного ответа S1 на SARS-CoV-2. Как ранее наблюдалось для других инактивированных и адъювантных вакцин на основе RABV, CORAVAX индуцировал иммунный ответ, смещенный на Th2, о чем свидетельствуют высокие ответы SARS CoV-2 S1 IgG2/3, обнаруженные на 26 и 56 дни (рис. 2B).Мы не смогли обнаружить S1-специфические ответы IgG1 ни у одного из хомяков. Подобно ответам, обнаруженным с помощью ИФА на SARS CoV-2 S1, мы наблюдали высокие титры ВНА SARS-CoV-2 со средними титрами 976 ± SD 685 на 56-й день (рис. 2C). Следует отметить, что VNA против SARS-CoV-2 не были обнаружены у животных, иммунизированных FILORAB1, до заражения (рис. 2C).
Рис. 2. Иммунные реакции на SARS CoV-2.
Образцы сыворотки, взятые у каждого хомяка, оценивали на S-специфические иммунные ответы против SARS-CoV-2 с помощью A) ELISA, ответы IgG против SARS CoV-2 S1, представленные в виде титров EC50 с течением времени, B) ELISA, Anti-SARS CoV -2 ответы IgG2/3, C) антитела, нейтрализующие вирус, и D) ELISA, ответы Anti-SARS COV-2 S RBD IgG.Группа вакцины CORAVAX показана синим цветом, а группа FILORAB1 — черным. Для AD показаны средние титры ± SD для каждой группы в момент времени. Значения P, определенные с помощью теста Манна-Уитни. Показаны только существенные различия.
https://doi.org/10.1371/journal.ppat.1009383.g002
Затем мы проанализировали иммунные реакции после заражения (п.к.). К 63-му дню, через 3 дня после начала, мы наблюдали значительное снижение (P = 0,0069) ответов S1 IgG у животных, вакцинированных CORAVAX, в то время как у контрольных хомяков (FILORAB1) не наблюдалось S1-специфических ответов IgG (FILORAB1) (рис. 2A–2C).К 75 дню у хомяков, вакцинированных CORAVAX и FILORAB1, и зараженных ими, были обнаружены S1-специфические IgG и VNA (фиг. 2A, 2B и 2C). Однако как S1-специфические IgG, так и VNA были значительно выше у животных, вакцинированных CORAVAX, на 75-й день (рис. 2A–2C). Более того, п.к. Вакцинированные CORAVAX животные показали более сильный иммунный ответ, основанный на Th2, по сравнению с контрольными животными FILORAB1, о чем свидетельствуют ответы IgG2/3 (рис. 2B). В дополнение к антителам, направленным против рецептор-связывающего домена (RBD) SARS-CoV-2, высокие титры RBD-специфических IgG были обнаружены у животных, вакцинированных CORAVAX, на 56-е сутки, а также в р.в. на 63-й и 75-й дни. Интересно, что титры RBD IgG не обнаруживались у контрольных животных, вакцинированных FILORAB1, на 63-й день, но были выше, чем титры ELISA, обнаруженные у животных, вакцинированных CORAVAX, на 75-й день, что бросает вызов догме о том, что высокий титр ELISA против RBD предсказывает VNA. против SARS-CoV-2 (рис. 2D).
CORAVAX вызывает мощный иммунный ответ против RABV
Мы также проанализировали ВНА, индуцируемый двумя вакцинами против RABV. CORAVAX — это вакцина как против SARS-CoV-2, так и против RABV, и в значительной части мира RABV по-прежнему представляет собой серьезную проблему, ежегодно убивая около 55 000 человек, в основном детей.Мы обнаружили титр нейтрализующих антител против RABV выше стандарта ВОЗ 0,5 МЕ у животных, вакцинированных FILORAB1 и CORAVAX, без существенных различий (рис. 3).
CORAVAX защищает хомяков от потери веса и вирусной нагрузки в легких и носовых раковинах после заражения SARS CoV-2
На 60-й день хомяков интраназально заразили 10 5 БОЕ изолята SARS-CoV-2 USA_WA1/2020 и наблюдали в течение 15 дней. Вакцинированные CORAVAX животные показали значительно меньшую потерю веса, чем контрольные животные FILORAB1 (P = 0.0098), которые потеряли более 10% веса и восстановились только на 11-й день (рис. 4). На 3-й и 15-й дни половину хомяков в каждой исследовательской группе подвергали эвтаназии, собирали легкие и носовые раковины и выделяли вирус для определения вирусной нагрузки с помощью анализа уменьшения бляшек (рис. 5А и 5В). Кроме того, количество копий вируса анализировали с помощью анализа RT-qPCR (фиг. 5C и 5D). Отсутствие потери массы тела совпадало с отсутствием какого-либо инфекционного вируса в легких и носовых раковинах вакцинированных КОРАВАКС животных на 3-и и 15-е сутки.в. (Фиг.5А и 5В).
Рис. 4. Масса тела хомяка после заражения SARS CoV-2.
Хомяков вакцинировали на 0 и 28 день, интраназально заразили 10 5 БОЕ SARS-CoV-2 на 60 день. Процентное изменение массы тела. Группа вакцины CORAVAX показана синим цветом, а группа FILORAB1 — черным. N = 12 для группы FILORAB1 (6 хомяков усыпили на 3-й день ПК) и N = 11 для группы CORAVAX (6 хомяков подвергли эвтаназии на 3-й день ПК). Значение Р массы тела, определенное с помощью теста Уилкоксона.Р > 0,123 (нс), Р < 0,033 (*), Р < 0,002 (**), Р < 0,001 (***).
https://doi.org/10.1371/journal.ppat.1009383.g004
Рис. 5. Вирусная нагрузка тканей SARS-CoV-2 у хомяков.
Хомяков интраназально заражали 10 5 БОЕ SARS-CoV-2, и половину животных в каждой группе подвергали эвтаназии на 3-й и 15-й день после заражения. Правое легкое (A, C) и носовые раковины (B, D) каждого животного гомогенизировали в среде, и вирусную нагрузку определяли с помощью анализа бляшек на клетках Vero E6 (A, B) или с помощью qRT-PCR (C, D).Предел обнаружения для анализа бляшек составлял 70 БОЕ на легкое и 35 БОЕ на носовую раковину. Предел обнаружения для анализа qRT-PCR составляет 10 копий. Группа вакцины CORAVAX показана синим цветом, а группа FILORAB1 — черным. Данные представляют собой среднее значение ± стандартное отклонение, N = 6 для группы FILORAB1, 3-й и 15-й день, временные точки, и N = 6 для группы CORAVAX, 3-й день, и N = 5 для группы CORAVAX, 15-й день. Значения P, определенные с помощью теста Манна-Уитни. Показаны только существенные различия.
https://дои.org/10.1371/journal.ppat.1009383.g005
В отличие от животных, иммунизированных CORAVAX, контрольные животные FILORAB1 имели высокие титры инфекционного вируса в легких и носовых раковинах на 3-й день pc Как и ожидалось, обе группы избавились от SARS- КоВ-2 15 дней.
Аналогичная тенденция между двумя группами была обнаружена при анализе РНК-копий SARS-CoV-2 с помощью ОТ-ПЦР. У вакцинированных CORAVAX животных было значительно снижено количество копий РНК в легких и носовых раковинах при вскрытии (3-й день и 15-й день).c.), чем контрольная группа FILORAB1 (рис. 5C и 5D). Наличие вирусной РНК при отсутствии инфекционного SARS-CoV-2 хорошо известно и основано на стабильности генома SARS-CoV-2 [32,33]. Однако следует отметить, что примерно в 1000 раз более низкое число копий у животных, вакцинированных CORAVAX, указывает на значительное снижение репликации вируса с помощью CORAVAX.
Вакцинированные CORAVAX животные имеют значительно меньше патологий легких, чем контрольные животные
Срезы легких собирали у контрольных и вакцинированных животных на 3-й и 15-й дни.в. (рис. 6 и 7). Разделы оценивались слепым методом. Гистопатологические изменения, соответствующие вирусной интерстициальной пневмонии, были отмечены у всех животных, независимо от лечения или времени сбора (рис. 6, репрезентативные изображения патологии; рис. 7A и 7B означают общие баллы патологии). К ним относятся консолидация, распространенное утолщение альвеолярных перегородок и патология дыхательных путей, состоящая из гиперплазии эпителия дыхательных путей и накопления воспалительных клеток в дыхательных путях, что иногда приводит к обструкции просвета.На 3-й день у животных, вакцинированных CORAVAX, средние показатели патологии были значительно ниже. В частности, были улучшены показатели компонентов для размера и количества воспалительных очагов и патологии дыхательных путей (рис. 7А). Животные избавились от вируса на 15-й день (рис. 5А и 5В), и в соответствии с ожидаемым восстановлением повреждения тканей после элиминации мы наблюдали снижение патологии как у животных, вакцинированных CORAVAX, так и у контрольных животных, вакцинированных FILORAB1 (рис. 7В).
Рис. 6. Патология легких, вызванная SARS-CoV 2.
Репрезентативные гистологические изображения инфекции SARS-CoV-2 в легких контрольных и вакцинированных хомячков.A и B, изображения с малым увеличением, 3-й день p.c. легкие. A: контроль FILORAB1, B: вакцинированный CORAVAX. C и D, большое увеличение A и B, детализирующие специфические патологические признаки, расположение указано звездочками на изображениях с малым увеличением. Инфильтрация паренхимы и дыхательных путей мононуклеарными воспалительными клетками заметна у контрольных животных. Заметное улучшение инфильтрации дыхательных путей наблюдается у вакцинированных животных. Различная степень консолидации и утолщения перегородки присутствует у контрольных и вакцинированных животных.E и F, изображения с малым увеличением, 15-й день п.к. легкие. E: контроль FILORAB1, F: вакцинированный CORAVAX. G и H, большое увеличение E и F, детализирующие специфические патологические признаки, расположение указано звездочками (*) на изображениях с малым увеличением. Значительная инфильтрация дыхательных путей отсутствует у всех животных, но сохраняются другие аспекты воспалительной патологии, такие как эпителиальная гиперплазия. Общая консолидация улучшилась у вакцинированных животных, но не достигла статистической значимости.
https://дои.org/10.1371/journal.ppat.1009383.g006
Рис. 7. Сравнительные показатели патологии легких у вакцинированных CORAVAX и контрольных хомячков после заражения SARS-CoV-2.
Баллы через 3 дня (A) и 15 дней (B) шт. Баллы отображаются для общей патологии легких и отдельных критериев, включая консолидацию или степень воспаления, тип воспалительных очагов, патологию дыхательных путей и утолщение перегородки. Баллы патологии (средние) рассчитывали на основе критериев, описанных в таблице S1.Группа вакцины CORAVAX показана синим цветом, а контрольная группа — черным. Данные представляют собой среднее значение ± стандартное отклонение, N = 6 для группы FILORAB1 в моменты времени 3-й и 15-й день и N = 6 для группы вакцины CORAVAX на 3-й день и N = 5 для временных точек CORAVAX 15-й день. Р > 0,123 (нс), Р < 0,033 (*), Р < 0,002 (**), Р < 0,001 (***). Показаны только существенные различия.
https://doi.org/10.1371/journal.ppat.1009383.g007
Обсуждение
Существует острая необходимость в безопасной и эффективной вакцине против SARS-COV-2, которую можно было бы вводить беременным женщинам, детям, пожилым людям и людям с ослабленным иммунитетом.Две вакцины против COVID-19, получившие разрешение FDA на экстренное использование (EUA), BNT162b2 (Pfizer-BioNTech) и мРНК-1273 (Moderna), основанные на платформе мРНК, показали многообещающие результаты с эффективностью выше 90% [34,35]. Ни одна из этих вакцин EUA против COVID-19 не одобрена для использования беременными женщинами, кормящими матерями, детьми в возрасте до 18 лет и лицами с ослабленным иммунитетом [36], и они еще не продемонстрировали длительный иммунный ответ. Поэтому по-прежнему необходимы другие подходы к вакцинам.
Это первое исследование, демонстрирующее эффективность векторной RABV-вакцины против COVID-19, CORAVAX, на модели тяжелого заболевания у сирийских хомяков.Вакцинный вектор против бешенства имеет ряд преимуществ: 1) он имеет отличный профиль безопасности, так как используется как инактивированная вакцина; 2) имеются исторические данные о длительном иммунитете; 3) его можно безопасно и эффективно вводить детям, беременным женщинам, пожилым людям и людям с ослабленным иммунитетом; 4) ранее существовавший иммунитет против бешенства не влияет на бустерный потенциал вакцины; 5) вирионы RABV легко включают чужеродные антигены; и 6) вакцины на основе RABV демонстрируют превосходную температурную стабильность [2,19,28].
В наших подходах к вакцинации использовалась только часть спайкового белка SARS-CoV-2. Использование S1, а не полного спайкового белка в качестве иммуногена, обеспечивает иммунный ответ против важных нейтрализующих эпитопов, идентифицированных у выздоравливающих пациентов, распознающих RBD, NTD S1 и четвертичный эпитоп, соединяющий два RBD [37]. Наше использование S1 в CORAVAX может объяснить более высокие титры ВНА у сирийских хомячков по сравнению с другими вакцинами против COVID-19, использующими полный шип в качестве антигена в векторах желтой лихорадки и Ad26, а также в платформе ДНК-вакцины [38–40]. .
Несколько вакцин-кандидатов против COVID-19 с использованием ДНК, РНК, вирусных векторов, инактивированных вакцин и субъединичных вакцинных платформ находятся на различных стадиях доклинической или клинической разработки [41]. Хотя иммунные корреляты защиты еще предстоит определить, в большинстве испытаний вакцин-кандидатов сравниваются их антитела и нейтрализующий ответ на сыворотки реконвалесцентов SARS-CoV-2. Клинические испытания с лечением реконвалесцентной плазмой показали небольшую разницу или отсутствие существенной разницы в результатах среди пациентов с SARS-CoV-2 по сравнению с группой плацебо [42,43].Кроме того, большинство образцов реконвалесцентной плазмы, полученных от лиц, выздоровевших от COVID-19, не содержат высоких уровней нейтрализующей активности [44].
CORAVAX индуцировал высокие титры специфических антител к SARS CoV-2 S1 и RBD и нейтрализующие титры на 26-й день после первичной вакцинации. Титры антител и нейтрализующие титры немного (но не значительно) увеличивались на 56-й день после бустер-иммунизации (на 28-й день). CORAVAX также индуцировал сильный иммунный ответ со смещением Th2, на что указывает ответ IgG2/3 перед контрольным заражением.После заражения животные, вакцинированные CORAVAX, индуцировали значительно более высокие титры S1 IgG, чем контрольные, что хорошо коррелировало с ответом нейтрализующих антител. Интересно, что титры RBD IgG были выше у контрольных животных на 15 день п.к. чем CORAVAX при вакцинации животных. Корреляция титров S1 IgG с ответами нейтрализующих антител у животных, вакцинированных CORAVAX, позволяет предположить, что титры S1 IgG являются лучшим предиктором защиты, чем титры RBD IgG. Наш результат совпадает с результатами Chi et al.исследование, в котором были выявлены не связывающие RBD, связывающие N-концевой домен SARS CoV-2 (NTD), нейтрализующие антитела, выделенные от выздоравливающих пациентов [45]. Также было высказано предположение, что антитела S1, не связывающиеся с RBD, могут сдерживать конформационные изменения белка S, тем самым предотвращая проникновение вируса. И наоборот, вакцины, которые индуцируют только антитела RBD, могут вызывать мутации резистентности вируса [46]. CORAVAX индуцирует антитела против RBD, а также против других эпитопов S1. Антитела, индуцированные у хомячков, вакцинированных CORAVAX, защищали их от потери веса после контрольного заражения, в то время как животные, вакцинированные FILORAB1, демонстрировали потерю веса.Отсутствие инфекционного вируса в легких и носовых раковинах вакцинированных КОРАВАКС животных на 3-й день п.к. предполагает, что CORAVAX может контролировать передачу вируса.
У людей инфекция SARS-CoV-2 гистопатологически проявляется как острая вирусная интерстициальная пневмония, как правило, долевой природы. Особенности включают консолидацию воздушных пространств, утолщение альвеолярных перегородок, лимфоцитарную инфильтрацию воздушных пространств и дыхательных путей, плеврит, плевральный выпот и периваскулярные манжеты [47]. Острое повреждение легких обычно сопровождает эту пневмонию в форме диффузного альвеолярного повреждения (DAD), гистопатологического коррелята острого респираторного дистресс-синдрома [48].Представление в модели сирийского золотого хомяка в целом похоже на то, что наблюдается при тяжелом заболевании человека [49]. В этом исследовании мы обнаружили, что общие баллы патологии и баллы по двум компонентам были улучшены у животных, вакцинированных CORAVAX, после заражения SARS-CoV-2. Мы наблюдали улучшение элементов патологии, связанных с острой активностью иммунных клеток, таких как инфильтрация дыхательных путей иммунными клетками, а также общее количество и размер очагов воспаления (частично определяемых инфильтрацией иммунных клеток) при отсутствии статистически значимого улучшения элементов патология более тесно связана с повреждением, возникающим в результате иммунного ответа на инфекцию (в частности, утолщение перегородки).Эта закономерность очень похожа на то, что мы наблюдаем, когда животным позволяют избавиться от инфекции естественным путем. Таким образом, этот результат находится в пределах того, что можно было бы ожидать от вакцины, которая обеспечивает защиту без стерилизации иммунитета, поскольку он предполагает, что, хотя репликация вируса, вероятно, действительно происходила после заражения, вирус был быстро очищен, и процесс восстановления тканей шел полным ходом, когда вирус был заражен. животных усыпили. В совокупности эти результаты свидетельствуют о том, что CORAVAX может значительно снизить заболеваемость вакцинированных животных.
Что касается адъюванта, мы ранее показали, что вакцина FILORAB1 на основе вируса бешенства Эбола с адъювантом GLA-SE защищает 100% НЧП, зараженных лихорадкой Эбола, что является улучшением по сравнению с вакциной FILORAB1 без адъюванта, которая была менее защитной. Эта защита была приписана сильному Th2-смещенному иммунному ответу, индуцированному GLA-SE, который является синтетическим агонистом TRL4 [20]. Чтобы вызвать более сильную реакцию, предвзятую к Th2, в нашем исследовании мы использовали другой агонист TRL4, MPLA-AddaVax, поскольку MPLA является агонистом TLR4, а AddaVax представляет собой наноэмульсию масла в воде на основе сквалена (аналогичную компоненту SE в GLA-SE). ).Было показано, что MPLA повышает иммуногенность и защиту вакцины против бешенства за счет индукции ответов плазматических клеток. Мыши, вакцинированные MPLA, ускоряли активацию дендритных клеток, улучшая Т-зависимый В-клеточный ответ, стимулирующий выработку антител, которая смещалась в сторону сильного смещения Th2 [47–50]. Как видно для пациентов с легкой формой COVID-19, иммунный ответ, смещенный на Th2, полезен для защиты от болезни [48–51]. Наша предыдущая работа показала, что CORAVAX индуцирует сильный иммунный ответ, смещенный на Th2, у мышей Balb/C, генерируя более высокие антитела IgG2a [30].У сирийских хомяков животные, вакцинированные CORAVAX, индуцировали более сильный ответ S1 IgG2/3 перед контрольным заражением. Что еще более важно, у хомячков, вакцинированных CORAVAX, на 15-й день наблюдался значительно более высокий уровень S1 IgG2/3. чем животные, вакцинированные FILORAB1. Мы не смогли обнаружить ответы S1 IgG1, но мы смогли обнаружить ответы IgG1 RABV-G, предполагая, что антитела S1 IgG1 присутствуют на низких уровнях или отсутствуют.
В заключение, наша вакцина против COVID-19 с RABV-вектором CORAVAX эффективна и способна предотвращать репликацию вируса и снижать заболеваемость у сирийских хомяков.CORAVAX также служит в качестве вакцины против RABV, поскольку он индуцирует высокий уровень VNA RABV. Будущие исследования по оценке эффективности одной вакцины CORAVAX будут проводиться, поскольку мы не наблюдали значительного бустерного эффекта в иммунных реакциях у хомяков. Производство CORAVAX должно быть относительно простым, поскольку оно будет соответствовать существующим производственным мощностям и технологиям вакцин против RABV. Кроме того, использование адъюванта может обеспечить экономию дозы. Эти результаты требуют дальнейшего изучения CORAVAX в рамках клинических испытаний, проводимых Bharat Biotech International Ltd.
Материалы и методы
Заявление об этике
Исследования проводились в строгом соответствии с рекомендациями, изложенными в Руководстве по уходу и использованию лабораторных животных Национального исследовательского совета. UTMB является учреждением, аккредитованным AAALAC, и все работы с животными были одобрены комитетом IACUC UTMB. Были предприняты все усилия, чтобы свести к минимуму страдания животных, и все процедуры, связанные с потенциальной болью, проводились с использованием соответствующего анестетика или анальгетика.Количество использованных хомяков было научно обосновано на основе статистического анализа вирусологических и иммунологических результатов. Семинедельным золотым сирийским хомячкам (Envigo) анестезировали 5% изофлураном перед иммунизацией и забором крови, а также кетамином/ксилазином перед заражением SARS-CoV-2. Животных ежедневно контролировали на предмет потери веса и признаков заболевания. Половину животных в каждой группе (6 вакцинированных и 6 контрольных хомяков) усыпили передозировкой инъекционных анестетиков на 3-й день р.в. (день 63) для определения вирусной нагрузки.
Антитела
Следующие специфичные для SARS-CoV-2 моноклональные антитела человека были любезно предоставлены компанией Distributed Bio: COVID-19 DB_A03-09, 12; ДБ_Б01-04, Б07-10, 12; DB_C01-05, 07, 09, 10; DB_D01, 02; DB_E01-04, 06, 07; DB_F02-03.
Вирусы
Штамм SARS-CoV-2, использованный в этом исследовании, является первым американским изолятом SARS-CoV-2 USA_WA1/2020 от пациента из штата Вашингтон, выявленным 22 января 2020 г. [31]. Пассаж 3 был получен из Всемирного справочного центра новых вирусов и арбовирусов (WRCEVA) в UTMB.Запасы вируса размножали в клетках Vero E6. Контрольный образец, используемый в этом исследовании, представляет собой пассаж 5. Рекомбинантный белок SARS-CoV-2, экспрессирующий неоновый зеленый белок (SARS-CoV-2-mNG) [49], используемый в анализе нейтрализации, был разработан доктором Пей-Йонг Ши в UTMB. . Запасы вируса размножали в клетках Vero E6 и использовали пассаж 4.
Производство и очистка вакцин
рекомбинантных RABV были выделены, очищены, инактивированы и оттитрованы. Вкратце, реагент для трансфекции X-tremeGENE 9 (Millipore Sigma, № по каталогу 6365809001) использовали для котрансфекции полноразмерного вирусного клона кДНК, кодирующего CORAVAX, вместе с плазмидами, кодирующими белки N, P и L RABV и РНК-полимеразу T7, в BEAS- 2B клетки легких человека в 6-луночных планшетах (RABV).Через 8 дней после трансфекции супернатант собирали, фильтровали через мембранный фильтр 0,22 мкм (Millipore) и титровали на клетках VERO. Наличие рекомбинантного вируса подтверждали иммуноокрашиванием моноклональными антителами против нуклеопротеина (FujiRebio, № по каталогу 800–092) и поликлональной антисывороткой против домена S1 (Thermo Fisher, № по каталогу PA581798). Затем отфильтрованный вирус использовали для инокуляции клеток VERO, высеянных в культуральные камеры Cellstack (Corning) и размноженных в среде VP-SFM (Thermo Fisher Scientific) в течение 18 дней.Супернатант, собранный на 10-й день после инфицирования, фильтровали через мембранные фильтры PES 0,45 мкм (Nalgene) и наслаивали на 20% сахарозу в DPBS. Вирионы осаждали ультрацентрифугированием на роторе SW32 в течение 1,5 ч при 25 000 об/мин. Вирусные частицы ресуспендировали в фосфатно-солевом буфере (PBS) и инактивировали 50 мкл на мг частиц β-пропиолактона в разведении 1:100 (BPL, Millipore Sigma, кат. № P5648) в холодной воде. Отсутствие инфекционных частиц проверяли путем инокуляции клеток BSR 10 мкг BPL-инактивированных вирусов в течение 3 пассажей.
Исследования на животных
Исследования проводились в строгом соответствии с рекомендациями, изложенными в Руководстве по уходу и использованию лабораторных животных Национального исследовательского совета. UTMB является учреждением, аккредитованным AAALAC, и все работы с животными были одобрены комитетом IACUC UTMB. Были предприняты все усилия, чтобы свести к минимуму страдания животных, и все процедуры, связанные с потенциальной болью, проводились с использованием соответствующего анестетика или анальгетика. Количество использованных хомяков было научно обосновано на основе статистического анализа вирусологических и иммунологических результатов.
Вакцинация и вызов SARS-CoV-2
Семинедельным золотым сирийским хомячкам (Envigo) анестезировали 5% изофлураном перед иммунизацией и забором крови, а также кетамином/ксилазином перед заражением SARS-CoV-2. В день 0 12 животных в группе инокулировали 10 мкг CORAVAX или FILORAB1 (контрольная вакцина) с адъювантом MPLA-AddaVax (на животное: 5 мкг MPLA, InvivoGen, кат. № vac-mpls; 50 мкл AddaVax, InvivoGen, кат. № -adx-vac) в объеме инъекции 100 мкл внутримышечно (по 50 мкл на заднюю ногу).На 28-й день животным проводили ревакцинацию. За два дня до иммунизации, на 26-й и 56-й день, проводили забор крови из полой вены. На 60-й день вакцинированные и контрольные животные подвергались интраназальному введению целевой дозы изолировать SARS-CoV-2. Животных ежедневно контролировали на предмет потери веса и признаков заболевания. Половина животных в каждой группе (6 вакцинированных и 6 контрольных хомяков) была подвергнута эвтаназии передозировкой инъекционных анестетиков на 3-й день п.к. (день 63) для определения вирусной нагрузки.Остальных животных (5 вакцинированных и 6 контрольных хомячков) подвергали эвтаназии на 15-й день после заражения (пк) (75-й день). Одно животное в группе CORAVAX не оправилось от анестезии после контрольного заражения.
Рекомбинантные белки для ИФА
Очистка HA-меченого белка из супернатанта трансфицированных клеток для ELISA.
Субконфлюэнтные флаконы T175 клеток 293T (линия клеток эмбриональной почки человека) трансфицировали вектором pDisplay, кодирующим аминокислоты с 16 по 682 S (S1) SARS-CoV-2, слитого с C-концевым гемагглютининовым (HA) пептидом с использованием реагента X-tremeGENE 9 (Millipore Sigma, № по каталогу 6365809001).Супернатант собирали через 6 дней после трансфекции, фильтровали через мембранные фильтры PES 0,22 мкм (Nalgene) и загружали на колонку с анти-НА-агарозой (Pierce, № по каталогу 26182), уравновешенную в PBS. После промывки десятью объемами слоя PBS в колонку загружали 2 объема колонки пептида HA в концентрации 400 мкг/мл в PBS и инкубировали в течение ночи при 4°C. На следующий день белок элюировали двумя колоночными объемами пептида НА, а затем двумя колоночными объемами PBS. Фракции собирали и анализировали вестерн-блоттингом с поликлональной антисывороткой против домена S1 (Thermo Fisher, № по каталогу PA581798).Затем пиковые фракции объединяли и подвергали диализу против PBS в диализных кассетах с отсечкой молекулярной массы 10000 (MWCO) (Thermo Fisher Scientific) для удаления избытка пептида HA. После диализа белок количественно определяли с помощью УФ-спектрофотометрии и замораживали небольшими аликвотами при -80°С.
Очистка белка RBD-His для ELISA
RBD-HIS [52]: плазмида SARS CoV-2, меченная RBD-His, была приобретена у Bei Resources (NR-52309). Субконфлюэнтные флаконы T175 с клетками 293T (линия клеток эмбриональной почки человека) трансфицировали плазмидой, меченной RBD-His, с использованием реагента X-tremeGENE 9 (Millipore Sigma, № по каталогу 6365809001).Супернатант собирали через 6 дней после трансфекции и фильтровали через мембранные фильтры PES 0,22 мкм (Nalgene). Колонку с картриджем HisTALON объемом 5 мл (Clontech Laboratories, № по каталогу 635683) уравновешивали 10 объемами колонок уравновешивающего буфера (набор буферов HisTALON, Clontech Laboratories, № по каталогу 635651). Отфильтрованный супернатант загружали в колонку с картриджем HisTALON (Clontech Laboratories, № по каталогу 635683) со скоростью 1 мл/мин. После промывки десятью колоночными объемами промывочного буфера (приготовленного путем смешивания 6.6 частей элюирующего буфера с 93,4 частями уравновешивающего буфера из набора буферов HisTALON), образец элюируют (при скорости потока ~1 мл/мин) приблизительно 8 объемами колонки с элюирующим буфером, собирая фракции по 1 мл. Концентрацию белка в образце оценивали путем измерения поглощения элюированных фракций при 280 нм (Nanodrop, Thermo Fisher Scientific). Элюированные фракции анализировали вестерн-блоттингом с мышиным моноклональным RBD-специфическим антителом (InvivoGen, кат. № srbd-mab10). Затем пиковые фракции объединяли и подвергали диализу против PBS в диализных кассетах на 10000 молекулярных масс (MWCO) (Thermo Fisher Scientific).После диализа белок количественно определяли с помощью УФ-спектрофотометрии и замораживали небольшими аликвотами при -80°С.
Иммуноферментный анализ
Для определения реакции антител на белок S SARS-CoV-2 был разработан непрямой ИФА с использованием очищенного белка S1 или домена связывания рецептора (RBD). Получение рекомбинантных белков описано выше. Гуморальные ответы на S1 SARS-CoV-2 и белок RBD измеряли с помощью непрямого ИФА. Мы протестировали отдельные сыворотки хомяков с помощью иммуноферментного анализа (ELISA) на наличие IgG, специфичных к SARS-Cov-2 S1 или RBD.Чтобы проверить гуморальный ответ S1 против SARS CoV-2, мы получили растворимый S1 или RBD, как описано выше. Два рекомбинантных белка ресуспендировали в буфере для покрытия (50 мМ Na 2 CO 3 [pH 9,6]) в концентрации 0,5 мкг/мл S1 или 2 мкг/мл RBD, а затем высевали в 96 -луночные планшеты ELISA MaxiSorp (Nunc) по 100 мкл в каждой лунке. После инкубации в течение ночи при 4 °C планшеты промывали 3 раза 1× PBST (0,05% Tween 20 в 1× PBS), затем добавляли 250 мкл блокирующего буфера (5% сухого молока в 1× PBST) и инкубировали. при комнатной температуре 1.5 ч. Затем планшеты промывали 3 раза PBST и инкубировали в течение ночи при 4 °C с серийными разведениями сыворотки (в трех экземплярах) в 1× PBST, содержащем 0,5% BSA. Планшеты промывали 3 раза на следующий день с последующим добавлением конъюгированных с HRP козьих анти-IgG сирийских хомяков вторичных антител (иммунологическое исследование Джексона, кат. № 107-035-142, 1:8000 в PBST) или мышиных анти-хомячковых IgG2. /3-HRP (Southern Biotech, кат. № 1935–05, 1:8000 в PBST) или мышиный анти-хомячковый IgG1-HRP (Southern Biotech, кат. № 1940–05, 1:8000 в PBST) в течение 2 ч при комнатной температуре .После инкубации планшеты трижды промывали PBST и в каждую лунку добавляли по 200 мкл субстрата о-фенилендиаминдигидрохлорида (OPD) (Sigma). Реакцию останавливали добавлением 50 мкл 3 М H 2 SO 4 на лунку. Оптическую плотность определяли при 490 нм (OD490) и 630 нм (OD630) с использованием планшетного ридера ELX800 (Biotek Instruments, Inc., Winooski, VT). Планшеты инкубировали в течение 15 мин (IgG) или 20 мин (IgG2/3 или IgG1) с субстратом OPD перед остановкой реакции с помощью 3 М H 2 SO 4 .Данные анализировали с помощью GraphPad Prism (версия 8.0 g) с использованием 4-параметрической нелинейной регрессии для определения титра, при котором кривые достигают 50% значения верхнего плато (эффективная концентрация 50% [EC50]).
Реакция нейтрализующих антител
Сыворотки, собранные у животных, были протестированы на способность нейтрализовать SARS-CoV-2. Вкратце, образцы сыворотки инактивировали нагреванием (30 мин при 56°C), а затем 10-кратно разбавленные сыворотки дополнительно разбавляли 2-кратным способом серий , и 60 мкл каждого разведения сыворотки смешивали с 60 мкл SARS-CoV-2-mNG (200 БОЕ) [49–53].Смеси сыворотка/вирус инкубировали в течение 1 ч при 37°С. Затем 100 мкл смесей сыворотка/вирус переносили в монослои клеток Vero E6 в плоскодонных 96-луночных планшетах и инкубировали в течение 2 дней при 37°С. Флуоресценцию вируса измеряли с помощью ридера Cytation Hybrid Multi-Mode при 488 нм (Biotek Instruments).
Обработка тканей и определение вирусной нагрузки
Животных подвергали эвтаназии на 3-й и 15-й день после заражения и собирали легкие и носовые раковины. Правое легкое и носовые раковины помещали в среду L15 с добавлением 10% эмбриональной бычьей сыворотки (Gibco) и раствора антибиотика-антимикотика (Gibco).Ткани гомогенизировали с использованием системы TissueLyser II (Qiagen), гомогенаты тканей разделяли на аликвоты и хранили при -80°C. Гомогенаты тканей титровали на монослоях клеток Vero E6 в 24-луночных планшетах для определения вирусной нагрузки. Планшеты инкубировали 3 дня при 37°C, затем фиксировали 10% формалином и извлекали из герметика. Бляшки визуализировали с помощью иммуноокрашивания смесью 1 мкг/мл 37 специфических человеческих антител против SARS-CoV-2, любезно предоставленных компанией Distributed Bio. В качестве вторичного антитела использовали меченый HRP козий античеловеческий IgG (SeraCare) в разведении 1:500.Первичные и вторичные антитела разводили в 1X DPBS с 5% молока. Бляшки выявляли с помощью субстрата AEC (enQuire Bioregents).
копий вирусной РНК методом qRT-PCR
Гомогенаты тканей смешивали с реагентом TRIzol (Life Technologies) при объемном соотношении гомогената и TRIzol 1:5. Протокол экстракции РНК из биологических жидкостей с использованием реагента TRIzol следовали до стадии разделения фаз. Остальную экстракцию РНК проводили с использованием мини-набора PureLink RNA (Ambion).Количество и качество (соотношение 260/280) выделенной РНК измеряли с помощью NanoDrop (Thermo Fisher). кДНК нуклеопротеина SARS-CoV-2 была получена из РНК от Bei Resources (NR-52285) с помощью одностадийной RT-ПЦР (SuperScript IV, Thermo Fisher) с праймерами SARS CoV-2 N IVT F1 (5'-GAATTCTAATACGACTCACTATAGGGGATGTCTGATAATGGACCC-3') и SARS CoV-2 N IVT R1 (5'-GCTAGCTTAGGCCTGAGTTGAGTCAGCACTGCT-3'). Стандарты N SARS-CoV-2 были получены путем транскрипции in-vitro сгенерированной кДНК N SARS-CoV-2 с использованием набора для транскрипции MegaScript T7 (Invitrogen) с последующим использованием набора для очистки транскрипции MEGAclear.Аликвоты 2×10 10 копий/мкл замораживали при -80°С. Пять микролитров РНК на образец анализировали в трех экземплярах с использованием праймеров 2019-nCoV_N2-F (5'-TTACAAACATTGGCCGCAAA-3'), 2019-nCoV_N2-R (5'-GCGCGACATTCCGAAGAA-3') и зонда 2019-nCoV_N2-P. -FAM (5'-ACAATTTGCCCCCAGCGCTTCAG-3').
Гистопатология
После эвтаназии было проведено вскрытие, были отмечены грубые поражения, и левое легкое было помещено в 10% формалин для гистопатологической оценки. После 24-часовой инкубации при 4°C легкие переносили в свежий 10% формалин для дополнительной 48-часовой инкубации перед изъятием из гермооболочки.Ткани обрабатывали стандартными гистологическими процедурами с помощью UTMB Anatomic Pathology Core, делали срезы толщиной 4 мкм и окрашивали гематоксилином и эозином. Срезы легких исследовали на степень воспаления, тип воспалительных очагов и изменения альвеол/альвеолярных перегородок/дыхательных путей/кровеносных сосудов параллельно со срезами неинфицированных или невакцинированных легких. Слепые срезы ткани полуколичественно оценивали на наличие патологических поражений с использованием критериев, описанных в таблице S1.Исследование проводилось с помощью микроскопа Olympus CX43 при увеличении в 40 раз для общего наблюдения и при увеличении в 100 раз для детального наблюдения. Каждый раздел оценивался обученным сотрудником.
Статистический анализ
Статистический анализ выполнен с помощью GraphPad Prism для Windows (версия 6.07). P <0,05 считалось значимым. Р > 0,123 (нс), Р < 0,033 (*), Р < 0,002 (**), Р < 0,001 (***).
Работы по биоизоляции
Работа с SARS-CoV-2 проводилась на объектах BSL-4 Галвестонской национальной лаборатории в соответствии с утвержденными стандартными операционными протоколами.
Благодарности
Мы благодарим Дженнифер Уилсон (Университет Томаса Джефферсона, Филадельфия, Пенсильвания) за критическое прочтение и редактирование рукописи.
Каталожные номера
- 1. Всемирная организация здравоохранения.
- 2. Центры по контролю и профилактике заболеваний.
- 3. Кайзер Дж. Проблемы с температурой могут замедлить внедрение новых вакцин против коронавируса. https://www.sciencemag.org/news/2020/11/temperature-concerns-could-slow-rollout-new-coronavirus-vaccines.
- 4. Лейтнер В.В., Ин Х., Рестифо Н.П. ДНК- и РНК-вакцины: принципы, успехи и перспективы. вакцина. 1999;18(9–10):765–77. Эпублик 1999/12/02. пмид:10580187; Центральный PMCID в PubMed: PMC1986720.
- 5. Гарг Х., Мехметоглу-Гурбуз Т., Джоши А. Вирусоподобные частицы (VLP) в качестве поливалентной вакцины-кандидата против чикунгуньи, японского энцефалита, желтой лихорадки и вируса Зика. Научный доклад 2020; 10 (1): 4017. Эпублик 2020/03/07. пмид:32132648; Центральный PMCID в PubMed: PMC7055223.
- 6. Ролдао А., Мельядо М.С., Кастильо Л.Р., Каррондо М.Дж., Алвес П.М. Вирусоподобные частицы в разработке вакцин. Эксперт Rev Вакцины. 2010;9(10):1149–76. Эпублик 2010/10/07. пмид: 20923267.
- 7. ГАВИ. https://www.gavi.org/vaccineswork/what-are-viral-vector-based-vaccines-and-how-could-they-be-used-against-covid-19.
- 8. Ура Т., Окуда К., Шимада М. Развитие вакцин на основе вирусных векторов. Вакцины (Базель). 2014;2(3):624–41. Эпублик от 01.01.2014.пмид: 26344749; Центральный PMCID в PubMed: PMC4494222.
- 9. Лауэр К.Б., Борроу Р., Бланшар Т.Дж. Мультивалентные и полипатогенные вирусные векторные вакцины. Клин Вакцина Иммунол. 2017; 24(1). Эпб 2016/08/19. пмид: 27535837; Центральный PMCID в PubMed: PMC5216423.
- 10. Папанери А.Б., Вирблих С., Мариссен В.Е., Шнелл М.Дж. Аланиновое сканирование антигенного сайта III гликопротеина вируса бешенства с использованием рекомбинантного вируса бешенства: значение для лечения после контакта. вакцина. 2013;31(49):5897–902.пмид: 24120673.
- 11. Blaney JE, Marzi A, Willet M, Papaneri AB, Wirblich C, Feldmann F, et al. Качество антител и защита от летального заражения вирусом Эбола у нечеловеческих приматов, иммунизированных бивалентной вакциной на основе вируса бешенства. PLoS Патог. 2013;9(5):e1003389. Эпублик 2013/06/06. пмид: 23737747; Центральный PMCID в PubMed: PMC3667758.
- 12. Schnell MJ, Tan GS, Dietzschold B. Применение технологии обратной генетики в изучении патогенеза вируса бешенства (RV) и для разработки новых вакцин против RV.J Нейровирол. 2005;11(1):76–81. пмид: 15804964.
- 13. Schnell MJ, McGettigan JP, Wirblich C, Papaneri A. Клеточная биология вируса бешенства: использование невидимости для достижения мозга. Nat Rev Microbiol. 2010;8(1):51–61. пмид: 19946287.
- 14. Гомме Э.А., Фаул Э.Дж., Фломенберг П., Макгеттиган Дж.П., Шнелл М.Дж. Характеристика одноциклового вакцинного вектора на основе вируса бешенства. Журнал вирусологии. 2010;84(6):2820–31. пмид: 20053743; Центральный PMCID в PubMed: PMC2826042.
- 15.Lawrence TM, Wanjalla CN, Gomme EA, Wirblich C, Gatt A, Carnero E, et al. Сравнение гетерологичных стратегий Prime-Boost против вируса иммунодефицита человека типа 1 Gag с использованием вирусов с отрицательной цепочкой РНК. ПлоС один. 2013;8(6):e67123. пмид: 23840600; Центральный PMCID в PubMed: PMC3694142.
- 16. McGettigan JP, Koser ML, McKenna PM, Smith ME, Marvin JM, Eisenlohr LC, et al. Усиление гуморального ВИЧ-1-специфического иммунного ответа, генерируемого рекомбинантными вакцинными векторами на основе рабдовирусов, коэкспрессирующими белки ВИЧ-1 и ИЛ-2.Вирусология. 2006;344(2):363–77. Эпублик 18.10.2005. пмид: 16226782.
- 17. Уолш П.Д., Куруп Д., Хассельшверт Д.Л., Вирблих С., Гетцманн Дж.Э., Шнелл М.Дж. Окончательное испытание вакцины (оральной лихорадки Эбола) на шимпанзе в неволе? Научный доклад 2017; 7: 43339. Эпб 2017/03/10. пмид: 28277549; Центральный PMCID в PubMed: PMC5344013.
- 18. McKenna PM, Koser ML, Carlson KR, Montefiori DC, Letvin NL, Papaneri AB, et al. Высокоаттенуированные вакцинные векторы на основе вируса бешенства, экспрессирующие обезьяно-человеческий вирус иммунодефицита89.6P Env и вирус иммунодефицита обезьян mac239 Gag безопасны для макак-резусов и защищают от СПИДоподобного заболевания. Журнал инфекционных болезней. 2007;195(7):980–8. пмид: 17330788.
- 19. Kurup D, Fisher CR, Smith TG, Abreu-Mota T, Yang Y, Jackson FR, et al. Инактивированная вакцина против Эболы на основе вируса бешенства, консервированная путем испарения, является термостабильной и иммуногенной против Эболы и защищает от заражения бешенством. Журнал инфекционных болезней. 2019; 220(9):1521–8. Эпб 2019/08/03.пмид:31374568; Центральный PMCID в PubMed: PMC6761974.
- 20. Джонсон Р.Ф., Куруп Д., Хаген К.Р., Фишер С., Кешвара Р., Папанери А. и др. Вакцина против Эболы на основе инактивированного вируса бешенства, FILORAB1, с адъювантом глюкопиранозиллипида А в стабильной эмульсии, обеспечивает полную защиту в моделях заражения нечеловеческих приматов. Журнал инфекционных болезней. 2016; 214 (прил. 3): S342–S54. пмид: 27456709; Центральный PMCID в PubMed: PMC5050469.
- 21. Фишер Ч.Р., Шнелл М.Дж.Новые разработки в вакцинации против бешенства. Rev Sci Tech. 2018;37(2):657–72. Эпаб 2019/02/13. пмид:30747119.
- 22. Абреу-Мота Т., Хаген К.Р., Купер К., Ярлинг П.Б., Тан Г., Вирблих С. и др. Нейтрализующие антитела, вырабатываемые рекомбинантной вакциной Ласса-бешенства, имеют решающее значение для защиты от лихорадки Ласса. Нац коммун. 2018;9(1):4223. Эпаб 13.10.2018. пмид:30310067; Центральный PMCID в PubMed: PMC6181965.
- 23. Wirblich C, Coleman CM, Kurup D, Abraham TS, Bernbaum JG, Jahrling PB, et al.One-Health: безопасная, эффективная вакцина двойного назначения для людей и животных против ближневосточного респираторного синдрома, коронавируса и вируса бешенства. Журнал вирусологии. 2017;91(2). пмид: 27807241; Центральный PMCID в PubMed: PMC5215356.
- 24. Кешвара Р., Шилс Т., Постникова Э., Куруп Д., Вирблих С., Джонсон Р.Ф. и соавт. Вакцина против бешенства вызывает мощный иммунный ответ против вируса Нипах. Вакцины NPJ. 2019;4:15. Эпаб 2019/04/25. пмид:31016033; Центральный PMCID в PubMed: PMC6465360.
- 25.Кешвара Р., Хаген К.Р., Абреу-Мота Т., Папанери А.Б., Лю Д., Вирблих С. и соавт. Рекомбинантный вирус бешенства, экспрессирующий гликопротеин вируса Марбург, зависит от опосредованной антителами клеточной цитотоксичности для защиты от болезни, вызванной вирусом Марбург, на мышиной модели. Журнал вирусологии. 2019;93(6). Эпаб 2018/12/21. пмид:30567978; Центральный PMCID в PubMed: PMC6401435.
- 26. Худачек А.В., Аль-Салим Ф.Х., Уиллет М., Эйземанн Т., Мэттис Дж.А., Симпсон Л.Л. и др. Частицы рекомбинантного вируса бешенства, представляющие антигены ботулинического нейротоксина, вызывают защитный гуморальный ответ in vivo.Mol Ther Methods Clin Dev. 2014;1:14046. пмид: 26015984; Центральный PMCID в PubMed: PMC4362357.
- 27. Куруп Д., Вирблих С., Фельдманн Х., Марци А., Шнелл М.Дж. Вакцинные платформы против генипавирусов на основе рабдовирусов. Журнал вирусологии. 2015;89(1):144–54. пмид: 25320306; Центральный PMCID в PubMed: PMC4301098.
- 28. Шер Г., Шнелл М.Дж. Рабдовирусы как векторы для вакцин и терапевтических средств. Curr Opin Virol 2020; 44: 169–82. Эпублик 2020/11/02. пмид:33130500
- 29.Фишер К.Р., Штрайкер Д.Г., Шнелл М.Дж. Распространение и эволюция вируса бешенства: покорение новых рубежей. Nat Rev Microbiol. 2018;16(4):241–55. Эпаб 2018/02/27. пмид: 29479072; Центральный PMCID в PubMed: PMC6899062.
- 30. Куруп Д., Вирблих С., Рэймидж Х., Шнелл М.Дж. Вакцина против COVID-19 на основе вируса бешенства CORAVAX индуцирует высокие уровни нейтрализующих антител против SARS-CoV-2. Вакцины NPJ. 2020;5:98. Эпублик 23.10.2020. пмид:33088593; Центральный PMCID в PubMed: PMC7568577.
- 31.Харкорт Дж., Тамин А., Лу Х., Камили С., Сактхивел С.К., Мюррей Дж. и др. Тяжелый острый респираторный синдром Коронавирус 2 у пациента с коронавирусным заболеванием, США. Эмердж Инфекция Дис. 2020;26(6):1266–73. Эпаб 12.03.2020. пмид:32160149; Центральный PMCID в PubMed: PMC7258473.
- 32. Сиа С.Ф., Ян Л.М., Чин А.В.Х., Фунг К., Чой К.Т., Вонг Э.Л. и др. Патогенез и передача SARS-CoV-2 у золотистых хомяков. Природа. 2020; 583 (7818): 834–8. Эпб 2020/05/15. пмид:32408338; Центральный PMCID в PubMed: PMC7394720.
- 33. Чевик М., Куппалли К., Киндрачук Дж., Пейрис М. Вирусология, передача и патогенез SARS-CoV-2. БМЖ. 2020;371:m3862. Эпублик 2020/10/25. пмид:33097561.
- 34. Полак Ф.П., Томас С.Дж., Китчин Н., Абсалон Дж., Гуртман А., Локхарт С. и др. Безопасность и эффективность мРНК-вакцины BNT162b2 Covid-19. N Engl J Med. 2020; 383: 2603–15. Эпублик 2020/12/11. пмид:33301246.
- 35. Многообещающие промежуточные результаты клинических испытаний вакцины NIH-Moderna COVID-19.Управление связи NIAID. https://www.nih.gov/news-events/news-releases/promising-interim-results-clinical-trial-nih-moderna-covid-19-vaccine [Интернет]. 16 ноября 2020 г.
- 36. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США.
- 37. Лю Л., Ван П., Наир М.С., Ю Дж., Рапп М., Ван К. и др. Мощные нейтрализующие антитела против нескольких эпитопов на шипе SARS-CoV-2. Природа. 2020; 584 (7821): 450–6. Эпаб 2020/07/23. пмид:32698192.
- 38. Tostanoski LH, Wegmann F, Martinot AJ, Loos C, McMahan K, Mercado NB, et al.Вакцина Ad26 защищает от тяжелого клинического заболевания SARS-CoV-2 у хомяков. Нат Мед. 2020;26(11):1694–700. Эпб 2020/09/05. пмид:32884153; Центральный PMCID в PubMed: PMC7671939.
- 39. Санчес-Фелипе Л., Веркруйсс Т., Шарма С., Ма Дж., Лемменс В., Ван Луверен Д. и др. Однодозовая вакцина-кандидат против SARS-CoV-2 с живым аттенуированным вектором YF17D. Природа. 2020. Эпублик 2020/12/02. пмид:33260195.
- 40. Ребекка Л. Брокато САК, Роберт К. Ким, Сянькун Цзэн, Люсия М.Принцип, Джеффри М. Смит, Джей В. Хупер. Защитная эффективность ДНК-вакцины против SARS-CoV-2 у сирийских хомяков дикого типа и с подавленным иммунитетом. bioRxiv 2020.11.10.376905; https://doi.org/10.1101/2020.11.10.37690. 2020.
- 41. Донг И, Дай Т, Вэй И, Чжан Л, Чжэн М, Чжоу Ф. Систематический обзор вакцин-кандидатов против SARS-CoV-2. Сигнальный преобразователь Target Ther. 2020;5(1):237. Эпублик 2020/10/15. пмид:33051445; Центральный PMCID в PubMed: PMC7551521.
- 42. Симонович В.А., Бургос Прач Л.Д., Шибона П., Беруто М.В., Валлоне М.Г., Васкес С. и соавт.Рандомизированное исследование реконвалесцентной плазмы при тяжелой пневмонии Covid-19. N Engl J Med. 2020. Эпублик 25.11.2020. пмид:33232588.
- 43. Лю СТХ, Лин ХМ, Бейн И., Вайнберг А., Гумпрехт Дж. П., Рахман Ф. и др. Лечение реконвалесцентной плазмой тяжелого COVID-19: контрольное исследование с сопоставлением показателей склонности. Нат Мед. 2020; 26 (11): 1708–13. Эпб 2020/09/17. пмид:32934372.
- 44. Robbiani DF, Gaebler C, Muecksch F, Lorenzi JCC, Wang Z, Cho A, et al. Конвергентные ответы антител на SARS-CoV-2 у выздоравливающих лиц.Природа. 2020;584(7821):437–42. Эпаб 20.06.2020. пмид:32555388; Центральный PMCID в PubMed: PMC7442695.
- 45. Chi X, Yan R, Zhang J, Zhang G, Zhang Y, Hao M и другие. Нейтрализующее человеческое антитело связывается с N-концевым доменом шиповидного белка SARS-CoV-2. Наука. 2020;369(6504):650–5. Эпаб 2020/06/24. пмид:32571838; Центральный PMCID в PubMed: PMC7319273.
- 46. Чжоу Х., Чен Ю., Чжан С., Ню П., Цинь К., Цзя В. и др. Структурное определение нейтрализующего эпитопа на N-концевом домене шиповидного гликопротеина БВРС-КоВ.Нац коммун. 2019;10(1):3068. Эпаб 13.07.2019. пмид:31296843; Центральный PMCID в PubMed: PMC6624210.
- 47. Борчук А.С., Сальваторе С.П., Сешан С.В., Патель С.С., Бассел Дж.Б., Мостика М. и др. Легочная патология COVID-19: когорта вскрытий в нескольких учреждениях из Италии и Нью-Йорка. Мод Патол. 2020;33(11):2156–68. Эпб 2020/09/04. пмид:32879413; Центральный PMCID в PubMed: PMC7463226.
- 48. Hariri LP, North CM, Shih AR, Israel RA, Maley JH, Villalba JA, et al. Гистопатология легких при коронавирусном заболевании 2019 г. по сравнению с тяжелым острым респираторным синдромом и гриппом h2N1: систематический обзор.Грудь. 2021;159(1):73–84. Эпублик 2020/10/11. пмид:33038391; Центральный PMCID в PubMed: PMC7538870.
- 49. Имаи М., Ивацуки-Хоримото К., Хатта М., Лобер С., Хальфманн П.Дж., Накадзима Н. и др. Сирийские хомяки как модель мелких животных для заражения SARS-CoV-2 и разработки мер противодействия. Труды Национальной академии наук Соединенных Штатов Америки. 2020;117(28):16587–95. Эпаб 2020/06/24. пмид:32571934; Центральный PMCID в PubMed: PMC7368255.
- 50. Chen C, Zhang C, Li R, Wang Z, Yuan Y, Li H и др.Монофосфорил-липид А (MPLA) является эффективным адъювантом для инактивированных вакцин против бешенства. Вирусы. 2019;11(12). Эпублик 2019/12/11. пмид:31816996; Центральный PMCID в PubMed: PMC6950009.
- 51. Аллегра А., Ди Джоаккино М., Тоначчи А., Мусолино С., Гангеми С. Иммунопатология инфекции SARS-CoV-2: иммунные клетки и медиаторы, прогностические факторы и иммунотерапевтические последствия. Int J Mol Sci. 2020;21(13). Эпублик 2020/07/10. пмид:32640747; Центральный PMCID в PubMed: PMC7370171.
- 52.Stadlbauer D, Amanat F, Chromikova V, Jiang K, Strohmeier S, Arunkumar GA, et al. Сероконверсия SARS-CoV-2 у людей: подробный протокол серологического анализа, производства антигена и настройки теста. Курр Проток Микробиол. 2020;57(1):e100. Эпаб 2020/04/18. пмид:32302069; Центральный PMCID в PubMed: PMC7235504.
- 53. Xie X, Muruato A, Lokugamage KG, Narayanan K, Zhang X, Zou J и др. Инфекционный клон кДНК SARS-CoV-2. Клеточный микроб-хозяин. 2020;27(5):841–8 e3. пмид:32289263; Центральный PMCID в PubMed: PMC7153529.
Иммуноглобулин против бешенства и вакцина
Что такое иммуноглобулин против бешенства и вакцина против бешенства?
Иммуноглобулин против бешенства (RabIg) обеспечивает немедленную кратковременную защиту от вируса, вызывающего бешенство. RabIg содержит большое количество антител, взятых из донорской крови человека. Антитела — это белки, которые иммунная система человека вырабатывает для борьбы с микробами, такими как бактерии и вирусы.
Вакцина против бешенстваобеспечивает длительную защиту от заражения вирусом бешенства.Вакцина изготовлена из убитого вируса бешенства и не может вызвать бешенство. В Британской Колумбии вакцина против бешенства предоставляется бесплатно тем, кто контактировал с животным, которое может быть заражено бешенством. Он также предоставляется бесплатно студентам Канадского ветеринарного колледжа или учебного центра по охране здоровья животных.
RabIg и вакцина против бешенства одобрены Министерством здравоохранения Канады.
Безопасны ли антирабический иммуноглобулин и антирабическая вакцина?
Да, оба эти продукта очень безопасны. Гораздо безопаснее сделать прививку этими продуктами, чем заразиться бешенством.У людей обычно возникают лишь незначительные реакции, которые могут длиться несколько дней после иммунизации.
RabIg получают из донорской крови человека, прошедшей испытания на безопасность. Все доноры крови проверяются на наличие таких вирусов, как ВИЧ и гепатит. Каждая донорская кровь также проверяется на наличие передающихся через кровь вирусов, прежде чем она будет использована для получения RabIg. При получении RabIg включают множество химических и физических стадий. Эти шаги включают инактивацию и удаление вирусов и бактерий, которые могут вызывать заболевания.Окончательный препарат RabIg подвергается дополнительным испытаниям, чтобы убедиться в отсутствии известных инфекционных вирусов. Однако риск передачи некоторых инфекций, передающихся через кровь, при использовании RabIg крайне мал. С момента начала скрининга и тестирования крови не поступало сообщений об инфекциях, передающихся через кровь, таких как ВИЧ, гепатит В или гепатит С, у людей, получавших RabIg.
Кто должен получать антирабический иммуноглобулин и антирабическую вакцину?
Если животное, которое может быть заражено бешенством, укусило или поцарапало вас, как можно скорее сделайте RabIg и вакцину против бешенства.Если вы уже получили полную серию вакцин против бешенства, вам не нужно получать RabIg. RabIg вводят путем инъекции в область (области), окружающую рану. Вводится одновременно с первой дозой антирабической вакцины.
Вакцина против бешенства обычно вводится в виде серии из 4 доз в течение 14 дней. Остальные дозы вакцины вы получите через 3, 7 и 14 дней. Если у вас ослабленная иммунная система или вы принимаете хлорохин, вы получите 5-ю дозу вакцины через 28 дней после 1-й дозы.
Людям с ослабленной иммунной системой необходимо сдать анализ крови через 7–14 дней после введения 5-й дозы вакцины, чтобы определить, что вы защищены. Если анализ крови показывает, что вы не защищены, вам потребуется вторая серия вакцин.
Если вы прошли курс вакцинации против бешенства до контакта с вирусом бешенства, вы должны получить 2 дозы вакцины. Эти дозы вводят с интервалом в 3 дня.
Кому еще следует сделать прививку от бешенства?
Вакцину против бешенства можно также вводить для профилактики бешенства до контакта с вирусом бешенства.Вакцина рекомендуется, но не предоставляется бесплатно, лицам, подверженным риску заражения вирусом бешенства, в том числе:
- Ветеринары и их персонал
- Работники лабораторий и другие работники, регулярно контактирующие с вирусом бешенства
- Работники службы охраны животных и дикой природы
- Охотники и звероловы в районах, где распространено бешенство, например, на Крайнем Севере
- Те, кто исследует или изучает пещеры
- Путешественники, которые проведут 1 месяц или более в странах, где распространено бешенство
Вакцина вводится в виде серии из 3 доз.2-ю дозу вводят через 7 дней после 1-й дозы. 3-ю дозу вводят через 21-28 дней после 1-й дозы.
Каковы преимущества антирабического иммуноглобулина и антирабической вакцины?
RabIg и вакцина против бешенства предотвращают заболевание бешенством, которое почти всегда приводит к летальному исходу. RabIg обеспечивает немедленную кратковременную защиту от заражения вирусом бешенства. Вакцина против бешенства обеспечивает длительную защиту от инфекции.
Какие возможны реакции после антирабического иммуноглобулина и вакцины против бешенства?
Общие реакции на RabIg могут включать болезненность и ригидность местных мышц, в которых проводилась иммунизация.Также могут возникать лихорадка, кожные реакции и аллергические реакции (крапивница или отек).
Некоторые иммуноглобулины могут быть связаны с риском тромбоза (сгустков крови) в течение 24 часов после их приема, особенно при введении больших объемов. Риск тромбоза повышен у тех, кто:
- 45 лет и старше
- С тромбозами в анамнезе; или
- С факторами риска тромбоза
Общие реакции на вакцину против бешенства могут включать болезненность, покраснение, отек и зуд в месте введения вакцины.Также могут возникать головная боль, лихорадка, болезненность мышц или суставов, тошнота, головокружение и утомляемость.
Ацетаминофен (например, Тайленол ® ) или ибупрофен* (например, Адвил ® ) можно назначать при лихорадке или болезненности. АСК (например, аспирин ® ) не следует назначать лицам моложе 18 лет из-за риска развития синдрома Рея.
*Ибупрофен не следует давать детям младше 6 месяцев без предварительной консультации с лечащим врачом.Для получения дополнительной информации о синдроме Рея см. файл HealthLinkBC #84 Синдром Рейе.
Важно оставаться в клинике в течение 15 минут после получения любой иммунизации, потому что существует редкая возможность, менее 1 на миллион, опасной для жизни аллергической реакции, называемой анафилаксией. Это может включать крапивницу, затрудненное дыхание или отек горла, языка или губ. Если эта реакция произойдет, ваш лечащий врач готов ее лечить. Неотложная помощь включает введение эпинефрина (адреналина) и доставку машиной скорой помощи в ближайшее отделение неотложной помощи.Если симптомы появятся после того, как вы покинете клинику, позвоните по номеру 9-1-1 или в местный номер службы экстренной помощи.
Важно всегда сообщать о серьезных или неожиданных реакциях своему лечащему врачу.
Кто не должен получать антирабический иммуноглобулин и антирабическую вакцину?
Любой человек, подвергшийся воздействию вируса бешенства и не получивший одобренную серию вакцин против бешенства, должен получить RabIg и вакцину против бешенства. Если вы получили серию вакцин против бешенства, вам не нужно получать RabIg, но вы все равно должны получить вакцину против бешенства.
Поговорите со своим лечащим врачом, если вы получаете вакцину против бешенства и у вас была опасная для жизни аллергическая реакция на предыдущую дозу вакцины против бешенства или какой-либо компонент вакцины, включая неомицин, хлортетрациклин, амфотерицин В, желатин или яичный белок.
Если вы получаете иммуноглобулин против бешенства, поговорите со своим лечащим врачом, если у вас есть:
- Имел опасную для жизни аллергическую реакцию на предыдущую дозу любого продукта иммуноглобулина или любой части иммуноглобулина против бешенства
- Состояние, называемое изолированным дефицитом иммуноглобулина А
- Тромбоз в анамнезе или факторы риска тромбоза; или
- Были привиты против кори, эпидемического паротита, краснухи или ветряной оспы в течение последних 14 дней
Нет необходимости откладывать вакцинацию из-за простуды или другого легкого заболевания.Однако, если у вас есть опасения, поговорите со своим лечащим врачом.
Что такое бешенство?
Бешенство — очень серьезное и почти всегда смертельное заболевание, вызываемое вирусом бешенства. Люди могут заразиться вирусом, если их укусит или поцарапает животное, больное бешенством. Вирус поражает мозг и нервную систему и приводит к летальному исходу у людей, если болезнь не предотвратить иммунизацией вскоре после заражения. Симптомы бешенства включают головную боль, лихорадку, затрудненное глотание, чрезмерное слюнотечение, мышечный спазм или слабость и странное поведение.
Для получения дополнительной информации о бешенстве см. файл HealthLinkBC № 07a Бешенство.
Согласие зрелого и несовершеннолетнего
Рекомендуется, чтобы родители или опекуны и их дети обсуждали согласие на иммунизацию. Дети в возрасте до 19 лет, которые в состоянии понять преимущества и возможные реакции на каждую вакцину, а также риск отказа от иммунизации, могут на законных основаниях дать согласие на иммунизацию или отказаться от нее. Для получения дополнительной информации о согласии совершеннолетних несовершеннолетних см. файл HealthLinkBC № 119 Закон о младенцах, Согласие совершеннолетних несовершеннолетних и иммунизация.
Для получения дополнительной информации о прививках посетите сайт ImmunizeBC по адресу https://immunizebc.ca/.
Предэкспозиционная вакцинация против бешенства и титры для ветеринаров
Заражение бешенством представляет собой профессиональную опасность для ветеринарных специалистов , и профилактические меры необходимы для защиты ветеринарной бригады. Вакцинация против бешенства до контакта обеспечивает дополнительную защиту для ветеринаров из группы риска, ветеринарных техников и других членов команды. Но вакцинация не заменяет хорошие профилактические меры, такие как средства индивидуальной защиты и безопасные процедуры обращения с животными и образцами.
Ветеринары и вспомогательный ветеринарный персонал входят в группу частого риска заражения бешенством и должны быть вакцинированы против бешенства до контакта в соответствии с рекомендациями Консультативного комитета по иммунизации Центров США по контролю и профилактике заболеваний (CDC) (ACIP). ). Сборник ветеринарных стандартных мер предосторожности для профилактики зоонозных заболеваний у ветеринарного персонала Национальной ассоциации государственных ветеринаров общественного здравоохранения указывает, что все члены команды, контактирующие с животными, должны быть вакцинированы против бешенства с последующей периодической проверкой титра и ревакцинацией против бешенства в соответствии с ACIP. рекомендации.
Преимущества доконтактной вакцинации против бешенства для ветеринарной бригады
Вакцинация против бешенства до контакта не устраняет необходимость в дополнительном лечении после контакта с бешенством. Но это устраняет необходимость постэкспозиционного введения антирабического иммуноглобулина и уменьшает количество необходимых постэкспозиционных доз вакцины. Доконтактная профилактика также может обеспечить защиту, если постконтактное лечение бешенства задерживается или если контакт с бешенством остается нераспознанным.
Активный гуморальный ответ развивается примерно через 7–10 дней, а обнаруживаемые антитела, нейтрализующие вирус бешенства, обычно сохраняются в течение нескольких лет. Продолжительность защиты варьируется, поэтому необходимы регулярные титры для оценки необходимости ревакцинации. Согласно руководящим принципам ACIP: «Хотя уровни антител, нейтрализующих вирус, не могут окончательно определить восприимчивость человека или защиту от воздействия вируса бешенства, титры у лиц, подвергающихся риску воздействия, используются для мониторинга относительного иммунного статуса против бешенства с течением времени.Чтобы гарантировать наличие первичного иммунного ответа с течением времени среди лиц с более высоким, чем обычно, риском заражения, следует периодически проверять титры, а бустерные дозы вводить только по мере необходимости».
Введение антирабической вакцины до контакта
Предэкспозиционная вакцинация против бешенства либо вакциной из диплоидных клеток человека (HDCV), либо вакциной из клеток очищенного куриного эмбриона (PCEC) вводится внутримышечно в дельтовидную область плеча по схеме, состоящей из трех инъекций, по одной инъекции в день в дни 0, 7 и 21 или 28. Если вы не завершите серию, вы рискуете получить неполную защиту в случае заражения бешенством.
Предэкспозиционная вакцинация для ветеринаров, ветеринарных техников и других членов ветеринарной бригады может быть заказана врачом или организована через местное или государственное управление здравоохранения. Страховое покрытие варьируется, поэтому узнайте у своего поставщика услуг, включает ли ваш полис полное или частичное покрытие. (AVMA LIFE предлагает льготы по вакцинации против бешенства; см. ниже.)
Требования к вакцинации против бешенства перед контактом и титры
Ветеринары и члены ветеринарных бригад по закону не обязаны проходить вакцинацию против бешенства или определять титры.В большинстве ветеринарных школ требуется предварительная вакцинация перед поступлением или во время доклинических курсов, и могут предлагать последующие титры до окончания учебы.
Титры и ревакцинация
ACIP рекомендует измерять титры каждые два года для оценки защитного иммунитета, при этом рекомендуется ревакцинация с одной инъекцией, если уровень титра ниже разведения сыворотки 1:5 (0,1–0,2 МЕ/мл). Пороговое значение титра бешенства, установленное Всемирной организацией здравоохранения (ВОЗ), выше; ВОЗ рекомендует однократную ревакцинацию против бешенства, когда титр падает ниже 0.5 МЕ/мл по RFFIT. Тем не менее, не существует установленного «защитного титра», и постконтактная профилактика по-прежнему необходима после известного воздействия.
По данным Ветеринарной диагностической лаборатории штата Канзас, уровни титра или значения МЕ/мл, равные или превышающие 0,5 МЕ/мл (~1:50), свидетельствуют о стойком иммунном ответе после вакцинации против бешенства. Хотя наличие антител после вакцинации важно, конкретный уровень выше 0,5 МЕ/мл не дает полной гарантии защиты от болезни у каждого человека , поскольку существуют другие иммунологические факторы, участвующие в защите от заражения бешенством .Тем не менее, обзор исследований по заражению бешенством показывает, что уровни нейтрализующих антител к вирусу бешенства (RVNA), равные или превышающие 0,5 МЕ/мл, обеспечивают, по крайней мере, такую же гарантию защиты, как и текущий статус вакцинации.
Две лаборатории в США проводят рекомендованный ACIP быстрый тест на ингибирование флуоресцентных очагов (RFFIT), который измеряет способность RVNA предотвращать проникновение вируса бешенства в клетки.
Хотя руководство ACIP рекомендует, чтобы ревакцинация основывалась на результатах RFFIT, тест не является обязательным, и некоторые ветеринары могут выбрать ревакцинацию вместо титра.
AVMA LIFE предлагает льготы по вакцинации против бешенства
AVMA LIFE включает в себя покрытие вакцинацией против бешенства в рамках Базового пакета защиты участников для ветеринаров и Студенческого базового пакета защиты для студентов-ветеринаров. До 600 долларов будет выплачено за серию профилактических мер против бешенства, проводимых ветеринарным врачом-участником или правомочным иждивенцем до или после контакта с бешенством; студенческий план предоставляет выгоду до 300 долларов. Титры бешенства также покрываются планами как для участников, так и для студентов.AVMA Life также ежегодно спонсирует Wellness Booth на съезде AVMA, предлагая ветеринарам, их иждивенцам, членам команды и студентам-ветеринарам титры на бешенство по цене 50 долларов.
Предварительная вакцинация против бешенства для ветеринарных техников и другого персонала
Насколько нам известно, ветеринарная практика не обязана платить за вакцинацию против бешенства для ветеринарного персонала. Тем не менее, владельцы практики должны ознакомиться с государственными нормативными актами, чтобы определить свои обязательства, и должны взвесить преимущества вакцинации своих сотрудников.Обратите внимание, что расходы на постконтактную профилактику бешенства могут легко достигать тысяч и могут включать требования компенсации работникам. Вакцинация против бешенства до контакта может не только обеспечить защиту персонала, но и снизить общие расходы, связанные с воздействием бешенства. Если вы предлагаете своим сотрудникам медицинские льготы, уточните у своей страховой компании, покрывается ли эта льгота.



 Никогда не беги!
Никогда не беги! 

 .
.