Постановка внутривенного катетера собакам и кошкам
Постановка внутривенного катетера собакам и кошкам
9 июня 2014
Катетеризация вены проводится в нескольких случаях. Она необходима, когда нужно быстро ввести лекарственный препарат при лечении кошек или животное нуждается в перинатальном питании. Также данная процедура проводится при переливании крови.
При выборе материала лучше отдать предпочтение тефлону или полиуретану, поскольку они снижают риск развития осложнений.
Врач должен работать в перчатках, используя стерильный пакет инструментов.
Катетер внутривенный: плюсы и минусы
Катетер внутривенный необходим, когда животному нужно ввести большое количество препаратов в разное время или питомец весь день проводит под капельницей. Применяя катетер внутривенный, можно также избежать тромбофлебита в результате многочисленных проколов вен.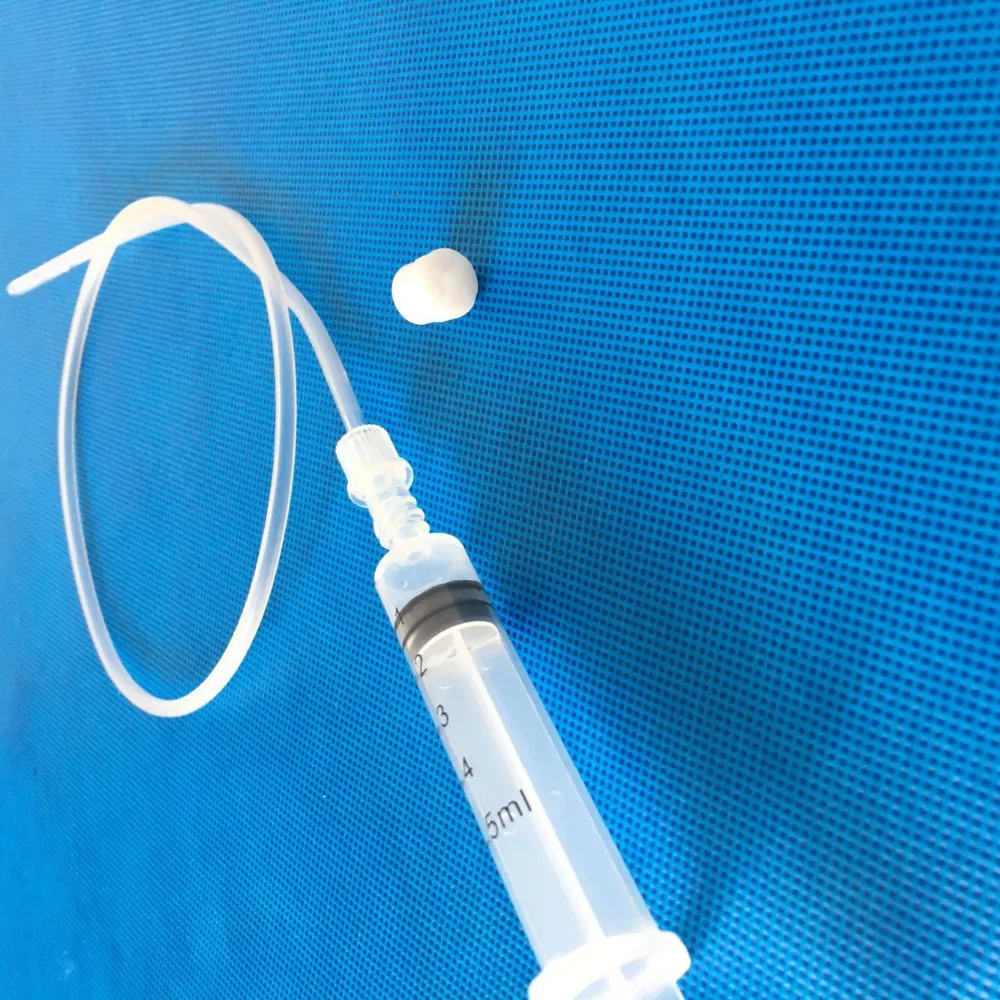
Из недостатков стоит отметить трудности постановки. Здесь необходимы определенные навыки, которыми обладают ветеринары. Самостоятельная постановка катетера недопустима. Данная процедура проводится только в ветеринарной клинике.
Вторым недостатком является высокий риск заражения крови, если место укола не было хорошо продезинфицировано или катетер животных находится слишком долго. Через 3-5 дней после введения его нужно удалить или переставить на другую лапу.
Поскольку животное может перегрызть или сдвинуть катетер, его необходимо надежно зафиксировать при помощи специального горького бинта.
Если Вашему питомцу требуется поставить внутривенный катетер и провести инфузионную терапию или другие ветеринарные услуги, приезжайте в клинику «Доктор Айболит» по одному из адресов, который находится ближе к Вам:
- г. Екатеринбург, ул. Рассветная 3 «Б» тел. 286-000-7, 357-33-03;
- г. Екатеринбург, ул. Крауля 63 «А» тел. 286-000-7, 207-60-03;
- г.
 Екатеринбург, ул. Родонитовая 26 тел. 286-000-7, 290-95-03.
Екатеринбург, ул. Родонитовая 26 тел. 286-000-7, 290-95-03.
Мы ждем вас с 10 до 20 часов без перерывов и выходных.
Быстрый ответ: Могу ли я удалить внутривенный катетер моей собаки?
Ножницами для перевязки разрежьте ленту по внешнему краю ноги. Оттяните ленту от кожи по обе стороны от катетера. Одним легким движением удалите катетер и скотч, как показано здесь. При удалении катетера убедитесь, что при удалении присутствует весь катетер.
Могу ли я удалить катетер для собак?
Быстрый ответ: если вашего питомца выписали с пластырем на ноге, где был внутривенный катетер, очень важно удалить эту повязку, иначе ступня опухнет. Как правило, его можно удалить через 2-4 часа после извлечения катетера.
Как долго может оставаться внутривенный катетер у собаки?
Когда место катетера высохнет, накройте место введения стерильной марлевой салфеткой 2 × 2. Затем повторно наложите перевязку на катетер. Традиционно рекомендуется не оставлять катетер на месте дольше 72–96 часов.
Затем повторно наложите перевязку на катетер. Традиционно рекомендуется не оставлять катетер на месте дольше 72–96 часов.
Когда можно удалить внутривенный катетер?
Распространенными причинами прекращения внутривенного введения жидкостей являются: объем жидкости пациента вернулся к исходному уровню; пациент выписывается из учреждения; необходимо заменить катетер для внутривенного введения; или место внутривенного вливания стало неблагоприятным из-за инфекции, инфильтрации, экстравазации или флебита.
Как снять ветеринарную повязку?
Есть два способа: оторвать или разрезать ножницами. Некоторые виды ветеринарных бинтов, такие как WildCow Vet Wrap, можно оторвать от рулона вручную, поэтому вам не нужно использовать ножницы, чтобы разрезать его. Другие ветеринарные бинты трудно оторвать от рулона, и их нужно разрезать.
Сколько стоит поставить катетер собаке?
Некоторые процедуры катетеризации мочи могут стоить всего 100 долларов. Процедуры, которые считаются более серьезными, могут стоить до 3,000 долларов.
Как часто следует промывать в / в?
Когда вы промываете капельницу? Промывки обычно назначаются каждые восемь часов, а также до и после введения лекарства через капельницу. Если вы получаете несколько лекарств по одной и той же линии, промывка будет использоваться между лекарствами, чтобы предотвратить смешивание несовместимых лекарств.
Как часто следует промывать внутривенные катетеры? Ветеринарный?
Внутривенные трубки, используемые для введения жидкости, следует менять каждые 72 часа. Трубку для внутривенного вливания, используемую для введения ПП, следует менять каждый раз, когда вводится новый пакет с ПП или каждые 24 часа, в зависимости от того, что происходит чаще.
Что произойдет, если вы оставите капельницу слишком долго?
Как только внутривенный катетер не понадобится, его следует удалить ». В то время как исследование Lancet сообщило только об одной инфекции кровотока среди участников, возможно, что оставление катетеров на более длительное время может со временем увеличить риск инфекций кровотока, сказал доктор Мермел, который также помог написать рекомендации CDC.
Что является наиболее важным шагом при прекращении внутривенной терапии?
21 карт в этом наборе
| Основная функция вен - переносить кровь из .. | тело к сердцу. |
|---|---|
| Что является наиболее важным шагом при прекращении внутривенной терапии? | Проверьте состояние наконечника катетера и немедленно сообщите врачу, если обнаружено какое-либо повреждение. |
Как часто следует менять повязку на внутривенные мешки?
Заменяйте марлевые повязки каждые 2 дня и прозрачные повязки каждые 7 дней на краткосрочных катетерах. Замените повязку, когда заменяют катетер, или когда повязка становится влажной, ослабленной или загрязненной, или когда необходимо осмотреть место.
Замените повязку, когда заменяют катетер, или когда повязка становится влажной, ослабленной или загрязненной, или когда необходимо осмотреть место.
В чем разница между канюлей и катетером?
В чем разница между катетером и канюлей? Канюля - это короткая гибкая трубка, которая вводится в кровеносный сосуд, а катетер - это трубка, которая значительно длиннее, чем внутрисосудистая канюля, для периферического доступа к телу.
Как предотвратить внутривенные инфекции?
Что должна делать медсестра при отмене периферического внутривенного катетера?
Что должна делать медсестра при отмене периферического внутривенного катетера? После удаления проверьте катетер на целостность. Предполагается, что пациенту потребуется внутривенная терапия в течение нескольких лет для лечения хронического болезненного процесса.
Предполагается, что пациенту потребуется внутривенная терапия в течение нескольких лет для лечения хронического болезненного процесса.
Услуги и цены
Услуги и ценыБ
- Балашиха
- Быково
Ж
- Железнодорожный
- Жуковский
К
- Королёв
- Красково
- Красногорск
- Курск
Л
- Лобня
- Лыткарино
- Люберцы
М
- Москва
- Московский
- Мытищи
Р
- Раменское
- Реутов
- Ростов-на-Дону
С
- Санкт-Петербург
Капельница собаке в Минске - внутривенное введение лекарственных средств
Как правило, первые симптомы болезни у питомца протекают незаметно для владельца. Но чем животное меньше, тем быстрее у него прогрессирует заболевание. Домашние любимцы нередко поступают к ветеринару в критическом состоянии, а самый быстрый способ помочь хвостатому пациенту – ввести лекарство подкожно или через вену с помощью капельницы.
Но чем животное меньше, тем быстрее у него прогрессирует заболевание. Домашние любимцы нередко поступают к ветеринару в критическом состоянии, а самый быстрый способ помочь хвостатому пациенту – ввести лекарство подкожно или через вену с помощью капельницы.
Чем поможет капельница?
Процедура будет полезна тем животным, которым нужно ввести антибиотик или физиологический раствор. В первом случае ставится внутривенный катетер в переднюю лапу, во втором – вводится игла под кожу на холке.
Потребность в процедуре может возникнуть при:
- интоксикации организма;
- диарее, температуре, рвоте;
- шоковом состоянии;
- потери крови.
Капельница необходима в том случае, если собака съела отравленную еду или ее укусило ядовитое насекомое, начался гнойно-воспалительный процесс (также когда требуется вскрытие абсцесса), диарея, рвота, повысилась температура. При этих состояниях организм теряет жидкость и полезные микроэлементы, которые важно быстрее восполнить. Процедура является незаменимой в том случае, если нужно перелить питомцу кровь, ввести еду при парентеральном питании.
При этих состояниях организм теряет жидкость и полезные микроэлементы, которые важно быстрее восполнить. Процедура является незаменимой в том случае, если нужно перелить питомцу кровь, ввести еду при парентеральном питании.
Подготовка собаки к процедуре
Находящееся в критическом состоянии животное не нуждается в подготовке к проведению процедуры. В этом случае откладывать помощь уже нельзя, нужно действовать быстро. Достаточно найти ровную поверхность, на которой собака сможет комфортно пролежать и перетерпеть манипуляцию.
Чаще всего вливание происходит в широкие вены передних лап. На этом участке нужно выстричь или сбить шерсть, после чего перетянуть лапу жгутом (выше зоны с проколом). Немаловажно обработать руки антисептиком, надеть защитные перчатки, а после введения иглы – зафиксировать место прокола пластырем, убрать жгут. Далее дело осталось за малым – проследить за состоянием любимца.
Необходимо обязательно говорить с собакой: благодаря уверенному и спокойному тону питомец легче переживет стресс от манипуляции.
Записаться на прием
Стоимость услуги
Как установить и управлять постоянным мочевым катетером
Постоянные мочевые катетеры (IDUC) регулярно используются в ветеринарной практике и служат многим целям. IDUC часто улучшает уход за пациентом, предотвращая загрязнение и ожоги мочой, обеспечивая необходимый мониторинг и общий комфорт и уход. Необходимый навык ветеринарных медсестер - уметь размещать их и знать, как правильно с ними обращаться. Они также должны понимать, почему катетер необходим их пациентам и на какие признаки следует обратить внимание, чтобы обеспечить наилучший уход за своим пациентом.В этой статье будут рассмотрены причины, по которым используются IDUC, как разместить их у собак, как ими управлять и какие могут быть потенциальные осложнения.
Постоянные мочевые катетеры (IDUC) часто используются в ветеринарной практике. Дипломированные ветеринарные медсестры (RVN) в первую очередь участвуют в принятии решений о катетеризации своих пациентов, а также в выборе, размещении и управлении IDUC ( Orpet and Welsh, 2011 ). IDUC иногда необходимы во время госпитализации пациента, когда пациенту требуется помощь при мочеиспускании из-за его состояния, например.г. синдром нижнего двигательного нейрона, хирургическое вмешательство, такое как уретропексия, или ятрогенные причины, такие как эпидуральная анестезия ( Pomfret, 2009 ). Поскольку ветеринарные медсестры постоянно стремятся к профессионализму и улучшению ухода за пациентами, можно сказать, что размещение и управление IDUC позволяет медсестрам использовать свои навыки для обеспечения наилучшего ухода за своими пациентами с точки зрения управления и наблюдения. Это помогает поддерживать использование планов сестринского ухода, обеспечивая более точную и информативную обратную связь о физиологическом статусе пациента ( Aggleton and Chalmers, 2000 ).Планы сестринского ухода являются довольно новой разработкой в ветеринарной профессии медсестер и расширяют стандартные больничные листы, обеспечивая более целостный подход к сестринскому уходу и вынуждая RVN задавать вопросы, касающиеся их пациентов, например, может ли животное мочиться ( Orpet и Welsh).
IDUC иногда необходимы во время госпитализации пациента, когда пациенту требуется помощь при мочеиспускании из-за его состояния, например.г. синдром нижнего двигательного нейрона, хирургическое вмешательство, такое как уретропексия, или ятрогенные причины, такие как эпидуральная анестезия ( Pomfret, 2009 ). Поскольку ветеринарные медсестры постоянно стремятся к профессионализму и улучшению ухода за пациентами, можно сказать, что размещение и управление IDUC позволяет медсестрам использовать свои навыки для обеспечения наилучшего ухода за своими пациентами с точки зрения управления и наблюдения. Это помогает поддерживать использование планов сестринского ухода, обеспечивая более точную и информативную обратную связь о физиологическом статусе пациента ( Aggleton and Chalmers, 2000 ).Планы сестринского ухода являются довольно новой разработкой в ветеринарной профессии медсестер и расширяют стандартные больничные листы, обеспечивая более целостный подход к сестринскому уходу и вынуждая RVN задавать вопросы, касающиеся их пациентов, например, может ли животное мочиться ( Orpet и Welsh). , 2011 )?
, 2011 )?
Протоколы ухода за мочевым пузырем и управления им могут различаться в зависимости от практики. В некоторых случаях IDUC не может использоваться регулярно и может быть установлен только ветеринарным хирургом, например, установка катетера тома для устранения обструкции уретры у кота, страдающего кошачьим заболеванием нижних мочевыводящих путей.Тем не менее, другие ветеринарные практики могут регулярно использовать IDUC для лечения более сложных пациентов и операций, например, лежачих пациентов с позвоночником или пациентов после операции на мочевыводящих путях ( Rawlings et al, 2002 ). Кобелям может потребоваться прерывистая катетеризация или установка IDUC для уменьшения задержки мочи либо из-за травмы позвоночника, либо по другим причинам, которые будут обсуждаться позже. Это часто выполняется ветеринарной медсестрой и может быть сделано у пациента в сознании в зависимости от темперамента животного.Катетеризация сук считается более сложной из-за их анатомии. Кошки тоже, как известно, являются более сложными и требуют седативных средств и ветеринарной помощи. Поэтому в этой статье основное внимание будет уделено тому, как размещать и управлять ВДЯК у собак, учитывая показания для установки катетера, возможные осложнения, как размещать и управлять НДЯК, а также выбор открытой или закрытой системы сбора.
Кошки тоже, как известно, являются более сложными и требуют седативных средств и ветеринарной помощи. Поэтому в этой статье основное внимание будет уделено тому, как размещать и управлять ВДЯК у собак, учитывая показания для установки катетера, возможные осложнения, как размещать и управлять НДЯК, а также выбор открытой или закрытой системы сбора.
Показания
Существует ряд причин для катетеризации мочевого пузыря, в том числе:
Для получения незагрязненного образца мочи для посева и определения чувствительности ( Lane and Cooper, 2003 )
Для опорожнения мочевого пузыря перед абдоминальной, вагинальной и уретральной операцией или исследованием мочевыводящих путей или при наличии обструкции и невозможности мочеиспускания ( Busch, 2006 )
Для введения лекарств или контрастных веществ для рентгенографических исследований ( Lane and Cooper, 2003 ) мочевого пузыря и обеспечивают оптимальные условия для заживления ( Busch, 2006 )
Для поддержания открытой уретры или для гидропропульсии у пациентов с обструкцией ( Lane and Cooper, 2003 )
Для контроля диуреза (UOP) у пациентов с заболеваниями почек или у пациентов, перенесших операции на почках, во время анестезии для контроля почечной перфузии и инфузионной терапии или у пациентов интенсивной терапии ( Welsh, 2003 )
Для мониторинга и лечения инфекций мочевыводящих путей (ИМП) ( Lane and Cooper, 2003 ) пациент ( валлийский , 2003 )
Для предотвращения подтекания мочи в стерильное поле во время операций на мягких тканях с вовлечением окружающих структур крайней плоти ( Busch, 2006 )
Осложнения
Существует множество осложнений, которые могут возникнуть во время или после установки IDUC. Эти осложнения следует учитывать перед размещением IDUC у пациента, и их следует контролировать на протяжении всего времени использования. Необходимо вести хорошие записи, касающиеся IDUC и мочи для каждого пациента, и ветеринар должен быть проинформирован о любых осложнениях. В случае их возникновения следует принять соответствующие меры, которые будут обсуждаться далее, особенно в случае ИМП. Существует ряд возможных осложнений:
Эти осложнения следует учитывать перед размещением IDUC у пациента, и их следует контролировать на протяжении всего времени использования. Необходимо вести хорошие записи, касающиеся IDUC и мочи для каждого пациента, и ветеринар должен быть проинформирован о любых осложнениях. В случае их возникновения следует принять соответствующие меры, которые будут обсуждаться далее, особенно в случае ИМП. Существует ряд возможных осложнений:
ИМП является наиболее частым осложнением и возникает, когда бактерии заносятся из уретры во время введения, после нестерильного введения, IDUC, повторной катетеризации, травмы мочевого пузыря или у пациентов с ослабленным иммунитетом ( Bubenik and Hosgood, 2008 )
Цистит, который может быть реактивным или инфекционным.Это редко наблюдается и часто возникает после повторной катетеризации ( Lane and Cooper, 2003 ). У сук это часто вызвано чрезмерным усилием при введении катетера ( Orpet and Welsh, 2011 ).

Пошаговое руководство по размещению IDUC у собаки
Уложите пациента в положении лежа на боку на чистую простыню для страдающих недержанием, а ассистент удерживает пациента.Седация может быть сочтена необходимой на этом этапе, если животное отказывается сотрудничать ( Lane and Cooper, 2003 ).
Вымойте руки и наденьте перчатки.
Подстригите и пропылесосьте волосы с дистальной части крайней плоти и 2 дюймов вокруг места введения, включая вентральную часть живота ( Smarick et al, 2004 ).
Выдавите половой член из крайней плоти и подготовьте область (протрите конец полового члена и промойте крайнюю плоть пять раз) с помощью разбавленного хлоргексидина (0.05%) ( Sullivan et al, 2010 ).
Закапывайте 1 мл 2% лидокаина или 0,5–3 мл стерильного лидокаинового желе в отверстие уретры под руководством ветеринарного хирурга ( Smarick et al, 2004 ).

Замените перчатки на стерильные, используя метод открытых перчаток ( Smarick et al, 2004 ).
Создайте стерильное поле, используя стерильную барьерную салфетку с прорезанным отверстием для доступа к половому члену.
Сохранение катетера как можно более стерильным с использованием «бесконтактной техники», когда в упаковке катетера вырезается «питательная» секция, позволяющая постепенно продвигать катетер в мочевой пузырь из стерильной упаковки, тем самым улучшая асептику, выньте наконечник катетера из упаковки и нанесите стерильную смазку.Затем начните вводить катетер в отверстие уретры, осторожно продвигаясь вперед. Оставшаяся часть катетера должна оставаться внутри стерильной упаковки, так как катетер вводится постепенно, чтобы сохранить его как можно более стерильным во время установки. На этом этапе может потребоваться проводник/стилет, если продвижение катетера затруднено ( Orpet and Welsh, 2011 ).
Продолжайте продвигать катетер до тех пор, пока моча не начнет течь обратно и не будет подтверждено его размещение в мочевом пузыре.
 Если моча не видна, катетер можно промыть или начать процесс заново ( Sullivan et al, 2010 ).
Если моча не видна, катетер можно промыть или начать процесс заново ( Sullivan et al, 2010 ).Прикрепите адаптер шприца/втулку и пробку к концу катетера, чтобы предотвратить подтекание мочи ( Smarick et al, 2004 ).
Наполните баллон Фолея стерильной водой, чтобы он оставался на месте, и осторожно извлекайте катетер до тех пор, пока не почувствуете сопротивление, чтобы убедиться, что баллон надут и катетер надежно закреплен ( Sullivan et al, 2010 ).
Промойте IDUC 5–10 мл стерильной воды и аспирируйте такое же количество обратно ( Smarick et al, 2004 ).
Опорожните мочевой пузырь, измерьте и запишите количество или присоедините к системе сбора ( Orpet and Welsh, 2011 ).
Закрепите катетер на пациенте с помощью отрезка повязки, завязанной вокруг его живота или ноги, или Surgifix вокруг его живота, не слишком туго ( Orpet and Welsh, 2011 ).
При необходимости прикрепите к мочеприемнику мешок для сбора мочи, расположите мешок ниже тела пациента и прикрепите трубку выше к ноге пациента или к вольеру так, чтобы катетер не натягивал катетер, вызывая боль и дискомфорт или потенциально удаляя его.
 .Мешок для сбора должен храниться в чистом лотке, выстланном чистой простыней при недержании ( Smarick et al, 2004 ).
.Мешок для сбора должен храниться в чистом лотке, выстланном чистой простыней при недержании ( Smarick et al, 2004 ).Убедитесь, что пациент носит елизаветинский воротник ( Orpet and Welsh, 2011 ) ( Рисунок 1 ). Рисунок 1.
Постоянный мочевой катетер, установленный пациенту под анестезией с использованием асептической, «бесконтактной» техники
Неудачная катетеризация может произойти у суки, если уретральное отверстие пройдено.Это также может произойти у кобелей, если вокруг полового члена наблюдается сильный отек мягких тканей, например, у пациентов с дорожно-транспортными происшествиями ( Lane and Cooper, 2003 ).
Резистентность пациента — это ситуация, которая часто возникает и чаще всего встречается у сук и кошек ( Lane and Cooper, 2003 ).
Закупорка/обструкция IDUC может произойти из-за неправильного лечения или осадка мочи ( Lane and Cooper, 2003 )
Вероятность членовредительства/удаления катетера должна быть предотвращена путем закрепления IDUC на пациенте и наложения елизаветинского воротника ( Orpet and Welsh, 2011 )
Как разместить IDUC
Оборудование/расходные материалы, необходимые для размещения IDUC
Важно, чтобы все было готово для установки IDUC до начала процедуры. Также важно подумать о подходящей системе сбора, подходящей для пациента, его темпераменте, состоянии и будущем ведении, прежде чем устанавливать IDUC, что будет обсуждаться в этой статье. Для размещения требуется:
Также важно подумать о подходящей системе сбора, подходящей для пациента, его темпераменте, состоянии и будущем ведении, прежде чем устанавливать IDUC, что будет обсуждаться в этой статье. Для размещения требуется:
Прокладка при недержании для поддержания чистоты области и поглощения любых подтеканий мочи во время установки
Катетер — силиконовый Foley соответствующего размера (длины и толщины) для животного
Стерильная смазка на водной основе для облегчения продвижения катетера
Разбавленный раствор хлоргексидина или раствор повидон-йода для обработки кожи; при использовании хлоргексидина участок необходимо промыть водой после подготовки из-за его цитотоксических свойств ( Orpet and Welsh, 2011 )
Стерильная вода для надувания баллона (необходимое количество указано на катетере, например,г. 1,5 мл) для удержания катетера на месте и для промывания катетерного штифта
Местный анестетик, напр.
 2% лидокаин или гель лидокаина для снижения чувствительности крайней плоти или преддверия ( Sullivan et al, 2010 )
2% лидокаин или гель лидокаина для снижения чувствительности крайней плоти или преддверия ( Sullivan et al, 2010 )Проволочный направитель/стилет может потребоваться для придания жесткости гибким катетерам во время установки, что особенно полезно для сук ( Orpet and Welsh, 2011 )
Стерильный шприц для дренирования мочевого пузыря и мерный стакан
Заглушка и втулка для герметизации свободного конца катетера ( Orpet and Welsh, 2011 )
Источник света для установки IDUC у суки и стерильное зеркало соответствующего размера ( Orpet and Welsh, 2011 )
Для введения IDUC суке могут потребоваться седативные препараты — обратитесь за советом и направлением к ветеринарному врачу , 2003 )
Повязка/Surgifix для закрепления катетера на пациенте ( Рисунок 2 .)
Оборудование для установки постоянного мочевого катетера.
Установка IDUC у собаки
Размещение IDUC у кобелей считается самым простым и наиболее часто выполняемым RVN, поскольку это часто может быть сделано у пациента в сознании, в зависимости от темперамента собаки, и, как правило, его легче разместить, чем у сук. См. пошаговое руководство и Рисунок 1 .
Размещение IDUC у суки
Установка IDUCу суки включает те же принципы подготовки и стерильности, что и у собаки, но пациенту может потребоваться седация; поскольку положение ограничения, необходимое для размещения, менее удобно/переносимо, размещение может занять больше времени и быть более сложным.
Для размещения пациента фиксируют в положении лежа на спине с согнутыми и вытянутыми вперед задними конечностями. Для визуализации отверстия уретры используют стерильное зеркало и источник света, затем кончик катетера вводят в отверстие уретры между вульвой и шейкой матки и продвигают в мочевой пузырь. Это также можно сделать «вслепую» с помощью цифрового метода, при котором палец находит отверстие уретры и направляет катетер в уретру, но это часто требует большого опыта. После того, как катетер установлен асептически, необходимо надуть баллон, промыть катетер, закрепить его и выбрать соответствующую систему сбора, как при установке IDUC у собаки.
После того, как катетер установлен асептически, необходимо надуть баллон, промыть катетер, закрепить его и выбрать соответствующую систему сбора, как при установке IDUC у собаки.
Как управлять IDUC
IDUC всегда должен быть безопасным и всегда должен быть «закрытой» системой. Закрытая система означает, что катетер закрыт для наружного воздуха. Нахождение на открытом воздухе может привести к ожогу мочой, поскольку моча будет постоянно вытекать из катетера, а также увеличить риск бактериальной инфекции из-за миграции бактерий ( Bubenik and Hosgood, 2008 ).Поэтому IDUC следует либо закрывать стерильной пробкой и периодически опорожнять, либо подсоединять к стерильному мешку для сбора мочи ( , рис. 3, ). Мешок для сбора мочи или мочевой пузырь следует опорожнять, а мочу измерять каждые 4 часа. Необходимо записать количество и рассчитать UOP (количество мочи, деленное на 4 (часа), деленное на массу тела пациента = ___ мл/кг/ч) ( Orpet and Welsh, 2011 ). Минимальный UOP = 1–2 мл/кг/час. Эта информация важна, поскольку она является хорошим индикатором функции почек и состояния гидратации ( Orpet and Welsh, 2011 ).
Минимальный UOP = 1–2 мл/кг/час. Эта информация важна, поскольку она является хорошим индикатором функции почек и состояния гидратации ( Orpet and Welsh, 2011 ).
Рисунок 3. Собака с септическим перитонитом, нуждающаяся в IDUC для предоперационного дренирования мочевого пузыря и послеоперационного ведения и наблюдения.
IDUC следует промыть стерильной водой, если проходимость катетера находится под вопросом, например, снижение UOP; частая промывка увеличивает риск заражения, поскольку закрытая система нарушается и подвергается воздействию внешней среды ( Orpet and Welsh, 2011 ). Когда катетер промывается, следует отметить количество закапываемой воды, чтобы оно не было включено в общее количество мочи, что может привести к ложным показаниям UOP.
Также следует обратить внимание на цвет, запах и количество мочи, так как это может указывать на инфекцию, обезвоживание, почечные осложнения или перегрузку жидкостью. При обнаружении аномалий следует провести анализ мочи с помощью тест-полоски и определение удельного веса. Кроме того, незагрязненный образец мочи можно отправить в лабораторию для посева мочи и определения чувствительности при подозрении на инфекцию. Удельный вес менее 1,030 указывает на неадекватную концентрационную способность почечных канальцев ( Lane and Cooper, 2003 ).Щуп для определения уровня мочи должен показывать pH от 5 до 7 и отсутствие следов белка, крови, глюкозы, кетонов или желчи в нормальной пробе мочи. Цвет должен быть прозрачным, желтым и с характерным запахом ( Lane and Cooper, 2003, ). Помимо асептического размещения IDUC, место введения должно содержаться в чистоте. Область вульвы или препуция следует очистить, промыть разбавленным раствором хлоргексидина и промыть, открытую часть катетера протереть антисептическим раствором, а все соединения мочевого катетера держать затянутыми, чистыми и лежать в лотке, выстланном чистым листом для лечения недержания ( Smarick et al, 2004 ) ( Рисунок 4 ) .
Кроме того, незагрязненный образец мочи можно отправить в лабораторию для посева мочи и определения чувствительности при подозрении на инфекцию. Удельный вес менее 1,030 указывает на неадекватную концентрационную способность почечных канальцев ( Lane and Cooper, 2003 ).Щуп для определения уровня мочи должен показывать pH от 5 до 7 и отсутствие следов белка, крови, глюкозы, кетонов или желчи в нормальной пробе мочи. Цвет должен быть прозрачным, желтым и с характерным запахом ( Lane and Cooper, 2003, ). Помимо асептического размещения IDUC, место введения должно содержаться в чистоте. Область вульвы или препуция следует очистить, промыть разбавленным раствором хлоргексидина и промыть, открытую часть катетера протереть антисептическим раствором, а все соединения мочевого катетера держать затянутыми, чистыми и лежать в лотке, выстланном чистым листом для лечения недержания ( Smarick et al, 2004 ) ( Рисунок 4 ) .
Рис. 4. Лежащий пациент, подключенный к открытой системе сбора.

Также следует регулярно менять повязку, фиксирующую катетер на пациенте, и использовать чистую и правильную систему сбора. При работе с катетером или системой сбора мочи следует мыть руки и надевать перчатки ( Sullivan et al, 2010 ).
Следует избегать применения антибиотиков в качестве профилактики ИМП, поскольку исследования, подобные проведенному Smarick et al (2004) по изучению частоты катетер-ассоциированных ИМП среди собак в отделении интенсивной терапии, показали, что они могут увеличить риск ИМП, и когда инфекции все же возникают, они обладают высокой степенью устойчивости к антибактериальным препаратам ( Lane, 2009 ).Однако антибиотикотерапии не всегда можно избежать, так как большинство стационарных пациентов получают антибиотики по своему состоянию или хирургическому вмешательству, не связанному с IDUC ( Smarick et al, 2004 ). Если присутствует инфекция, RVN должен удалить катетер и отправить кончик катетера в лабораторию для посева и определения чувствительности, результаты позволят назначить животному правильное лечение ( Smarick et al, 2004 ). Также важно учитывать, что IDUC может вызывать дискомфорт или раздражение, что может привести к стрессу, длительному заживлению и членовредительству, поэтому могут потребоваться анальгетики, если пациент уже не принимает их по поводу другого состояния ( Siddle, 2003 ). ).Исследование Bubenik and Hosgood (2008) предполагает, что IDUC не следует поддерживать дольше 4–5 дней, поскольку риск ИМП увеличивается с каждым днем (в 1,5 раза), несмотря на применение антибактериальной терапии. Поэтому в Orpet and Welsh (2011) рекомендуется, чтобы IDUC в идеале оставляли на месте не более чем на 24 часа, чтобы еще больше снизить риск ИМП. Если IDUC требуется на более длительный период, катетер следует удалить и заменить новым с использованием асептической техники.Систему сбора также следует заменить на новую, стерильную, чтобы снизить риск ИМП. Что еще более важно, это помогает ветеринарным медсестрам распознавать способность пациента к самопроизвольному мочеиспусканию и, следовательно, больше не требует IDUC ( Bubenik and Hosgood, 2008 ).
Также важно учитывать, что IDUC может вызывать дискомфорт или раздражение, что может привести к стрессу, длительному заживлению и членовредительству, поэтому могут потребоваться анальгетики, если пациент уже не принимает их по поводу другого состояния ( Siddle, 2003 ). ).Исследование Bubenik and Hosgood (2008) предполагает, что IDUC не следует поддерживать дольше 4–5 дней, поскольку риск ИМП увеличивается с каждым днем (в 1,5 раза), несмотря на применение антибактериальной терапии. Поэтому в Orpet and Welsh (2011) рекомендуется, чтобы IDUC в идеале оставляли на месте не более чем на 24 часа, чтобы еще больше снизить риск ИМП. Если IDUC требуется на более длительный период, катетер следует удалить и заменить новым с использованием асептической техники.Систему сбора также следует заменить на новую, стерильную, чтобы снизить риск ИМП. Что еще более важно, это помогает ветеринарным медсестрам распознавать способность пациента к самопроизвольному мочеиспусканию и, следовательно, больше не требует IDUC ( Bubenik and Hosgood, 2008 ).
Открытая система сбора мочи по сравнению с закрытой системой сбора мочи
Открытая система сбора мочи включает подключение катетера к стерильному мешку-резервуару с длиной линии сбора, чтобы он находился вдали от пациента.Закрытая система сбора мочи — это когда конец катетера закрывается стерильной пробкой ( , рис. 5, ).
Рис. 5. Пациент с нервно-мышечным расстройством с закрытой системой (мочевой пузырь дренируется вручную каждые четыре часа).
На самом деле обе эти системы могут быть классифицированы как «закрытые», поскольку ни одна из них не позволяет катетеру открываться для воздуха. Предполагается, что закрытая система увеличивает риск нозокомиальной бактериурии, так как пробка периодически отсоединяется от катетера для дренирования мочевого пузыря ( Рисунок 3 ), подвергая систему воздействию внешней среды ( Sullivan et al. , 2010 ).
По этой же причине промывать катетер рекомендуется только в том случае, если UOP уменьшается или проходимость ставится под сомнение, чтобы избежать слишком частого «открытия» системы. Однако открытая система означает, что нет необходимости отсоединять линию для сбора мочи из мешка-резервуара, что снижает частоту возникновения бактериурии. Теоретически в линии с этой системой есть больше соединений, которые могут быть местом потенциальной миграции бактерий, и может потребоваться отсоединение системы от катетера, чтобы катетер можно было промыть.
Однако открытая система означает, что нет необходимости отсоединять линию для сбора мочи из мешка-резервуара, что снижает частоту возникновения бактериурии. Теоретически в линии с этой системой есть больше соединений, которые могут быть местом потенциальной миграции бактерий, и может потребоваться отсоединение системы от катетера, чтобы катетер можно было промыть.
Исследование Sullivan and Campbell (2010) , в котором оценивались открытые и закрытые системы сбора мочи и развитие внутрибольничной бактериурии, показало, что тип системы сбора мочи (открытая или закрытая) не связан с возможностью развития внутрибольничной бактериурии. Требуются дальнейшие исследования, но наиболее важными факторами для предотвращения ИМП являются установка асептического катетера и его обслуживание, а также минимизация продолжительности катетеризации ( Sullivan et al, 2010 ).
Заключение
Способность RVN размещать и управлять IDUC является ценным преимуществом при уходе за госпитализированными пациентами, поскольку позволяет точно контролировать UOP и предотвращает пачкание пациентов и получение ожогов мочой. Согласно исследованиям, проведенным Салливаном и Кэмпбеллом, при правильном размещении и управлении IDUC может улучшить самочувствие пациента, его прогресс и выздоровление. Можно сделать вывод, что использование асептической техники при размещении и последующей обработке, а также тщательный мониторинг снижают риск осложнений, таких как ИМП.IDUC помогает RVN обеспечивать наилучший уход за пациентами и применять свои знания и навыки. Из недавних исследований IDUC и UTI стало ясно, что необходимы дальнейшие исследования по размещению и лечению IDUC, ситуации, в которую мы, как RVN, можем внести свой вклад посредством практики, основанной на доказательствах.
Согласно исследованиям, проведенным Салливаном и Кэмпбеллом, при правильном размещении и управлении IDUC может улучшить самочувствие пациента, его прогресс и выздоровление. Можно сделать вывод, что использование асептической техники при размещении и последующей обработке, а также тщательный мониторинг снижают риск осложнений, таких как ИМП.IDUC помогает RVN обеспечивать наилучший уход за пациентами и применять свои знания и навыки. Из недавних исследований IDUC и UTI стало ясно, что необходимы дальнейшие исследования по размещению и лечению IDUC, ситуации, в которую мы, как RVN, можем внести свой вклад посредством практики, основанной на доказательствах.
Катетеры для собак — всего 1,55 фунта стерлингов
Стоимость катетеров для собак:
- ПУНКТ
Катетер для собак: стерильный
Катетер для собак: стерильный
Катетер для собак: стерильный
Катетер для собак: стерильный
- РАЗМЕР
1.
 Внешний диаметр 3 мм x 50 см
Внешний диаметр 3 мм x 50 смВнешний диаметр 2,0 мм x 50 см
Внешний диаметр 2,6 мм x 50 см
Внешний диаметр 3,3 мм x 50 см
- ЛУЭР
Белый
Желтый
Оранжевый
Красный
- ЦЕНА
1 фунт стерлингов.55
1,55 фунта стерлингов
1,55 фунта стерлингов
1,55 фунта стерлингов
ОПЛАТА ДОСТАВКИ / ПЕРЕВОЗКИ:
ТОРГОВЫЕ КЛИЕНТЫ (только ветеринарные клиники и больницы)
Торговые клиенты получат бесплатную доставку на следующий рабочий день для всех заказов на материковую часть Великобритании на сумму более 75 фунтов стерлингов (без НДС). При заказе на сумму менее 75 фунтов стерлингов взимается плата за обработку в размере 6,99 фунтов стерлингов (без учета НДС).Плата за международные или отдаленные места (например, Шотландское нагорье и острова) всегда будет взиматься, и окончательная сумма будет определена при получении заказа. Заказы будут доставлены нашим назначенным перевозчиком по адресу, указанному в заказе. Заказы, полученные до 17:00. обрабатываются в тот же день для доставки на следующий рабочий день.
Заказы будут доставлены нашим назначенным перевозчиком по адресу, указанному в заказе. Заказы, полученные до 17:00. обрабатываются в тот же день для доставки на следующий рабочий день.
ЧАСТНЫЕ ЗАКАЗЧИКИ
Частные клиенты могут выбрать один из следующих вариантов;
Обслуживание 3-5 рабочих дней – 6 фунтов стерлингов.99 + НДС
Обслуживание в течение 1-2 рабочих дней – 9,99 фунтов стерлингов + НДС
Обслуживание на следующий рабочий день – 12,99 фунтов стерлингов + НДС
Обратите внимание, что эти сроки указаны в рабочие дни и не включают выходные и праздничные дни. Эти расходы покрывают упаковку и транспортировку независимо от потраченной суммы. За более тяжелые и объемные заказы будет взиматься дополнительная плата, и с клиентами свяжутся напрямую для утверждения перед отправкой. Заказы будут доставлены нашим назначенным перевозчиком по адресу, указанному в заказе.Заказы, полученные до 17:00. обрабатываются в тот же день.
ПЕРЕНОСКИ
Vet Store оставляет за собой право выбирать партнера по логистике по своему выбору, и это время от времени может меняться. В настоящее время это может варьироваться между TNT, Hermes и Royal Mail.
В настоящее время это может варьироваться между TNT, Hermes и Royal Mail.
ЗАДЕРЖКИ
Несмотря на то, что прилагаются все усилия для обеспечения доставки в указанные выше сроки, мы не можем дать никаких гарантий из-за обстоятельств, не зависящих от нас, и мы не несем никакой ответственности за любые убытки или ущерб, вызванные задержкой, какой бы ни была причина.
НЕДОСТАТКИ
В случае недопоставки или повреждения необходимо уведомить ветеринарный магазин в течение 48 часов. О неполучении товаров, по которым выставлен счет, необходимо сообщить нам в течение 24 часов с даты доставки. Vet Store не несет ответственности за проблемы с доставкой, возникшие из-за неверной информации, предоставленной покупателем.
ЗАРУБЕЖНЫЕ КЛИЕНТЫ
ЕС: 45 или 55 фунтов стерлингов за перевозку за 20 кг будут взиматься независимо от потраченной суммы в зависимости от того, в какую страну доставляется заказ.
ОСТАЛЬНОЙ МИР: 125 фунтов стерлингов за перевозку 20 кг будут взиматься независимо от потраченной суммы.
Эти суммы предназначены только для справки, и в определенных обстоятельствах может потребоваться связаться с вами для дополнительной платы за перевозку, например, если посылка большая или тяжелая.
ВОЗВРАТ
В том маловероятном случае, если товар необходимо вернуть, мы предлагаем политику возврата в течение 10 рабочих дней без споров, разработанную для минимальных неудобств.
Для товаров, заказанных по ошибке, вы будете нести полную стоимость почтовых расходов и упаковки.
Перед возвратом предметов необходимо получить одобрение.
Пожалуйста, заполните форму возврата и, как только вы получите уникальный номер возврата (URN#) и одобрение, верните его вместе с товаром для возврата – нажмите здесь, чтобы загрузить.
ПОЖАЛУЙСТА, ОБРАТИТЕ ВНИМАНИЕ. В целях безопасности мы настоятельно рекомендуем при отправке товаров обратно использовать «подписанную» службу доставки, такую как Royal Mail Recorded или Special Delivery, и убедиться, что посылка надлежащим образом застрахована. Мы не несем ответственности за какие-либо посылки, утерянные по почте, и не берем на себя ответственность за какие-либо предметы до тех пор, пока один из наших сотрудников не распишется на посылке. Товары должны быть возвращены в надлежащей упаковке, чтобы избежать повреждений при транспортировке.
Мы не несем ответственности за какие-либо посылки, утерянные по почте, и не берем на себя ответственность за какие-либо предметы до тех пор, пока один из наших сотрудников не распишется на посылке. Товары должны быть возвращены в надлежащей упаковке, чтобы избежать повреждений при транспортировке.
Кредит предоставляется только за возвращенные товары, полученные в состоянии, пригодном для перепродажи.
Вы можете позвонить в нашу службу поддержки клиентов по телефону 01274 736319, чтобы разместить заказ, с понедельника по пятницу с 9:00 до 17:30.
Кроме того, вы можете отправить нам факс по номеру 01274 491585 или электронное письмо по адресу sales@thevetstore.нетто
Установка и обслуживание постоянных уретральных катетеров
Для очистки всех мест наденьте смотровые перчатки и используйте стерильные марлевые тампоны для очистки, чередуя соответствующие разбавленные кожные антисептики (например, , хлоргексидиновый скраб, разбавленный стерильным физиологическим раствором от 5–5% до 90,204 90,204). хлоргексидин, 1:200 повидон-йод/стерильный физиологический раствор ) и стерильный физиологический раствор.
хлоргексидин, 1:200 повидон-йод/стерильный физиологический раствор ) и стерильный физиологический раствор.
Собаки
- Подстригите волосы на крайней плоти и окружающей вентральной части живота.Укоротите близлежащие длинные волосы.
- Очистите область, используя не менее трех скрабов с каждым раствором.
Самцы
- Промойте крайнюю плоть три-пять раз 2–12 мл разбавленного кожного антисептика (объем зависит от размера собаки) с помощью стерильного шприца.
- Ассистент в чистых смотровых перчатках должен экстериоризировать половой член. Очистите все крупные экссудаты, затем очистите всю область, используя не менее трех салфеток с каждым раствором.Промойте 2–5 мл разбавленного кожного антисептика.
Самки
- Очистите вульву и перивульварную область, используя не менее трех скрабов каждым раствором.

- Промойте свод влагалища три-пять раз 0,5–12 мл разбавленного кожного антисептика (объем зависит от размера животного) с помощью стерильного шприца.
Все
- Накройте рабочую зону стерильной салфеткой с отверстиями.
- Выполните гигиену рук и наденьте стерильные перчатки .
- Проверьте баллоны катетеров Фолея перед установкой.
- Покройте дистальный катетер стерильным гелем-смазкой из одноразовой упаковки и установите катетер стерильным способом.
- Немедленно подключите стерильную закрытую систему сбора.
- Закрепите катетер, чтобы предотвратить его смещение, и наденьте на животное елизаветинский воротник.
Ежедневное обслуживание постоянных катетеров
Проведите гигиеническую обработку рук и наденьте стерильные перчатки . Очищать место соединения пациента и внешней части катетера каждые 24 часа стерильными марлевыми тампонами, чередуя разбавленный кожный антисептический раствор и стерильный физиологический раствор (не менее трех скрабов каждым раствором ).
Управление системой закрытого сбора
- Не применять профилактические противомикробные препараты ; они увеличивают риск внутрибольничных резистентных инфекций, и не доказано, что они предотвращают инфекцию. Назначайте противомикробные препараты только при подтвержденной инфекции .
- Расположите мешки для сбора ниже уровня животного, чтобы моча вытекала под действием силы тяжести. Предотвратите ретроградный поток мочи из мешка для сбора обратно в пациента, поскольку это может вызвать ятрогенную инфекцию мочевыводящих путей резистентными микроорганизмами. Зажим системы сбора следует закрывать, когда пациент перемещается или ходит, и сразу же снова открывать, как только мешок для сбора снова окажется ниже пациента.Ежечасно проверяйте проходимость трубки.
- Посев мочи (посредством цистоцентеза) во время удаления катетера указать только d если есть признаки кисты ит .
 Результаты посева мочи из постоянного катетера (не рекомендуется) следует интерпретировать с осторожностью. Не культивируйте кончик удаленного катетера .
Результаты посева мочи из постоянного катетера (не рекомендуется) следует интерпретировать с осторожностью. Не культивируйте кончик удаленного катетера .
Границы | Преимущества нового устройства для фиксации артериального катетера у собак под наркозом: пилотное рандомизированное клиническое исследование
Введение
Мониторинг артериального давления обычно проводится у ветеринарных пациентов под общей анестезией (1).Артериальные катетеры используются для интраоперационного непрерывного прямого мониторинга артериального давления в случаях риска гемодинамических нарушений (2). Установлено, что введение артериального катетера в дорсальную артерию стопы у собак является безопасной процедурой (3) и обеспечивает удобный доступ для многократного забора крови и анализа газов крови (4). Таким образом, катетеризация артерий является важным клиническим методом, когда требуется прямое измерение артериального давления для гемодинамического мониторинга у тяжелобольных ветеринарных пациентов под общей анестезией.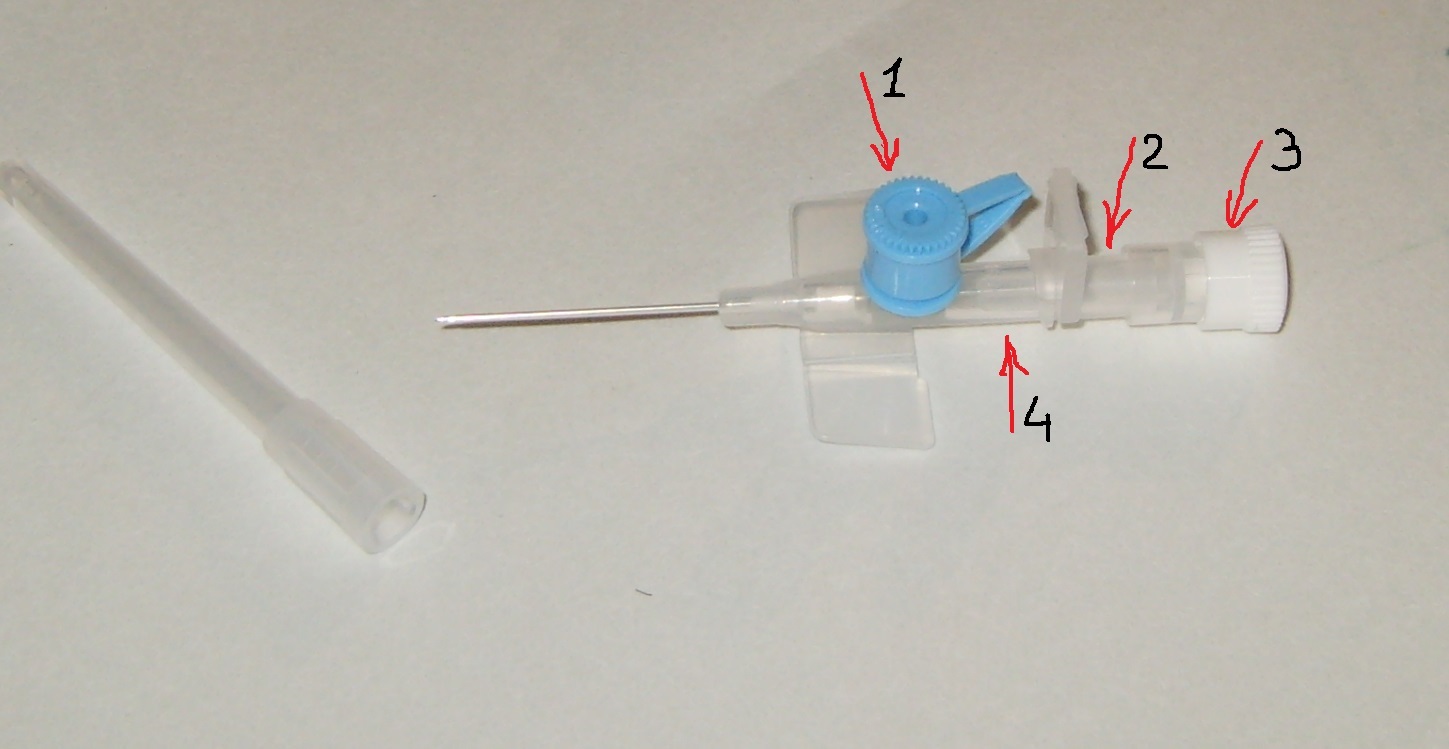
Как правило, место канюляции фиксируется имеющейся в продаже пленочной повязкой и/или медицинской лентой (4), и для непрерывного прямого мониторинга артериального давления требуется успешное поддержание проходимости артериального катетера. Необходимость частого промывания катетера и случаи окклюзии постоянного артериального катетера являются обычными явлениями в клинических условиях, что приводит к помехам при прямом измерении артериального давления. Таким образом, снижение частоты промывания катетера и скорости окклюзии может быть важным шагом для оценки гемодинамического статуса в интраоперационном периоде.В медицине сообщалось об успешных методах фиксации артериального катетера с использованием специальных пленочных повязок (5) и устройств для фиксации артериального катетера (6). Однако в ветеринарии, несмотря на использование артериальных катетеров для прямого мониторинга артериального давления, исследований по определению влияния методов фиксации катетеров на повышение проходимости артериального катетера не проводилось.
Таким образом, целью этого пилотного исследования было изучение проходимости артериального катетера с использованием нового устройства фиксации артериального катетера у собак под наркозом.Мы предположили, что если устройство для фиксации артериального катетера обеспечит стабильность узла катетера в дорсальной артерии стопы, частота промывания катетера и частота окклюзии будут снижены во время прямого мониторинга артериального давления у собак под общей анестезией.
Материалы и методы
Дизайн исследования
Это пилотное исследование было проспективным рандомизированным слепым исследованием, проведенным в Службе неотложной и интенсивной терапии мелких животных Сендайского центра ухода за животными и исследований.Исследование было одобрено Институциональным этическим комитетом по использованию животных Центра спинномозговой и сердечно-сосудистой патологии акита (№ 18-02). Владельцы пациентов предоставили письменное информированное согласие клиентов до регистрации как для участия в исследовании, так и для публикации этого отчета.
Критерии включения и исключения
Собаки были собственностью клиентов, доставленных в нашу ветеринарную клинику для следующих хирургических процедур: односторонняя мастэктомия, овариогистерэктомия (пиометра), цистолитэктомия или холецистэктомия.Этих собак оценивали на соответствие требованиям в соответствии с рекомендациями «Сводные стандарты отчетности об испытаниях» (CONSORT) (7) (рис. 1). В исследование были включены собаки с шириной дорсальной поверхности стопы >2,5 см (чтобы разместить устройство для фиксации артериального катетера шириной 2,0 см) (рис. 2С). Собак случайным образом распределили в одну из двух групп следующим образом: экспериментальную (DEV) группу (артериальный катетер закрепляли с помощью устройства для фиксации артериального катетера, пленочной повязки и медицинской ленты, рис. 3A–C) или контрольную (CTL). ) группа (артериальный катетер был зафиксирован пленочной повязкой и медицинской лентой, рис. 3D, E) в соответствии с автоматически сгенерированным списком с помощью онлайн-программы RESEARCH RANDOMIZER (8). Критериями исключения служили кожные аномалии в области тыла стопы, отмена операции и неудачная установка артериального катетера.
Критериями исключения служили кожные аномалии в области тыла стопы, отмена операции и неудачная установка артериального катетера.
Рисунок 1 . Схема приема ветеринарных пациентов. Группа CTL: фиксация катетера пленочной повязкой и медицинской лентой. Группа DEV: фиксация катетера с помощью устройства для фиксации артериального катетера, пленочной повязки и медицинской ленты.
Рисунок 2 . Позиционирование устройства фиксации артериального катетера. (A) Увеличенная фотография устройства для фиксации артериального катетера с указанием размера и (B) расположением катетера в держателе устройства под углом 12,5° по отношению к поверхности. (C) Исследовались только собаки с площадью дорсальной поверхности стопы >2,5 см в ширину.
Рисунок 3 . Крепление артериального катетера к дорсальной педальной артерии собак. (A) Относительное расположение артериального катетера и фиксатора артериального катетера. (B) Вид сбоку и (C) , вид сзади фиксации артериального катетера с использованием устройства для фиксации артериального катетера, пленочной повязки и медицинской ленты. (D) Вид сбоку на фиксацию артериального катетера с помощью пленочной повязки и медицинской ленты. (E) Изгиб артериального катетера, закрепленного пленочной повязкой и медицинской лентой (вид сверху). (F) Пример аномальной кривой давления, наблюдаемой у собаки с окклюзией катетера.
(B) Вид сбоку и (C) , вид сзади фиксации артериального катетера с использованием устройства для фиксации артериального катетера, пленочной повязки и медицинской ленты. (D) Вид сбоку на фиксацию артериального катетера с помощью пленочной повязки и медицинской ленты. (E) Изгиб артериального катетера, закрепленного пленочной повязкой и медицинской лентой (вид сверху). (F) Пример аномальной кривой давления, наблюдаемой у собаки с окклюзией катетера.
Анестезия и интраоперационный мониторинг
Анестезию индуцировали с помощью специальных протоколов, соответствующих физическому состоянию животных и основанных на результатах предоперационного медицинского осмотра, включая клинические признаки, эхокардиографию, рентгенографию, общий анализ крови, тест системы свертывания крови и биохимический профиль сыворотки.Всем собакам была проведена интубация трахеи и начата механическая вентиляция легких с использованием аппарата ИВЛ с регулируемым объемом (Pro-Next +i/+s, ACOMA Medical Industry, Токио, Япония). Дыхательный объем (V T ), частота дыхания ( f R ), положительное давление в конце выдоха и поддержка давления на вдохе были скорректированы для поддержания уровня углекислого газа в конце выдоха (Pe'CO 2 ). 35–45 мм рт. ст. (4,7–6,0 кПа) в режиме вспомогательной контролируемой или синхронизированной перемежающейся принудительной вентиляции в зависимости от ситуации для каждого животного.За животными проводили постоянный мониторинг V T ; частота сердцебиения; насыщение гемоглобина кислородом; ф Р ; доля вдыхаемого кислорода; севофлуран в конце выдоха, Pe'CO 2 ; систолическое, среднее и диастолическое артериальное давление; и ректальной температуры с помощью многопараметрического монитора (Life Scope BSM-5192, Nihon Kohden, Токио, Япония) со встроенной системой автоматической калибровки. Артериальный катетер устанавливал обученный ветеринарный техник. Кровь брали из артериального катетера для анализа газов крови и лабораторных исследований во время анестезии.
Дыхательный объем (V T ), частота дыхания ( f R ), положительное давление в конце выдоха и поддержка давления на вдохе были скорректированы для поддержания уровня углекислого газа в конце выдоха (Pe'CO 2 ). 35–45 мм рт. ст. (4,7–6,0 кПа) в режиме вспомогательной контролируемой или синхронизированной перемежающейся принудительной вентиляции в зависимости от ситуации для каждого животного.За животными проводили постоянный мониторинг V T ; частота сердцебиения; насыщение гемоглобина кислородом; ф Р ; доля вдыхаемого кислорода; севофлуран в конце выдоха, Pe'CO 2 ; систолическое, среднее и диастолическое артериальное давление; и ректальной температуры с помощью многопараметрического монитора (Life Scope BSM-5192, Nihon Kohden, Токио, Япония) со встроенной системой автоматической калибровки. Артериальный катетер устанавливал обученный ветеринарный техник. Кровь брали из артериального катетера для анализа газов крови и лабораторных исследований во время анестезии.
Устройство фиксации артериального катетера
В этом предварительном исследовании мы использовали устройство для фиксации артериального катетера с углом введения 12,5° (A-namaran plus, Sun Arrow Kasei, Ниигата, Япония), которое представляет собой безбелковую колыбель, изготовленную из силиконового эластомера, 2,00 × Размер 3,15 см (ширина × длина), толщина 0,84 см и вес 1,80 г (рис. 2А, В). Конфигурация интерфейса устройства может быть адаптирована к форме соединения артериального катетера и датчика давления.
Введение артериального катетера
Всем собакам артериальный катетер вводили после индукции общей анестезии. Волосы над предполагаемым местом остригли и кожу продезинфицировали 70% этиловым спиртом и хлоргексидином. Катетер 22 калибра 0,9 × 30 мм (BD Insyte-A, Becton, Dickinson, UT, США) был введен в дорсальную артерию стопы с использованием несовместимого комплекта для мониторинга давления с одноразовым датчиком (DX-360, Nihon Kohden). подключен к многопараметрическому монитору, как описано выше. Датчик располагали горизонтально на уровне правого предсердия в качестве нулевой точки отсчета. Артериальный катетер промывали 1 мл гепаринизированного физиологического раствора (1), приготовленного путем добавления гепарина (гепарин натрия, Mochida Pharmaceutical, Япония) к 0,9% физиологическому раствору до конечной концентрации 4 МЕ/мл (3). Гепаринизированный физиологический раствор вводили со скоростью 3 мл/ч при давлении 300 мм рт. ст., прикладываемом к мешкам для инфузии (9, 10). Артериальный катетер удаляли перед эндотрахеальной экстубацией.
Датчик располагали горизонтально на уровне правого предсердия в качестве нулевой точки отсчета. Артериальный катетер промывали 1 мл гепаринизированного физиологического раствора (1), приготовленного путем добавления гепарина (гепарин натрия, Mochida Pharmaceutical, Япония) к 0,9% физиологическому раствору до конечной концентрации 4 МЕ/мл (3). Гепаринизированный физиологический раствор вводили со скоростью 3 мл/ч при давлении 300 мм рт. ст., прикладываемом к мешкам для инфузии (9, 10). Артериальный катетер удаляли перед эндотрахеальной экстубацией.
Клиническая оценка
В течение периода исследования все собаки находились в положении лежа на спине.Форма артериальной волны слепо отслеживалась одним исследователем (KS). Количество необходимых процедур промывания катетера, частота окклюзии и время до окклюзии также регистрировались с помощью KS. В настоящем пилотном исследовании промывание катетера 1–2 мл выполнялось каждый раз (максимум два раза на катетер), когда артериальная волна считалась ненадежной, чтобы восстановить нормальную форму артериальной волны, которая состоит из систолического подъема, систолического пика давление, систолическое снижение, дикротическая насечка и конечно-диастолическое давление (1, 2, 11, 12). Приемлемая форма волны была достигнута, если была соответствующая характеристика кривой на тест быстрой промывки (11). Неспособность восстановить артериальную кривую и невозможность забора крови даже после промывания катетера считались указанием на окклюзию катетера (рис. 3F). Записывали ширину дорсальной области педали, количество попыток пункции, время нахождения катетера, количество образцов крови и количество раз, когда собака меняла положение во время операции.
Приемлемая форма волны была достигнута, если была соответствующая характеристика кривой на тест быстрой промывки (11). Неспособность восстановить артериальную кривую и невозможность забора крови даже после промывания катетера считались указанием на окклюзию катетера (рис. 3F). Записывали ширину дорсальной области педали, количество попыток пункции, время нахождения катетера, количество образцов крови и количество раз, когда собака меняла положение во время операции.
Статистический анализ
Данные были проверены на нормальность с использованием критерия Шапиро-Уилка.С помощью теста Манна-Уитни U оценивали групповые различия характеристик пациентов по ширине конечности в месте пункции, количеству попыток пункции, длительности пребывания постоянного артериального катетера, количеству заборов крови и количество раз, когда собака меняла положение во время операции (таблица 1). Точный критерий Фишера использовался для определения связи между переменными в отношении количества процедур промывания катетера и частоты окклюзии. Кроме того, мы оценили относительный риск (RR) частоты промывания катетера и скорости окклюзии.Кривые Каплана-Мейера были построены для оценки вероятности окклюзии, и сравнения между группами были выполнены с использованием критерия логарифмического ранга. Значение P , равное 0,05, считалось статистически значимым. Данные представлены в виде медианы (межквартильный диапазон 25–75 %), если не указано иное. Статистический анализ проводили с использованием GraphPad Prism версии 6.0 (GraphPad Software Inc., Ла-Хойя, Калифорния, США) и SigmaPlot версии 13.0 (Systat Software Inc., Сан-Хосе, Калифорния, США).
Кроме того, мы оценили относительный риск (RR) частоты промывания катетера и скорости окклюзии.Кривые Каплана-Мейера были построены для оценки вероятности окклюзии, и сравнения между группами были выполнены с использованием критерия логарифмического ранга. Значение P , равное 0,05, считалось статистически значимым. Данные представлены в виде медианы (межквартильный диапазон 25–75 %), если не указано иное. Статистический анализ проводили с использованием GraphPad Prism версии 6.0 (GraphPad Software Inc., Ла-Хойя, Калифорния, США) и SigmaPlot версии 13.0 (Systat Software Inc., Сан-Хосе, Калифорния, США).
Таблица 1 .Характеристики собак, включенных в исследование.
Результаты
Из 138 взрослых собак, прошедших скрининг на соответствие требованиям, 129 были рандомизированы и распределены в группы CTL ( n = 64) и DEV ( n = 65). В общей сложности 9 собак были исключены из рандомизации (5 не соответствовали критериям включения, а 4 операция была отменена). Среди рандомизированных собак было 120 собак ( n = 60 на группу, 97 сук и 23 кобеля) со средним весом 15.6 кг (межквартильный диапазон: 13,1–18,7 кг) завершили испытание, в то время как 9 из них не удалось проанализировать ( n = 4 в группе CTL и n = 5 в группе DEV). Достоверных различий в характеристиках пациентов в отношении ширины конечности в месте пункции, количества попыток пункции, длительности введения артериального катетера, количества заборов крови и количества репозиций собаки во время операции выявлено не было. Таблица 1). Во время введения артериального катетера в дорсальную артерию стопы частота необходимой промывки катетера в группе DEV (8/60, 13.3%) был значительно ниже, чем в группе CTL (21/60, 35,0%) ( P = 0,001, относительный риск [ОР]: 0,381, 95% доверительный интервал [ДИ]: 0,183–0,792) (таблица 2). ). Кроме того, частота окклюзии катетера была ниже в группе DEV (5/60, 8,3%), чем в группе CTL (14/60, 23,3%) ( P = 0,044, ОР: 0,376, 95% ДИ: 0,145–0,977) (табл.
Среди рандомизированных собак было 120 собак ( n = 60 на группу, 97 сук и 23 кобеля) со средним весом 15.6 кг (межквартильный диапазон: 13,1–18,7 кг) завершили испытание, в то время как 9 из них не удалось проанализировать ( n = 4 в группе CTL и n = 5 в группе DEV). Достоверных различий в характеристиках пациентов в отношении ширины конечности в месте пункции, количества попыток пункции, длительности введения артериального катетера, количества заборов крови и количества репозиций собаки во время операции выявлено не было. Таблица 1). Во время введения артериального катетера в дорсальную артерию стопы частота необходимой промывки катетера в группе DEV (8/60, 13.3%) был значительно ниже, чем в группе CTL (21/60, 35,0%) ( P = 0,001, относительный риск [ОР]: 0,381, 95% доверительный интервал [ДИ]: 0,183–0,792) (таблица 2). ). Кроме того, частота окклюзии катетера была ниже в группе DEV (5/60, 8,3%), чем в группе CTL (14/60, 23,3%) ( P = 0,044, ОР: 0,376, 95% ДИ: 0,145–0,977) (табл. 2). Кривые Каплана-Мейера, оценивающие вероятность окклюзии, значительно различались между группами (отношение рисков: 0,404 [95% ДИ: 0.141–0,857], P = 0,042) (рис. 4). Медиана (межквартильный диапазон 25–75%) времени выживания проходимости катетера в группах DEV и CTL составила 141,0 мин (101,0–145,0 мин) и 99,5 мин (87,3–114,5 мин) соответственно. Ни в одной из групп не наблюдалось значимых послеоперационных осложнений, таких как контактный дерматит и ишемия тканей.
2). Кривые Каплана-Мейера, оценивающие вероятность окклюзии, значительно различались между группами (отношение рисков: 0,404 [95% ДИ: 0.141–0,857], P = 0,042) (рис. 4). Медиана (межквартильный диапазон 25–75%) времени выживания проходимости катетера в группах DEV и CTL составила 141,0 мин (101,0–145,0 мин) и 99,5 мин (87,3–114,5 мин) соответственно. Ни в одной из групп не наблюдалось значимых послеоперационных осложнений, таких как контактный дерматит и ишемия тканей.
Таблица 2 . Частота промывания катетера и скорость окклюзии во время установки артериального катетера.
Рисунок 4 .Кривые выживаемости Каплана-Мейера при окклюзии артериального катетера между группами. Группа CTL: фиксация катетера пленочной повязкой и медицинской лентой. Группа DEV: фиксация катетера с помощью устройства для фиксации артериального катетера, пленочной повязки и медицинской ленты.
Обсуждение
Мы продемонстрировали, что новое устройство фиксации артериального катетера позволило значительно снизить частоту промывания артериального катетера и скорость окклюзии. Насколько нам известно, это первое исследование по изучению полезности устройства для фиксации артериального катетера в ветеринарии.В настоящем пилотном исследовании характеристики включенных собак существенно не отличались между группами, и мы использовали одну и ту же пленочную повязку и медицинскую ленту для всех собак. Таким образом, наши результаты были связаны только с использованием устройства для фиксации артериального катетера.
Насколько нам известно, это первое исследование по изучению полезности устройства для фиксации артериального катетера в ветеринарии.В настоящем пилотном исследовании характеристики включенных собак существенно не отличались между группами, и мы использовали одну и ту же пленочную повязку и медицинскую ленту для всех собак. Таким образом, наши результаты были связаны только с использованием устройства для фиксации артериального катетера.
Мы не смогли сравнить наши результаты с результатами предыдущих связанных исследований, поскольку в этой области исследований нет опубликованных данных. Однако пилотное исследование, проведенное в отделении анестезиологии Высшей школы медицины и стоматологии Университета Ниигата в Японии, показало, что частота промывания катетера в группе, использующей экспериментальное устройство ( n = 49; 2/49, 4.1%) было ниже, чем в контрольной группе ( n = 48; 9/48, 18,8%) при использовании обычных пленочных повязок для фиксации артериального катетера в лучевой артерии во время анестезии ( P < 0,05) (неопубликованные данные) . Поскольку нестабильность места канюляции возникает в результате контакта поверхности кожи с соединительным сегментом артериального катетера и датчика давления, авторы предположили, что это устройство поддерживало стабильную фиксацию и, таким образом, улучшало проходимость артериального катетера.Несмотря на то, что устройство для фиксации артериального катетера, используемое в настоящем пилотном исследовании, было разработано для медицинских целей, результаты этого пилотного исследования демонстрируют, что использование устройства для фиксации артериального катетера является клинически эффективным для обеспечения стабильного контакта между поверхностью кожи и узловое соединение артериального катетера с датчиком давления и связано со сниженной частотой промывания катетера и скоростью окклюзии у собак. Кроме того, это фиксирующее устройство обеспечивало пролонгированную продолжительность проходимости катетера с приемлемой формой волны в течение периода исследования.Изучение метода фиксации артериального катетера не обсуждалось в современной ветеринарной литературе, и, таким образом, это исследование будет обнадеживающим для будущих исследований.
Поскольку нестабильность места канюляции возникает в результате контакта поверхности кожи с соединительным сегментом артериального катетера и датчика давления, авторы предположили, что это устройство поддерживало стабильную фиксацию и, таким образом, улучшало проходимость артериального катетера.Несмотря на то, что устройство для фиксации артериального катетера, используемое в настоящем пилотном исследовании, было разработано для медицинских целей, результаты этого пилотного исследования демонстрируют, что использование устройства для фиксации артериального катетера является клинически эффективным для обеспечения стабильного контакта между поверхностью кожи и узловое соединение артериального катетера с датчиком давления и связано со сниженной частотой промывания катетера и скоростью окклюзии у собак. Кроме того, это фиксирующее устройство обеспечивало пролонгированную продолжительность проходимости катетера с приемлемой формой волны в течение периода исследования.Изучение метода фиксации артериального катетера не обсуждалось в современной ветеринарной литературе, и, таким образом, это исследование будет обнадеживающим для будущих исследований.
Необходимо учитывать следующие ограничения исследования. Во-первых, это пилотное исследование было проведено с ограниченным размером выборки ( n = 60 на группу) и в одном центре; Необходимы крупномасштабные многоцентровые исследования, чтобы получить более убедительные доказательства эффективности устройства для фиксации артериального катетера у собак.Во-вторых, устройство обеспечивает угол введения катетера в лучевую артерию человека 12,5°; таким образом, необходимы дальнейшие исследования, чтобы оценить, приведет ли другой угол введения к лучшим результатам в дорсальной педальной артерии собак. В-третьих, необходимы исследования с использованием более мелких пород собак с более узкими дорсальными педальными зонами, чем в настоящем пилотном исследовании, чтобы подтвердить его универсальную эффективность и полезность у собак. В-четвертых, артериальная волна оценивалась исследователем с многолетним опытом мониторинга артериальной волны, но не существовало объективных методов для определения нормальной морфологии артериальной волны. В-пятых, в этом предварительном исследовании не оценивалось влияние типа катетера (диаметра, материала и длины) на проходимость. Необходимы дополнительные исследования для оценки эффективности устройства фиксации артериального катетера в поддержании проходимости артериального катетера при различных типах катетера. В-шестых, наши результаты не могут быть распространены на другие артерии, включая ушную артерию, копчиковую артерию, лучевую артерию и бедренную артерию. Необходимы дополнительные исследования, чтобы подтвердить полезность устройства для фиксации артериального катетера в различных артериях.В-седьмых, в настоящем пилотном исследовании продолжительность введения артериального катетера в дорсальную артерию стопы составляла <3,5 ч, и необходимы дальнейшие исследования, чтобы подтвердить, можно ли достичь аналогичных результатов при более длительных периодах времени введения. Наконец, мы провели несколько заборов крови в течение периода исследования. У критически больных ветеринарных пациентов требуется большее количество образцов крови, чем в настоящем пилотном исследовании, для анализа газов крови (4) и лабораторных анализов.
В-пятых, в этом предварительном исследовании не оценивалось влияние типа катетера (диаметра, материала и длины) на проходимость. Необходимы дополнительные исследования для оценки эффективности устройства фиксации артериального катетера в поддержании проходимости артериального катетера при различных типах катетера. В-шестых, наши результаты не могут быть распространены на другие артерии, включая ушную артерию, копчиковую артерию, лучевую артерию и бедренную артерию. Необходимы дополнительные исследования, чтобы подтвердить полезность устройства для фиксации артериального катетера в различных артериях.В-седьмых, в настоящем пилотном исследовании продолжительность введения артериального катетера в дорсальную артерию стопы составляла <3,5 ч, и необходимы дальнейшие исследования, чтобы подтвердить, можно ли достичь аналогичных результатов при более длительных периодах времени введения. Наконец, мы провели несколько заборов крови в течение периода исследования. У критически больных ветеринарных пациентов требуется большее количество образцов крови, чем в настоящем пилотном исследовании, для анализа газов крови (4) и лабораторных анализов. Повторный забор крови может повлиять на частоту гиперемии и частоту окклюзии.Необходимы дальнейшие исследования для изучения полезности устройства в ветеринарных отделениях интенсивной терапии.
Повторный забор крови может повлиять на частоту гиперемии и частоту окклюзии.Необходимы дальнейшие исследования для изучения полезности устройства в ветеринарных отделениях интенсивной терапии.
В заключение, это пилотное исследование предоставляет предварительные результаты эффективности метода фиксации артериального катетера, когда требуется прямой мониторинг артериального давления у собак под общей анестезией. Мы считаем, что новое устройство фиксации артериального катетера будет полезно для непрерывного гемодинамического мониторинга и повышения безопасности пациентов во время общей анестезии.Это клиническое испытание будет способствовать оптимизации медицинской помощи собакам, которым требуется введение инвазивных артериальных катетеров в дорсальную артерию стопы, которой уделялось мало внимания в качестве темы исследования.
Доступность данных
Все наборы данных, созданные для этого исследования, включены в рукопись.
Заявление об этике
Исследование было одобрено Институциональным этическим комитетом по использованию животных Центра спинномозговой и сердечно-сосудистой патологии акита. Владельцы пациентов предоставили письменное информированное согласие клиентов до регистрации как для участия в исследовании, так и для публикации этого отчета.
Владельцы пациентов предоставили письменное информированное согласие клиентов до регистрации как для участия в исследовании, так и для публикации этого отчета.
Вклад авторов
KS: дизайн исследования, интерпретация данных, статистический анализ и подготовка рукописи. ТС: интерпретация данных и подготовка рукописи. IAGS: поиск литературы и подготовка рукописи.
Финансирование
Это исследование было поддержано Фондом Сендайского центра ухода за животными и исследований (SACRC), Сендай, Япония.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Авторы выражают благодарность директору нашего учреждения Тацуе Исикаве, центру цереброспинальной и сердечно-сосудистой системы Акита, Акита, Акита, Япония, за рассмотрение проекта ветеринарного клинического исследования. Мы хотели бы поблагодарить Editage (www.editage.jp) для редактирования на английском языке.
Мы хотели бы поблагодарить Editage (www.editage.jp) для редактирования на английском языке.
Каталожные номера
2. Cooper E, Cooper S. Прямой системный мониторинг артериального давления. В: Creedon JMB, Davis H, редакторы. Усовершенствованный мониторинг и процедуры для неотложной и интенсивной терапии мелких животных . Оксфорд: Уайли-Блэквелл (2012). п. 122–33.
Академия Google
3. Trim CM, Hofmeister EH, Quandt JE, Shepard MK. Обзор использования артериальных катетеров у собак и кошек под наркозом: 267 случаев. J Vet Emerg Crit Care (Сан-Антонио) . (2017) 27:89–95. doi: 10.1111/vec.12543
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
4. Mazzaferro EM, Hauser C. Катетеризация артерий. В: Silverstein DC, Hopper K, редакторы. Медикаменты для интенсивной терапии мелких животных . Сент-Луис, Миссури: Saunders Elsevier (2015). п. 1040–43.
Академия Google
5. Ueshima H, Ariyama J, Kitamura A. SorbaView SHIELD — полезный продукт для использования в периоперационном ведении. Масуи . (2015) 64:772–4.
SorbaView SHIELD — полезный продукт для использования в периоперационном ведении. Масуи . (2015) 64:772–4.
Реферат PubMed | Академия Google
6. Reynolds H, Taraporewalla K, Tower M, Mihala G, Tuffaha HW, Fraser JF, et al. Новые технологии могут обеспечить эффективную перевязку и фиксацию периферических артериальных катетеров: пилотное рандомизированное контролируемое исследование в операционной и отделении интенсивной терапии. Aust Crit Care . (2015) 28:140–8. doi: 10.1016/j.aucc.2014.12.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
7.Шульц К.Ф., Альтман Д.Г., Мохер Д. Заявление CONSORT 2010 г.: обновленные рекомендации по составлению отчетов о рандомизированных испытаниях с параллельными группами. Дж Фармакол Фармакотер . (2010) 1:100–7. doi: 10.4103/0976-500X.72352
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
9. Tuncali BE, Kuvaki B, Tuncali B, Capar E. Сравнение эффективности гепаринизированных и негепаринизированных растворов для поддержания периоперационной проходимости радиального артериального катетера и последующей окклюзии. Анест анальг. (2005) 100:1117–21. doi: 10.1213/01.ANE.0000146963.19543.D4
Сравнение эффективности гепаринизированных и негепаринизированных растворов для поддержания периоперационной проходимости радиального артериального катетера и последующей окклюзии. Анест анальг. (2005) 100:1117–21. doi: 10.1213/01.ANE.0000146963.19543.D4
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
10. Эверсон М., Уэббер Л., Пенфолд С., Шах С., Фрешуотер-Тернер Д. Поиск решения: сравнение гепаринизированного физиологического раствора с физиологическим раствором при поддержании инвазивных артериальных линий в интенсивной терапии. J Интенсивная терапия Soc. (2016) 17:284–9. дои: 10.1177/1751143716653763
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
11.МакГи Б.Х., Бриджес Э.Дж. Мониторинг артериального давления: что вы можете не знать. Медсестра реанимации . (2002) 22:60–4, 66–70, 73 пасс.
Академия Google
12. Шредер Б., Барабеито А., Бар-Йосеф С., Марк Дж. Б. Сердечно-сосудистый мониторинг. В: Миллер Р.Д., редактор. Анестезия Миллера . Том. 1. Филадельфия, Пенсильвания: Сондерс; Эльзевир (2015). п. 1345–95.
Б. Сердечно-сосудистый мониторинг. В: Миллер Р.Д., редактор. Анестезия Миллера . Том. 1. Филадельфия, Пенсильвания: Сондерс; Эльзевир (2015). п. 1345–95.
Академия Google
Как установить внутривенный катетер над иглой
В этой статье мы дадим вам пошаговые инструкции по установке внутривенного катетера поверх иглы у мелких животных.
Как установить внутривенный катетер над иглой
1. Сначала закрепите зажимом область над катетеризируемой веной. Чаще всего используется головная вена, хотя могут использоваться и другие участки, такие как подкожные или яремные вены.
2. Очистите и подготовьте участок с помощью хлоргексидина или повидон-йода.
3. Выберите катетер соответствующего размера, который вы будете использовать. Лучше всего выбрать самый большой размер, который сможет уместить пациент.Как правило, мы рекомендуем калибр 24 для щенков, котят или очень маленьких собак, калибр 22 для маленьких собак и взрослых кошек, калибр 20 для собак среднего размера и калибр 18 для крупных собак. Чем ниже датчик, тем больше катетер.
Чем ниже датчик, тем больше катетер.
Если пациент будет находиться на внутривенных капельницах или жидкостях, вам нужно будет подключить адаптер Т-образного порта к катетеру сразу после установки. Если вы просто делаете инъекции, вам может понадобиться штекер-переходник.
4. Фиксатор поддерживает конечность в локтевом суставе, удерживая вену. Иногда вы можете визуализировать вену, а иногда можете только почувствовать ее. Вы можете пальпировать вену, чтобы определить, куда вы введете катетер (она будет слегка упругой и может перекатываться вперед и назад).
5. Катетер следует вводить в вену срезом вверх. Вы будете представлять, как поместите его вниз и в вену, когда будете его помещать. После того, как вы сделаете первоначальный укол в вену, вы будете ждать, чтобы увидеть, есть ли вспышка крови во втулке.
6. Если есть вспышка крови, вы продвинете катетер чуть дальше, пока он не станет хорошо течь , а затем отделите втулку катетера от иглы и проденьте его (сдвиньте с иглы) в вену.
Если вспышки нет, вы можете немного отступить назад и перенаправить катетер туда, где вы можете пальпировать вену, пока не появится вспышка. Если вы не можете получить вспышку после перенаправления, удалите катетер и держите участок на ноге пациента, чтобы предотвратить кровотечение.
Со второй попытки можно попробовать немного выше. (Всегда приобретайте новый катетер и не используйте повторно первый.)
7. После того, как катетер вставлен и отпущен, человек, удерживающий вену, может освободить ее (все еще поддерживая конечность, но не удерживая ее). Игла вытягивается из катетера, а Т-образный порт или заглушка помещается в отверстие катетера. Я слегка надавливаю примерно в том месте, где был вставлен катетер, чтобы при извлечении иглы кровь не вытекала чрезмерно до тех пор, пока не будет подсоединен Т-образный порт или штекер адаптера.
8. Когда это будет сделано, пора заклеивать катетер. Используйте более тонкий кусок ленты (липкой стороной вверх), подкладывая его под катетер к его основанию. Оберните его вокруг катетера и закрепите на конечности. Теперь пришло время промыть катетер стерильным физиологическим раствором или другими жидкостями, чтобы убедиться, что он проходит правильно. Если он нормально промывается, вы можете закончить закрепление катетера. Используйте кусок ленты обычного размера, чтобы закрепить сверху и снизу, и, наконец, используйте ветеринарную пленку для дополнительной фиксации.
Оберните его вокруг катетера и закрепите на конечности. Теперь пришло время промыть катетер стерильным физиологическим раствором или другими жидкостями, чтобы убедиться, что он проходит правильно. Если он нормально промывается, вы можете закончить закрепление катетера. Используйте кусок ленты обычного размера, чтобы закрепить сверху и снизу, и, наконец, используйте ветеринарную пленку для дополнительной фиксации.
Хотите больше? Загрузите это бесплатное учебное пособие VetPrep!
Загрузите это 8-шаговое руководство по выполнению обоих методов в 7-м или 8-м межреберье. Заполните форму ниже, и мы отправим вам по электронной почте ссылку для получения PDF-файла.
|
Техника сбора мочи у кобеля через мочевой катетер.
Контекст 1
... рутинный анализ мочи, образцы мочи были собраны у 100 собак с почечной недостаточностью и у 30 здоровых собак при опорожнении животного, катетеризации или цистоцентезе (рис. 1 и 2). Около 10 мл образца мочи было собрано в чистую стеклянную пробирку для обычного урологического исследования, а также около 2 мл образца мочи было собрано в стерильную стеклянную пробирку для микробного посева и определения чувствительности к антибиотикам. ...
1 и 2). Около 10 мл образца мочи было собрано в чистую стеклянную пробирку для обычного урологического исследования, а также около 2 мл образца мочи было собрано в стерильную стеклянную пробирку для микробного посева и определения чувствительности к антибиотикам. ...
Контекст 2
... Лейкоциты и эпителиальные клетки), цилиндры, микроорганизмы (бактериальные, грибковые), кристаллы, слизь и артефакты или загрязнения. Было замечено наличие или отсутствие кристаллов, мочевых цилиндров и капель липидов. Положительные результаты были дополнительно охарактеризованы как немногочисленные, умеренные или многочисленные, а результаты в среднем по 10 полям микроскопии представлены в таблице 1 и на рис.5-10. Значительное увеличение количества эпителиальных клеток в моче собак с почечной недостаточностью по сравнению со здоровыми собаками указывает на патологический процесс в почках и не дает окончательного результата [9]. Клетки плоского эпителия, наблюдаемые как у здоровых, так и у пациентов с почечной недостаточностью, представляли собой крупные полигональные клетки с маленькими округлыми ядрами (рис. 6). Это также наблюдается при мочеиспускании или ...
6). Это также наблюдается при мочеиспускании или ...
Контекст 3
... серьезном заболевании и называется слепком почечной недостаточности (рис. 5) [13,14]. Зернистые цилиндры в мочевом осадке составляют около 30% и 10% при острой и хронической почечной недостаточности соответственно, что отмечают многие авторы [15][16][17].Тем не менее, другие сообщают о 8,1% собак, страдающих хроническим заболеванием почек [18]. Более того, некоторые неклассифицированные цилиндры (рис. 10) также наблюдались у собак с тяжелым поражением почек. Во время этого исследования у пациентов с почечной недостаточностью наблюдалось множество цилиндров почечных эпителиальных клеток. Чаще всего это происходит у пациентов с острым некрозом канальцев или пиелонефритом с тяжелыми повреждениями канальцев. Они часто связаны с нефротоксическим или ишемическим повреждением почек и могут наблюдаться ...
Контекст 4
.... исследование мочи, выявляющее различные типы кристаллов в моче, представлено в таблице 2 и на рис. 11-16. Преобладающими кристаллами в образцах мочи были тройной фосфат (фосфат магния аммония) или кристаллы струвита - 47,83% (11/23), затем кристаллы оксалатов кальция - 26,09% (6/23), биурат аммония - 13,04% (3/23). ), аморфные кристаллы - 8,70% (2/23) и самые низкие - кристаллы билирубина 4,35% (1/23). Эти кристаллы были идентифицированы по ...
11-16. Преобладающими кристаллами в образцах мочи были тройной фосфат (фосфат магния аммония) или кристаллы струвита - 47,83% (11/23), затем кристаллы оксалатов кальция - 26,09% (6/23), биурат аммония - 13,04% (3/23). ), аморфные кристаллы - 8,70% (2/23) и самые низкие - кристаллы билирубина 4,35% (1/23). Эти кристаллы были идентифицированы по ...
Контекст 5
.... в уретре и во многих местах это был оксалат кальция. Топографическая особенность мочевых конкрементов при сканирующей электронной микроскопии (СЭМ) характеризовалась столбчатым скоплением кристаллитов (рис. 17-22), предполагающим наличие оксалатов кальция, что в дальнейшем подтверждалось химическим анализом. Мочекаменная болезнь у собак, участвовавших в настоящем исследовании, также была причиной развития вторичной почечной азотемии из-за постобструкции почек. Приблизительно 70% собак со струвитной мочекаменной болезнью были связаны с инфекцией мочевыводящих путей...
Быстрый ответ: Могу ли я удалить внутривенный катетер моей собаке?
С помощью бинтовых ножниц разрежьте ленту по внешнему краю ноги. Оттяните ленту от кожи с обеих сторон катетера. Удалите катетер и соедините их скотчем одним плавным движением, как показано здесь. При удалении катетера убедитесь, что при удалении катетер присутствует целиком.
Оттяните ленту от кожи с обеих сторон катетера. Удалите катетер и соедините их скотчем одним плавным движением, как показано здесь. При удалении катетера убедитесь, что при удалении катетер присутствует целиком.
Могу ли я удалить внутривенный катетер у собак?
Быстрый ответ: Если вашего питомца выписали с «лейкопластырем» на ноге, где был внутривенный катетер, крайне важно снять повязку, иначе лапа опухнет.Как правило, его можно удалить через 2–4 часа после извлечения внутривенного катетера.
Как долго внутривенный катетер может находиться у собаки?
Когда место введения катетера высохнет, накройте его стерильной марлевой салфеткой 2×2. Затем повторно перевяжите катетер. Традиционно рекомендуется не оставлять катетер на месте более чем на 72–96 часов.
Когда можно удалить внутривенный катетер?
Распространенными причинами прекращения внутривенного введения жидкостей являются: объем жидкости пациента вернулся к исходному уровню; пациент выписывается из учреждения; внутривенный катетер необходимо заменить; или место внутривенного вливания стало неблагоприятным из-за инфекции, инфильтрации, экстравазации или флебита.
Как снять ветеринарную повязку?
Есть два способа: порвать или разрезать ножницами. Некоторые типы ветеринарных повязок, например, WildCow Vet Wrap, можно оторвать от рулона вручную, поэтому вам не нужно использовать ножницы, чтобы разрезать его. Другие бинты для ветеринарных обертываний не так легко отрываются от рулона, и их приходится разрезать.
Сколько стоит поставить катетер собаке?
Некоторые процедуры катетеризации мочевого пузыря могут стоить всего 100 долларов. Процедуры, которые считаются более серьезными, могут стоить до 3000 долларов.
Как часто следует промывать внутривенно?
Когда нужно промывать капельницу? Промывки обычно назначают каждые восемь часов, а также до и после введения лекарств через капельницу. Если вы получаете несколько лекарств по одной и той же линии, между лекарствами будет использоваться промывка, чтобы предотвратить смешивание несовместимых лекарств.
Как часто следует промывать внутривенные катетеры Ветеринария?
Внутривенные трубки, используемые для введения жидкости, следует менять каждые 72 часа.Трубку для внутривенного введения, используемую для введения ППП, следует менять каждый раз, когда помещается новый пакет с ППП, или каждые 24 часа, в зависимости от того, что происходит чаще.
Что произойдет, если оставить капельницу слишком долго?
Как только внутривенный катетер станет не нужен, его следует удалить». Хотя исследование Lancet сообщило только об одной инфекции кровотока среди участников, возможно, что длительное использование катетеров может увеличить риск инфекций кровотока с течением времени, сказал доктор Мермель, который также участвовал в написании рекомендаций CDC.
Какой самый важный шаг при прекращении внутривенной терапии?
21 карта в этом наборе
Основная функция вен – переносить кровь от. . . | тело к сердцу. |
|---|---|
| Какой самый важный шаг при прекращении внутривенной терапии? | Осмотрите состояние кончика катетера и немедленно сообщите врачу, если обнаружено какое-либо повреждение |
Как часто следует менять повязку для внутривенных мешков?
Заменяйте марлевые повязки каждые 2 дня и прозрачные повязки каждые 7 дней на катетерах для кратковременного использования.Замените повязку при замене катетера, или когда повязка становится влажной, ослабленной или загрязненной, или когда необходим осмотр участка.
В чем разница между канюлей и катетером?
В чем разница между катетером и канюлей? Канюля представляет собой короткую гибкую трубку, которая вводится в кровеносный сосуд, в то время как катетер определяется как трубка, которая значительно длиннее внутрисосудистой канюли для периферического доступа к телу.

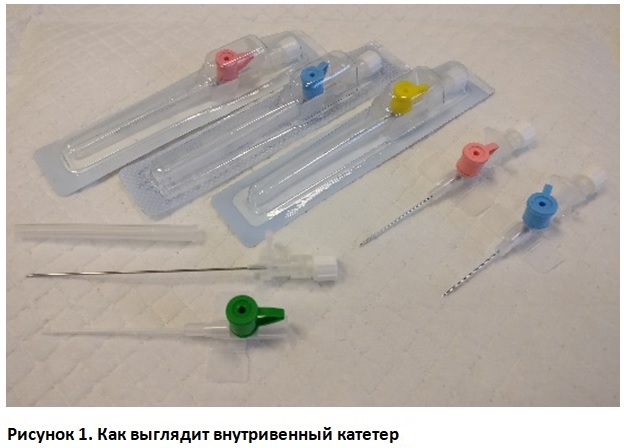
 Если моча не видна, катетер можно промыть или начать процесс заново ( Sullivan et al, 2010 ).
Если моча не видна, катетер можно промыть или начать процесс заново ( Sullivan et al, 2010 ). .Мешок для сбора должен храниться в чистом лотке, выстланном чистой простыней при недержании ( Smarick et al, 2004 ).
.Мешок для сбора должен храниться в чистом лотке, выстланном чистой простыней при недержании ( Smarick et al, 2004 ). 2% лидокаин или гель лидокаина для снижения чувствительности крайней плоти или преддверия ( Sullivan et al, 2010 )
2% лидокаин или гель лидокаина для снижения чувствительности крайней плоти или преддверия ( Sullivan et al, 2010 )
 Внешний диаметр 3 мм x 50 см
Внешний диаметр 3 мм x 50 см
 Результаты посева мочи из постоянного катетера (не рекомендуется) следует интерпретировать с осторожностью. Не культивируйте кончик удаленного катетера .
Результаты посева мочи из постоянного катетера (не рекомендуется) следует интерпретировать с осторожностью. Не культивируйте кончик удаленного катетера .