Гемобартонеллез у кошек и собак (распространение, эпизоотология, этиология, патогенез, диагностика и лечение). Биологические свойства Гемотропных Микоплазм у кошек (Mycoplasma Haemofelis, Mycoplasma haemominutum, Mycoplasma turicensis). Меры борьбы и профилактики при гемобартонеллезе у кошек
Этиология гемобартонеллеза у кошек и собак
Гемотропные микоплазмы (возбудители гемобартонеллеза) – бактериальные организмы без клеточной стенки, которые прикрепляются и растут на поверхности эритроцитов. Они Грамотрицательные некислотоустойчивые, и, несмотря на множественные попытки, культивирование их на искусственных средах оказалось безуспешным. Эти эпицеллюлярные организмы были классифицированы как риккетсии рода Haemobartonella и Eperythrozoon многие годы, однако, результаты последовательности 16S рибосомной РНК и Рибонуклеаз P РНК генов показывают, что они являются микоплазмами. Следовательно, роды Haemobartonella и Eperythrozoon были расформированы и эти микроорганизмы перешли в род Mycoplasma.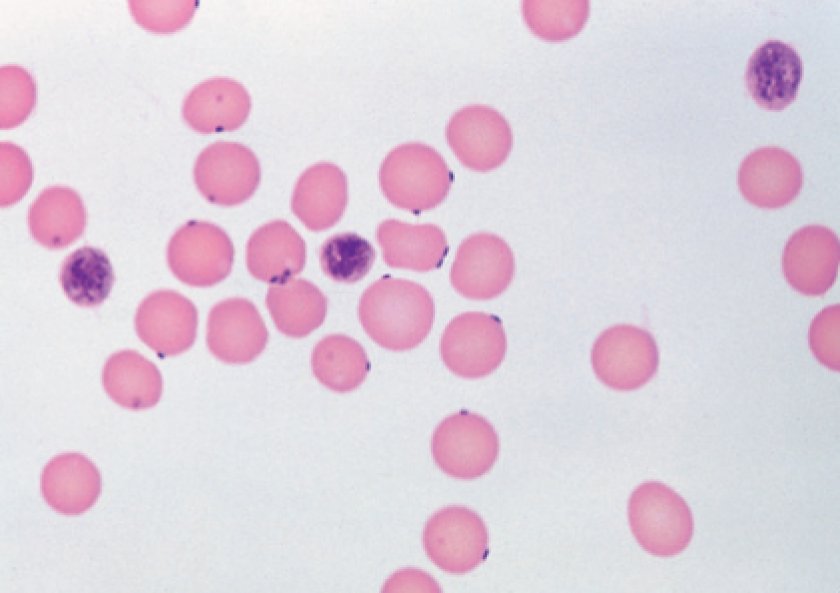 Это вызвало споры. Из-за специфических биологических свойств и данных о последовательности, некоторые считают, что гемотропные микоплазмы должны быть выделены в отдельный род от микоплазм. Тем не менее, описанные названия видов часто имеют префикс «гемо-«, чтобы отличать этих уникальных микоплазм, которые прикрепляются к эритроцитам, в то время как новые, не полностью описанные таксоны имеют название Candidatus. Было предложено название Гемоплазмы для общего описания гемотропных микоплазм. Они содержат РНК и ДНК и размножаются путем бинарного деления. Они могут быть палочкообразными, сферическими или кольцеобразными, одиночными и в цепях на красных кровяных тельцах.
Это вызвало споры. Из-за специфических биологических свойств и данных о последовательности, некоторые считают, что гемотропные микоплазмы должны быть выделены в отдельный род от микоплазм. Тем не менее, описанные названия видов часто имеют префикс «гемо-«, чтобы отличать этих уникальных микоплазм, которые прикрепляются к эритроцитам, в то время как новые, не полностью описанные таксоны имеют название Candidatus. Было предложено название Гемоплазмы для общего описания гемотропных микоплазм. Они содержат РНК и ДНК и размножаются путем бинарного деления. Они могут быть палочкообразными, сферическими или кольцеобразными, одиночными и в цепях на красных кровяных тельцах.
Гемотропные микоплазмы у кошек
Три гемоплазмы известно у кошек (возбудители гемобартонеллеза):
- M. Haemofelis
- Candidatus Mycoplasma haemominutum
- Candidatus Mycoplasma turicensis
Соответствие 16S рРНК и RNase (рибонуклеаза) P РНК последовательностей генов между ними составляет около 83%. Один из них раньше назывался Haemobartonella felis large вариант, и сейчас называется Mycoplasma Haemofelis, другой – H. Felis small – теперь классифицирован как Candidatus M. Haemominutum. Организмы, ранее называвшиеся Florida, Ohio, Oklahoma, Illinois сейчас классифицированы, как изоляты M. Haemofelis, а California, Birmingham – изоляты Candidatus M. Haemominutum согласно схожести последовательностей 16S рРНК гена. Последовательность 16S рРНК гена австралийского штамма M. Haemofelis идентична изолятам Ohio и Florida. Candidatus M. Turicensis – третий вид, был описан у швейцарских кошек. Схожесть последовательности 16S рРНК гена этого вида с M. Haemofelis и Candidatus M. Haemominutum составляет 88 и 83% соответственно.
Один из них раньше назывался Haemobartonella felis large вариант, и сейчас называется Mycoplasma Haemofelis, другой – H. Felis small – теперь классифицирован как Candidatus M. Haemominutum. Организмы, ранее называвшиеся Florida, Ohio, Oklahoma, Illinois сейчас классифицированы, как изоляты M. Haemofelis, а California, Birmingham – изоляты Candidatus M. Haemominutum согласно схожести последовательностей 16S рРНК гена. Последовательность 16S рРНК гена австралийского штамма M. Haemofelis идентична изолятам Ohio и Florida. Candidatus M. Turicensis – третий вид, был описан у швейцарских кошек. Схожесть последовательности 16S рРНК гена этого вида с M. Haemofelis и Candidatus M. Haemominutum составляет 88 и 83% соответственно.
При полихромном окрашивании крови гемотропные микоплазмы выглядят как маленькие темно-синие палочки, кокки или кольца немного большего размера, которые обычно прикреплены к эритроцитам. Размер генома M. haemofelis составляет примерно 1200 кб, что было определено с помощью строительства оптической модели их полного генома.
Haemominutum около 0,6 μm в диаметре. Морфологически различия не столь значимы, поэтому для дифференцирования изолятов необходим генетический анализ. Candidatus M. Turicensis не был обнаружен при световой или электронной микроскопии зараженных кошек. Размер генома Candidatus M. Turicensis и Candidatus M. Haemominutum не был описан.
Рис. 1. M. haemofelis в мазке крови инфицированной гемобартонеллезом кошки; кольцевидные, палочкообразные и коккообразные формы с регенераторной анемией.
Рис. 2. Candidatus M. Haemominutum в мазке крови инфицированной гемобартонеллезом кошки; коккообразные формы без признаков регенерации и умеренной анемией.
Эпицеллюлярное (поверх клеток) расположение Mycoplasma haemofelis на эритроцитах становится очевидным при электронной микроскопии (Рис. 3). Микроорганизмы частично углублены в ямочки на поверхности эритроцитов. Наблюдаются дисковидные, конические, кокковые, палочковидные, тороидальной формы. Пораженные эритроциты могут терять привычную двояковогнутую форму и становится сфероцитами или стоматосфероцитами. Трансмиссивная электронная микроскопия (Рис. 4) также подтверждает эпицеллюлярное расположение. Зона в 15-25 нм разделяет микроорганизм от мембраны эритроцита, мягкие фибриллы идут от микоплазмы к эритроциту в местах плотного контакта. Отмечено образование пятен на мембране эритроцита, в то время как полной эрозии не наблюдается. Одиночная мембрана окружает организм. Цитоплазма состоит из гранул разного размера и плотности, цитоплазматические органеллы не обнаруживаются. У некоторых присутствуют вакуоли. Ультраструктура Candidatus M. Haemominutum схожа с M. haemofelis и другими Молликутами (класс бактерий). Они более мелкие, имеют плазматическую мембрану без клеточной стенки или внутренних мембранных структур.
У некоторых присутствуют вакуоли. Ультраструктура Candidatus M. Haemominutum схожа с M. haemofelis и другими Молликутами (класс бактерий). Они более мелкие, имеют плазматическую мембрану без клеточной стенки или внутренних мембранных структур.
Рис. 4. Трансмиссивная электронная микроскопия пяти микроорганизмов Mycoplasma haemofelis в прерывистом контакте с плазмалеммой эритроцита у больной гемобартонеллезом кошки
Гемотропные микоплазмы собак
Mycoplasma haemocanis (ранее Haemobartonella canis) считается возбудителем микоплазмоза у собак, однако, последовательность 16S рРНК гена M. haemocanis оказалась практически идентична M. haemofelis (99% гомологичности), из чего следует, что данные агенты могут быть разными разновидностями одного и того же микроорганизма. Другие исследования, оценивающие последовательности генов рибонуклеазы Р (RNase P), показали меньшую гомологичность между ними (95%), следовательно эти микроорганизмы могут быть разными.
Рис. 5. Несколько эритроцитов с паразитирующими Mycoplasma haemocanis.
Результаты электронной микроскопии показывают, что M. haemocanis по своей ультраструктуре идентична M. haemofelis. Они также углубляются в поверхность эритроцитов, как было описано для M. haemofelis, цепи микроорганизмов часто образуют «канавки» или глубокие складки, заметно искажая форму эритроцитов.
Новая маленькая гемоплазма Candidatus Mycoplasma haematoparvum, которая генетически более близка к Candidatus M. Haemominutum, чем к M. haemofelis, была изолирована из крови сленэктомированной собаки с гематопоэтической неоплазией. В ПЦР исследовании во Франции эти микроорганизмы оказались более распространенными, чем M. haemocanis. В исследовании таким же методом в Швейцарии распространенность собачьих гемоплазм оказалась ниже.
Эпидемиология и патогенез гемобартонеллеза животных
Распространенность гемобартонеллезов
Сравнение исследований по распространенности гемоплазм проблематично, потому как популяции тестируемых кошек крайне различаются. Иногда исследуются кошки с анемией, в других исследованиях учитывают популяцию больных, вялых кошек, а третьих – всех кошек, независимо от статуса их здоровья. Также географический и климатический фактор могут сильно влиять на распространенность.
Исследования с использованием ПЦР в США и Испании показывают, что около 30% кошек с анемией имеют положительные результаты на гемотропных микоплазм (гемобартонеллез), у большинства обнаруживают только Mycoplasma haemofelis или в комбинации с Candidatus M. Haemominutum. В дополнение к этому, около 14% здоровых кошек контроля в США имеют положительные результаты ПЦР. Из них 19 были инфицированы только Candidatus M.

У анемичных и неанемичных кошек, исследованных ПЦР в ветеринарном госпитале на западном побережье США, распространенность гемоплазменных инфекцией составила: 16% Candidatus M. Haemominutum, но только 0,4% имели оба варианта Candidatus M. Haemominutum и M. haemofelis. Вероятность наличия четвертого типа гемоплазм, похожего на M. haematoparvum, была обнаружена у 0,7% кошек. В исследовании в Великобритании мене 2% больных кошек (с анемией и без) и менее 2% здоровых кошек были инфицированы M. haemofelis. Распространенность Candidatus M. Haemominutum составила около 20% больных кошек (с анемией и без), при этом 8% здоровых кошек тоже имели положительные результаты. В исследовании диких кошек Северной Флориды 8% имели положительные результаты на M. haemofelis, 12% - Candidatus Mycoplasma Haemominutum. Как и в других исследованиях, самца были инфицированы чаще самок, и была отмечена положительная корреляция с ВИК и ВЛК инфекцией. Распространенность инфекции Candidatus M. Turicensis сравнивали в Швейцарии, Великобритании, США, Австралии и Южной Африке, распространенность среди больных и здоровых кошек составила 1, 2, 3, 10 и 26% соответственно.
M. haemocanis была отмечена у собак Северной Америки и Европы. На юге Франции распространенность (методом ПЦР) Candidatus M. haematoparvum составила 9,6%, а M. haemocanis – 3,3%. В Швейцарии только 1,2% собак имели положительные результаты ПЦР на собачьи гемоплазмы. Распространенность в Европе выше в странах средиземноморья. В исследованиях с обратной ПЦР на собаках со свободным выгулом в Судане была обнаружена гораздо большая распространенность. Считается, что наличие или отсутствие переносчиков может объяснять эти различия.
Гемобартонеллез у кошек
Судя по морфологическим особенностям, клиническим признакам и лабораторным данным, почти все публикации относительно кошачьего гемобартонеллеза до 1998 года касаются M. haemofelis. Подвиды Флорида и Огайо, используемые в экспериментах, согласно ПЦР и последовательности 16S рРНК генов идентичны M. haemofelis. M. haemofelis часто вызывает анемию и клинические признаки заболевания, в то время как Candidatus M. Haemominutum приводит к бессимптомной инфекции и минимальному снижению гематокрита, если не связана с ВИК, ВЛК или другой сопутствующей болезнью. Дальнейшее описание патогенеза заболевания касается инфекции M. haemofelis.
haemofelis часто вызывает анемию и клинические признаки заболевания, в то время как Candidatus M. Haemominutum приводит к бессимптомной инфекции и минимальному снижению гематокрита, если не связана с ВИК, ВЛК или другой сопутствующей болезнью. Дальнейшее описание патогенеза заболевания касается инфекции M. haemofelis.
Экспериментально, Mycoplasma haemofelis передается внутриперитонеальной, внутривенной инъекцией или пероральным введением зараженной крови. Распространение инфекции кровососущими членистоногими, такими как блохи, считается основным способом передачи. Однако, такой способ был показан экспериментально лишь однажды, и кошка пережила это без клинических или гематологических изменений. Было предположено, что M. haemofelis может передаваться от кошек котятам без участия членистоногих. Происходит ли трансмиссия в матке во время родов или в послеродовой период, неизвестно, потому как экспериментальные исследования на этот счет очень скудны. Ятрогенная передача может происходит при трансфузии крови от клинически здоровых носителей.
Тяжесть гемобартонеллеза варьирует, некоторые кошки имеют умеренную анемию без клинических признаков, а другие болеют с выраженной депрессией и серьезной анемией, приводящей к смерти. Для простоты понимания заболевание патогенез был разделен на препаразитемическую, острую, стадию выздоровления и стадию носительства (Рис. 6). Стадия препаразитемии длится около 1-3 недель после внутривенной инъекции. Острая фаза заболевания затрагивает период от появления паразитемии до ее окончания. Они обычно длится месяц и более, но часто кошки быстро гибнут от массивной паразитемии и снижения гематокрита в начале заболевания. Микроорганизмы появляются в крови циклично с прерывистыми эпизодами паразитемии. Их число растет до пиковых значений за 1-5 дней с последующим быстрым снижением. Синхронизированное исчезновение паразитов из крови может происходить в течение 2 часов и меньше. Микроорганизмы не удается найти или их совсем мало в мазках крови в течение нескольких дней после эпизода паразитемии, но небольшое их количество можно обнаружить методом ПЦР.
Рис. 6. Ежедневные измерения гематокрита, температуры и количества паразитов у кошки после внутривенной инокуляции крови с M. haemofelis с 0 дня. Темные стрелки указывают на внутривенное введение тиацетарсамида натрия (1мг/кг). Белая стрелка на 60 день указывает на трансфузию 25 цельной крови. Фазы гемобартонеллеза отмечены буквами: А – препаразитемия, В – острая фаза, С – фаза выздоровления и Д – фаза носительства.
Во многих случаях быстрое снижение гематокрита с последующим быстрым ростом происходит в связи с появлением и исчезновением большого количества паразитов из крови. Эти колебания гематокрита происходят из-за секвестрации селезенкой пораженных эритроцитов и высвобождением неинфицированных эритроцитов. В других случаях гематокрит остается низким или продолжает снижаться еще 1 день или дольше после эпизода паразитемии, возможно, в результате разрушения эритроцитов.
Повторяющиеся эпизоды паразитемии похоже вызывают прогрессивное разрушение эритроцитов и укорочение продолжительности их жизни. Небольшое повреждение эритроцитам наносится самими микроорганизмами, но более важны повреждения, обусловленные иммуноопосредованными механизмами. Тест Кумбса (прямой антиглобулин, 37◦ C) может иметь положительный результат спустя неделю после первой паразитемии, и, обычно, проба Кумбса остается положительной во время острой фазы заболевания, независимо от того, присутствуют ли микроорганизмы. Антитела к эритроцитам, действующие при 4◦ C ( иммуноглобулин G и M, холодовые антитела) появляются спустя 8-22 дня после экспериментальной инфекции M. haemofelis и персистируют 2-4 недели, в то время как тепловые агглютинины (37◦ C) появляются позже – между 22 и 29 дней и персистируют до 5 недель. Авторы этого исследования предположили, что антитела к эритроцитам скорее возникают как следствие микоплазменной инфекции и/или гемолиза, чем связаны с анемией. Прикрепление микроорганизмов к эритроцитам или выставляет спрятанные антигены эритроцитов или приводит к изменению антигенов эритроцитов с последующим ответом макроорганизма в виде антиэритроцитарных антител.
Небольшое повреждение эритроцитам наносится самими микроорганизмами, но более важны повреждения, обусловленные иммуноопосредованными механизмами. Тест Кумбса (прямой антиглобулин, 37◦ C) может иметь положительный результат спустя неделю после первой паразитемии, и, обычно, проба Кумбса остается положительной во время острой фазы заболевания, независимо от того, присутствуют ли микроорганизмы. Антитела к эритроцитам, действующие при 4◦ C ( иммуноглобулин G и M, холодовые антитела) появляются спустя 8-22 дня после экспериментальной инфекции M. haemofelis и персистируют 2-4 недели, в то время как тепловые агглютинины (37◦ C) появляются позже – между 22 и 29 дней и персистируют до 5 недель. Авторы этого исследования предположили, что антитела к эритроцитам скорее возникают как следствие микоплазменной инфекции и/или гемолиза, чем связаны с анемией. Прикрепление микроорганизмов к эритроцитам или выставляет спрятанные антигены эритроцитов или приводит к изменению антигенов эритроцитов с последующим ответом макроорганизма в виде антиэритроцитарных антител. Специфические антитела против антигенов M. haemofelis были обнаружены в сыворотке через 14 дней после экспериментального инфицирования. Однако и другой возможный механизм иммуноопосредованного повреждения можно предполагать. Если происходит фиксация комплемента, эритроцитарная мембрана может быть повреждена как «невинный свидетель». Однако в таком случае происходит минимальный интраваскулярный гемолиз. Анемия возникает первично из-за экставаскулярного эритрофагоцитоза макрофагами селезенки, печени, легких и ККМ. В сравнении с инфекцией Mycoplasma haemofelis, ни холодные, ни теплые антитела не были обнаружены у кошек с Candidatus M. Haemominutum и Candidatus M. Turicensis.
Специфические антитела против антигенов M. haemofelis были обнаружены в сыворотке через 14 дней после экспериментального инфицирования. Однако и другой возможный механизм иммуноопосредованного повреждения можно предполагать. Если происходит фиксация комплемента, эритроцитарная мембрана может быть повреждена как «невинный свидетель». Однако в таком случае происходит минимальный интраваскулярный гемолиз. Анемия возникает первично из-за экставаскулярного эритрофагоцитоза макрофагами селезенки, печени, легких и ККМ. В сравнении с инфекцией Mycoplasma haemofelis, ни холодные, ни теплые антитела не были обнаружены у кошек с Candidatus M. Haemominutum и Candidatus M. Turicensis.
Как лимфоцитарный и макрофагальный фильтр крови, селезенка имеет большое значение в очистке антигенов крови и выработке специфического иммунного ответа на эти антигены. Результаты ПЦР показывают, что ткани селезенки и легких содержат больше M. haemofelis, чем другие ткани, в сравнении с уровнями в крови. Однако циклическое повышение числа паразитов в крови скорее вызвано быстрой репликацией, чем высвобождением после секвестрации. Кроме кошек, у других животных для возникновения клинической болезни (многими гемотропными микоплазмами) необходима спленэктомия. Избавление от микроорганизмов M. haemofelis у кошек после спленэктомиии происходит тяжелее и связано с вдвое более долгими периодами паразитемии, чем у кошек с селезенкой. Однако спленэктомия, проведенная перед инфицированием, не влияет на инкубационный период и тяжесть заболевания. Спленэктомия у выздоровевших кошек приводит к временной паразитемии, но у большинства животных гематокрит не снижается до клинически значимого уровня.
Однако циклическое повышение числа паразитов в крови скорее вызвано быстрой репликацией, чем высвобождением после секвестрации. Кроме кошек, у других животных для возникновения клинической болезни (многими гемотропными микоплазмами) необходима спленэктомия. Избавление от микроорганизмов M. haemofelis у кошек после спленэктомиии происходит тяжелее и связано с вдвое более долгими периодами паразитемии, чем у кошек с селезенкой. Однако спленэктомия, проведенная перед инфицированием, не влияет на инкубационный период и тяжесть заболевания. Спленэктомия у выздоровевших кошек приводит к временной паразитемии, но у большинства животных гематокрит не снижается до клинически значимого уровня.
Без терапии треть кошек с неосложненной острой инфекцией M. haemofelis погибают вследствие серьезной анемии. Кошки с достаточным иммунным ответом на инфекцию и высоким регенеративным ответом красного костного мозга, компенсирующим разрушение эритроцитов, выздоравливают. Период выздоровления – время от последней крупной паразитемии до стабилизации гематокрита до или близко к нормальному уровню – занимает месяц или больше. У кошек без терапии микроорганизмы обнаруживаются в небольшом количестве в период выздоровления, но обычно это не вызывает дискретных эпизодов паразитемии.
У кошек без терапии микроорганизмы обнаруживаются в небольшом количестве в период выздоровления, но обычно это не вызывает дискретных эпизодов паразитемии.
Кошки, выздоровевшие после острого гемобартонеллеза, остаются хронически инфицированными на месяцы, годы или на всю жизнь. Тогда как экстрацеллюлярные микроорганизмы должны быть уничтожены иммунными механизмами, неповрежденные микроорганизмы, как сообщается, могут оставаться в фагоцитарных вакуолях макрофагов селезенки и легких. Некоторые микроорганизмы могут выживать в этих клетках, что будет считаться хронически инфекционным состоянием (однако исследования in situ инфекционных кошек с использованием специфических проб ДНК показали наличие микроорганизмов только на эритроцитах). Сообщение о внутриклеточном расположении других гемоплазм интригует, потому как это может увиливать защиту и служить источником хронической инфекции. Кошки-носители (с латентной инфекцией) выглядят клинически здоровыми. Они могут иметь нормальный гематокрит или небольшую регенераторную анемию. Небольшое количество микроорганизмов регулярно обнаруживают у некоторых таким кошек в мазках крови в течении нескольких недель. Кошки-носители имеют некоторое стабильное состояние баланса между репликацией микроорганизмов и фагоцитозом и уничтожением инфекции.
Небольшое количество микроорганизмов регулярно обнаруживают у некоторых таким кошек в мазках крови в течении нескольких недель. Кошки-носители имеют некоторое стабильное состояние баланса между репликацией микроорганизмов и фагоцитозом и уничтожением инфекции.
M. haemofelis может быть условно-патогенным агентом у здоровых кошек, вызывая заболевание у кошек заболевание в связи со стрессом другой болезни или хирургическими процедурами; однако, некоторые кошки с гемотропным микоплазмозом не имеют явного другого предрасполагающего заболевания или стресс-состояния. Абсцессы кусаных ран кошек похоже являются самой частой предрасполагающей причиной гемотропного микоплазмоза, возникающего через несколько недель. Несмотря на то, что абсцесс, конечно, это стресс-фактор, стоит предполагать возможность трансмиссии заболевания через кошачий укус. Исследования показали, что Mycoplasma haemofelis не может быть обнаружена в слюне или слюнных железах инфекционных кошек. Таким образом, социальные контакты и груминг маловероятно приводят к трансмиссии, однако, это по-прежнему не исключает возможность передачи при агрессивных взаимодействиях с помощью крови или чрезкожной инокуляции зараженных фекалий блох с шерсти инфицированных кошек. Другие факторы, увеличивающие вероятность нахождения микоплазмы в мазках – мужской пол, отсутствие вакцинаций, выгул, положительные результаты тестов на ВЛК и ВИК.
Другие факторы, увеличивающие вероятность нахождения микоплазмы в мазках – мужской пол, отсутствие вакцинаций, выгул, положительные результаты тестов на ВЛК и ВИК.
Интересна возможная связь между гемобартонеллезом и индуцированной ВЛК болезнью. Около 40-50% с клиническим гемотропным микоплазмозом оказываются ВЛК положительными. ВЛК может супрессировать нормальный иммунный ответ на другие агенты, таким образом, эта вирусная инфекция может повышать предрасположенность кошек к гемотропному микоплазмозу или переводить латентную инфекцию в клинически проявляющееся заболевание. Однако, ВЛК-инфицированные кошки в Бразилии не были более предрасположены к M. haemofelis, чем свободные от ВЛК.
Экспериментальые исследования показали, что обратное тоже может случиться – гемобартонеллез может повысить предрасположенность кошек к ВЛК инфекции. ВЛК и ВИК инфекции кошек в США были сильно ассоциированы с инфекцией M. haemofelis, что подтверждает такую взаимосвязь. Инфекция совместно ВЛК и M. haemofelis приводит к более серьезной анемии и клиническим признакам, чем одиночные агенты. В противоположность, конкурентная инфекция ВИК и M. haemofelis по всей видимости не приводит к более серьезной анемии, чем только M. haemofelis.
haemofelis приводит к более серьезной анемии и клиническим признакам, чем одиночные агенты. В противоположность, конкурентная инфекция ВИК и M. haemofelis по всей видимости не приводит к более серьезной анемии, чем только M. haemofelis.
Доступен все больший объем информации касательно патогенеза Candidatus M. haemominutum. Инфекция этой микоплазмой часто протекает без симптомов и серьезной анемии, чаще наблюдается статус носителя. Интересно, что существенная паразитемия может возникать с небольшим изменением гематокрита.. Однако, в одном исследовании небольшое снижение гематокрита было продемонстрировано после экспериментальной инфекции Candidatus M. haemominutum, что позволяет предположить, что этот микроорганизм может индуцировать разрушение эритроцитов. Пик количества копий ДНК микроорганизма наблюдался около 30 дня, но значимой вариации в их числе не было обнаружено. Есть также сообщения о Candidatus M. haemominutum как единственной обнаруженной причине анемии естественно инфицированных кошек.
Кофакторы могут играть роль в развитии клинически значимого гемобартонеллеза, связанной с инфекцией Candidatus M. haemominutum. В одном более старом исследовании возможность выгула, кожный плоскоклеточный рак и стоматит были идентифицированы как риск-факторы инфекции. Несколько исследований показали, что кошки с ВИК и дикие кошки имеют больший риск иметь инфекцию. Как было описано по поводу M. haemofelis ранее, кошки, коинфицированные ВЛК и Candidatus M. haemominutum, имеют более серьезную анемию, чем только с Candidatus Mycoplasma haemominutum. В дополнение, стресс от инфекции Candidatus M. haemominutum может индуцировать развитие миелопролиферативных заболеваний у ВЛК-инфицированных кошек.
Некоторые исследования показывают, что инфекция Candidatus M. haemominutum защищает от инфицирования вирулентной M. haemofelis, однако, другие исследования говорят о том, что кошки хронически инфицированные Candidatus M. haemominutum, не защищены от M. haemofelis. Эти последние исследования также указывают о том, что при инфицировании двумя подвидами анемия более серьезна, чем только при M. haemofelis. Предыдущая инфекция одним подвидом может предрасполагать кошек к повышенному иммуноопосредованному ответу, когда они инфицируются другой разновидностью.
haemofelis. Предыдущая инфекция одним подвидом может предрасполагать кошек к повышенному иммуноопосредованному ответу, когда они инфицируются другой разновидностью.
Информации о патогенезе Candidatus M. turicensis мало, это уникальна гемоплазма, выделенная из крови кошек с серьезной анемией. Ее трансмиссия с помощью внутривенной инокуляции предрасположенным кошкам привела к анемии от умеренного до серьезного уровня. Пик паразитемии, измеренный с помощью ПЦР, возникает через 16-18 дней после экспериментального инфицирования, но очевидного увеличения объема гемоплазм не обнаруживается (?). Характерных включений, похожих на микоплазм, не было обнаружено в мазках крови. У естественно инфицированных кошек небольшое число копий Candidatus M. turicensis обнаруживается в крови. Похоже, что возможна элиминация Candidatus M. turicensis без лечения инфицированных кошек.
Candidatus M. turicensis также была обнаружена в слюну и фекалиях инфицированных кошек с помощью молекулярных техник. Однако, инокуляция слюны, положительной на гемоплазму, ороназальным и подкожным путем не привела к инфицированию кошек. Исследования показывают, что коинфекция ВИК и иммуносупрессия могут повысить потенциальную патогенность микроорганизма. Candidatus M. turicensis инфекция часто была ассоциирована коинфекцией другими гемоплазмами, особенно Candidatus M. haemominutum.
Однако, инокуляция слюны, положительной на гемоплазму, ороназальным и подкожным путем не привела к инфицированию кошек. Исследования показывают, что коинфекция ВИК и иммуносупрессия могут повысить потенциальную патогенность микроорганизма. Candidatus M. turicensis инфекция часто была ассоциирована коинфекцией другими гемоплазмами, особенно Candidatus M. haemominutum.
Гемобартенеллез собак
Трансмиссия Mycoplasma haemocanis с помощью коричневого собачьего клеща (Rhipicephalus sanguineus) была продемонстрирована экспериментально. Также была описана трансстадийная и трановариальная передача возбудителя у клещей, что указывает на то, что клещи могут быть важным резервуаром и переносчиком инфекции. Ятрогенная трансмиссия M. haemocanis с помощью крови от клинически здоровых носителей (собак) также происходит, но имеет меньшее значение, чем у кошек, потому как собака-реципиент обычно должна быть спленэктомирована прежде чем клинически значимая болезнь может возникнуть. Гемотропный микоплазмоз, приведший к смерти двух животных от выводка 4-месячных щенков был описан. Экспериментальные исследования не смогли доказать возможность трансмиссии микоплазмоза щенкам через матку или при кормлении, но косвенное подтверждение для внутриматочной трансмиссии было обнаружено. Передача инфекции с помощью перорального введения инфицированной крови также было задокументировано.
Гемотропный микоплазмоз, приведший к смерти двух животных от выводка 4-месячных щенков был описан. Экспериментальные исследования не смогли доказать возможность трансмиссии микоплазмоза щенкам через матку или при кормлении, но косвенное подтверждение для внутриматочной трансмиссии было обнаружено. Передача инфекции с помощью перорального введения инфицированной крови также было задокументировано.
Инкубационный период после внутривенного введения инфицированной крови спленэктомированным собакам составляет от 1-2 дней до 2 недель или больше. Некоторые случаи гемобартонеллеза характеризовались быстрым прогрессированием анемии, ассоциированной с почти постоянной паразитемией. Смерть таких собак обычно наступает через месяц после инокуляции. У других собак развитие анемии более постепенное с повторяющимися эпизодами паразитемии. Микроорганизмы обнаруживаются в больших количествах в крови в течение недели или дольше с небольшими перерывами, когда м/о не обнаруживаются. Проходит около 1-2 месяцев до снижения гематокрита и гемоглобина до минимальных значений, и примерно такое же время нужно, чтобы они поднялись до нормы. Несмотря на то, что иммунологическое обследованием этих собак было ограничено, предполагается, что образуются антитела к эритроцитам.
Несмотря на то, что иммунологическое обследованием этих собак было ограничено, предполагается, что образуются антитела к эритроцитам.
Для развития клинически значимого гемотропного микоплазмоза у собак обычно требуется спленэктомия. Однако, были описаны и случаи неспленэктомированных собак с конкурентными инфекциями: эрлихиозом, бабезиозом, бактериальными и вирусными инфекциями. Гемотропный микоплазмоз также возможен у собак, получающих иммуносупрессивные препараты, и с патологиями селезенки. Редкие случаи острого заболевания были задокументированы у собак без спленэктоми, у которых не было обнаружено доказательств иммуносупресии.
В отличие от инфекции M. haemofelis у кошек, большинство неспленэктомированных собак, инфицированных M. haemocanis не развивают клинического заболевания. Они не становятся анемичными и не имеют значимого числа паразитов в крови, которое можно было бы обнаружить в мазках крови. Есть молекулярные доказательства, что хроническая или латентная инфекция M. haemocanis часто бывает у выращенных в питомниках биглей. Но неизвестно, имеет ли значение в передачи инфекции трансплацентарная передача или поедание крови или артроподы или генетическая предрасположенность. Тем не менее, наличие хронической инфекции M. haemocanis может значимо влиять и спутывать результаты исследований, особенно при использовании спленэктомированных питомниковых биглей.
haemocanis часто бывает у выращенных в питомниках биглей. Но неизвестно, имеет ли значение в передачи инфекции трансплацентарная передача или поедание крови или артроподы или генетическая предрасположенность. Тем не менее, наличие хронической инфекции M. haemocanis может значимо влиять и спутывать результаты исследований, особенно при использовании спленэктомированных питомниковых биглей.
Клинические признаки
Симптомы и признаки гемобартонеллеза у кошек
Клинические признаки гемоплазменной инфекции варьируют и зависят от вовлеченных видов. В дополнение к этому влияет, является ли инфекция острой или хронической, есть ли сопутствующие заболевания или стресс. В сравнении с острой инфекцией M. haemofelis, лишь небольшое количество клинических признаков может быть обнаружено у кошек с субклинической инфекцией и анемия, если есть, то умеренная.
Острый гемобартонеллез возникает у кошек в любом возрасте. Но среди инфицированных кошек молодые более часто проявляют клинически значимую болезнь. Некоторые исследования показали более частые случаи и взрослых котов, что связали с их выгулом и драками, приводящими к более частой экспозиции с кошками, инфицированными M. haemofelis. Кошачий гемотропный микоплазмоз – обычно индивидуальное заболевание кошек, но случаи множественной инфекции в многокошковых () домах были доложены.
Некоторые исследования показали более частые случаи и взрослых котов, что связали с их выгулом и драками, приводящими к более частой экспозиции с кошками, инфицированными M. haemofelis. Кошачий гемотропный микоплазмоз – обычно индивидуальное заболевание кошек, но случаи множественной инфекции в многокошковых () домах были доложены.
Наиболее частые симптомы при острой инфекции гемобартонеллеза у кошек с анемией – это тахипноэ, депрессия, вялость, анорексия, снижение веса, бледность слизистых оболочек и дегидратация. Также сообщалось о спленомегалии, которая, видимо, связана с экстраваскулярным разрушением эритроцитов и возможным экстрамедуллярным гематопоэзом. Только когда разрушение эритроцитов очень значимое и происходит быстро, может наблюдаться желтуха. Клинические признаки, как упомянуто выше, зависят от стадии заболевания и скорости развития анемии. Если анемия развивается постепенно, кот пожжет терять вес, но оставаться активным. В противовес этому, быстрое снижение гематокрита в начале заболевания вместе с выраженной паразитемией вызывает незначительное снижение веса, но значимую депрессию и другие признаки анемии. Ректальная температура обычно в норме, кроме как при острой фазе заболевания, когда она повышена примерно 50% времени. Пониженная температура может наблюдаться у кошек при смерти.
Ректальная температура обычно в норме, кроме как при острой фазе заболевания, когда она повышена примерно 50% времени. Пониженная температура может наблюдаться у кошек при смерти.
У кошек с Candidatus Mycoplasma haemominutum симптомы гемобартонеллеза умеренные или их нет. Небольшая лихорадка может возникать временами. Инфекция Candidatus M. haemominutum была обнаружена чаще у больных кошек, чем у здоровых, но непонятно связаны ли симптомы с инфекцией Candidatus M. haemominutum или сопутствующей болезнью. В одном сообщении Candidatus M. haemominutum была единственной обнаруженной причиной анемии у нескольких естественно инфицированных кошек.
Candidatus M. turicensis, новая открытая гемоплазма, может быть патогенной у кошек и вызывать гемолитическую анемию от умеренной до тяжелой. Есть более ранние доклады, указывающие, что клинические признаки более тяжелые у кошек с коинфекцией ВИК или после приема ГКС.
Клинические признаки гемобартонеллеза у собак
Если нет других сопутствующих заболеваний, клинические признаки неявны у неспленэктомированных собак, инфицированных Mycoplasma haemocanis или Candidatus M. haematoparvum. Спленэктомированные собаки, экспериментально инфицированные M. haemocanis, становились вялыми, с прогрессированием анемии их слизистые становились бледными, но обычно они имели нормальную ректальную температуру и аппетит. Спустя 1 неделю обнаружения в крови Candidatus M. haematoparvum у спленэктомированной собаки с лимфоидной неоплазией развилась серьезная регенераторная анемия, о клинически признаках в этом единственном сообщении нет данных.
haematoparvum. Спленэктомированные собаки, экспериментально инфицированные M. haemocanis, становились вялыми, с прогрессированием анемии их слизистые становились бледными, но обычно они имели нормальную ректальную температуру и аппетит. Спустя 1 неделю обнаружения в крови Candidatus M. haematoparvum у спленэктомированной собаки с лимфоидной неоплазией развилась серьезная регенераторная анемия, о клинически признаках в этом единственном сообщении нет данных.
Диагностика
Лабораторные данные относительно гемобартенеллеза у кошек
Микроорганизмы Mycoplasma haemofelis, которых можно обнаружить в мазках крови, присутствуют в крови только около 50% времени острой фазы заболевания гемобартонеллеза. Гематокрит обычно опускается ниже 20%, часто ниже 10% до того, как симптомы заболевания становятся заметны владельцу. Гематокрит наиболее надежный индикатор общей эритроцитарной массы у кошек с гемотропным микоплазмозом. Эритроциты с паразитами, которые в основном изолированы в селезенке и других органах могут возвращаться в общий кровоток после удаления микроорганизмов с их поверхности.
Если гематокрит снижается быстро (менее чем за 4 дня до обнаружения, средний объем эритроцитов может быть в референсном интервале с небольшим количеством ретикулоцитов. К тому времени, как проявляются клинические признаки, кошки имеют регенераторную анемию с полихромазией и ретикулоцитозом. Эритроциты обычно макроцитарные со средним объемом эритроцитов более 50 fL и обычно гипохромные со средней концентрацией гемоглобина менее 31 g/dL. Хотя, анизоцитоз, ядерные эритроциты и повышенное число телец Хауэлла-Жолли часто обнаруживают в острой фазе кошачьего гемотропного микоплазмоза, эти данные не являются надежными индикаторами регенераторного ответа у кошек. Тельца Хауэлла-Жолли часто обнаруживаются у здоровых кошек, ядерные эритроциты могут обнаруживаться при многих других заболеваниях, значимый анизоцитоз без полихромазии обнаруживается у кошек с миелопролиферативными заболеваниями. Кошки с латентной инфекцией (носители) при гемобартонеллезе обычно имеют небольшое количество м/о, видимых в крови. Их гематокрит колеблется время от времени, он может быть нормальным или немного сниженным, однако не менее 20%. Небольшой ретикулоцитоз с полихромазией и повышенным средним объемом эритроцитов присутствует временами.
Их гематокрит колеблется время от времени, он может быть нормальным или немного сниженным, однако не менее 20%. Небольшой ретикулоцитоз с полихромазией и повышенным средним объемом эритроцитов присутствует временами.
Так как существует две морфологические формы ретикулоцитов у кошек описано у кошек, важно знать, какие критерии использует лаборатория для подсчета ретикулоцитов. Агрегатные эритроциты составляют небольшую часть эритроцитов крови обычных кошек (0-0,4%). Процент этих форм хорошо коррелирует с процентом полихроматофильных эритроцитов. Большее число циркулирующих эритроцитов составляют пунктатные ретикулоциты (до 10%), которые содержат пунктатные включения преципитированных рибосом. Число ретикулоцитов у кошек с тяжелой паразитемией тяжело точно оценить, так как м/о тоже окрашиваются как голубые включения, как и пятна ретикулоцитов.
Общее и дифференциальное число лейкоцитов вариабельно, ограниченную диагностическую ценность может иметь повышенная реактивность моноцитов. При сканировании под малым увеличением можно обнаружить эритрофагоцитоз с помощью моноцитов или макрофагов. Число тромбоцитов обычно в норме.
При сканировании под малым увеличением можно обнаружить эритрофагоцитоз с помощью моноцитов или макрофагов. Число тромбоцитов обычно в норме.
Фагоцитоз эритроцитов мононуклеарными клетками в кровотоке происходит из-за образования антител, реакции комплемента или обоих на поверхности эритроцитов. Аутоагглютинация часто обнаруживается в охлажденных образцах крови на ранних стадиях гемотропного микоплазмоза, но клиническая значимость этих холодовых агглютининов иммуноглобулинов М неясна. Результаты теста Кумбса (37◦ C) часто положительны на тот момент, когда проводится обследование пациента. Согласно предыдущим находкам, все экспериментально инфицированные кошки с гемобартонеллезом в одном исследовании имели или персистентную аутоагглютинацию промытых эритроцитов или положительную пробу Кумбса в какой-то момент клинической оценки. Однако никто из кошек, экспериментально зараженных Candidatus Mycoplasma haemominutum или Candidatus M. turicensis не имел положительных результатов пробы Кумбса.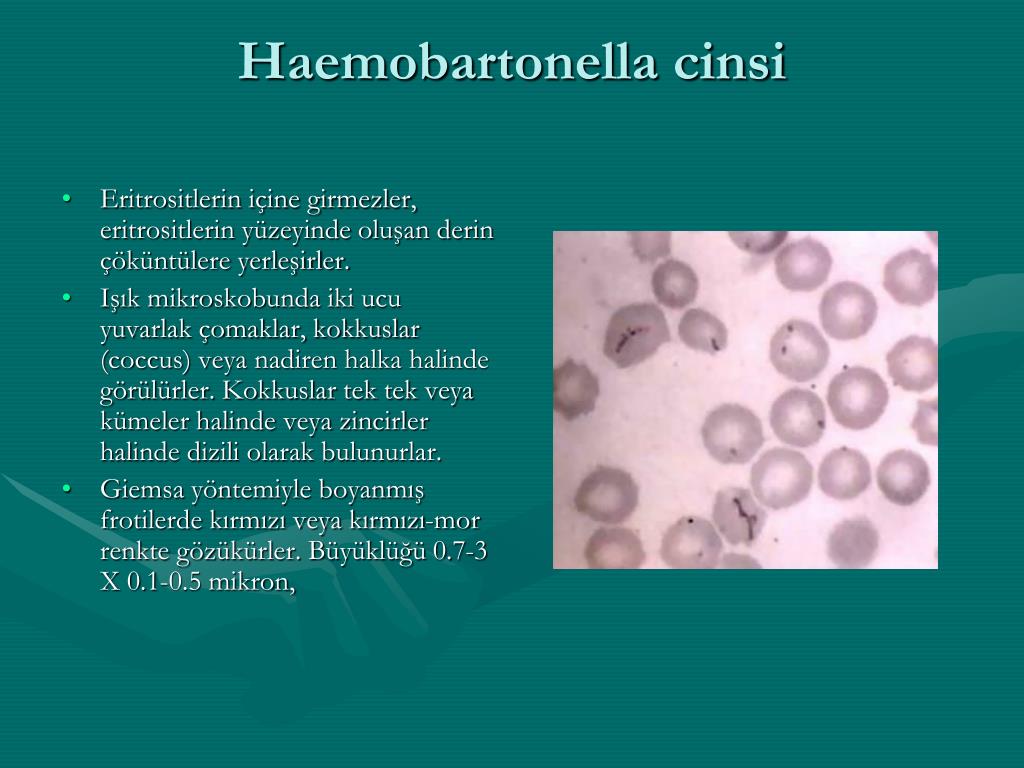
Соотношение миелоидного к эритроидному ростку (М:Е) в красном костном мозге в норме в начальных стадиях инфекции Mycoplasma haemofelis, но значительно снижается позднее при заболевании. Эритроидная гиперплазия происходит не только из-за увеличения общего числа эритроцитов, но и из-за увеличения пропорции незрелых форм. Эритрофагоцитоз макрофагами от слабого до серьезного уровня обычно присутствует.
Иктеричность плазмы не всегда обнаруживается при гемобартонеллезе кошек, но она может присутствовать спустя 1-2 дня после быстрого снижения гематокрита. Иктеричность и увеличение концентрации билирубина не всегда следует за быстрым снижением гематокрита, возможно, из-за того, что эритроциты могут быть секвестрированы в капиллярах или сосудистых пространствах в пределах селезенки без их разрушения. Концентрация белка обычно в норме (6-9 g/dL), но может быть повышена у некоторых кошек. Сывороточная концентрация АЛТ и АСТ обычно умеренно повышена. Эти изменения могут быть связаны с гипоксией печени вторично к анемии или липидозом вторично к анорексии. Концентрация мочевины может быть немного или сильно повышена без одновременного повышения креатинина. Повышение мочевины, считается, связано с преренальным, вторично к дегидратации. Умирающие кошки могут иметь низкий уровень глюкозы.
Концентрация мочевины может быть немного или сильно повышена без одновременного повышения креатинина. Повышение мочевины, считается, связано с преренальным, вторично к дегидратации. Умирающие кошки могут иметь низкий уровень глюкозы.
Кошки, инфицированные Candidatus M. haemominutum могут иметь слабо регенераторную анемию или нормальные гематологические показатели. Ранние исследования показали, что Candidatus M. turicensis может быть патогенным, вызывая умеренную или сильную гемолитическую анемию. В одном исследовании, проведенном в Соединенном Королевстве, не было обнаружено связи гемоплазменной инфекции и положительной по пробе Кумбса анемии у кошек.
Лабораторные изменения в организме собак при гемобартонеллезе
Когда присутствуют клинические признаки анемии, вызванной гемотропным микоплазмозом, Mycoplasma haemocanis обычно обнаруживают. Однако анемия варьирует от умеренной до серьезной в исследованиях спленэктомированных собак, гематокрит обычно снижается менее 20% до возникновения клинических признаков. Микроорганизмы могут быть обнаружены временами при исследовании крови собак с клиническими признаками других конкурентных заболеваний.
Микроорганизмы могут быть обнаружены временами при исследовании крови собак с клиническими признаками других конкурентных заболеваний.
В большинстве случаев значительное время проходит до возникновения анемии от первичного обнаружения заболевания, до развития регенераторного ответа красного костного мозга на анемию. Гематологические изменения включают ретикулоцитоз с повышением полихромазии и анизоцитоза, циркуляцией ядерных эритроцитов и часто тельцами Хауэлла-Жолли. Нужно больше времени для развития макроцитоза, то есть, его может не быть, когда ветеринар сначала обследует животное.
Изменений в лейкограмме обычно не обнаруживают при гемотропном микоплазмозе. Ни иктеричности плазмы, ни гемоглобинемии обычно не возникает в неосложненных случаях гемобартонеллеза, но может возникнуть существенная билирубинурия. Сфероцитоз и положительная проба Кумбса возникают у некоторых собак. Однако, в одном исследовании на собаках из Англии, не было обнаружено связи между гемотропным микоплазмозом и положительной по пробе Кумбса анемией. Собаки с латентной инфекцией обычной имеют нормальные результаты гематологического исследования.
Собаки с латентной инфекцией обычной имеют нормальные результаты гематологического исследования.
Обнаружение микроорганизма и нуклеиновой кислоты возбудителя гемобартенеллеза у кошек
Для идентификации гемотропных микоплазм требуются тонкие, хорошо-окрашенные мазки крови без артефактов, связанных с неправильной сушкой или фиксацией и остатками краски. Многие модификации красок Романовского (например, Wright-Giemsa) можно использовать, однако микроорганизмы сложно обнаружить, используя Diff-Quik. Мазки должны быть исследованы до лечения гемобартонеллеза, так гемоплазмы отсутствуют в крови у кошек, получавших тетрациклины. Микроорганизмы могут открепляться от эритроцитов во время хранения в ЭДТА, поэтому следует проводить исследование как можно быстрее после взятия образца крови. Клиницист должен мочь отличить микоплазм от частиц краски, артефактов сушки, телец Хауэлла-Жолли, базофильной зернистости, сидеротических включений и паразитов Cytauxzoon, которые являются мелкими простейшими с цитоплазмой и ядрами (Табл. 1). Не должны использоваться препараты метиленового синего, а также окрашенные ретикулоциты не должны использоваться для диагностики гемотропного микоплазмоза, потому как здоровые кошки тоже имеют до 10% пунктатных эритроцитов, и преципитированный рибосомный материал в ретикулоцитах нельзя точно отличить от микоплазм.
1). Не должны использоваться препараты метиленового синего, а также окрашенные ретикулоциты не должны использоваться для диагностики гемотропного микоплазмоза, потому как здоровые кошки тоже имеют до 10% пунктатных эритроцитов, и преципитированный рибосомный материал в ретикулоцитах нельзя точно отличить от микоплазм.
Потому как паразитемии цикличны, отсутствие M. haemofelis в мазках крови не исключает инфекцию. Регенераторная анемия с положительным тестом Кумбса, наличие аутоагглютинации в охлажденных пробах крови или эритрофагоцитоза моноцитами позволяет предполагать инфекцию M. haemofelis. Однако, другие гемоплазмы и заболевания, например, первичная иммуноопосредованная гемолитическая анемия, также стоит предполагать.
Candidatus Mycoplasma haemominutum редко видны в крови, а когда обнаруживаются их сложно идентифицировать, так как они очень маленькие. Candidatus M. turicensis не были окончательно обнаружены в мазках крови.
Высокочувствительные ПЦР исследования обнаруживают небольшое количество гемоплазм в крови, когда сложно установить диагноз используя мазки крови из-за слишком небольшого чиста паразитов. Обратная ПЦР разработана для диагностики M. haemofelis и Candidatus M. haemominutum и одна для Candidatus M. turicensis. Есть также ПЦР в реальном времени для обнаружения и подсчета всех типов гемоплазм.
Обратная ПЦР разработана для диагностики M. haemofelis и Candidatus M. haemominutum и одна для Candidatus M. turicensis. Есть также ПЦР в реальном времени для обнаружения и подсчета всех типов гемоплазм.
С использованием сравнительной и количественной ПЦР было установлено, что примерно 50 копий (микроорганизмов) M. haemofelis могут быть обнаружены с помощью ПЦР. С помощью SYBR green ПЦР можно обнаружить от 1 до 10 ДНК копий, а также возможно определение видоспецифичности с анализом кривых плавления. Специфические ПЦР праймеры были разработаны для дифференциации M. haemofelis и Candidatus M. haemominutum для расширенных ДНК продуктов. Результаты ПЦР были положительными 4-115 дней после экспериментальной инфекции и результаты оставались положительными до начала специфической антимикробной терапии. Результаты ПЦР отрицательны во время антмикробной терапии, но большинство кошек снова имели положительные результаты ПЦР через 3-5 недель после окончания терапии, но небольшое количество кошек имели отрицательные результаты в течение 6 месяцев после лечения. С использованием количественной ПЦР было обнаружено, что концентрация M. haemofelis в крови обратно пропорциональная гематокриту инфицированных кошек.
С использованием количественной ПЦР было обнаружено, что концентрация M. haemofelis в крови обратно пропорциональная гематокриту инфицированных кошек.
Диагноз при гемобартонеллезе обычно ставится на основании обнаружения м/о в крови или с помощью ПЦР. Однако, ELISA метод для обнаружения антител к кошачьим микоплазмам тоже был разработан. Тесты были положительны у кошек, инфицированных M. haemofelis, Candidatus Mycoplasma haemominutum и Candidatus Mycoplasma turicensis, у а неинфицированных нет.
При обнаружении микроорганизмов в мазках крови или методом ПЦР, все равно серьезность гемоплазменной инфекции должна быть оценена в свете гематологических и клинических данных. Просто обнаружение микроорганизмов в крови не обязательно указывает, что существующая клиническая болезнь вызвана этим агентом, потому как м/о могут быть периодически обнаружены у носителей без заболевания. С другой стороны, если анемия оказывается нерегенераторной, клиницист не должен совсем исключать значимость микрооргаизмов у кошек. Если гематокрит падает стремительно после инфекции, кошка может быть вялой или анемичной несколько дней до развития значимого регенераторного ответа красного костного мозга, обнаруживаемого в периферической крови. Однако, при постоянной нерегенераторной анемии клиницист должен искать другие причины анемии, такие как ВЛК и ВИК инфекции.
Если гематокрит падает стремительно после инфекции, кошка может быть вялой или анемичной несколько дней до развития значимого регенераторного ответа красного костного мозга, обнаруживаемого в периферической крови. Однако, при постоянной нерегенераторной анемии клиницист должен искать другие причины анемии, такие как ВЛК и ВИК инфекции.
Исследование методом ПЦР полезно при тестировании клинически здоровых кошек-доноров или при введении их в колонии, свободные от патогена. В Американском Колледже Ветерианрной Интернальной Медицины было рекомендовано скринингово исследовать всех доноров на гемобартонеллез. Хотя и не указано, исследование проводится методом ПЦР, как более чувствительным, чем микроскопия. Кошки в приютах, гуляющие кошки или после контакта с блохами, исследованные перед донорством методом ПЦР, имели более высокую распространенность инфекции. Оказалась возможна передача гемобартонеллеза кошкам с помощью инфицированной крови, хранившейся в растворе CPDA-1 антикоагулянта, спустя 1 час после хранения, а крови, инфицированной Candidatus M. haemominutum, может передавать инфекцию спустя 1 неделю. ПЦР исследования также оказались полезными в эпидемиологических исследованиях по разнообразию и распространенности инфекции в популяциях кошек.
Табл. 1. Цитологические неточности в обнаружении гемотропных микоплазм кошек.
| Причины | Представление | Исправление |
| Ложноположительные | ||
| Преципитаты краски | над фокальной плоскостью, больше и более глубокое окрашивание, разный размер | используйте свеже-фильтрованные краски |
| Артефакты сушки | неровные края, не изменяются при фокусировке | делайте тонкие мазки, сушите быстро |
| Тельца Хауэлла-Жолли | больший размер (1-2 μm), ремнанты ядер | нет |
| Сидеротические включения | хорошо фокусируются, гранулы, окрашенные синим | Положительно при окрашивании Прусской синей краской |
| Ложноотрицательные | ||
| Временная паразитемия | отсутствие м/о несмотря на регенераторную анемию | ПЦР исследование |
| Избыток или длительная экспозиция ЭДТА | отсутствие м/о несмотря на регенераторную анемию | Новый свежий образец, гепарин или без антикоагулянта |
Обнаружение возбудителя гемобартенеллеза у собак
Mycoplasma haemocanis может быть обнаружен в крови собак с клинически значимым гемотропным микоплазмозом, однако м/о может быть мало и их трудно найти. Как и у кошек, клиницист должен дифференцировать микроорганизмы и артефакты окрашивания, базофильной зернистости, телец Хауэлла-Жолли. Наиболее полезный критерий – тенденция M. haemocanis к образованию цепей из микроорганизмов поперек поверхности эритроцитов. Размером около 0,3μm Candidatus M. haematoparvum, эти микроорганизмы могут быть легко пропущены. Они обычно обнаруживаются в числе 3-4 кокков на один эритроцит или в парах, но кольцевидных форм и цепей не было описано. Мазки крови должны исследоваться тщательно, если анемия развивается или становится более серьезной у собаки после спленэктомии.
Разработана ПЦР для обнаружения M. haemocanis. Эти исследования достаточно чувствительны для обнаружения и субклинической инфекции при гемобартонеллезе. Количественные ПЦР методы также разработаны для M. haemocanis и Candidatus M. haematoparvum.
Патологоанатомические изменения гемобартонеллеза у животных
Данные патологоанатомического исследования кошек при гемобартонеллезе включают бледность тканей во всех случаях, истощение примерно в 75% случаев, небольшую или значимую спленомегалию у 50%, и умеренную или серьезную желтушность у некоторых кошек.
Гистологические изменения варьируют и включают эритроидную и иногда миелоидную гиперплазию в ККМ и пассивную перегрузку, экстрамедуллярный гематопоэз, фолликулярную гиперплазию, эритрофагоцитоз и повышение гемосидерина в селезенке. В некоторых случаях наблюдается жировая дистрофия и центродолевой некроз печени.
Данных о патологоанатомических изменениях при гемобартонеллезе у собак мало. Кровь кажется более разбавленной, а ткани бледными. ККМ красный и желеобразный. Может присутствовать гиперплазия мононуклеарной фагоцитарной системы.
Лечение кошек при гемобартонеллезе
Антимикробная терапия гемобартонеллеза снижает или элиминирует обнаруживаемую паразитемию, но полностью не избавляет животное от микроорганизма. Несмотря на то, что доксициклин, энрофлоксацин, марбофлоксацин снижают клинические признаки и количество м/о у инфицированных кошек, эти антибиотики не полностью избавляют от гемоплазм.
Лечение инфекции Mycoplasma haemofelis фторхинолоном прадофлоксацином может обеспечить более эффективное длительное избавление от инфекции, чем доксициклин. Доксициклин (10 мг/кг перорально, каждый день) или тетрациклин/окситетрациклин нужно давать 3 недели (Табл. 2). К сожалению, тетрациклиновые антибиотики могут вызывать лихорадку, заболевания ЖКТ (например, стриктуру пищевода) у кошек. Предварительные данные указывают, что энрофлоксацин (5 мг/кг, перорально, 1 раз в день) в течение 2 недель может быть эффективной альтернативой для кошек, которые не переносят тетрациклины. Более высокие дозы энрофлоксацина не рекомендованы из-за риска дистрофии сетчатки и слепоты. Использование марбофлоксацина (2 мг/кг, перорально, ежедневно) также оказалось эффективным для лечения M. haemofelis, но гораздо менее эффективен относительно Candidatus Mycoplasma haemominutum. Азитромицин или имидокарб дипропионат неэффективны в лечение гемотропных микоплазм кошек.
Хлорамфеникол, рекомендованный ранее для лечения M. haemofelis, не должен использоваться с этой целью, потому как вызывает дозо-зависимую эритроидную гипоплазию в ККМ кошек. О лечении Candidatus Mycoplasma turicensis нет или очень мало данных.
Глюкокортикоиды, такие как преднизолон (1-2 мг/кг, перорально каждые 12 часов), могут быть назначены животным с серьезной анемией, чтобы снизить эритрофагоцитоз. Доза ГКС должна быть снижена постепенно, когда гематокрит повышается. Гемотрансфузия необходима, когда анемия является жизнеугрожающей, Внутривенное введение растворов с глюкозой рекомендовано для кошек при смерти.
С лечением или без, когда животные выздоравливают от инфекции M. haemofelis, они обычно остаются носителями, и рецидив с клиническими признаками возникает редко, когда гематокрит возвращается к норме. После иммуносупресии ГКС, м/о по-прежнему могут быть обнаружены ПЦР.
Лечение собак, больных гемобартонеллезом
Экспериментальные исследования с лечением собачьего гемотропного микоплазмоза ограничены. Количественная ПЦР использовалась для мониторинга лечения спленэктомированной собаки. ДНК копии оставались в большом количестве несмотря на лечение, со снижением спустя 11 месяцев терапии в совокупности с клиническим и гематологическим улучшением. Организм никогда не исчезал из циркуляции во время лечения. Гемотрансфузия необходима, когда анемия является жизнеугрожающей. Есть сообщение об эффективном лечении инфекции M. haemocanis лечение пероральными формами тетрациклинами (Табл. 2). Собаки, выздоровевшие после гемотропного микоплазмоза, возможно, имеют латентную инфекцию. Данных о лечении Candidatus Mycoplasma haematoparvum нет.
Табл. 2. Дозы препаратов для лечения гемотропного микоплазмоза собак и кошек
| Название | Вид | Доза (мг/кг) | Метод введения | Интервал (часы) |
| Тетрациклин (или Окситетрациклин) | Собака | 20 (7,5-10) | п/о, в/в | 8 (12) |
| Доксициклин | Собака | 10 | п/о | 24 |
| Доксициклин | Кошка | 5 | п/о | 12 |
| Энрофлоксацин | Кошка | 5-10 * | п/о | 24 |
| Прадофлоксацин | Кошка | 5 | п/о | 24 |
| Марбофлоксацин | Кошка | 2,75 | п/о | 24 |
| Преднизолон | Собака, кошка | 1-2 ** | п/о | 12 |
* - дозы более 5 мг/кг могут быть ретинотоксичны у кошек, должны использоваться с осторожностью или с другими препаратами. У собак могут быть использованы те же дозы, согласно данным, основанным на одном случае.
** - назначение глюкокортикоидов необязательно. Кошки при экспериментальной инфекции отвечали на лечение тетрациклинами в монорежиме.
Профилактика гемобартонеллеза у кошек и собак
Профилактика в отношении кровососущих артропод собак и кошек рекомендована, так как они могут переносить инфекционные заболевания, включая гемотропный микоплазмоз. Ятрогенная передача инфекции Mycoplasma haemocanis у собак обычно возможна только, если реципиент был спленэктомирован. Ятрогенная передача инфекции может быть профилактирована исследованием ПЦР крови доноров кошек и собак.
Вопросы здравоохранения и гемобартонеллез человека
Гемотропные микроорганизмы, похожие на собачьи и кошачьи, были обнаружены при цитологическом исследовании крови людей с ослабленным иммунитетом. Однако, до появления молекулярно-генетических методов, эти инфекции с некультивируемыми м/о не были подтверждены.Наверх
Полезно знать
Бартенелез у кошек и человека (этиология, патогенез, диагностика, симптомы и признаки, анализы, лечениеи и профилактика). Болезнь кошачьей царапины. Как не допустить заражения?
Что такое бартонеллез кошек?
- Бартонеллез - это инфекционное бактериальное заболевание кошек , вызываемое грамотрицательными бактериями Bartonella henselae. Заболевание также широко известно как болезнь кошачьей царапины или "лихорадка кошачьей царапины".
- Бартонеллез у кошек - это зоонозная болезнь, означающая, что она может передаваться между животными и людьми.
- У кошек заболевание обычно передается при контакте с блохами.
- Бактерия выделяется через блох и через ее экскременты, которые она оставляет на коже кошки.
- Кошка, ухаживая за собой, заражается штаммами Bartonella. Люди не заражаются этой инфекцией от блох. Важно отметить, что эта бактериальная инфекция также может передаваться людям и кошкам клещами.
Хотя кошки, как правило, не страдают от бартонеллезной инфекции, помимо возможной лихорадки, опухания лимфоузлов и мышечной боли, болезнь кошачьей царапины может передаваться человеку, когда зараженная кошка царапает или кусает человека. Слюна также может быть источником для передачи инфекции, например, когда зараженная кошка облизывает кожу человека или имеет открытую рану.
Хотя инфекция, вызванная бактериями Bartonella, обычно легкая у людей, по оценкам ежегодно у 12 000 человек диагностируется заболевание кошачьей царапиной, а около 500 госпитализируются. Многие из инфицированных - дети, так как дети, скорее всего, играют с котятами, которых, в свою очередь, чаще всего царапают и кусают кошки.
Симптомы могут проявиться в течение 7-14 дней после травмы, но могут длиться до восьми недель. Типичными симптомами являются отек ближайших к укушенному или поцарапанному участку лимфатических узлов, лихорадка, головная боль и общее недомогание. Как правило, симптомы бартонеллеза непродолжительны, в больщинстве случаев они исчезнут сами по себе, обычно без медицинского лечения. Некоторым пациентам требуется курс антибиотиков.
К счастью, болезнь кошачья царапина не смертельна для людей, но все же представляет большой риск для пациентов с ослабленным иммунитетом, например вирусом СПИДа, или те, кто проходит химиотерапию. Хотя многим владельцам кошек не нужно заботиться о том, являются ли их кошки носителями бартонелл, тем, кто должен охранять свое здоровье, рекомендуется проверять и лечить своих кошек, а также проявлять особую бдительность в отношении блох.
Симптомы и типы бартонеллеза у кошек и человека
Большинство больных людей моложе 21 года. У людей могут наблюдаться следующие симптомы бартонеллеза:
- Красноватое небольшое твердое округлое выступание или папула в месте царапины или укуса
- Отек и проявление инфекции на месте
- Отек лимфатических узлов, ближайших к месту царапины или укуса
- Слабая лихорадка
- Озноб
- Усталость
- Общее недомогание
- Отсутствие аппетита
- Мышечная боль (миалгия)
- Тошнота или спазмы в животе
Симптомы бартонеллеза у кошек включают в себя:
- Заражение блохами и / или клещами
- В большинстве случаев клинических симптомов не наблюдается
- Лихорадка, опухшие лимфоузлы
- У некоторых кошек наблюдается летаргия, отсутствие аппетита и репродуктивные трудности
Причины (этиология)
- Bartonella henselae - это возбудитель бактериальной инфекции
- Передается человеку через царапину или укус кошки
- Передается кошкам через укусы блох и клещей
Диагностика
У больных бартонеллезом людей обычно бывает история того, что кошка поцарапала или даже слегка укусила. У многих пациентов на месте царапины или укуса наблюдается характерная небольшая красноватая округлая шишка. Для выделения и идентификации бактерии-возбудителя может потребоваться более конкретное тестирование. Поскольку это заболевание не вызывает каких-либо симптомов у кошек, в большинстве случаев не требуется диагностическое обследование. В тяжелых случаях ваш ветеринар возьмет образцы крови у вашей кошки для дальнейшего тестирования. Полный профиль ОКА крови, биохимические показатели и общий анализ мочи часто не показывают никаких отклонений у кошек при бартонеллезе.
Дальнейшее тестирование будет включать более конкретные тесты для подтверждения болезни кошачьей царапины. Выращивание или культивирование возбудителя из образца крови остается наиболее надежным методом диагностики. Полимеразная цепная реакция (ПЦР) - более продвинутый тест для обнаружения бактериальной ДНК, который может быть сделан путем взятия образца ткани из пораженного участка. Тем не менее, эти тесты не всегда подтверждают, что бартонеллез является причиной заболевания, поскольку бактерии не постоянно циркулируют через кровоток. Возможно, потребуется провести несколько тестов, чтобы убедиться в наличии Bartonella henselae.
Наконец, иммуноферментный анализ (ИФА) может использоваться для проверки вашей кошки на иммунный ответ на бактерию Bartonella henselae, но наличие антител не обязательно означает, что кошка в настоящее время инфицирована, только то, что она переносила инфекцию когда-либо.
Лечение бартонеллеза
У людей участок раны тщательно очищается и пациентам рекомендуется временно избегать контакта с молодыми кошками. В случаях с опухшими или болезненными лимфатическими узлами, лимфатические узлы могут быть аспирированы для удаления гноя или экссудата. Рекомендуется постельный режим для предотвращения дальнейшего обострения симптомов, а в тяжелых случаях - антимикробная терапия.
Большинство случаев разрешаются в течение нескольких недель, а в некоторых случаях незначительные симптомы могут сохраняться в течение нескольких месяцев. В общем, кошки не нуждаются в терапии бартонеллеза.
Профилактика бартонеллеза у кошек и людей
Пациенты с ослабленным иммунитетом (например, люди со СПИДом, пациенты, проходящие химиотерапию) имеют более высокий риск развития более серьезных симптомов лихорадки кошачьей царапиной. В таких случаях предлагается, чтобы эти владельцы кошек проверяли своих кошек на наличие бактерий. Для людей с ослабленным иммунитетом, которые находятся в процессе принятия кошки в семью, предлагается проверить кошку до того, как ее привезут в дом, в том числе, что кошка свободна от блох.
Точный риск передачи этого заболевания от кошек человеку неизвестен; однако, если вас поцарапала или укусила кошка, немедленно проведите обработку раны и кожи. При появлении таких симптомов, как усталость, головная боль, опухшие лимфатические узлы, обратитесь к врачу за надлежащей консультацией.
Общий прогноз этого заболевания у кошек сильно варьируется в зависимости от клинической картины бартонеллеза. Вы должны контролировать свою кошку на предмет повторения клинических признаков во время лечения и позвонить ветеринару, если вы видите какие-либо нежелательные симптомы у вашей кошки, такие как опухшие лимфоузлы или лихорадка.Наверх
Полезно знать
- Чума кошек (этиология, диагностика, лечение, профилактика, вакцинация, эпизоотология). Как не заразить своего питомца кошачьей чумкой?
- Панлейкопения кошек (этиология, эпизоотология, меры борьбы и профилактики, методы диагностики и терапии, дезинфекция, вакцинация). Что делать после переболевания панлейкопенией?
- Вирусный Лейкоз Кошек (Этиология, Симптомы, Диагностика, Лечение, Профилактика, Вакцина, Тесты при Лейкозе у Кошек)
- Лептоспироз у кошек (распространение, эпизоотология, этиология, патогенез, признаки симтпомы, диагностика, лечение и профилактика). Вакцинация при лептоспирозе кошек
- Вирусный лейкоз у котов (симптомы и лечение). Как помочь коту при лейкозе?
- Гемобартонеллез у кошек и собак (эпизоотология, этиология, патогенез, диагностика и лечение). Биологические свойства Гемотропных Микоплазм у кошек (Mycoplasma Haemofelis, Mycoplasma turicensis). Меры борьбы и профилактики при гемобартонеллезе у кошек
- Боррелиоз у животных и человека (этиология, диагностика, распространение, причины, терапия, признаки и симптомы, профилактика). Болезнь, вызываемая боррелиями у собак и кошек. Болезнь Лайма у собак, других животных и человека
- ВЛК у кошек (эпизоотология, распространение, этиология, патогенез, диагностика, дифференциальная диагностика и лечение) FeLV для кошек (причины, вакцинация, профилактика и терапия)
- Вирусная лейкемия кошек (этиология, патогенез, эпизоотология, диагностика, терапия, профилактика). Что делать, если моя кошка заболела вирусом лейкемии
Гемобартонеллез — инфекционная анемия кошек
Паразитарная инфекция эритроцитов способна вызывать гемолитическую анемию. У кошек существует несколько ее форм. Все они объединены под общим названием ИАК – инфекционная анемия кошек. Гемобартонеллез кошек – наиболее загадочная из инфекционных анемий.
Так выглядит гемобартонелла на эритроците под микроскопом
Описание болезни
Это заболевание впервые было выявлено в Южной Африке. Возбудитель – Haemobartonella felis. В Европе и России общий уровень данной патологии невысок, но диагностика в ряде случаев представляет затруднения.
Этиология
Гемобартонеллы долгое время относили к риккетсиям, однако, недавние исследования показали их близость к микоплазмам.
Микроорганизмы хорошо окрашиваются по Романовскому-Гимзе. Под электронным микроскопом видны коккоподобные и палочковидные бактерии, паразитирующие на мембране эритроцитов.
Гемобартонеллы, окрашенные в синий цвет, на поверхности эритроцитов
Размножаются простым делением и почкованием, тем не менее точный характер размножения не выяснен, поскольку невозможно культивировать бактерии вне живого организма.
Патогенез
При экспериментальном заражении кошек гемобартонеллезом латентный период, до выявления микроорганизмов, составляет от 2 до 20 дней. Местонахождение паразитов в это время неизвестно. В дальнейшем паразитемия – появление гемобартонелл в крови – быстро нарастает, чередуясь с периодами их полного исчезновения.
Паразитирующие микроорганизмы повреждают поверхность мембран эритроцитов без проникновения внутрь. При этом нарушается липидный состав мембраны, сокращается вдвое продолжительность жизни эритроцитов, повышается их способность к разрушению. Все это приводит к преждевременному внутрисосудистому гемолизу и гемолитической анемии.
Макрофаги селезенки способны удалять паразита вместе с поврежденным эритроцитом, но до сих пор не выяснено, что происходит с бактериями после фагоцитоза.
Это интересно! Паразитирующие микроорганизмы наблюдали в фагоцитных вакуолях. Возможно даже, что они способны к выживанию и размножению в фагоцитах, чем и объясняются множественные рецидивы.
У инфицированных кошек вырабатываются антитела против гемобартонелл, но наряду с ними появляются и аутоиммунные антитела, разрушающие неповрежденные эритроциты.
Эпизоотология
Возбудитель поражает чаще молодых животных, в возрасте от 1 до 3 лет. Сезонные колебания отсутствуют.
Точный путь передачи заболевания неизвестен. Кровососущие эктопаразиты, раны и покусы, полученные в драках, по-видимому, участвуют в передаче микроорганизмов, но экспериментальных доказательств этому нет. Возможно заражение здоровых кошек после инъекции им инфицированной крови. Имеются свидетельства внутриутробного заражения котят.
Внимание! В питомниках наблюдаются спорадические вспышки эпизоотий гемобартонеллеза.
Неизвестно, являются ли животные-носители источником заражения или передача гемобартонелл возможна только в активной фазе болезни. Но доказано, что все кошки, перенесшие острую фазу, становятся носителями.
Также не выяснено защищают ли появившиеся антитела от повторной инфекции и как они влияют на течение болезни.
«Вопрос – Ответ: Заразен ли гемобартонеллез кошек для людей? – Нет. До сих пор не зафиксировано ни одного случая заболевания человека гемобартонеллезом кошек».
Клинические признаки
Гемобартонеллез кошек может протекать без выраженных симптомов. Клинические признаки проявляются в присутствии интеркуррентной (случайно присоединившейся) инфекции и не являются специфическими. Течение заболевания бывает острым, подострым и хроническим.
Слева – бледные анемичные слизистые, справа – нормальные
Интенсивность основных признаков зависит от патогенности штамма и состояния иммунной системы.
Хроническое проявление болезни:
- бледность и желтушность слизистых оболочек,
- вялость,
- анорексия,
- слабо наполненный пульс,
- тахикардия,
- тахипноэ – поверхностное учащенное дыхание,
- гипертермия – редко, не более 5% случаев,
- увеличение лимфатических узлов,
- спленомегалия – патологическое увеличение селезенки,
- волнообразные циклы гемолиза – разрушения эритроцитов,
- низкий уровень гемоглобина,
- снижение гематокрита – количества красных кровяных клеток в крови.
Подострое течение имеет сходные признаки, при этом быстро прогрессирует. На фото выше показана прогрессирующая анемия у кошки при гемобартонеллезе.
Острая форма – самая редкая из клинически наблюдаемых. Сопровождается гемолитическим кризом – массивным гемолизом эритроцитов. Часты одышка, резкая сердечно-сосудистая недостаточность, потеря сознания. Возможен летальный исход через несколько часов после появления симптомов криза.
Диагностика
Диагностика гемобартонеллеза кошек зависит от лабораторных исследований.
Гематологическое исследование
Гематологическое исследование выявляет анемию. В серьезных случаях наблюдаются:
- Анизоцитоз – изменение размеров эритроцитов. В крови уменьшается количественное соотношение нормальных эритроцитов и увеличивается – микроцитов и макроцитов.
- Пойкилоцитоз – изменение формы эритроцитов. Уменьшается содержание нормальных двояковогнутых эритроцитов и увеличивается других форм: сфероциты, эллиптоциты и др.
- Полихромазия – наличие в крови большого количества эритроцитов, способных окрашиваться как кислыми, так и основными красителями.
- Ретикулоцитоз – увеличение в крови незрелых эритроцитов (ретикулоцитов).
- Билирубинемия – повышение желчного пигмента билирубина.
Техника приготовления мазка крови
Главный критерий диагностики – обнаружение паразитирующего микроорганизма – затруднен. Паразитемия циклична и скоротечна, может длиться от одного часа до нескольких дней. Зачастую возникает перед гемолитическим эпизодом, при котором происходит удаление бактерий.
Необходимо неоднократное исследование мазков крови с суточным интервалом в течение нескольких дней. Причем исследовать мазки надо сразу после их подготовки, поскольку при добавлении антикоагулянтов микроорганизмы могут отделиться от эритроцитов.
При окраске мазка по Романовскому-Гимзе в растворе быстро образуется осадок, частицы которого иногда невозможно отличить от микроорганизмов.
Более точным является иммунофлуоресцентный анализ, но он доступен не всем лабораториям.
Это важно! Наличие в крови гемобартонелл подтверждает диагноз, но их отсутствие не отрицает его.
Полимеразная цепная реакция
Чувствительный и специфичный метод исследования – ПЦР – полимеразная цепная реакция. Это метод молекулярной биологии, позволяющий выявлять фрагменты ДНК при ничтожно малом их количестве.
Это интересно! Исследования, проведенные методом ПЦР, показали, что почти 20% клинически здоровых кошек являются носителями инфекции.
Фрагмент ДНК бактерии
Лечение
Лечение гемобартонеллеза кошек подразделяется на специфическое и симптоматическое.
Специфическая терапия
Специфическая терапия направлена на уничтожение и удаление из организма паразитирующей бактерии. Хорошо зарекомендовали себя антибиотики тетрациклинового ряда. Препаратами выбора являются Окситетрациклин или Доксициклин. Антибиотикотерапия длится не меньше 14 дней, затем необходимо исследование мазка крови на присутствие гемобартонелл.
Симптоматическая терапия
Симптоматическая терапия призвана устранять симптомы заболевания.
Основные методы:
- Инфузионная терапия. Однако следует учитывать, что введение в кровеносное русло большого количества физиологического раствора значительно снижает концентрацию эритроцитов и гемоглобина в крови (гемодилюция).
- Гемотрансфузия – переливание крови. Необходима при падении общего гематокрита ниже 15%. Это важно! При переливании крови необходимо провести анализ на совместимость.
- Высокобелковая диета важна как для лечения, так и для профилактики гемобартонеллеза кошек.
- Гормонотерапия – введение иммуносупрессивных доз глюкокортикоидов применяется с целью подавления развития аутоиммунных антител.
- При ускоренном гемолизе значительно повышается содержание сывороточного железа в крови. Для снижения его уровня применяют Десферал.
Предупреждение! При любой гемолитической анемии противопоказаны железосодержащие препараты, повышающие уровень гемоглобина в крови – Феррум-лек, Гемофер, Тардиферрон и другие.
Прогноз
При экспериментальном заражении гемобартонеллезом все выздоровевшие кошки остались носителями инфекции. Носительство сохраняется многие месяцы и интеркуррентные заболевания могут вызывать неоднократные рецидивы анемии. Любой из них может оказаться смертельным.
Патологоанатомические изменения
После смерти кошки от гемобартонеллеза на вскрытии обнаруживаются следующие патологоанатомические изменения:
- Кожа и слизистые оболочки: генерализованная бледность, желтушность (иногда), множественные кровоизлияния.
- Костный мозг: гиперплазия – массивное разрастание кроветворной ткани в клетчатке, структурная однородность.
- Лимфатические узлы: гиперплазия и увеличение от легкого до умеренного.
- Селезенка: значительное увеличение, утолщение капсулы, фиброзные спайки с окружающими тканями.
- Печень: увеличение, жировая дистрофия, некроз центральной доли, связанный с кислородной недостаточностью.
- Сердечно-сосудистая система: множественные тромбозы, дистрофия миокарда.
- Гемосидероз различных органов и тканей – отложения гемосидерина, образующегося при распаде гемоглобина и денатурации ферритина (белка, отвечающего за хранение железа в организме).
Профилактика
В профилактике гемобартонеллеза большую роль играет своевременная обработка кошек от кровососущих эктопаразитов – блох и клещей.
Совершенно не допустимым является контакт домашних кошек с бродячими.
Однозначно необходимы полноценное кормление и соблюдение гигиенических норм содержания.
Замечательную лекцию о диагностике гемолитической анемии читает Светлана Шишканова – заведующая ветеринарной лабораторией «Поиск» в Санкт-Петербурге:
лечение инфекционной анемии у котят, симптомы
Гемобартонеллез у кошек – это тяжело протекающее инфекционное заболевание, в ряде случаев сопровождающееся гибелью животных. Что собой представляет эта болезнь и как можно помочь инфицированному питомцу?
Причины развития патологии
Гемобартонеллез – патология, развивающаяся вследствие инфицирования кошки риккетсией Haemobartonella felis (гемобартонеллой), обитающей на мембране эритроцитов и приводящей к расстройствам процесса кроветворения в организме.
Болезнь передается:
- при укусах насекомых, питающихся кровью – блох, клещей;
- при повреждении кожных покровов и слизистых оболочек грызунами, являющимися носителями заболевания – крысами и мышами;
- при прямом переливании крови инфицированного животного;
- внутриутробно – от больной кошки котятам.
Попав в кошачий организм, микроорганизм временно «засыпает», активизируясь при резком снижении иммунитета на фоне вакцинаций, инфекционных заболеваний, беременности, операций, стрессов.
Наиболее подвержены инфекции молодые животные, котофеи с иммунодефицитом и котята.
К сведению. Гемобартонеллез кошек встречается только у представителей кошачьих и не представляет опасности ни для других животных, ни для людей.
Симптомы заболевания
Попав в кошачий организм, Haemobartonella felis прикрепляются к мембранам эритроцитов и разрушают их, вследствие чего продолжительность жизни клеток значительно сокращается и – у кошки развивается анемия. Больше всего в этом случае страдают структурные составляющие печение, селезенки, костного мозга и лимфоузлов.
У больных кошек могут наблюдаться:
- учащение сердцебиения и дыхания;
- сухость и шелушение кожи, потеря ее эластичности;
- взъерошенность и потускнение шерсти, облысение;
- побледнение и пожелтение слизистых оболочек;
- окрашивание мочи в темный цвет;
- снижение двигательной активности;
- отказ от пищи;
- искажение вкусовых восприятий – питомец может есть песок, мел, грязь и т.д.
- увеличение лимфатических узлов;
- осиплость голоса;
- похудение.
К сведению. Клинические признаки болезни наблюдаются лишь у 30% больных кошек. Остальные животные становятся носителями заболевания.
В крови у заболевших животных выявляют:
- изменение размеров и формы эритроцитов;
- увеличение количества незрелых кровяных клеток;
- рост уровня билирубина;
- эритроциты, окрашивающиеся как основными, так и кислыми красителями (полихромазию).
Постановка диагноза производится ветеринарным врачом на основании осмотра и результатов анализов животного.
Лечение взрослых животных
Лечение гемобартонеллеза кошек включает в себя как борьбу с возбудителем заболевания, так и снятие сопутствующей болезни симптоматики.
Животным назначают:
- тетрациклины – Тетрациклин, Окситетрациклин, Доксициклин;
- Байтрил;
- препараты железа;
- витамины;
- успокоительные средства;
- капельницы, действие которых направлено на устранение обезвоживания;
- Преднизолон для купирования явлений анемии;
- гепатопротекторы для поддержания печени;
- переливание крови.
Продолжительность лечения составляет 2-4 недели. После выздоровления кошки, как правило, становятся носителями заболевания. Случаи рецидивов при этом редки.
Внимание! Без адекватного лечения кошки с гемобартонеллезом погибают в 30% случаев.
Лечение котят
Лечение инфекционной анемии у котят проходит так же, как и у взрослых животных. Дозировка препаратов подбирается в соответствии с весом животного.
Профилактика заболевания
Вакцин, позволяющих предотвратить инфицирование гемобартонеллезом, не существует.
Для того, чтобы свести к минимуму риски заражения, владельцу следует:
- ограничить контакты питомца c уличными животными;
- использовать средства, защищающие от блох и клещей;
- обеспечить правильное питание и достаточную двигательную активность – это позволит укрепить иммунитет и предупредить развитие инфекции;
- своевременно посещать ветеринара и вакцинировать питомца.
При малейшем подозрении на гемобартонеллез, животное следует немедленно показать ветеринарному врачу. Самолечение в данном случае не допустимо.
А вы когда-нибудь сталкивались с этим заболеванием? Как вы лечили своего питомца? Поделитесь своим положительным или отрицательным опытом с нашими читателями.
Гемобартонеллез кошек: симптомы, лечение, профилактика
Гемобартонеллез у кошек относится к опасным для жизни питомца инфекционным заболеваниям. Провоцирует его появление специфический вид риккетсий, которые ветеринары называют бартонеллами. Они приводят к тяжелым дисфункциям системы обмена веществ животного и нехватке кислорода в крови. При этом кот стремительно теряет вес, а его внутренние органы патологически изменяются.
Коварство инфекции проявляется в том, что достаточно долго кот может быть заражен гемобартонеллёзом, выступая переносчиком недуга, однако болезнь никак не будет проявляться на носителе. По статистическим данным только у 30% представителей семейства кошачьих, патология протекает с ярко выраженными клиническими симптомами. В статье пойдет речь о причинах и симптомах заболевания, методах его лечения, а также о том, опасен ли гемобартонеллез кошек для людей.
Содержание статьи
Механизм развития и пути инфицирования
Специалисты сходятся во мнении, что бартонелла занимает промежуточное положение между риккетсиями и бактериями. Она являет собой микроскопического внутриклеточного паразита, предпочитающего селится на эритроцитах. При попадании в кровь животного бартонелла крепится к красным кровяным тельцам и тут же начинает активно размножаться. Это провоцирует разрушение эритроцитов, недостаток которых в крови вызывает у питомца анемию. Следует понимать, что в отдельных случаях течение патологии проходит бессимптомно, так как выработка красных кровяных телец может превышать их разрушение.
Гемобартонеллез кошек может переходить из скрытой стадии в активную форму, под действием таких причин, как:
- значительные нарушения в работе иммунной системы питомца, авитаминоз;
- появление в теле кошки «фоновых» инфекций или болезней, вызванных деятельностью паразитов;
- онкологические заболевания;
- беременность;
- стерилизация или кастрация инфицированного питомца;
- процесс родов.
Каждая из вышеперечисленных причин способна привести к тому, что гемобартонеллез будет осложнен и начнет выражаться в более тяжелой форме.
Существует множество путей для попадания инфекции в кровь. Это может произойти из-за укуса или царапины зараженного соплеменника. Именно поэтому в особую зону риска попадают самцы, так как они по своей природе более драчливы. Еще одна из распространенных причин — укусы кровососущих паразитов, в частности блох и клещей.
Не менее редко гемобартонеллез кошек передается по наследству от родителей к котятам. Однако врачи затрудняются дать точные ответ на то, каким именно путем: то ли с молоком матери, то ли через плаценту, то ли во время прохождения плода по половым путям. Статистические данные показали, что чаще других недугом страдают молодые особи, не достигшие возраста в 2,5-3 года.
Симптоматика заболевания
Владельцам важно понимать, что симптомы гемобартонеллеза кошек проявляются далеко не сразу. Недуг имеет инкубационный период, занимающий около 10-14 дней. Хозяин может заметить, что кошка стала быстро уставать, много лежать и мало двигаться, теряя аппетит даже к своим любимым лакомствам. При этом дифференцировать именно эту инфекцию от других заболеваний поможет то, что кот начинает учащенно дышать, а его пульс значительно повышается.
Если ко всем этому прибавляется еще и замеченные пару недель назад укусы блох или вытащенный после прогулки клещ, то хозяин может быть уверен, что его животное инфицировано бартонеллами. К характерным признакам следует относить:
- апатичность питомца;
- полный или частичный отказ от приема пищи;
- тахикардия;
- цвет мочи становится более темным;
- повреждения кожного покрова;
- частота дыхания повышена.
Помните, гемобартонеллез может не выдавать себя яркими симптомами, но это вовсе не значит, что он не ведет внутри организма кошки свою разрушительную работу. В связи с этим ветеринары советуют хозяевам быть внимательными к малейшим отклонениям в поведении и привычках усатого любимца. Именно от оперативности владельцев и быстрой диагностики зависит то, насколько будет эффективным и быстрым лечение.
Способы диагностики
Ветеринары категорически не рекомендуют владельцам кошек, которые заподозрили у своих питомцев гемобартонеллез, пытаться лечить их самостоятельно в домашних условиях. Это может привести к расширению патологических процессов и отягощению симптоматических проявлений. Поэтому кота нужно везти в ветеринарную лечебницу, для полного обследования и проведения диагностических процедур.
В первую очередь у кошки врач возьмет кровь, из которой в лаборатории сделают мазок. Благодаря этой мере можно будет определить наличие в крови инфекционного агента и клиническую картину, характерную для анемии. Бартонеллу сложно определить с первого раза, поэтому специалисту может понадобиться до 10-12 мазков, взятых в разные этапы развития патологического процесса, сравнение которых поможет уточнить диагноз. В запущенных случаях обоснованным будет применение исследования с помощью УЗИ, которое может показать значительное увеличение печени и селезенки, а также наличие внутренних кровотечений.
Сложность дифференциации гемобартонеллеза связана с тем, что у инфекции достаточно долгий латентный период, когда она никак себя не проявляет. Помимо этого, анемия может вызывать общее ослабление организма кота и некоторые сопутствующие этому заболевания, что дополнительно затрудняет окончательное заключения ветеринара.
Лечение болезни
Лечебное воздействие при инфекционной анемии может назначать только квалифицированный специалист. В противном случае, самостоятельное лечение в домашних условиях может привести к тому, что симптомы и общая клиническая картина патологии смажется, что приведет к неточному диагнозу уже в ветлечебнице. А это дополнительный риск для жизни питомца.
Терапия гемобартонеллеза проводится комплексно, включая применение как антибиотических, так и симптоматических препаратов. Бартонеллы отличаются уязвимостью к тетрациклинам и фторхинолонам. Статистические исследования показали, что хорошие и стабильные результаты дает Доксициклин. В случае значительного снижения уровня гематокрита применяется переливания крови от здоровой и привитой особи.
Если болезнь была выявлена на ранних этапах, то врач может ограничить применение препаратов курсом глюкокортикоидов (например, Преднизолон). В зависимости от постепенного затухания симптомов дозировка препарата должна постоянно корректироваться. В случае обезвоживания организма кошки ветеринар назначает курс витаминов и аминокислот, что вводятся в виде инъекций, а также инфузионную терапию солевыми растворами.
Признаки сильных расстройств ЖКТ устраняются с помощью адсорбентов, антацидов, спазмолитиков и противорвотных средств. Чтобы повысить насыщаемость тканей и органов кота кислородом в совокупности с ускорением снятия последствий интоксикации, допустимо применение Мексидола, хорошо зарекомендовавшего себя антиоксиданта.
Кошке, при наличии тяжелой формы анемии, показана специальная диета из разработанных для подобных целей кормов. Их особенность в том, что содержащиеся в составе компоненты значительно облегчают процесс полного переваривания и усвоения еды. Помимо этого, хвостатому любимцу требуется спокойная атмосфера и постоянная забота со стороны хозяина. Кстати, многих владельцев интересует вопрос — может ли заразиться инфекционной анемией человек? Об этом мы расскажем в следующем разделе.
Опасность для людей
Гемобартонеллез относится к инфекционным недугам, поэтому вполне закономерно узнать, заразен ли он для людей или других домашних животных? Ветеринары убеждены, что бартонелла не относится к зооантропонозам, а значит, человеку они никаким образом не угрожают.
Помимо этого, они безвредны и для собак. У них есть свой недуг с похожим названием, но провоцируется он другим видом инфекционных агентов. Так что гемобартонеллез представляет опасность исключительно для представителей семейства кошачьих.
Меры профилактики
При должной внимательности хозяина к своему питомцу риск появления у него анемии можно полностью предотвратить. Для этого необходимо постараться исключить контакт любимца с возможными носителями инфекции. Специалисты выделили ряд рекомендаций, способных обезопасить кошку от данной болезни. Сюда относятся:
- содержание кошки в домашних условиях;
- заводчикам, которые занимаются разведением породистых котят, нужно тщательно убедиться в том, что выбранный для питомца партнер полностью здоров;
- усиление иммунной системы животного с помощью правильного, сбалансированного рациона и достаточной двигательной активности;
- устранение всяческих путей заражения кошки кровососущими паразитами, благодаря ошейникам, каплям и инъекциям, направленным против блох и клещей;
- при выгуле надевать на кота шлейку или поводок, особенно если местные любители котов упоминали о том, что их питомцы были в недавнем времени заражены гемобартонеллезом.
Напоследок хочется сказать, что инфекционная анемия — это серьезный и грозный недуг, в запущенных формах способный привести к гибели питомца. Поэтому хозяева должны тщательно исследовать кожные покровы кошки на предмет укусов или царапин, а при первых признаках болезни постараться оперативно доставить животное на осмотр к врачу. Помните, что лучшая защита домашних любимцев включает в себя не сверхмощные медикаментозные препараты или специальные корма с витаминными добавками, а именно внимание владельцев.
Гемобартонеллез (Гемоплазмоз) кошек и собак
Гемоплазмоз – достаточно распространенное кровопаразитарное заболевание кошек в России. Собаки болеют крайне редко. Возбудителями являются Mycoplasma haemofelis, Mycoplasma haemominutum и Candidatus M. turicensis. Чаще всего встречается Mycoplasma haemofelis.
Распространение заболевания до конца не изучено, но наиболее вероятный путь передачи – с эктопаразитами, чаще блохами. Так же возможен прямой путь передачи и заражение потомства трансплацентарно. Учитывая возможность заражения при укусе блохи, большему риску заражения подвержены бездомные животные, кошки, содержащиеся в приютах и в большом скоплении собратьев. Заболевание чаще встречается у котов, чем у кошек.
Во внешней среде возбудитель неустойчив и опосредованный путь передачи не считается значимым.
Заболевание может протекать остро и хронически.
При остром течении симптомами чаще всего являются вялость, апатия, анорексия, желтушность и бледность слизистых оболочек и кожи, гипертермия, одышка, бурый цвет мочи. Возбудитель при попадании в кровяное русло начинает активно размножаться, вызывая разрушение красных кровяных клеток, что может привести к анемии, которая в свою очередь чаще всего будет регенераторной.
При хроническом течении симптомы могут не проявляться клинически или быть сглаженными.
Животное также может быть латентным носителем инфекции, не проявляя симптомов.
Кошки с носительством хронических вирусных инфекций более подвержены заболеванию имеют более осторожный прогноз.
Для диагностики гемоплазмоза проводят исследование крови методом ПЦР. Мазок крови для обнаружения кровепаразита считается менее информативным. Так же для обнаружения характерных изменений, таких как анемия, желтушность, сдают общий клинический и биохимический анализы крови.
Лечение гемоплазмоза проводится антибиотиком доксициклин курсом не менее 4х недель, энрофлоксацин и марбофлоксацин. Рекомендуется проводить контроль анализов крови на фоне лечения. После курса лечения животное может остаться носителем инфекции на несколько лет или пожизненно, не проявляя симптомов болезни. Соответственно после лечения возможен положительный результат анализа крови на гемобартонеллез ПЦР.
В целом гемоплазмоз не является угрожающей жизни ситуацией и при своевременно начатом лечении общее состояние достаточно быстро приходит в норму, но течение может осложняться аутоиммунными реакциями, носительством вируса лейкемии или иммунодефицита, реакциями со стороны сердечно-сосудистой системы.
Считается, что собаки подвержены заболеванию в случае удаления селезенки или при наличии проблем, угнетающих работу иммунной системы.
Гемобартонелез Felina - Anemia Infecciosa Felina
La Hemobartolenosis también conocida como Anemia Infecciosa Felina (AIF) y es producida por Hemobartonella Felis , que ataca la superficie de los glóbulos rojos del gato.
Patogenia de la Hemobartonelosis Felina :
La transmisión se производит través de artrópodos (¿pulgas?) aunque se desconoce el mecanismo precision.См. Описание всех mordeduras como otra forma de contagio. También es posible el contagio перинатальный .
La anemia se productions básicamente por dos mecanismos:
1- La Hemobartonella felis se une a la superficie de los eritrocitos causando daño directo de lambrana celular, incrementando la fragilidad de los mismos, con la consiguiente hemólisis . (la vida media se acorta a 5 d)
2- La alteración de lambrana celular del glóbulo rojoide a que algunos antígenos de superficie se oculten ya que aparezcan otros, generándose una reacción Ag-Ac-que Complemento la гемолиз .Con el tiempo también se produn autoanticuerpos, los que aumentan la lisis eritrocitaria.
Los macrófagos del hígado, bazo y pulmones atrapan a los eritrocitos infectados excludendolos por opsonización y los retornan a la circación. Esto explicaría los cambios del hematocrito durante la parasitemia.
A su vez los glóbulos rojos atrapados en el bazo son liberados a la circación pero pierden la biconcavidad, lo cual aumenta la fragilidad.
Puede haber casos peragudos en Individualuos que Presentan Severas anemias, los cuales mueren en pocas horas.
Episodios agudos pueden Presentarse sin parasitemia o como sucesivos ciclos de parasitemia los que causan cada vez más daño de los glóbulos rojos y pueden conducir a la enfermedad crónica.
Prevalencia y factores de riesgo de la Hemobartonelosis Felina o Anemia felina felina :
La prevalencia varía mucho en los отличительные отчеты, quizás losidoé la queto диагностика окультоз).La edad de incidencia también es переменная (1-3, 4-6, 7-8).
Se asocia como oportunista de los virus de la Leucemia Felina y de la Inmunodeficiencia Felina . Del mismo modo, se halla asociada en pacientes que desarrollan leucemias y linfomas .
Hallazgos clínicos:
La Hemobartonelosis felina inducida в форме экспериментального периода 4 этапа:
1) Preparasitémica (2 a 21 días), no muestran signos ni parásitos.
2) Fase aguda con signos y parasitemia.
3) Fase de recuperación con anemias leves y signos clínicos inaparentes.
4) Fase de portador (dura hasta 2 años) son clínicamente normales, con recidivas poco frecuentes.
Los signos varían según el estadío de la infcción cuando se presentan a consulta; зависимость от si la afección es primaria o secundaria, de la velocidad de desarrollo y de la severidad de la anemia.
Cuando la Hemobartonelosis es primaria los cuadros observados son:
1 - Анемия peraguda, decaimiento marcado, слизистых оболочек, гипотермия.
2- Fiebre repentina, aguda anemia, debilidad, mucosas pálidas, soplo cardíaco, esplenomegalia, taquicardia y taquipneapensatoria. Pueden tener antecedentes de 2 o 3 episodios similares previos.
3- Otros Presentan pérdida de peso, pocos signos clínicos, fiebre no muylevada y decaimiento. Настоящая анемия pero no tan grave, son gatos que tienen "días buenos y días malos" y por lo general tienen antecedentes de situaciones estresantes (parto, cirugía, viajes, peleas, и т. Д.)) .-
Cuando la Hemobartonelosis es secundaria pueden hallarse los siguientes cuadros:
1- Un cuadro menos grave en pacientes VIF y / o ViLeF negativos pero conenterrasis afeccionitis, negativos crónicas и др.).
2- Un cuadro muy grave en los gatos VIF y ViLeF positivos con anemia muy marcada, decaimiento, emaciación con pobre respuesta al tratamiento.
Diagnóstico:
El Diagnóstico Definitivo Requiere la demostración de la Hemobartonella felis en los eritrocitos del paciente. las muestras de sangre deben tomarse antes de iniciar el tratamiento y es más efectivo tomarlas de las venas de la cara interna del pabellón auricular, pues en dichos vasos es más fácil hallar la Hemobartonella.
Se Requieren gotas de sangre las que se colocan en portaobjetos y se efectúan frotis . Se pueden teñir con Giemsa, Wright, T15 , и т. Д. Por lo general se observan formas cocoides de 0,1 и 0,8 микра диаметром , a veces se detectan formas anulares.Pueden Hallarse Solos, de a pares y en cadenas.
Типо анемии detectada en los pacientes con Hemobartonelosis primaria es regenerativa con poiquilocitocis, policromasia, anisocitosis, cuerpos de Howell Jolly y metarrubricitos. Por lo general el recuento de blancos está aumentado y con neterofilia en los agudos y con monocitosis en los crónicos.
En los gatos VIF y / o ViLeF positivos la anemia es de tipo arregenerativa, especialmente en los estadios finales de ambas enfermedades.
Las pruebas bioquímicas no arrojan resultados important, a no ser porque en algunos casos pueden hallarse aumentadas la GOT, GPT y FAS así como también la bilirrubina sérica.
Pronóstico:
Благоприятный для гемобартонелеза primaria . Reservado a grave para la secundaria .
Prevención:
Llevar a cabo un righto plan sanitario.-
Combatir las pulgas.-
Evitar que los animales vagabundeen (castración) .-
Salud Pública:
Esta enfermedad no impla ningún tipo de riesgo para el hombre , específica de especie.
Agradecemos la colaboración para la publicación de esta nota a: Dra. Нелида В. Гомес - Profesora Adjunta Área Clínica Médica - Facultad de Ciencias Veterinarias - Universidad de Buenos Aires - Аргентина
Библиография:
1- Biberstein, E: Holzworth Bacterial disease, J et al.В Holzworth J: Болезни кошек: Медицина и хирургия. Филадельфия. У. Б. Сондерс, 1989; pp 301-308.
2- Бобаде, Пенсильвания; и др.: Гемобартонеллез кошек: клинические, гематологические и патологические исследования и их связь с инфицированием вирусом лейкемии кошек.
Вет. Запись 12: 32-36, 1988.
3- Карви, Х.С.: Гемобартонеллез кошек. Вет. Clin. North Am. Практика мелких животных Том 23, № 1 1993.
4 - Грин, Крейг: Enfermedades Infecciosas de los perros y gatos.Intermédica 1989.
Рекомендация единомышленник ...
ГЕМОБАРТОНЕЛЛОЗ (ИНФЕКЦИОННАЯ АНЕМИЯ КОШЕК)
- Ресурс исследования
- Исследовать
- Искусство и гуманитарные науки
- Бизнес
- Инженерная технология
- Иностранный язык
- История
- Математика
- Наука
- Социальная наука
Лучшие подкатегории
- Продвинутая математика
- Алгебра
- Основы математики
- Исчисление
- Геометрия
- Линейная алгебра
- Предалгебра
- Предварительный камень
- Статистика и вероятность
- Тригонометрия
- прочие →
Лучшие подкатегории
- Астрономия
- Астрофизика
- Биология
- Химия
- Науки о Земле
- Наука об окружающей среде
- Наука о здоровье
- Физика
- прочие →
Лучшие подкатегории
- Антропология
- Закон
- Политология
- Психология
- Социология
- прочие →
Лучшие подкатегории
- Бухгалтерский учет
- Экономика
- Финансы
- Менеджмент
- прочие →
Лучшие подкатегории
- Аэрокосмическая техника
- Биоинженерия
- Химическая инженерия
- Гражданское строительство
- Компьютерные науки
- Электротехника
- Промышленное проектирование
- Машиностроение
- Веб-дизайн
- прочие →
Лучшие подкатегории
- Архитектура
- Связь
- Английский
- Гендерные исследования
- Музыка
- Исполнительское искусство
- Философия
- Религиоведение
- Письмо
- прочие →
Лучшие подкатегории
- Древняя история
- Европейская история
- История США
CVMA | Документы | Гемотропный микоплазмоз (гемобартонеллез) у кошек
5 октября 2017 г.
Кошки могут быть инфицированы крошечными организмами, которые атакуют поверхность красных кровяных телец, что приводит к болезни или смерти из-за анемии.Это заболевание передается через укусы блох, но путь естественного заражения не подтвержден.
Заболевание ранее называлось кошачьей инфекционной анемией (FIA) или гемобартонеллезом, но недавнее генетическое секвенирование теперь классифицировало бактерии в пределах рода Mycoplasma, поэтому предпочтительным термином является гемотропный микоплазмоз. Организмы, ответственные за заболевание, были переименованы в Candidatus Mycoplasma haemominutum (CMhm) для штамма малого размера и Mycoplasma haemofelis для штамма большого размера.
Знаки
Дифференциация важна, потому что эти два подтипа вызывают разные клинические признаки и тяжесть заболевания.
Острая инфекция, вызванная M. haemofelis, вызывает гемолитическую анемию от умеренной до тяжелой. Обычно отмечаются лихорадка, потеря веса, плохой аппетит, бледные или желтые слизистые оболочки и летаргия. Термин « гемолитический » относится к низкому количеству эритроцитов или анемии, которая возникает в результате разрушения эритроцитов (так называемый лизис клеток).Организмы, прикрепленные к эритроцитам, распознаются иммунной системой как захватчики, а селезенка отфильтровывает инфицированные эритроциты, уничтожая их. Штамм CMhm может протекать бессимптомно (бессимптомно) или вызывать легкую регенеративную (чувствительную) анемию. Если присутствуют оба штамма или они присутствуют вместе с инфекцией вируса лейкемии кошек, может развиться более тяжелое заболевание.
Факторы риска
Путь передачи инфекции от кошек до конца не изучен, но мы знаем, что при переливании крови паразит может передаваться, а кошки заражают своих котят.Блохи считаются переносчиками, которые сначала кусают инфицированную кошку, а затем передают микоплазму кошке, впоследствии укушенной. Клещи, комары и вши также считались возможными переносчиками этого организма от кошки к кошке. Раны от кошачьих укусов были признаны предшествующими инфекциям и могут служить путем передачи инфекции. У кошки часто появляются признаки болезни примерно через месяц после заражения. Кошки, выздоравливающие после активных признаков инфекции, обычно остаются носителями, которые кажутся здоровыми, с различным количеством организмов, остающихся в кровотоке.
Диагностика
Бактерии Mycoplasma можно увидеть в мазках крови под микроскопом. Для выявления ДНК микоплазмы может быть проведен лабораторный тест ПЦР. Этот ПЦР-тест может быть необходим для постановки диагноза, поскольку бактерии, прикрепленные к эритроцитам, не всегда обнаруживаются в кровотоке. Это циклическое присутствие микоплазмы может также побудить вашего ветеринара предложить для взятия серийные образцы крови, взятые в разное время дня.
Более патогенный M.haemofelis может привести к смертности каждой третьей нелеченной кошки, поэтому очень важно незамедлительно начать лечение. Кошки с сопутствующим вирусом лейкемии кошек, как правило, имеют более тяжелую анемию, и совместное инфицирование этими вирусами часто встречается у пораженных диких кошек и кошек, находящихся на открытом воздухе.
Профилактика, лечение
Профилактика заключается в недопущении контакта с инфицированными кошками и переносчиками (насекомыми).
Могут потребоваться антибиотики и потенциально стероидная противовоспалительная терапия, внутривенные вливания и переливание крови.Терапия не полностью избавляет от паразита, и кошка продолжает нести паразита, но рецидив симптомов болезни случается редко.
Если ваша кошка проявляет признаки болезни, такие как депрессия, снижение аппетита, потеря веса, слабость или бледность, немедленно обратитесь к ветеринару. При своевременной диагностике и терапии прогноз выздоровления хороший.
Д-р Кэтлин Кавана, онлайн-редактор-консультант CVMA
BSc DVM ME
Др.Бет Хансельман, специалист-консультант
DVM DVSC Dip DACVIM
Бартонеллез кошек |
Отредактировано в июле 2020 г.
Инструкции по заражению кошек видами Bartonella были впервые опубликованы в J Feline Med Surg 2013, 15: 563-569 Марией Грации Пенниси и др. и обновлены Фульвио Марсилио в 2015 году и Марией Грацией Пенниси и Фульвио Марсилио в 2018 году. Настоящие правила были обновлены Марией Грацией Пенниси и Фульвио Марсилио.
Сводка
Патогенная роль многих видов Bartonella spp. как возбудители болезней человека и домашних животных до сих пор неизвестны. Bartonella hense lae является возбудителем болезни кошачьих царапин (CSD) у людей, самоограничивающейся регионарной лимфаденопатии, а кошки являются ее основным резервуаром-хозяином. Была продемонстрирована важная роль блох в передаче B. henselae и B. Clarridgeiae среди кошек, и контактные инфекции не возникают.Антитела не являются защитными, и кошки с положительными антителами могут быть повторно инфицированы. Большинство кошек, естественно инфицированных B. henselae , не имеют клинических признаков, но у некоторых людей могут развиться опасные для жизни сердечно-сосудистые заболевания. Более того, другие виды Bartonella , случайными хозяевами которых являются кошки, могут обладать патогенными свойствами. Бартонеллез диагностируется у кошек с симптомами Bartonella , положительных на основании исключения других совместимых диагнозов и путем оценки реакции на терапию антибиотиками.Никакой пользы от тестирования здоровых кошек и людей не приносит, за исключением случаев с ослабленным иммунитетом в домашних условиях.
Строгая борьба с блохами и клещами - единственная эффективная профилактическая мера.
Бактериальные свойства
Bartonella (B.) - небольшие (2 на 0,5 мкм) переносимые переносчиками грамотрицательные внутриклеточные бактерии, которые хорошо адаптированы к одному или нескольким резервуарным хозяевам млекопитающих. К настоящему времени описано более 22 видов Bartonella , но их роль в качестве возбудителей болезней человека и домашних животных является предметом текущих исследований (Таблица 1).
| Bartonella spp. | Первичный резервуар | Вектор | Случайный хозяин |
|---|---|---|---|
| B. bacilliformis | Человек | Lutzomia verrucarum | Нет |
| B. quintana | Человек | Pediculus humanus | Кошка, собака, обезьяна |
| B. elizabethae | Rattus norvegicus | Xenopsylla cheopis | Человек, собака |
| Б.grahamii | Несколько видов диких мышей | Блохи грызунов | Люди |
| B. henselae | Кошка | Ctenocephalides felis felis | Человек, собака |
| B. Clarridgeiae | Кошка | C. felis | Человек, собака |
| B. koehlerae subsp. koehlerae | Кот, лев | C.felis | Человек |
| B. koehlerae subsp. boulouisii | Горный лев | Блохи? | Неизвестно |
| B. koehlerae subsp. butieri | Bobcat, cheetah | Блохи? | Неизвестно |
| B. vinsonii subsp. berkhoffii | Койот, собака | Клещи? | Люди |
| Б.vinsonii subsp. arupensis | Peromyscus leucopus | Клещи? Блохи? | Люди |
| B. washoensis | Spermophilus beecheyii | Блохи? | Человек, собака |
| B. asiatica | Кролик | Блохи? | Люди |
| B. rochalimae | Дикие плотоядные животные | Блохи | Люди |
Наиболее распространенным видом как у кошек, так и у людей является B. henselae , который вызывает болезнь кошачьих царапин (CSD) у последних, а также другие потенциально смертельные заболевания, поражающие людей с ослабленным иммунитетом.
Кошки, естественно инфицированные Bartonella , обычно не проявляют клинических признаков. Учитывая длительную связь между B. henselae и домашними кошками, между хозяином и бактерией произошла адаптация, чтобы облегчить сосуществование и минимизировать патогенное воздействие на млекопитающего-хозяина (Guptill, 2010).
Эпидемиология
Bartonella spp. Распространены по всему миру с наибольшей распространенностью в районах, где условия наиболее благоприятны для членистоногих-переносчиков, в основном блох. В Европе было проведено множество исследований, и распространенность антител у кошек колебалась от 8 до 53% (Таблица 2).
| Страна | Количество кошек | Распространенность (%) | Ссылка |
|---|---|---|---|
| Нидерланды | 163 (заблудший) | 52 | Bergmans et al., 1997 |
| Австрия | 96 | 33 | Allerberger et al., 1995 |
| Швейцария | 728 | 8 | Glaus et al., 1997 |
| Германия | 713 | 15 | Haimerl et al., 1999 |
| 245 | 37,1 | Morgenthal et al., 2012 | |
| Франция | 64 | 36 | Chomel et al., 1995 |
| 94 | 53 | Heller et al., 1997 | |
| 179 | 41 | Gurfield et al., 2001 | |
| Испания | 680 | 23,8 | Ayllon et al., 2012 |
| Италия | 540 | 38 | Fabbi et al., 2004 |
| 1300 (случайный) | 23,1 | Brunetti et al., 2013 | |
| 197 | 45.7 | Persichetti et al., 2018 | |
| Шотландия | 78 | 15,3 | Bennett et al., 2011 |
Эпидемиологические данные и экспериментальные исследования продемонстрировали важную роль блох в передаче B. henselae и B.clarridgeiae между кошками. Bartonella henselae естественным образом передается среди кошек с блохами Ctenocephalides felis felis или с фекалиями блох. С помощью количественной ПЦР в реальном времени ДНК B. henselae была обнаружена как у блох, так и в их фекалиях на протяжении всей 12-дневной продолжительности жизни членистоногих, начиная с 24 часов после приема пищи с кровью (Bouhsira et al., 2013) . Возможная роль нескольких видов летучих мышей (Nycteribiidae) как векторов Bartonella была изучена. Это остается предметом споров, но в дополнение к патогенным, паразитарным или мутуалистическим взаимодействиям следует рассматривать функцию резервуара (Morse et al., 2012).
Persichetti et al. (2016) оценили позитивность ПЦР к трансмиссивным патогенам у кошек и их эктопаразитов, и они секвенировали B.clarridgeiae в продуктах ПЦР, амплифицированных из ДНК, выделенной от двух клещей (один образец Ixodes ventalloi и один образец Rhipicephalus sanguineus ), но не в крови двух кошек, несущих каждую из них. Аналогичным образом Regier et al. (2017) обнаружили B. henselae у клещей Ixodes ricinus , собранных у одной кошки с отрицательным результатом ПЦР, который, однако, оказался положительным по анти- B.henselae антитела. Означает ли это наблюдение роль клещей в передаче обоих видов Bartonella spp. кошкам нужно разрешить.
Недавно Mazurek et al. (2019) сообщили о частоте встречаемости Bartonella spp . ДНК собак из домашних хозяйств, в которых содержались кошки с клиническим бартонеллезом. Присутствие ДНК с 99–100% идентичностью нуклеотидной последовательности с последовательностью ДНК Bartonella , выделенной от кошек, было продемонстрировано в организме 10% исследованных собак.Результаты показали, что кошки служат резервуаром Bartonella для собак, и собаки могут играть ту же роль по отношению к людям.
Три других вида, B. koehlarae , B. bovis и B. quintana , были выделены из кошачьей крови, но способы передачи и резервуарный потенциал этих видов у кошачьих не установлены. Кроме того, B vinsonii subsp. berkhoffii ДНК была обнаружена в крови кошки (Varanat et al., 2009).
Патогенез
У зараженной кошки Bartonella населяет эритроциты, которые попадают в организм блох и выживают в ее кишечнике. Зараженные фекалии блох, осевшие на коже, попадают под когти кошки из-за ухода за ней. Кошачья царапина - это обычный способ передачи этого организма другим животным, включая человека (Chomel et al., 1996).
Bartonella henselae экспериментально передавалась среди кошек путем передачи блох, которых кормили естественно инфицированными кошками, кошкам с SPF и внутрикожной инокуляцией экскрементов, собранных от блох, которых кормили на B.henselae -инфицированные кошки (Chomel et al., 1996). Это продемонстрировало, что и переносчик, и кошка - через царапины - могут передавать организм. Инфекция усиливается в задней кишке блох, и B. henselae может сохраняться в окружающей среде с фекалиями блох в течение как минимум девяти дней (Finkelstein et al., 2002). Переливание крови также представляет собой риск: кошки были экспериментально инфицированы B. henselae и B.clarridgeiae путем внутривенного или внутримышечного введения инфицированной кошачьей крови (Abbott et al., 1997).
Bartonella henselae передачи не происходило, когда инфицированные кошки жили вместе с неинфицированными кошками в среде, свободной от блох. Следовательно, передача инфекции не происходит через укусы, царапины при отсутствии блох, уход или совместное использование туалетных принадлежностей и пищевых тарелок. Кроме того, нельзя было продемонстрировать передачу инфекции между бактериозными кошками и неинфицированными самцами во время спаривания или котятам инфицированных самок ни во время беременности, ни в неонатальном периоде, опять же в условиях, свободных от блох (Guptill et al., 1997).
Клещи могут также действовать как переносчики среди кошек, людей, собак и других млекопитающих-хозяев: трансстадиальная передача B. henselae была продемонстрирована на Ixodes ricinus (Cottè et al., 2008).
Хроническая бактериемия в основном встречается у кошек в возрасте до 2 лет (Guptill et al., 2004). Молодые экспериментально инфицированные кошки сохраняли рецидивирующую бактериемию B. henselae или B. clarridgeiae в течение 454 дней (Kordick et al., 1999). Избегание иммунной системы из-за ее внутриклеточного расположения, частые генетические перестройки и изменение белков внешней мембраны считаются важными для поддержания стойкой бактериемии. Считается, что расположение внутри эритроцитов и эндотелиальных клеток сосудов защищает бартонеллы от антимикробных агентов. Кошки могут быть повторно инфицированы различными штаммами Bartonella (Guptill, 2010).
Клинические признаки
Кошки, естественно инфицированные Bartonella spp.обычно не проявляют клинических признаков. Как экспериментальные, так и естественные исследования инфекций пытались установить связь между клиническими признаками и инфекцией, но эта связь не была однозначно доказана. Контакт с инфицированными блохами не вызывает клинических признаков (Chomel et al., 1996; Bradbury and Lappin, 2009). В некоторых случаях экспериментальной инокуляции сообщалось о самоограничивающемся фебрильном заболевании, преходящей легкой анемии, локальной или генерализованной лимфаденопатии, легких неврологических симптомах и репродуктивной недостаточности (Kordick et al., 1999). У этих животных пиогранулематозное воспаление было замечено в легких, печени, селезенке, почках, сердце (рис. 1) и лимфоидной ткани при вскрытии трупа (Guptill et al., 1997; Kordick et al., 1999).
Рис. 1. Общие и гистологические данные у двух кошек из приюта Северной Каролины, которые умерли после того, как в приют попали зараженные блохами котята. (а) Коалесцирующие гранулемы, распределенные по миокарду. (б) Пиогранулематозный миокардит у 8-месячного кастрированного кота, которого содержали вместе с зараженными блохами котятами.Макрофаги с редкой многоядерной гигантской клеткой (стрелка) особенно многочисленны в верхнем левом углу изображения. Окраска гематоксилином / эозином. Врезка: скопление коротких бацилл в очаге воспаления, иммунореактивных (коричневый цвет) в отношении B. henselae -специфического моноклонального антитела. Воспроизведено с разрешения Varanat et al., 2012
Роль Bartonella в возникновении клинических признаков у кошек после естественного инфицирования еще более неясна. Исследования, основанные на обнаружении антител, имеют ограниченную ценность, потому что антитела только доказывают воздействие, но не обязательно активную инфекцию.Более того, существует перекрестная реактивность между различными видами Bartonella , которые могут вызывать или не вызывать клинические признаки. Из-за высокого процента инфицированных здоровых кошек в эндемичных районах связь между клиническими признаками и инфекцией B. henselae продемонстрировать непросто.
Было высказано предположение, что инфекция Bartonella может играть роль в хроническом гингивостоматите (Ueno et al., 1996; Glaus et al., 1997), но распространенность антител или организмов у больных кошек не была выше, чем у контрольных кошек. популяции (Quimby et al., 2008; Дауэрс и др., 2010; Pennisi et al., 2010; Белгард и др., 2010; Namekata et al., 2010).
Кошки, положительные как на FIV, так и на антитела Bartonella , имели повышенный риск лимфаденопатии (Ueno et al., 1996). Была высказана предположение о связи между антителами против Bartonella и заболеванием мочевыводящих путей или гематурией (Glaus et al., 1997; Breitschwerdt et al., 2005). Пирс и др. (2006) не обнаружили никаких различий в распространенности антител у здоровых кошек и кошек с судорогами или другими неврологическими состояниями.Однако неконтролируемое ретроспективное исследование сообщило о ДНК Bartonella в спинномозговой жидкости и подтвердило продукцию специфических антител в ЦНС кошек с заболеванием ЦНС (Leibovitz et al., 2008). Несмотря на EBM степень III этого наблюдения, Bartonella spp. Следует учитывать инфекцию, когда у кошек с симптомами исключены другие совместимые диагнозы заболевания ЦНС.
Не было обнаружено различий в распространенности антител Bartonella между здоровыми кошками и кошками, пораженными увеитом (Fontenelle et al., 2008), но некоторые сообщили о наличии Bartonella spp. воздействие на кошек с увеитом, чувствительных к лекарствам, которые считаются эффективными против Bartonella (Lappin and Black, 1999; Ketring et al., 2004). Не было обнаружено различий в распространенности Bartonella PCR у кошек, страдающих анемией, по сравнению с контрольными кошками (Ishak et al., 2007). Распространенность антител против Bartonella была ниже у кошек с лихорадкой по сравнению с контрольной группой с афебрильной болезнью, но у первых была более высокая положительность ДНК в крови, приближающаяся к статистической значимости (Lappin et al., 2009). Более того, уникальный идентичный генотип B. henselae был культивирован из крови трех котят, и он был признан возбудителем их циклического возвратного тифа, связанного с анемией и нейтропенией, за счет исключения других инфекций и клинического лечения с помощью лечения азитромицином (Breitschwerdt et al. др., 2015).
Исследование, основанное на серологии и культуре, не обнаружило связи между инфекцией Bartonella и хроническим риносинуситом (Berryessa et al., 2008). Также не было обнаружено связи между инфекцией Bartonella и панкреатитом, потому что кошки с нормальными значениями fPLI и кошки с повышенными значениями fPLI не показали никаких различий в распространенности Bartonella (Bayliss et al., 2009).
С 1993 года многие виды Bartonella были связаны с эндокардитом у людей и собак (Breitschwerdt et al., 1995; La Scola and Raoult, 1999; Mc Donald et al., 2004). Некоторые исследовательские группы искали Bartonella у кошек с эндокардитом, необычной проблемой у кошек.Аортальный и фатальный митральный клапан Эндокардит, связанный с B. henselae , был зарегистрирован у двух кошек в США (Chomel et al., 2003; Chomel et al., 2009). Кроме того, B. henselae вегетативный эндокардит передней створки митрального клапана, связанный с систолическим шумом сердца III-IV степени и признаками эмболизации аорты (летаргия и слабость в задних конечностях, слабый бедренный пульс, тазовая боль, повышенная активность креатинкиназы сыворотки) была успешно пролечена на кошке (Perez et al., 2010), предполагая, что вид Bartonella могут быть причиной эндокардита с отрицательным посевом крови, как предполагалось ранее (Malik et al., 1999).
Миокардит, вызванный B. henselae , был диагностирован при патологоанатомическом исследовании у двух кошек (Varanat et al., 2012), а недавно Joseph et al. (2018) описали клинический случай острой сердечной недостаточности с острым началом у 3-летней кошки из семьи, воспитывающей бездомных кошек. Эхокардиография и электрокардиография соответственно свидетельствовали о желудочковом асимметричном утолщении миокарда с диффузно пестрой гипоэхогенной эхотекстурой и блокадой левой ножки пучка Гиса.После положительного результата ПЦР-анализа крови на B. henselae было проведено лечение азитромицином в течение месяца, и было задокументировано полное исчезновение клинических, ультразвуковых и электрокардиографических аномалий.
Хромота и боль при пальпации конечностей наблюдались у кошки, страдающей рецидивирующим остеомиелитом и полиартритом, связанным с B. vinsonii subsp. berkhoffii инфекция и бактериемия (Varanat et al., 2009).
В заключение, большинство кошек естественно инфицированы вирусом B.henselae не проявляет клинических признаков, но у некоторых людей могут развиться опасные для жизни сердечно-сосудистые заболевания. Более того, другие виды Bartonella , случайными хозяевами которых являются кошки, могут обладать патогенными свойствами.
Иммунитет
Пассивная невосприимчивость
Данные о пассивной невосприимчивости отсутствуют.
Активный иммунный ответ
Антительный ответ на B. henselae был исследован для идентификации вакцин-кандидатов.Кинетика реакции на антигены B. henselae у хронически инфицированных экспериментальных кошек сильно различается по степени и продолжительности (Chomel et al., 1996; Kordick et al., 1999; Yamamoto et al., 2002). Степень серологической перекрестной реактивности к другим видам Bartonella требует уточнения. Возможно повторное заражение другим штаммом B. henselae , что подтверждается выделением неродственных бактериальных клонов от одной и той же кошки в разное время (Arvand et al., 2008). Следовательно, антитела не считаются защитными, и кошки с серопозитивной реакцией на Bartonella spp. Могут быть инфицированы (Fabbi et al., 2004).
Диагноз
Лабораторное исследованиеBartonella требуется для доноров крови кошек, домашних кошек, принадлежащих к людям с ослабленным иммунитетом, или когда заболевание, связанное с Bartonella , диагностировано у человека, который живет с кошками или контактирует с кошками.
Культивирование бактерии является золотым стандартным методом диагностики инфекции Bartonella , но из-за высокой распространенности инфекции у здоровых кошек в эндемичных районах положительный посев не является подтверждением болезни, а другие совместимые диагнозы должны быть исключены. .
Таким образом, болезнь диагностируется на основе исключения и путем оценки реакции на терапию. Этот вывод «ex juvantibus» о причинно-следственной связи заболевания на основании наблюдаемой реакции на лечение может применяться к увеиту, эндокардиту и мультифокальному заболеванию ЦНС, которые могут быть совместимы с бартонеллезом кошек.
ПЦР может использоваться в крови, внутриглазной жидкости, спинномозговой жидкости или тканях, и были изучены несколько генных мишеней. Для быстрой лабораторной диагностики был описан алгоритм ПЦР в реальном времени и пиросеквенирования, который позволил быстро дифференцировать по крайней мере 11 видов Bartonella spp.в течение пяти часов с момента получения образцов (Buss et al., 2012). Недавно была проведена ПЦР в реальном времени на Bartonella spp. Обнаружение было предложено для повышения чувствительности ПЦР и выявления ранее не описанных видов (Parra et al., 2017). Более того, для обнаружения и классификации новых видов Bartonella от блох недавно была предложена матричная лазерная десорбционная / ионизационная масс-спектрометрия по времени пролета (MALDITOF-MS) (El Hamzaoui et al., 2018).
Серология (IFAT или ELISA) более полезна для исключения, чем для подтверждения, из-за низкой положительной прогностической ценности (39-46%) по сравнению с хорошей отрицательной прогностической ценностью (87-97%; Chomel et al., 1995; Гурфилд и др., 2001; Fabbi et al., 2004; Guptill et al., 2004).
Требуются повторные посевы крови или ПЦР для более чем одного вида биологических образцов (кровь, лимфатический узел, мазок из полости рта; Pennisi et al., 2010; Drummond et al., 2018). Комбинированный подход с предварительным обогащением культуры и ПЦР увеличивает чувствительность (Breitschwerdt et al., 2007).
Лечение
Лечение рекомендуется кошкам, живущим с людьми с ослабленным иммунитетом, или в тех редких случаях, когда Bartonella действительно вызвала заболевание, например.грамм. эндокардит или миокардит. Современные терапевтические стратегии у кошек (таблица 3) основаны на исследованиях in vitro, и бартонеллезе человека.
| Лекарство | Доза | Продолжительность | Ссылка | |
|---|---|---|---|---|
| Доксициклин | 50 мг / кошку, перорально, каждые 12-24 ч | 14-28 дней | Guptill-Yoran, 2012 | |
| Азитромицин | 10 мг / кг перорально каждые 24 часа (или каждые 48 часов) | 7 дней с последующим через день в течение 6-12 недель или ежедневно в течение 3 недель | Ketring et al., 2004; Varanat et al., 2009; Breitschwerdt et al., 2015 Joseph et al., 2018 | |
| Марбофлоксацин | 5 мг / кг перорально каждые 24 часа | 6 недель | Perez et al., 2010 | |
| Амоксициллин-клавуланат (с азитромицином) | 62,5 мг перорально каждые 12 часов | 2 месяца | Varanat et al., 2009 | |
Данные контролируемых исследований эффективности на кошках отсутствуют.Кошка, страдающая рецидивирующим остеомиелитом и полиартритом, связанным с B. vinsonii subsp. berkhoffii , инфекция генотипа II и бактериемия вылечились после терапии азитромицином (10 мг / кг перорально каждые 48 часов в течение трех месяцев) и амоксициллин-клавуланатом (62,5 мг перорально каждые 12 месяцев в течение двух месяцев; Varanat et al., 2009).
После естественного или экспериментального заражения бактериями B. henselae или B.clarridgeiae здоровые кошки прошли курс лечения для устранения бактериемии (Greene et al., 1996; Регнери и др., 1996; Kordick et al., 1997), и многие препараты были оценены: доксициклин, амоксициллин, амоксициллин-клавуланат, энрофлоксацин, эритромицин, рифампицин. На основании этих результатов нельзя гарантировать избавление от бактериемии, а в случае неэффективности лечения существует риск индуцирования устойчивости к противомикробным препаратам. Следовательно, лечение здоровых носителей нельзя рассматривать как эффективную меру устранения зоонозного риска; это иногда требуется в случаях заболевания человека CSD или другого заболевания, связанного с Bartonella , у члена семьи.
Профилактика
Согласно всем исследованиям передачи, строгая борьба с блохами (и клещами) является единственной успешной профилактической мерой. Вакцины против инфекции Bartonella не существует.
Зоонозный риск
Кошки являются основным резервуаром B. henselae , возбудителя CSD и других заболеваний человека, которые в основном наблюдаются у лиц с ослабленным иммунитетом. Признанными факторами риска бактериемии у кошек являются молодой возраст, заражение блохами, образ жизни на открытом воздухе и наличие нескольких кошек (Chomel et al., 1995; Фоли и др., 1998; Гурфилд и др., 2001; Guptill et al., 2004; Boulouis et al., 2005).
У людей CSD (рис. 2) представляет собой самоограничивающуюся региональную лимфаденопатию, развивающуюся после первичного папулезного поражения и продолжающуюся от нескольких недель до нескольких месяцев (Boulouis et al., 2005). Иногда сообщается об абсцессе лимфатического узла и системных признаках. Атипичные формы и расширяющийся спектр клинических состояний связаны с инфекцией B. henselae (Boulouis et al., 2005), таких как нейроретинит, увеит (Fonollosa et al., 2011), эндокардит (Tsuneoka et al., 2010) и энцефалопатия (Samarkos et al., 2018). Сообщается о необычном случае CSD у ветеринара, страдающего стойкой лихорадкой и болями в спине после случайного прокола иглой (Lin et al., 2011).
Бациллярный ангиоматоз (Lange et al., 2009) - одно из наиболее частых клинических проявлений у лиц с ослабленным иммунитетом, которое при отсутствии лечения может привести к летальному исходу, тогда как у иммунокомпетентных людей может возникнуть субклиническая инфекция Bartonella (Massei et al., 2004).
Рис. 2. Иммуногистохимическая идентификация B. henselae в случае болезни кошачьих царапин. Предоставлено Дхарамом Рамнани, Webpathology.com
Нет никакой пользы от тестирования бессимптомных кошек или людей, за исключением случаев с ослабленным иммунитетом в домашних условиях. Инфекция не всегда вызывает клинические признаки у здоровых людей, и многие из них имеют антитела (Massei et al., 2004; Mc Gill et al., 2005). Информирование владельцев о передаче Bartonella имеет важное значение для снижения зоонозного риска; Людям с ослабленным иммунитетом рекомендуется оставить свою домашнюю кошку или завести новую при условии, что будут приняты следующие превентивные меры для снижения риска заражения.
Ключевые моменты для минимизации зоонозного риска (Kaplan et al., 2002; Brunt et al., 2006):
- Владельцы с ослабленным иммунитетом должны предпочтительно брать кошек старше 1 года, без блох, здоровых, не из приютов или домашних хозяйств с несколькими кошками, и без контактов с кошками с неизвестным статусом здоровья
- Необходимо проводить строгую борьбу с блохами и клещами
- Следует избегать грубых люфтов и подстричь кошачьи когти
- Любую рану следует незамедлительно промыть водой с мылом и обратиться за медицинской помощью
- Кошек следует держать в помещении, чтобы избежать контакта с блохами и другими возможными переносчиками, а также для предотвращения других зоонозных рисков.
Благодарность
ABCD Europe с благодарностью отмечает поддержку Boehringer Ingelheim (спонсор-основатель ABCD) и Virbac.
Список литературы
Abbott RC, Chomel BB, Kasten RW, Floyd-Hawkins KA, Kikuchi Y, Koehler, JE, Pedersen NC (1997): экспериментальная и естественная инфекция кошек Bartonella henselae. Comp Immunol Microbiol Infect Dis 20, 41–57.
Allerberger F, Schonbauer M, Zangerle R, Dierich M (1995): Распространенность антител к Rochalimaea henselae среди австрийских кошек.Eur J Ped 154, 165.
Arvand M, Viezens J, Berghoff J (2008): Длительная бактериемия Bartonella henselae, вызванная повторным заражением кошек. Emerg Infect Dis 14, 152-154.
Ayllon T, Diniz PP, Breitschwerdt EB, Villaescusa A, Rodriguez-Franco F, Sainz A (2012): Трансмиссивные болезни у принадлежащих клиентам и бездомных кошек из Мадрида, Испания. Vector Borne Zoonotic Dis 12, 143-150.
Bayliss DB, Steiner JM, Сухолдольски JS, Radecki SV, Brewer MM, Morris AK, Lappin MR (2009): Концентрация иммунореактивности липазы поджелудочной железы кошек в сыворотке крови и распространенность антител против Toxoplasma gondii и видов Bartonella у принадлежащих клиентам кошек.J Feline Med Surg 11, 663-667.
Belgard S, Truyen U, Thibault JC, Sauter-Louis C, Hartmann K (2010): Актуальность калицивируса кошек, вируса иммунодефицита кошек, вируса лейкемии кошек, вируса герпеса кошек и Bartonella henselae у кошек с хроническим гингивостоматитом. Берл Мунк Тиерацтль Вохеншр 123, 369-376.
Беннетт А.Д., Ганн-Мур Д.А., Брюер М., Лаппин М.Р. (2011): Распространенность видов Bartonella, гемоплазм и Toxoplasma gondii у кошек в Шотландии.J Feline Med Surg 13, 553-557.
Bergmans AMC, de Jong CMA, van Amerongen G, Schot CS, Schouls LM (1997): Распространенность видов Bartonella у домашних кошек в Нидерландах. J Clin Microbiol 35, 2256-2261.
Berryessa NA, Johnson LR, Kasten RW, Chomel BB (2008): Микробный посев образцов крови и серологические тесты на бартонеллез у кошек с хроническим риносинуситом. J Am Vet Med Assoc 233, 1084-1089.
Bouhsira E, Ferrandez Y, Liu M, Franc M, Bouloius HJ, Biville F (2013): Ctnecephalides felis является потенциальным вектором in vitro для пяти видов Bartonella.Comp Immunol Microbiol Inf Dis 36, 105-111.
Boulouis HJ, Chang CC, Henn JB, Kasten RW, Chomel BB (2005): Факторы, связанные с быстрым появлением зоонозных инфекций Bartonella. Vet Res 36, 383-410.
Bradbury CA, Lappin MR (2009): Оценка местного применения 10% имидаклоприда-1% моксидектина для предотвращения передачи Bartonella henselae от кошачьих блох. J Am Vet Med Assoc 236, 869-873.
Breitschwerdt E, Broadhurst JJ, Cherry NA (2015): Bartonella henselae как причина острой фебрильной болезни у кошек.Открытые отчеты JFMS, 1-9.
Breitschwerdt EB, Kordick DL, Malarkey DE, Keene B, Hadfield T.I, Wilson K (1995): эндокардит у собаки из-за инфекции новым подвидом Bartonella. J Clin Microbiol 33, 154-160.
Breitschwerdt EB, Levine JF, Radulovich S, Hanby SB, Kordick DL, La Perle KMD (2005): серореактивность Bartonella henselae и Rickettisa в популяции больных кошек из Северной Каролины. Int J Appl Res Vet Med 3, 287-302.
Breitschwerdt EB, Maggi RG, Sigmon B, Nicholson WL (2007): Изоляция Bartonella quintana от женщины и кошки после предполагаемой передачи укуса.J Clin Microbiol 45, 270-272.
Брунетти Э, Фабби М., Феррайоли Дж., Прати П., Филиче С., Сассера Д. и др. (2013): Болезнь кошачьих царапин в Северной Италии: атипичные клинические проявления у людей и распространенность инфекции бартонеллы у кошек. Eur J Clin Microbiol Infect Dis 32, 531-534.
Brunt J, Guptill L, Kordick DL, Kudrak S, Lappin MR (2006): отчет группы по диагностике, лечению и профилактике Bartonella spp. инфекции. Am Assoc Feline Pract ;. Консультативный совет Академии кошачьей медицины.J Feline Med Surg 8, 213-226.
Бусс С.Н., Гебхардт Л.Л., Массер К.А. (2012): ПЦР в реальном времени и пиросеквенирование для дифференциации важных с медицинской точки зрения видов Bartonella. J. Microbiol Meth 91, 252-256.
Chomel BB, Boulouis HJ, Maruyama S, Breitschwerdt EB (2006): Bartonella spp. у домашних животных и влияет на здоровье человека. Emerg Inf Dis 12, 389-394.
Chomel BB, Gurfield AN, Boulouis HJ, Kasten RW, Piemont Y (1995): Резервуар болезней грифов, Bartonella henselae, en région parisienne: предварительные результаты.Rec Med Vet 171, 841-845.
Chomel BB, Kasten RW, Floyd-Hawkins KA, Chi B, Yamamoto K, Roberts-Wilson J, Gurfield AN, Abbott RC, Pedersen NC, Koehler J (1996): Экспериментальная передача Bartonella henselae кошачьей блохой. J Clin Microbiol 34, 1952–1956.
Chomel BB, Kasten RW, Williams C, Wey AC, Henn JB, Maggi R, Carrasco S, Mazet J, Boulouis HJ, Maillard R, Breitschwerdt EB (2009): Бартонеллезный эндокардит: патология, присущая животным-резервуарам и пациентам.Ann N Y Acad Sci 1166, 120–126.
Chomel BB, Molia S, Kasten RW, Borgo GM, Stuckey MJ, Maruyama S, Chang CC, Haddad N, Koehler JE (2016): Выделение Bartonella henselae и двух новых подвидов бартонелл, Bartonella koehlerae подвидов boulouisii subsp. ноя и Bartonella koehlerae подвиды Bothieri subsp. ноя от свободно живущих калифорнийских горных львов и рыси. PLoS One 11 (3), e0148299.
Chomel B, Wey AC, Kasten RW, Stacy BA, Labelle P (2003): Смертельный случай эндокардита, связанного с инфекцией Bartonella henselae типа I, у домашней кошки.J Clin Microbiol 41, 5337-5339.
Cottè V, Bonnet S, Le Rhun D, Le Naour E, Chauvin A, Boulouis HJ, Lecuelle B, Lilin T., Vayssier-Taussat M (2008): Передача Bartonella henselae через Ixodes ricinus. Emerg Infect Dis 14, 1074–1080.
Dowers KL, Hawley JR, Brewer MM, Morris AK, Radecki SV, Lappin MR (2010): Ассоциация видов Bartonella, кошачьего калицивируса и инфекции кошачьего герпеса 1 с гингивостоматитом у кошек. J Feline Med Surg 12, 314-321.
Drummond MR, Lania BG, Diniz PPVP, Gilioli R, Demolin DMR, Scorpio DG, Breitschwerdt EB, Velho PENF (2018): Улучшение обнаружения ДНК Bartonella henselae в образцах крови кошек путем объединения молекулярных и культуральных методов. J Clin Microbiol 56, e01732-17.
Эль-Хамзауи Б., Ларош М., Альмерас Л., Беренджер Дж. М., Рауль Д., Парола П. (2018 г.): Обнаружение Bartonella spp. у блох с помощью MALDI-TOF MS. PLoS Negl Trop Dis 12, e0006189.
Fabbi M, De Giuli L, Tranquillo M, Bragoni R, Casiraghi M, Genchi C (2004): Распространенность Bartonella henselae у итальянских бездомных кошек: оценка серологии для оценки риска передачи Bartonella человеку.J Clin Microbiol 42, 264–268.
Финкельштейн Дж. Л., Браун Т. П., О'Рейли К. Л., Уэдинкамп Дж-младший, Фойл Л. Д. (2002): Исследования роста Bartonella henselae у кошачьей блохи (Siphonaptera: Pulicidae). J Med Entomol 39, 915-919.
Фолей JE, Chomel B, Kikuchi Y, Yamamoto K, Pedersen NC (1998): Распространенность Bartonella henselae у кошек питомника: связь с гигиеной питомника и заражением блохами. Ветеринарный вопрос 20, 1-5.
Fonollosa A, Galdos M, Artaraz J, Perez-Irezabal J, Martinez-Alday N (2011): Окклюзионный васкулит и неоваскуляризация диска зрительного нерва, связанная с нейроретинитом.Ocul Immunol Inflamm 19, 62-64.
Fontenelle JP, Powell CC, Hill AE, Radecki SV (2008): Распространенность сывороточных антител против видов Bartonella в сыворотке кошек с увеитом или без него. J Feline Med Surg 10, 41-46.
Glaus T, Hofmann-Lehmann R, Greene C, Glaus B, Wolfensberger C, Lutz H (1997): Распространенность инфекции Bartonella henselae и корреляция со статусом болезни у кошек в Швейцарии. J Clin Microbiol 35, 2883-2885.
Greene CE, McDermott M, Jameson PH, Atkins CL, Marks AM (1996): Инфекция Bartonella henselae у кошек: оценка во время первичной инфекции, лечения и повторной инфекции.J Clin Microbiol 34, 1682-1685.
Guptill L (2010): Бартонеллез. Vet Microbiol 140, 347–359.
Guptill L, Slater L, Wu C-C, Lin T-L, Glickman LT, Welch DF, HogenEsch H (1997): экспериментальное заражение молодых кошек, свободных от специфических патогенов, с помощью Bartonella henselae. J Infect Dis 176, 206–216.
Guptill L, Wu CC, HogenEsch H, Slater LN, Glickman N, Dunham A, Syme H, Glickman L (2004): Распространенность, факторы риска и генетическое разнообразие инфекций Bartonella henselae у домашних кошек в четырех регионах США. .J Clin Microbiol 42, 652-659.
Guptill-Yoran L. (2012): Бартонеллез кошек. В: CE Грин (Ред.): Инфекционные болезни собак и кошек. 4 th ed., Elsevier Saunders St. Louis, MO-USA, 545-552.
Gurfield AN, Boulouis H-J, Chomel BB, Kasten RW, Heller R, Bouillin C, Gandoin C, Thibault D, Chang C-C, Barrat F, Piemont Y (2001): Эпидемиология инфекции Bartonella у домашних кошек во Франции. Vet Microbiol 80, 185-198.
Haimerl M, Tenter AM, Simon K, Rommel M, Hilger J, Autenrieth IB (1999): Распространенность Bartonella henselae у кошек в Германии.J Med Microbiol 48, 849-856.
Heller R, Artois M, Xemar V, de Briel D, Gehin H, Jaulhac B, Monteil H, Piemont Y (1997): Распространенность Bartonella henselae и Bartonella clridgeiae у бездомных кошек. J. Clin Microbiol. 35, 1327-1331.
Ishak AM, Radecki S, Lappin MR (2007): Распространенность Mycoplasma haemofelis, Candidatus Mycoplasma haemominutum, видов Bartonella, видов Ehrlichia и ДНК Anaplasma phagocytophilum в крови кошек с анемией.J Feline Med Surg 9, 1-7.
Joseph JL, Oxford EM, Santilli RA (2018): Преходящее утолщение миокарда у кошек с положительной реакцией на Bartonella henselae. Журнал J Vet Cardiol 20, 198-203.
Каплан Дж. Э., Мазур Х., Холмс К. К., USPHS; Общество инфекционных болезней Америки (2002): Руководство по профилактике оппортунистических инфекций среди ВИЧ-инфицированных. Рекомендации Службы общественного здравоохранения США и Американского общества инфекционистов. MMWR Recomm Rep 51, 1-52.
Ketring KL, Zuckerman EE, Hardy Jr WD (2004): Bartonella: новый этиологический агент глазных болезней кошек. J Am Animal Hospital Ass 40, 6-12.
Кордик Д., Браун Т.Т., Шин К., Брейчвердт Э.Б. (1999): Клиническая и патологическая оценка хронической инфекции Bartonella henselae или Bartonella Clarridgeiae у кошек. J Clin Microbiol 37, 1536-1547.
Кордик Д.Л., Папич М.Г., Брейчвердт Э.Б. (1997): Эффективность энрофлоксацина или доксициклина для лечения инфекций, вызванных Bartonella henselae или Bartonella Clarridgeiae у кошек.Антимикробные агенты Chemother 41, 2448-2455.
Lange D, Oeder C, Waltermann K, Mueller A, Oehme A, Rohrberg R, Marsch W, Fischer M (2009): Бациллярный ангиоматоз. J. Dtsch Dermatol Ges 7, 767-769.
Lappin MR, Black JC (1999): Инфекция Bartonella spp как возможная причина увеита у кошек. J Am Vet Med Assoc 214, 1205–1207.
Lappin MR, Breitschwerdt E, Brewer M, Hawley J, Hegarty B (2009): Распространенность антител видов Bartonella и ДНК видов Bartonella в крови кошек с лихорадкой и без нее.J Feline Med Surg 11, 141-148.
La Scola B, Raoult D. (1999): Культура Bartonella quintana и Bartonella henselae из образцов человека: 5-летний опыт (1993–1998). J Clin Microbiol 37, 1899–1905.
Лейбовиц К., Пирс Л., Брюер М., Лаппин М.Р. (2008): антитела и ДНК видов Bartonella в спинномозговой жидкости кошек с заболеванием центральной нервной системы. J Feline Med Surg 10, 332-337.
Лин JW, Chen CM, Chang CC (2011): Неизвестная лихорадка и боль в спине, вызванные Bartonella henselae у ветеринара после укола иглой: отчет о болезни и обзор литературы.Vector Borne Zoonotic Dis 11, 589-591.
Малик Р., Баррс В.Р., Черч Д.Б., Зан А., Аллан Г.С., Мартин П., Вигни Д.И. (1999): Вегетативный эндокардит у шести кошек. J Feline Med Surg 1, 171-180.
Massei F, Messina F, Gori L, Macchia P, Maggiore G. (2004): высокая распространенность антител к Bartonella henselae среди итальянских детей без признаков болезни кошачьих царапин. Clin Infect Dis 38, 145-148.
Mazurek L, Winiarczyk S, Skrzypczak M, Adaszek L (2019): Кошки как резервуар Bartonella henselae для собак.Энн Агр Энв Мед 26, 669-671.
Mc Donald KA, Chomel BB, Kittlesone MD, Kasten RW, Thomas WP, Pesavento P (2004): проспективное исследование инфекционного эндокардита собак в северной Калифорнии (1999-2001): появление бартонеллы как распространенного этиологического агента. J Vet Int Med 18, 56-64.
McGill S, Wesslen L, Hjelm E, Holmberg M, Auvinen M, Berggren K, Grandin-Jarl B, Johnson U, Wikström S, Friman G (2005): Bartonella spp. серологическая распространенность у здоровых шведских доноров крови.Scand J Infect Dis 37, 723-730.
Molia S, Kasten RW, Stuckey MJ, Boulouis HJ, Allen J, Borgo GM, Koehler JE, Chang CC, Chomel BB. (2016): Выделение Bartonella henselae, Bartonella koehlerae subsp. koehlerae, Bartonella koehlerae subsp. butieri и новый подвид B. koehlerae от львов, обитающих на свободе (Panthera leo) из Южной Африки, гепардов (Acinonyx jubatus) из Намибии и гепардов из Калифорнии. Epidemiol Infect 144, 3237-3243.
Morgenthal D, Hamel D, Arndt G, Silaghi C, Pfister K, Kempf VA и др. (2012): Распространенность гемотропных Mycoplasma spp, Bartonella spp и Anaplasma phagocytophilum у кошек в Берлине / Бранденбурге (Северо-Восточная Германия).Берл Мунк Тиерацтль Вохеншр 125, 418-427.
Морс С.Ф., Оливал К.Дж., Косой М., Биллетер С., Паттерсон Б.Д., Дик К.В. и др. (2012): Глобальное распространение и генетическое разнообразие Bartonella у летучих мышей (Hippoboscoidea, Strebilidae, Nycteribiide). Inf Gen Evol 12, 1717-1723.
Namekata DY, Kasten RW, Boman DA, Straub MH, Siperstein-Cook L, Couvelaire K, Chomel BB (2010): Оральное выделение Bartonella у кошек: корреляция с бактериемией и серопозитивностью.Vet Microbiol 146, 371-375.
Parra E, Segura F, Tijero J, Pons I, Nogueras MM (2017): Разработка ПЦР в реальном времени на Bartonella spp. обнаружение нового появляющегося микроорганизма. Молекулярные и клеточные зонды 32, 55-59.
Пирс Л.К., Радецки С.В., Брюер М., Лаппин М.Р. (2006): Распространенность антител к Bartonella henselae в сыворотке крови кошек с клиническими признаками заболевания центральной нервной системы и без них. J Feline Med Surg 8, 315-320.
Pennisi MG, La Camera E, Giacobbe L, Orlandella BM, Lentini V, Zummo S, Fera MT (2010): Молекулярное обнаружение Bartonella henselae и Bartonella Clarridgeiae в клинических образцах домашних кошек из Южной Италии.Res Vet Sci 88, 379-384.
Pennisi MG, Marsilio F, Hartmann K, Lloret A, Addie D, Bélak S и др. (2013): Инфекция видов Bartonella у кошек. Руководящие принципы ABCD по профилактике и ведению. J Feline Med Surg 15, 563-569.
Перес С., Хаммел Дж. Б., Кин Б. В., Магги Р. Г., Диниз ППВП, Брейчвердт Э. Б. (2010): Успешное лечение эндокардита, вызванного Bartonella henselae, у кошек. J Feline Med Surg 12, 483-486.
Persichetti MF, Solano-Gallego L, Serrano L, Altet L, Reale S, Masucci M, Pennisi MG (2016): Обнаружение трансмиссивных патогенов у кошек и их эктопаразитов на юге Италии.Паразиты Вектора 9, 247.
Persichetti MF, Pennisi MG, Vullo A, Masucci M, Migliazzo A, Solano-Gallego L (2018): Клиническая оценка уличных кошек, подвергшихся воздействию эктопаразитов, и связанный с этим риск трансмиссивных инфекций в южной Италии. Векторы паразитов 11, 136.
Quimby J, Elston T, Hawley J, Brewer M, Miller A, Lappin MR (2008): Оценка ассоциации видов Bartonella, вируса герпеса кошек 1, калицивируса кошек, вируса лейкемии кошек и вируса иммунодефицита кошек с хроническим гингивостоматитом кошек.J Feline Med Surg 10, 66-72.
Regier Y, Ballhorn W., Kempf VAJ (2017): Молекулярное обнаружение Bartonella henselae в 11 клещах Ixodes ricinus, выделенных от одной кошки. Parasit Vectors 10, 105.
Регнери Р.Л., Руни Дж. А., Джонсон А. М., Несби С. Л., Манзевич П., Бивер К., Олсон Дж. Г. (1996): экспериментально индуцированные инфекции Bartonella henselae с последующим контрольным воздействием и антимикробной терапией у кошек. Am J Vet Res 57, 1714. Исправление в: Am J Vet Res (1997) 58, 803.
Samarkos M, Antoniadou V, Vaiopoulos AG, Psichogiou M (2018): Энцефалопатия у взрослого с болезнью кошачьих царапин. BMJ Case Rep., Bcr-2017-223647.
Tsuneoka H, Yanagihara M, Otani S, Katayama Y, Fujinami H, Nagafuji H, Asari S, Nojima J, Ichihara K (2010): первый случай эндокардита, вызванного Bartonella henselae, в Японии, диагностированный с помощью длительного культивирования образца из иссеченный клапан. Диагностика Microbiol Infect Dis 68, 174-176.
Ueno H, Hohdatsu T, Muramatsu Y, Koyama H, Morita C (1996): вызывает ли коинфекция Bartonella henselae и FIV клинические расстройства у кошек? Microbiol Immunol 40, 617-620.
Varanat M, Broadhurst J, Linder KE, Maggi RG, Breitschwerdt EB (2012): Идентификация Bartonella henselae у 2 кошек с пиогранулематозным миокардитом и диафрагмальным миозитом. Vet Pathol 49, 608-611.
Варанат А., Трэвис А., Ли В., Магги Р.Г., Биссетт С.А., Линдер К.Э., Брейчвердт Э.Б. (2009): Рецидивирующий остеомиелит у кошек из-за инфекции Bartonella vinsonii subsp. berkhoffii генотип II. J Vet Intern Med 23, 1273-1277.
Ямамото К., Чомель Б.Б., Кастен Р.В., Хью С.М., Вебер Д.К., Ли В.И. (2002): Экспериментальное заражение кошек, свободных от конкретных патогенов (SPF), двумя разными штаммами Bartonella henselae типа I: сравнительное исследование.Vet Res 33, 669-684.
PPT - Джеки Лестер Ясмин Лутц Презентация PowerPoint, скачать бесплатно
Гемобартонеллез (кошачья инфекционная анемия) Джеки Лестер Ясмин Лутц Группа B
История Паразитарная болезнь, впервые описанная в США в 1953 году. выявлено два генотипа. Малый вариант (Hemobartonellafelis) и большой вариант (Mycoplasmahaemofelis.)
Этиология Гемабартонеллез вызывается инфицированием красных кровяных телец Hemobartonellafelisor Mycoplasmahaemofelis (эпицеллоцитрические паразиты f.) Организмы распознаются как маленькие синие кокки, кольца или палочки по краям или поперек мембраны красных кровяных телец. Иммунная система обнаруживает паразита, а затем пытается уничтожить его вместе с эритроцитом, к которому он прикреплен. Анемия, которая может быть вызвана этим паразитом, называется инфекционной анемией кошек (FIA)
1-я фаза: • препаразитемическая фаза • длится от 2 до 21 дня • кошки инфицированы, но не проявляют клинических признаков • микроорганизмы не обнаруживаются в кровотоке • 2-я фаза: • острая фаза • длится от 2 до 4 месяцев • иногда возникают клинические признаки и паразитемия, степень тяжести варьируется • некоторые из них протекают бессимптомно, у других кошек глубокая анемия и болезнь, которая может быть смертельной Четвертая секунда Первая третья Четыре фазы гемабартонеллеза • 4-я фаза: • фаза носительства • может длиться годами • казаться клинически нормальной • организм редко выявляется • 3-я фаза: • фаза выздоровления • может варьироваться по продолжительности • может оставаться легкой анемией и бессимптомной • фазы паразитемии минимальные
Сигнал Пол: Коты обычно более агрессивны, что делает их несколько более предрасположенными.Возраст: кошки в возрасте до четырех лет подвержены более высокому риску, но им может быть любой возраст. Кошки с неправильной вакцинацией, лейкозом кошек, вирусом иммунодефицита кошек и анемией более подвержены риску развития этого паразита. Те, у кого в анамнезе повторялись раны от укусов кошек, также более подвержены риску. География: кошки, живущие на улице, относятся к группе повышенного риска. Порода: Ни одна из известных пород не имеет повышенного риска.
Передача Считается, что гемабартонеллез передается / распространяется через: кровососущих насекомых (блох, клещей, комаров). Прямой контакт между кошками во время драки, особенно через открытые укушенные раны.Внутриутробно или от кормящих котят Также подозревается внутриутробная передача. (Передача при естественных инфекциях трудно полностью прояснить.)
Депрессия • Летаргия • Лихорадка • Тахикардия / тахипноэ • Иктеричность / бледность • Потеря веса / анорексия • Анемия • Чувствительный живот (спленомегалия) и гепатомегалия. Клинические признаки могут развиваться медленно при хроническом заболевании или развиваться остро.
Диагностические тесты и результаты • Поскольку паразит появляется циклически, он не всегда присутствует в кровотоке.Это означает, что для точного диагноза может потребоваться несколько тестов. • Если кошка страдает анемией и присутствует большое количество Hemabartonellafelis, диагностируется инфекционная анемия кошек. • Гемабартонеллез диагностируется с помощью анализа мазка крови, окрашенного методом Райта-Гимзы, и общего анализа крови. Они выявят на эритроцитах эпицлеточные коккоидные или кольцевидные организмы. • Также следует провести тест Кумбса, который может дать положительный результат.
Лечение Поскольку антибиотики не выводят организм полностью, инфицированные кошки, которые выздоравливают, все равно остаются хроническими носителями и могут быть подвержены рецидивам во время стресса или болезни.Гемабартонеллез прост и обычно успешен, если его лечить с помощью таких антибиотиков, как: доксициклин, тетрациклин, окситетрациклин, энрофлоксацин, глюкокортикоиды, антибиотики, не удаляют организм полностью, но подавляют размножение паразита. В тяжелых случаях анемии может потребоваться переливание крови.
Прогноз Даже без лечения почти 65% тяжелобольных кошек выживут. • Если гемабартонеллез является основной проблемой, прогноз выздоровления очень хороший.• 75% кошек выживут, если будет поставлен диагноз и будет проведено лечение. • Прогноз хуже, если основной проблемой является лейкемия кошек. • Переливание крови плюс антибактериальная терапия не вызывают длительной ремиссии.
Профилактика • Вакцины от гемабартонеллеза не существует, но своевременное использование комбинированных вакцин может предотвратить осложнения с FeLV и гемабартонеллафелисом. • Поскольку переносчиками этого паразита являются кровососущие паразиты, правильная борьба с блохами и клещами также снизит риск заражения вашей кошки.• Хранение кошки в дверях может предотвратить кошачьи драки, в конечном итоге предотвращая любой прямой контакт с другими инфицированными кошками через открытые раны.
ПРОФИЛАКТИКА ЭТО КЛЮЧ !!!! Профилактика блох и клещей может иметь важное значение для предотвращения гемабартонеллеза. Если держать кошку внутри или присматривать за ней, когда вы выпускаете ее, это может предотвратить раны от кошачьих укусов. После лечения ваша кошка останется хроническим носителем и по-прежнему будет подвержена рецидивам во время стресса или болезни.ЗДОРОВЫЙ КОШЕЧОК - СЧАСТЛИВЫЙ КОШЕЧОК! Client Education
ССЫЛКИ: http://ahdc.vet.cornell.edu/clinpath/modules/rbcmorph/mycoplasma-felis.htm http://caremoreanimalhospital.vetsuite.com/Templates/ContentPages/ArticleContext/ViewArtent .aspx? Id = 300 http://www.vet.uga.edu/VPP/clerk/Cowgill/Index.php http://www.sbvet.net/ClientEducation_FIA.html http://www.merckvetmanual.com/ mvm / index.jsp? cfile = htm / bc / 10406.htm КОНЕЦ!
Feline Infektiöse Anämie - Википедия
Die Feline Infektiöse Anämie (Abkürzung FIA , синоним: Hämobartonellose , Hämobartonellose , Hämolitérée de la de la de la de la de la de la de la de la de la de médée de la de la de la ménitérée.Sie wird durch hämotrope Mykoplasmen hervorgerufen, das sind Bakterien, welche die roten Blutkörperchen ( Erythrozyten ) befallen. Bei gesunden Tieren ist die Infektion zumeist harlos und verläuft ohne klinische Symptome. Bei geschwächten Tieren kann sie jedoch eine akute oder chronische Blutarmut (Anämie) hervorrufen. Die Krankheit ist heilbar, bleiben die Tiere lebenslang Träger des Erregers и stellen somit eine Infektionsquelle für andere Katzen dar. In der Praxis ist sie insbesondere as Begleiterkrankung von Viruskrankheiten, die zu einer weiteren Verschlechterung des Gesundheitszustandes führt, und als Potenzielle Gefahr bei Bluttransfusionen bei Katzen von Bedeutung.Da die Erreger eine hohe Wirtsspezifität besitzen, sind Menschen und andere Tiere als Katzen für diese Krankheit nicht empfänglich.
Erreger und PathogeneseBearbeiten
| Feline hämotrope Mykoplasmen |
|---|
| Систематик |
| Артен |
|
Mehrere Erreger der felinen Infktiösen Anämie werden unterschieden, die durch neuere molkularbiologische Untersuchungen taxonomisch den Mykoplasmen zord.Die große Form wird heute als Mycoplasma haemofelis bezeichnet, für die kleine Форма wurde der Имя Mycoplasma haemominutum vorgeschlagen. Beide Erreger wurden bis 2001 als Haemobartonella felis (daher der Name «Hämobartonellose») или Eperythrozoon felis bezeichnet und zu den Rickettsien gezählt, das frühere „Ohio-Isofelas“ , das frühere „Ohio-Isofelas“ Mycoplasma haemominutum . 2005 wurde ein dritter Erreger isoliert, für den der Имя Mycoplasma turicensis vorgeschlagen wurde.Die drei Erreger werden als hämotrope Mykoplasmen zusammengefasst. Es handelt sich um Obligat epizellulare (nur auf lebenden Zellen überlebensfähige), грамотрицательные бактерии Bakterien. Der in allen Studien am häufigsten nachgewiesene Erreger ist Candidatus Mycoplasma haemominutum .
Die Erreger befallen die roten Blutkörperchen und führen zu einer Membranschädigung. Die geschädigten Erythrozyten werden daraufhin von weißen Blutkörperchen (v. A. Monozyten, seltener durch нейтрофильный гранулозитен) phagozytiert.Ein Großteil der Eryrthrozytenelimination erfolgt durch die Makrophagen in der Milz, weshalb Katzen mit entfernter Milz (Спленэктомия) besonders gefährdet sind. Bei der Passage durch die rote Milzpulpa (vgl. Anatomie der Milz), dem Ort der Aussonderung geschädigter или gealterter Erythrozyten, wurde auch die Ablösung und Phagozytose der Mykoplasmen ohne Phagozytose des Erythrozytose. Die Menge des beim Abbau der Erythrozyten (Hämolyse) freigesetzten roten Blutfarbstoffs ( Hämoglobin ) kann im Regelfall von der Leber verarbeitet werden.Nur sehr selten kommt es zu einem Anstieg des Blutfarbstoffs im Blut (Hämoglobinämie) und dann zu einer Ausscheidung über den Harn (Hämoglobinurie).
Für die Pathogenese ist weiterhin von Bedeutung, dass das Immunsystem nicht nur Antikörper gegen die Erreger, sondern auch gegen die Erythrozyten selbst produziert, so dass die Erkrankung zum Teiltell eine Autoimmunkrankheit.
Die Krankheit wurde erstmals 1942 в Südafrika beobachtet. Hämotrope Mykoplasmen kommen jedoch weltweit latent bei vielen Katzen vor, diese Tiere stellen das Erregerreservoir dar.Neben Hauskatzen ist der Erreger auch bei Tigern nachgewiesen worden. В einer Studie zur epizootiologischen Situation in der Schweiz (Лит .: Willi, 2006) варен этва неун Prozent der Hauskatzen durch hämotrope Mykoplasmen infiziert. Über akute Erkrankungen gibt es in Europa bislang nur einzelne Fallberichte, darunter auch aus Deutschland und der Schweiz.
Der natürliche Übertragungsweg ist unbekannt. Es wird vermutet, dass blutsaugende Parasiten (Flöhe, Zecken und Läuse) beteiligt sind, sie также eine Feline Vector -borne Disease darstellen, oder auch Biss- und Kratzverletzungen.Eine Übertragung von der Kätzin auf die Welpen ist ebenfalls möglich, Allerdings ist bislang unklar, ob diese über die Muttermilch ( laktogen ) или bereits vor der Geburt über den Mutterkuchen, transfolentar (). Ein weiterer Übertragungsweg ist der über Bluttransfusionen (ятрогенная инфекция). Experimentell wurde weiterhin die Möglichkeit einer peroralen sowie intraperitonealen Übertragung nachgewiesen.
Die Inkubationszeit Beträgt Bei Experimenteller parent Infektion zwischen 2 and 17 Tagen, bei Experimenteler peroraler Infektion zwischen drei und sieben Wochen.
Im Regelfall verläuft die Симптомы инфекции. Klinisch tritt eine Erkrankung meist nur bei Schwächung des Immunsystems auf, zum Beispiel durch Stress oder andere Erkrankungen, vor all bei Katzenleukämie und Immundefizienzsyndrom der Katzen. Oft sind junge Tiere (unter 3 Jahre) von der Erkrankung betroffen. Daneben gelten Katzen mit Freilauf, unzureichend geimpfte Tiere und bereits einmal an von Katzenbissen verursachten Abszessen erkrankte Tiere als Risikogruppe. Das Geschlecht, die Anzahl der im Haushalt lebenden Katzen und der Befall der Tiere mit Flöhen sind keine signifikanten Risikofaktoren.
Die akute FIA zeigt sich in Fieber, reduzierter Nahrungsaufnahme, allgemeiner Schwäche, blassen Schleimhäuten und Milzvergrößerung. Eine Gelbsucht oder Hämoglobinurie tritt nur sehr selten auf. Nach Überstehen der ersten akuten Krankheitsphase treten die Symptome mit jeder erneuten Bakteriämie immer wieder schubweise (intermittierend) auf. Интервал симптомов Dazwischen liegen. In seltenen Fällen treten Hautirritationen wie Hyperästhesie und Haarausfall auf.
Bei der chronischen FIA sind die klinischen Symptome schwächer ausgeprägt, oftmals fehlen sie ganz.Die Körpertemperatur ist normal oder leicht erniedrigt.
Labordiagnostische BefundeBearbeiten
Bei der Labormedizinischen Untersuchung zeigt sich eine makrozytäre, normo- oder hypochrome hämolytische Anämie, welche durch drei Hauptkriterischen chauptkriteriencharakterien (auptkriteriencharakterien.
Auf einem Objektträger agglutiniertes Blut einer Katze, mikroskopisch- 1. Hauptkriterium: Als einfache Laboruntersuchung ist die Durchführung eines Objektträgeragglutinationstestes («биологический тест Кумбса») möglich: Ein Tropfen heparinisiertenophenchen und möglich: Ein Tropfen heparinisiertenophenchen und möglicht.Im Positiven Falle verklumpen (agglutinieren) die Erythrozyten. Um diesen Befund von der auch Physiologisch vorkommenden «Geldrollenbildung» roter Blutkörperchen abzugrenzen, sollte ein positiver Test unter Zusatz eines Tropfens Physiologischer Kochsalzlösung wiederholt werden. Durch Verwendung vorgekühlter Objektträger kann sogar das Vorhandensein von Kälteagglutininen nachgewiesen werden.
- 2. Hauptkriterium: Im Blutbild ist eine Verminderung der Zahl der roten Blutkörperchen, eine sogenannte Anämie feststellbar.Dabei handelt es sich um eine регенеративная Anämie, d. час es werden ständig neue Erythrozyten im Knochenmark nachgebildet. Da die Neubildungskapazität des Knochenmarks überschritten ist, werden auch unreife Erythrozyten (Retikulozyten, eventuell auch Normoblasten) в das Blut freigesetzt. Die Erythrozyten haben Verschiedene Zellgrößen ( Anisozytose ), es treten vergrößerte Erythrozyten ( Makrozytose ) и eine unterschiedliche Anfärbung der Erythrozyten (типичный .Somit liegt als zweites Majorkriterium eine (stark) регенеративный, макрозитарный, гипохромный Anämie mit Sphärozyten vor. Eine erhöhte Anzahl weißer Blutkörperchen (Leukozytose, zumeist als Neutrophilie) ist ebenfalls häufig.
- 3. Hauptkriterium: Durch die Veränderungen an den Erythrozytenmembranen ist der direkte Coombs-Test positiv.
Weitere mögliche Veränderungen im Blut sind ein erhöhter Gehalt von Protein ( Hyperproteinämie ), Bilirubin ( Hyperbilirubinämie ) und von Stickstoffhaltigen Abbauproduteme Enzyme.
DifferentialdiagnosenBearbeiten
Das klinische Bild ist wenig aussagekräftig. Bei Fieber und Anämie muss diese Erkrankung aber stets in das Diagnosespektrum einbezogen werden.
Andere Infektionskrankheiten, die mit einer Anämie einhergehen, sind Katzenleukämie (FeLV), ansteckende Bauchfellentzündung (FIP) и Katzenaids (FIV), аллергены herrscht hier eine näicht-регенеративные. Аух в более строгом Befall mit Endo- oder Ektoparasiten kann eine Anämie verursachen.Die Feline Babesiose (Erreger Babesia felis ) ist klinisch nicht von der FIA abzugrenzen und kommt zum Teil mit ihr vergesellschaftet vor. Die Cytauxzoonose (Infektion mit Cytauxzoon felis ) выделен в Mitteleuropa keine Rolle, sondern kommt vor allem in den Südstaaten der USA vor.
Die Bedeutung der autoimmunbedingten hämolytischen Anämien (AIHA) ist bei Katzen noch ungeklärt. Bislang wurde sie nur im Zusammenhang mit der FIA selbst sowie der Katzenleukose beschrieben.
Des Weiteren müssen nichtinfektiöse Ursachen für eine Anämie ausgeschlossen werden, wie beispielsweise Eisenmangel und chronische Blutverluste (Magengeschwüre, chronische Blasenentzündungen). Ein Erythropoetin-Mangel kommt v. A. bei chronischem Nierenversagen vor, die bei älteren Katzen häufig ist. Schädigungen des Knochenmarks (zum Beispiel durch Zytostatika oder Schwermetalle) verursachen nicht-регенеративная Anämien. Verschiedene Medikamente werden von Katzen relativ schlecht vertragen und können als Nebenwirkung eine Anämie verursachen, wie Azathioprin, Griseofulvin, Paracetamol, Phenazopyridin, Phenylbutazon und Propylthiouracil.
Auch genetisch bedingte Enzymdefekte (Pyruvatkinasemangel und Phosphofructokinase-Mangel) können eine Anämie verursachen, für diese existieren DNA-Nachweise.
Eine exakte Diagnose der felinen infktiösen Anämie ist nur durch den Erregernachweis möglich. Eine регенеративная Anämie unterstützt die Diagnose. Nicht-регенерирующий Anämien durch Mykoplasmen treten vermutlich nur bei gleichzeitiger Infektion mit dem felinen Leukosevirus (FeLV) auf, аллергия на Katzenleukose die häufigste Grundkrankheit, die eine FIA Beginnstigt.
Der Erregernachweis kann über eine Anfärbung von Blutausstrichen erfolgen. Zur Untersuchung sollte möglichst frisches Kapillarblut verwendet werden, da sich die Erreger vor allem bei Zugabe von chelatbildenden Gerinnungshemmern (zum Beispiel EDTA) auch von den Erythrozyten ablösen können. Außerdem müssen Blutproben über mehrere Tage entnommen und untersucht werden, da der Erreger nur schubweise im Blut auftritt. Bei der mikroskopischen Untersuchung lassen sich die Erreger als kleine, etwa 0,1 до 1 мкм große Kokken, Stäbchen oder Ringe in der Peripherie der etwa 5 до 7 мкм großen Erythrozyten nachweisen.Bei einer antibiotischen Vorbehandlung kann der Erregernachweis im Blut negativ sein. Außerdem können Artefakte und je nach Färbung erythrozytäre Einschlusskörperchen wie Howell-Jolly- (Reste des Zellkerns der normalerweise kernlosen Erythrozyten) или Heinz-Körper (denaturierzeners HämogiPlus). Die Sicherheit des Nachweises über einen Blutausstrich wird mit nur etwa 50% angegeben.
Weitaus sicherer und spezifischer ist der Erregernachweis über Polymerase-Kettenreaktion (PCR), der heute von allen größeren Untersuchungseinrichtungen angeboten wird.
Eine klinisch манифест Erkrankung ist in etwa 30% der Fälle tödlich, wenn keine Behandlung erfolgt, wobei die Todesursache die vom Erreger ausgelöste schwere Anämie ist. Die hämotropen Mykoplasmen sind empfindlich gegenüber Doxycyclin und anderen Tetracyclinen sowie Fluorchinolonen (энрофлоксацин, марбофлоксацин и прадофлоксацин). Die antibiotische Therapie sollte über zwei bis drei Wochen erfolgen. Eine unterstützende Therapie zur Stabilisierung des Allgemeinbefindens ist empfehlenswert.Bei schwerer Anämie sind Bluttransfusionen angezeigt (etwa 40 до 50 мл Blut, die Spendertiere müssen auf Erregerfreiheit getestet sein).
Da die schädigende Wirkung des Erregers zum Teil über Immunvermittelte Mechanismen erfolgt, wird bei schwerer Erkrankung die Verabreichung von Prednisolon empfohlen.
Nach erfolgreicher Behandlung bleiben die Katzen jedoch zumeist lebenslang Träger des Erregers.
Da der genaue Übertragungsweg unbekannt ist, ist eine gezielte Prophylaxe schwierig.Empfehlenswert ist eine regelmäßige Vorbeugung und Bekämpfung von Ektoparasiten. Hierfür eignen sich Depotpräparate. Katzen, die als Blutspender dienen sollen, sind vorher gründlich auf das eventuelle Vorhandensein der Erreger zu untersuchen.
- Дж. Б. Мессик: Новые взгляды на инфекции гемотрофной микоплазмы (ранее разновидности Haemobartonella и Eperythrozoon) у собак и кошек . В: Вет. Clin. North Am. Маленький. Anim. , Band 33, 2003, S. 1453–1465.PMID 14664208.
- Х. Неймарк, К. Э. Йоханссон, Ю. Рикихиса и Дж. Г. Талли: Пересмотр названий видов гемотрофных микоплазм. В: Международный журнал систематической и эволюционной микробиологии. Band 52, 2002, S. 683–683. PMID 11931184.
- Дж. Э. Сайкс: Гемотропный микоплазмоз кошек (гемобартонеллез кошек) . В: Вет. Clin. North Am. Маленький. Anim. , Band 33, 2003, S. 773–789. PMID 123.
- С. Таскер, М.R. Lappin: Haemobartonella felis: последние достижения в диагностике и лечении. In: J. Fel. Med. Surg. , Band 4, 2002, S. 3–11. PMID 11869051.
- Christiane Weingart und Barbara Kohn: Hämotrope Mykoplasmen bei der Katze: neue Aspekte zu Prävalenz, Klinik, Diagnose, Therapie und Prognose . В: Kleintierpraxis , Band 60, 2015, Nr. 11, S. 590–602.
- B. Willi et al .: Распространенность, анализ факторов риска и последующее наблюдение за инфекциями, вызванными тремя видами кошачьей гемоплазмы у кошек в Швейцарии. In: J. Clin. Microbiol. , Band 44, 2006, S. 961–969. PMID 16517884.

