Кокцидиоз кроликов
Кокцидиоз - инвазионное заболевание, вызываемое одноклеточными паразитическими простейшими - кокцидиям, сопровождающееся поражением кишечника и печени. Имеется 3 основных патогенных вида кокцидий вызывающих заболевание у кроликов: Eimeria stidae, Eimeria flavescenc и Еimeria interstinal.
Пути заражения: Заражение кроликов происходит алиментарным путем через корм, воду, молоко, зараженные ооцистами кокцидий. Крольчата заражаются с первых дней жизни — при сосании молока из загрязненных ооцистами кокцидий сосков матери, а в последующем — с кормом и водой, загрязненных калом, содержащим возбудителя кокцидиоза, а также при поедании кала. Кроличьими кокцидиями заражаются только кролики. Наибольшая восприимчивость наблюдается у молодняка до 3−4 месячного возраста. Взрослые кролики клинической формой болезни болеют редко, оставаясь носителями кокцидиоза.
Клиническая картина. Кокцидиоз у кроликов различается на два типа течения, желудочно-кишечная форма (E.
Инкубационный период при желудочно-кишечной форме составляет 10-15 дней. Характеризуется поносом, отказом от корма, вялостью, апатичностью, иногда судорогами. Смертность при ЖКТ форме кокцидиоза высокая, так как болезнь чаще всего протекает остро, и кролик погибает от обезвоживания, спазмов кишечника и голодания. Инкубационный период при печеной форме составляет от 30 до 50 дней. Чаще всего характеризуется желтушностью видимых слизистых оболочек, асцитом, вялостью и отказом от корма. Прогноз при печеночной форме благоприятней, но чаще всего кишечная и печеночная формы протекают вместе.
Цикл развития. У кокцидий выделяют три фазы развития, споруляция, инвазирование и шизогония, а в конце гематогония и формирования ооцисты.
Первая стадия развития споруляция происходит во внешней среде. Под воздействие температуры (25-27 градусов) в ооцисте начинает деление ядра на 4 споробласта, который секретируют из защитного материала и становятся спороцистой.
 Затем в каждой спороцисте происходит деление на 4 спорозоита. Время споруляции зависит от температуры окружающей среды, обычно оно занимает от 2-4 дней. На этой стадии кролик заглатывает спорулированную ооцисту. В желудочно-кишечном тракте ооциста под воздействие желчи выходит из цисты и внедряется в эпителиальную стенку желудка. После этого начинается вторая стадия развития ШИЗОГОНИЯ. После внедрения спорозоита в эпителий он становится трофозоитом. Через несколько дней после внедрения, трофозоит формирует шизонт. В шизонте формируются мерозоиты, это удлиненные ядерные организмы. После окончания деления шизонт созревает и разрывается, мерозоиты инвазируют окружающие ткани. Такое деление может повторяться. Следующий этап в деления называется ГАМЕТОГОНИЯ или половое деление. После выделения мерозоитов они начинают делиться на мужские и женские гаметоциты. Женская гаметоцита, внедряясь в эпителий, отличается от шизонта один большим ядром. Мужские гаметоциты называются микрогаметоциты, они подвергаются многократному делению с формированием жгутиковых микрогамет.
Затем в каждой спороцисте происходит деление на 4 спорозоита. Время споруляции зависит от температуры окружающей среды, обычно оно занимает от 2-4 дней. На этой стадии кролик заглатывает спорулированную ооцисту. В желудочно-кишечном тракте ооциста под воздействие желчи выходит из цисты и внедряется в эпителиальную стенку желудка. После этого начинается вторая стадия развития ШИЗОГОНИЯ. После внедрения спорозоита в эпителий он становится трофозоитом. Через несколько дней после внедрения, трофозоит формирует шизонт. В шизонте формируются мерозоиты, это удлиненные ядерные организмы. После окончания деления шизонт созревает и разрывается, мерозоиты инвазируют окружающие ткани. Такое деление может повторяться. Следующий этап в деления называется ГАМЕТОГОНИЯ или половое деление. После выделения мерозоитов они начинают делиться на мужские и женские гаметоциты. Женская гаметоцита, внедряясь в эпителий, отличается от шизонта один большим ядром. Мужские гаметоциты называются микрогаметоциты, они подвергаются многократному делению с формированием жгутиковых микрогамет.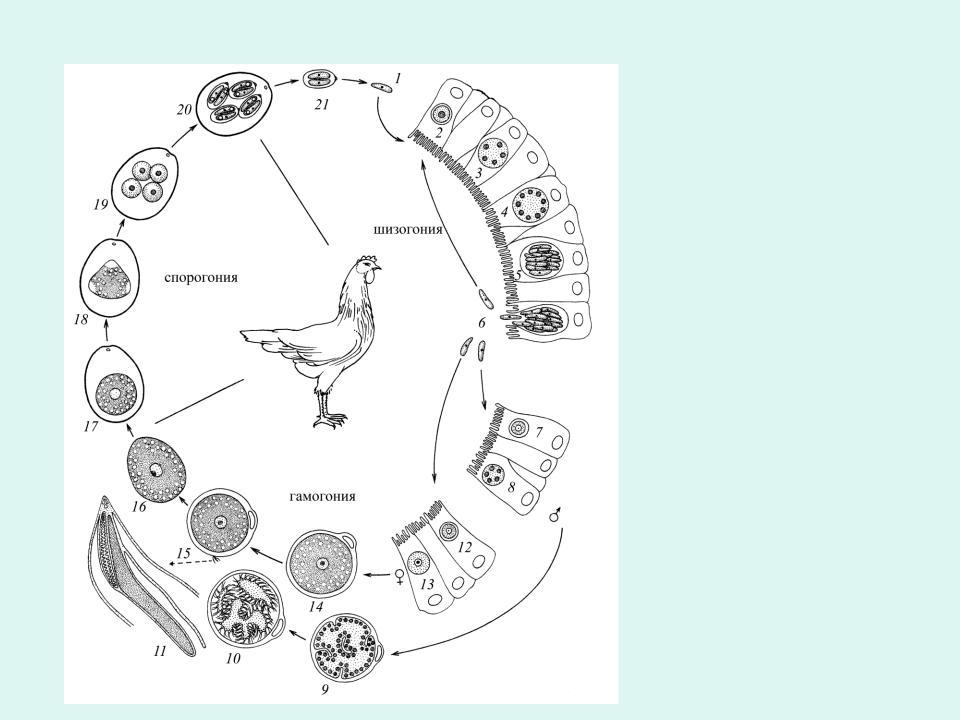
Кокцидиоз, стадии развития и разновидности кокцидий у кроликов
Отряд Кокцидии (Coccidia)
Так же как и грегарины, кокцидии представляют собой обширную группу паразитических простейших, включающую около 400 видов. Паразитируют они в самых различных группах беспозвоночных и позвоночных животных: кольчатых червях, моллюсках, членистоногих, позвоночных. Для кокцидий характерен внутриклеточный паразитизм в различных органах и тканях. Их жизненный цикл слагается (за единичными исключениями) из закономерного чередования бесполого размножения, полового процесса и спорогонии. У одних видов спорогония совершается вне организма хозяина, в наружной среде; У других, при наличии смены хозяев, бесполое размножение и спорогония происходят в организме разных хозяев.
Некоторые виды кокцидий являются опасными паразитами домашних животных, домашней птицы и некоторых разводимых в рыбоводческих хозяйствах рыб. Один очень редкий вид кокцидий паразитирует в человеке. Рассмотрим один пример из числа наиболее обычных и вместе с тем патогенных видов.
В кроликах паразитирует несколько видов рода эймерия (Eimeria). Большая часть их — паразиты кишечника, один вид локализуется в печени. Эймерии — кокцидии, развитие которых не сопровождается сменой хозяев. В их жизненном цикле имеется два основных этапа. Первый этап цикла протекает в кишечнике кролика. Это эндогенная часть цикла.
Второй этап проходит вне тела хозяина, во внешней среде—экзогенная часть цикла.
Eimeria magna — один из наиболее широко распространенных видов кокцидий кролика. На рисунке 70 схематически представлены основные этапы жизненного цикла этого паразита.
Начнем рассмотрение жизненного цикла Eimeria magna с момента, когда паразит проникает в кишечник хозяина.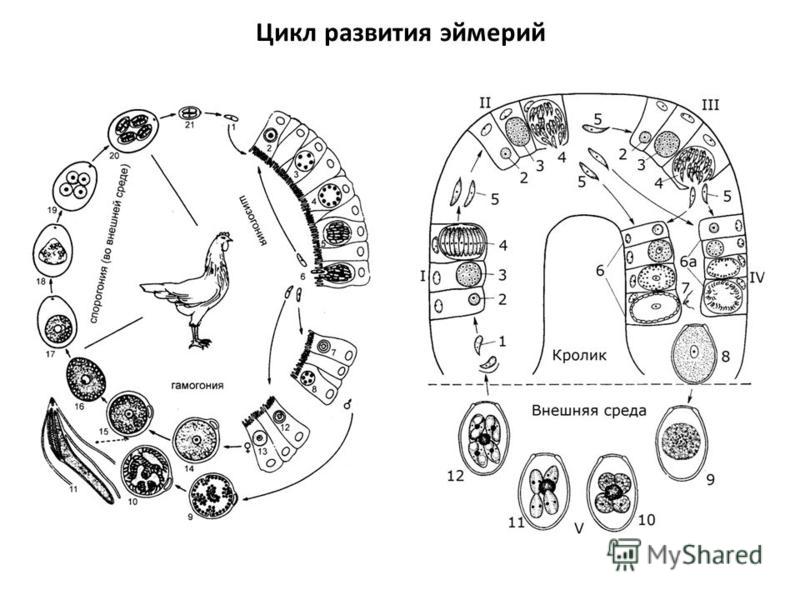 Первой стадией эндогенной части цикла является спорозоит, выходящий из заглоченной кроликом ооцисты (строение и развитие ооцист будет рассмотрено ниже). Спорозоиты — это очень маленькие клетки (длиной около 8 мк, шириной 2—3 мк), веретеновидной формы с одним ядром. Они активно внедряются в клетки эпителия кишечника, где тотчас же округляются, становятся шаровидными. За внедрением кокцидии в клетку хозяина следует активный рост: паразит увеличивается в размерах. Питание его осуществляется осмотическим путем. На этой стадии развития паразит носит название шизонта в соответствии с тем способом размножения, к которому он приступает.
Первой стадией эндогенной части цикла является спорозоит, выходящий из заглоченной кроликом ооцисты (строение и развитие ооцист будет рассмотрено ниже). Спорозоиты — это очень маленькие клетки (длиной около 8 мк, шириной 2—3 мк), веретеновидной формы с одним ядром. Они активно внедряются в клетки эпителия кишечника, где тотчас же округляются, становятся шаровидными. За внедрением кокцидии в клетку хозяина следует активный рост: паразит увеличивается в размерах. Питание его осуществляется осмотическим путем. На этой стадии развития паразит носит название шизонта в соответствии с тем способом размножения, к которому он приступает.
По мере роста паразита начинается деление ядра, благодаря чему шизонт становится многоядерным. Число ядер варьирует в довольно широких пределах — от 8 до 60. Растущий шизонт разрушает эпителиальную клетку и постепенно перемещается в субэпителиальный слой соединительной ткани. Развитие шизонта завершается бесполым размножением. Вокруг каждого из ядер обособляется участок цитоплазмы, в результате чего весь шизонт распадается на одноядерные мелкие клетки, каждая из которых имеет веретеновидную форму (рис.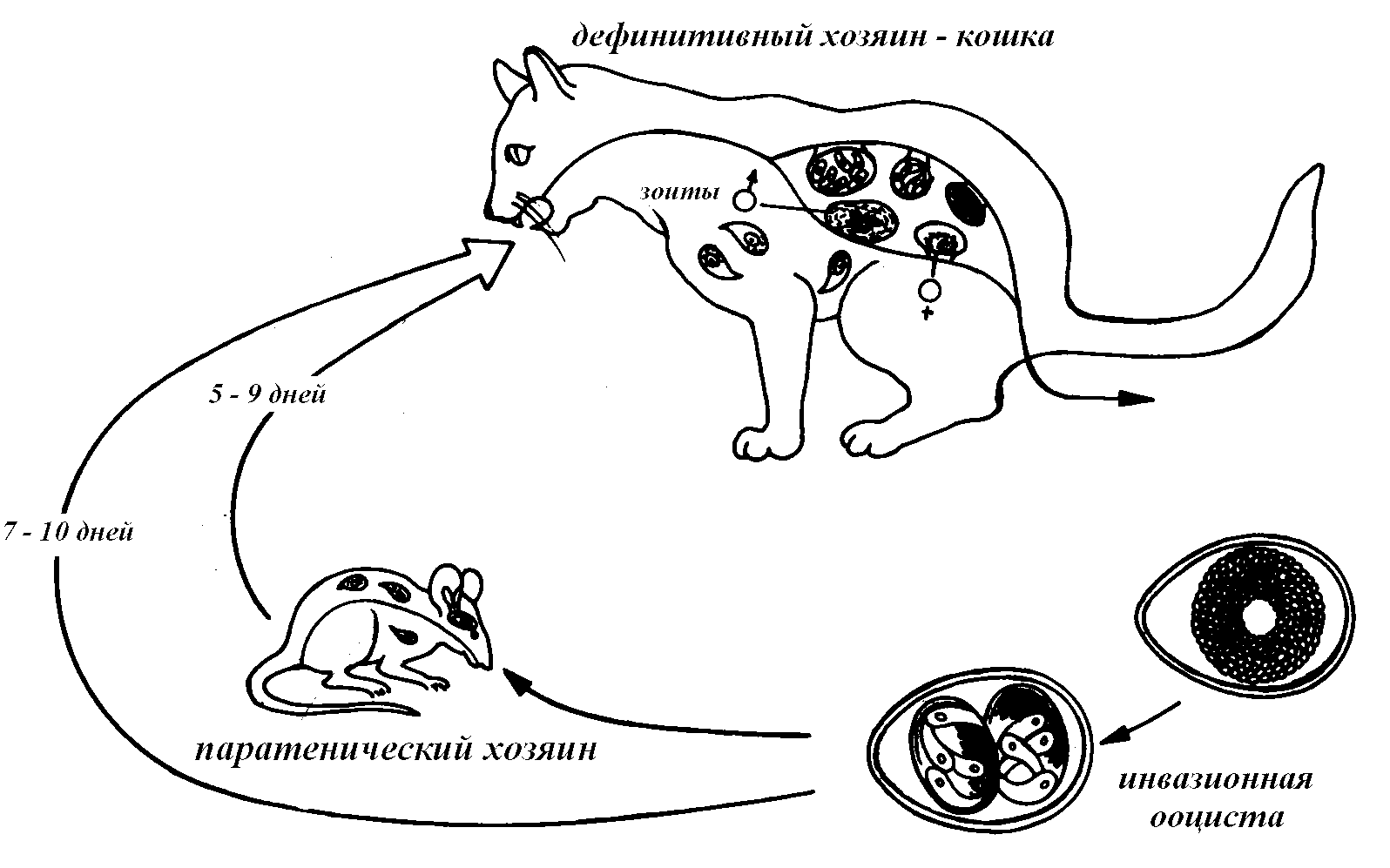 71). На этом заканчивается процесс бесполого размножения шизонта. Такое размножение носит название множественного деления или шизогонии. Весь процесс от момента внедрения спорозоита в эпителиальную клетку до завершения шизогонии занимает 80—96 часов. Одноядерные веретеновидные клетки, образовавшиеся в результате шизогонии, называют мерозоитами. Какова их дальнейшая судьба?
71). На этом заканчивается процесс бесполого размножения шизонта. Такое размножение носит название множественного деления или шизогонии. Весь процесс от момента внедрения спорозоита в эпителиальную клетку до завершения шизогонии занимает 80—96 часов. Одноядерные веретеновидные клетки, образовавшиеся в результате шизогонии, называют мерозоитами. Какова их дальнейшая судьба?
Мерозоиты вновь внедряются в эпителиальные клетки кишечника и дают начало второму поколению шизонтов. Процесс развития шизонтов второго поколения занимает несколько больше времени, чем первого, — 110—132 часа.
Часть мерозоитов от второго поколения дает начало третьему поколению шизонтов. Образующиеся в результате его мерозоиты, так же как и часть мерозоитов второго поколения, не образуют шизонтов. Внедряясь в эпителиальные клетки, они дают начало гаметам (половым клеткам). Гаметы кокцидий резко дифференцированы в половом отношении на мужские микрогаметы и женские макрогаметы. Образование тех и других из мерозоитов протекает различно.
Стадии развития кокцидий, дающие начало микрогаметам, называют микрогаметоцитами. При развитии их, сопровождающемся энергичным ростом, деление ядер начинается на самых ранних стадиях роста, оно совершается гораздо чаще, чем при шизогонии (рис. 72). В результате в цитоплазме располагается несколько сот мелких ядер. Микрогаметы образуются путем вытягивания отдельных ядер. Тело их почти целиком состоит из веретеновидно вытянутого ядра с очень тонким периферическим слоем цитоплазмы. На переднем конце каждой зрелой гаметы имеются два жгута. Длина их очень мала — 4—3 мк. Гаметы подвижны. Большая часть цитоплазмы микрогаметоцита не идет на образование гамет, а остается неиспользованной в виде большого так называемого остаточного тела.
Совсем иначе происходит развитие женских половых клеток — макрогамет (рис. 73). Происходит рост цитоплазмы, не сопровождающийся делением ядра, размеры которого увеличиваются. Ядро приобретает пузыревидное строение, в центре его расположено крупное ядрышко.
Следующий важный этап развития кокцидий — это процесс оплодотворения. Подвижные микрогаметы приближаются вплотную к макрогаметам. Одна микрогамета проникает через микропиле в макрогамету, причем ядра гамет сливаются, образуя характерную веретеновидную фигуру. В момент оплодотворения формируется вторая (внутренняя) оболочка, микропиле закрывается особой слизистой пробкой и зигота попадает в просвет кишечника. Обладающая двумя оболочками зигота получает название ооцисты.
На этом заканчивается эндогенная часть цикла, так как в кишечнике в отсутствие кислорода ооцисты эймерий кролика дальше развиваться не могут.
Экзогенная часть цикла сводится к процессу спорогонии и осуществляется вне тела хозяина. Из кишечника наружу ооцисты выходят вместе с фекальными массами. Только что вышедшие из кишечника ооцисты имеют овальную форму (рис. 70). Все протоплазматическое содержимое отделено от оболочки и занимает центральную часть ооцисты. Споруляция сводится к тому, что после двукратного деления ядра протоплазматическое содержимое ооцисты распадается на четыре одноядерных споробласта. Каждый из них выделяет свою оболочку, превращаясь в спору. Обычно не все протоплазматическое содержимое ооцисты идет на образование споробластов, часть его остается неиспользованной в виде остаточного тела.
В каждой споре ядро делится еще один раз, и образуются два червеобразных одноядерных спорозоита. На этом процесс спорообразования заканчивается. Размеры зрелых ооцист Eimeria magna: длина 25—40 мк, ширина 18—30 мк.
Таким образом, зрелая, способная к заражению ооциста содержит четыре споры, с двумя спорозоитами каждая.
При попадании зрелой ооцисты в кишечник кролика под воздействием кишечного сока пробка ооцисты разрушается, спорозоиты выходят из оболочки спор и проникают в клетки эпителия кишечника, начиная новую, эндогенную часть цикла.
В рассмотренном выше жизненном цикле кокцидий эймерий следует различать три основных этапа, из которых два первых относятся к эндогенной, а третий — к экзогенной части цикла.
Цикл начинается с нескольких поколений бесполого размножения — шизогонии. Это первый этап. Биологическое значение его очевидно: это увеличение числа особей паразита в данном экземпляре хозяина. Благодаря шизогонии количество паразитов возрастает в огромной степени. У кролика, проглотившего даже небольшое количество ооцист, благодаря шизогонии через короткий срок в кишечнике окажется огромное количество паразитов.
Второй этап — это образование половых клеток и оплодотворение. Он завершается формированием тех стадий жизненного цикла паразита (в данном
случае ооцист), при помощи которых происходит распространение паразита на новые особи хозяина, т. е. расселение вида.
е. расселение вида.
Третий этап — спорогония. Он приводит к тому, что «расселительные» стадии жизненного цикла становятся способными к инвазированию (заражению) хозяина. Зрелые ооцисты кокцидий обладают большой стойкостью к действию различных неблагоприятных факторов среды. Наличие двух оболочек является не только механической, но и химической защитой протоплазмы паразита. Это чрезвычайно затрудняет борьбу с кокцидиями, так как применение большинства распространенных дезинфицирующих средств оказывается неэффективным или малоэффективным. Ооцисты очень долго сохраняют жизнеспособность: в течение многих месяцев, а в некоторых случаях до года и более.
Кокцидии — паразиты с очень узкой специфичностью. Почти все виды их строго приурочены к одному виду хозяина и не могут паразитировать даже в близких видах. Например, кокцидии кролика не могут заражать зайцев, а кокцидии зайцев — развиваться в кроликах. В пределах организма хозяина кокцидии локализуются в строго определенных органах и даже частях органов. Например, Е. М. Хейсиным было доказано, что у кролика разные виды кокцидий локализуются в строго определенных отделах кишечника (рис. 74).
Например, Е. М. Хейсиным было доказано, что у кролика разные виды кокцидий локализуются в строго определенных отделах кишечника (рис. 74).
Как уже отмечалось, кокцидии приносят большой вред. Следует отметить, что большинство кокцидиозов (заболеваний, вызываемых кокцидиями) поражает молодых птиц и млекопитающих, это главным образом «детские болезни», хотя и взрослые животные могут заражаться кокцидиями.
Ряд видов кокцидий (Eimeria tenella, Е. praecox и др.) поражает кур (преимущественно цыплят), вызывая нередко гибель молодняка.
Крупный рогатый скот также страдает от кокцидий, причем заболевает преимущественно молодняк (Eimeria zurni, Е. smithi, Isospora aksaica).
В рыбоводных хозяйствах (особенно на Украине) кокцидиозы неоднократно поражали карпов (Eimeria cyprini), что также часто приводило к гибели рыб.
Борьба с кокцидиозами — важная задача животноводства и ветеринарии. Она строится главным образом на профилактических мероприятиях, направленных на предохранение животных от заражения.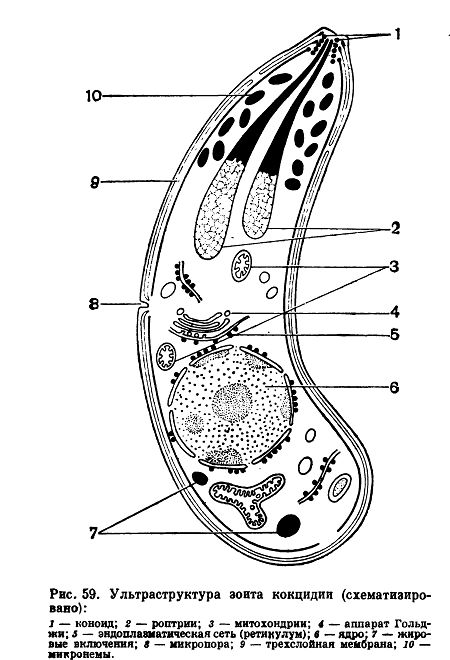
20. Кокцидии coccidia: цикл развития эймерии.
Еimeria stiedae параз-ет в печени кролика и выз-ет печеночный кокцидиоз.
В
организм кролика ооцисты Eimeria stiedae
попадают с загрязненным кормом и водой.
В пищеварительном тракте из ооцист
выходят спорозоиты и внедр. в эпител.
кл. желчных путей печени (куда они
проникают из 12перстной кишки), где
растут, размножаются бесполым путем
посредством множ-го деления – шизогонии.
Эпителиал. кл. разрывается, мерозоиты
внедряются в соседние клетки, вырастают
в шизонты, ядро и протоплазма к-рых снова
делятся, образуя доч. клетки. Последнее
поколение мерозоитов превр-ся в половые
формы: женские — макрогаметоциты (затем
макрогаметы) и мужские — микрогаметоциты.
Образованием половых форм заканч-ся
шизогония и сменяется гаметогонией. В
макрогамете разв-ся ядро, из к-рого
образуются подвижне микрогаметы с 2мя
жгутиками на одном конце (спермии). Микрогаметы выходят в просвет желчных
путей, проникают в макрогаметы и
оплодотворяют их, образуются ооцисты,
выделяемые из орган-ма кроликов с калом.
Образованием ооцист закан-ся гаметогония,
затем спорогония. В выделившимся кале
ооцисты образуюют шар, раздел-ся на 4
споробласта, к-рые покрываются оболочкой
= споры. По окончании спорогонии споры
становятся инвазионными.
Микрогаметы выходят в просвет желчных
путей, проникают в макрогаметы и
оплодотворяют их, образуются ооцисты,
выделяемые из орган-ма кроликов с калом.
Образованием ооцист закан-ся гаметогония,
затем спорогония. В выделившимся кале
ооцисты образуюют шар, раздел-ся на 4
споробласта, к-рые покрываются оболочкой
= споры. По окончании спорогонии споры
становятся инвазионными.
21. Кокцидии coccidia: цикл развития токсоплазмы.
Toxoplasma
gondii
– паразит в кишечнике кошачьих, вызывает
токсоплазмоз.
Ооцисты с калом попадают
во внешн. среду, в ооцистах – спорогония(2
споры с 4 спорозоитами). Ооцисты попадают
с пищей и водой в промеж. хоз.(далее ПХ)
(грызуны, птицы). В кишечнике ПХ из ооцист
и спор выходят спорозоиты; внедряются
в ткани, проникают в кровяное русло.
Паразиты могут оседать в тканях и мышцах,
где размн-ся б/полым путём. Возникают
скопления паразитов – цисты. Кошка жрёт
больную мышь и у неё в кишечнике
токсоплазмы выходят из цист, внедряются
в эпителиальные клетки. В кошке –
шизогония и размн.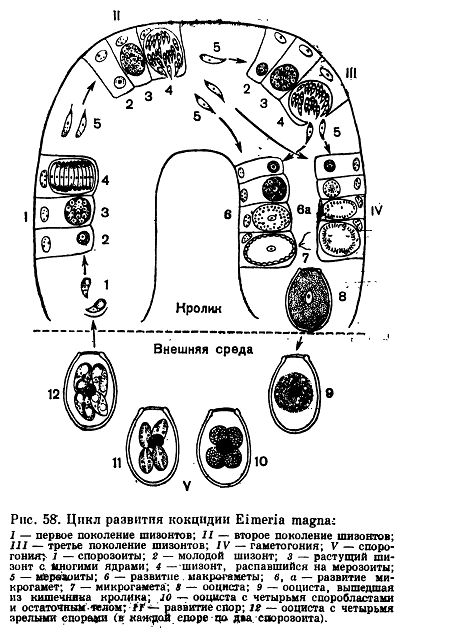 половым путём. Кошка
срёт, в говне ооцисты. Цикл продолжается.
половым путём. Кошка
срёт, в говне ооцисты. Цикл продолжается.
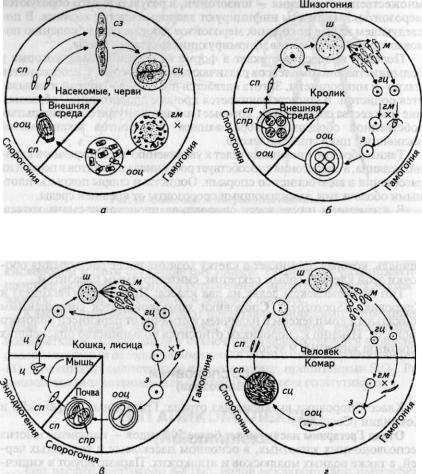
22. Гемоспоридии (haemosporina): цикл развития малярийного плазмодия (род Plasmodium).
ЦИКЛ
РАЗВИТИЯ МАЛЯР. ПЛАЗМОДИЯ(Plasmodium
malaria)
- две фазы: 1. бесполое размножение в
крови человека и половое размножение
в комарах. После укуса зараженного
комара возбудитель в форме активно
плавающего спорозоита попадает в
кровоток человека. Здесь спорозоит
проникает в эритроцит и превр-ся в
шизонт. Шизонт делится на мелкие
мерозоиты, и по мере заполнения эритроциты
разрушаются, а паразиты и токсичные
продукты их метаболизма попадают в
кровь. Часть мерозоитов превр-ся в
половые формы - гаметоциты (муж. и жен.
особи). Кусая зараженного человека,
самка комара вместе с кровью засасывает
и гаметоциты, к-рые превращаются в
гаметы. Муж. гамета сливается с жен., и
образов-ся оплодотворенная кл.(зигота)
проникает в стенку кишечника комара.
Там она превр-ся в ооцисту, в к-рой
развиваются споробласты - предшественники
спорозоитов.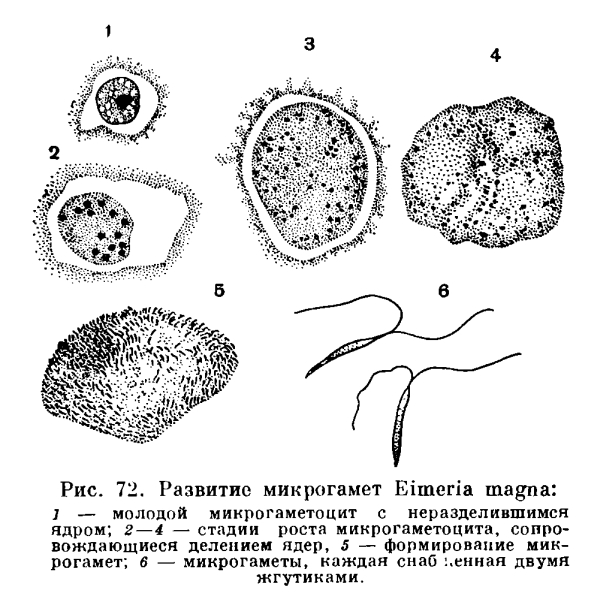 Созревшие спорозоиты
разрушают ооцисту и мигрируют в слюнные
железы комара. Теперь комар способен
заразить человека. В жизнен. цикле маляр.
плазмодия отсутствует стадии развития,
протекающие во внешн. среде.
Созревшие спорозоиты
разрушают ооцисту и мигрируют в слюнные
железы комара. Теперь комар способен
заразить человека. В жизнен. цикле маляр.
плазмодия отсутствует стадии развития,
протекающие во внешн. среде.
КОКЦИДИОЗЫ ЖИВОТНЫХ
Кокцидиозы - протозойные болезни, возбудителями которых являются простейшие,-из отряда кокцидий (Сосcidia). У скота и птицы кокцидий паразитируют преимущественно в эпителиальных клетках кишечника. Некоторые виды этих паразитов способны поражать печень кроликов (Eimeria stiedae).
Кокцидиозы причиняют большой экономический ущерб птицеводству, кролиководству и скотоводству не только на многих фермах колхозов и совхозов, но и на ряде животноводческих комплексов (кролиководческих и на птицефабриках), главным образом за счет падежа молодняка (на кролиководческих фермах отход может достигать 60- 85 %) Кроме того, больные животные отстают в росте и теряют от 12 до 30% своей массы.
СИСТЕМАТИКА КОКЦИДИЙ Возбудители кокцидиозов сельскохозяйственных животных относятся к типу Protozoa, классу Sporozoa, отряду Coccidia, семейству Eimeriidae и двум р"0ДаМ -"Eimeria и Jsospora. Заболевания называют по названию рода возбу дителей - Eimeria - эймериоз, Jsospora - изоспороз.
Жизненные циклы у возбудителей кокцидиозов сложные. Лучше они изучены у кокцидий рода Eimeria и несколько хуже - у представителей рода Jsospora.
Жизненный цикл кокцидий рода Eimeria характеризуется тремя периодами: 1) шизогонией, 2) гаметогонией и 3) спорогонисй. Шизогония и гаметогония происходят в эпителиальных клетках кишечника и развиваются внутри клеток хозяина (эндогенно). Спорогония - во внешней среде, вне хозяина - экзогенно (рис. 62). Так, кокцидий Eimeria media в стадии зрелой ооцисты попадают с водой или кормом в кишечник животного. Спорозоиты выходят из ооцисты н проникают в эпителиальные клетки кишечника, где растут и превращаются в шизонтов. Внутри такого шизонта образуются мелкие паразиты - мерозоиты. С развитием последних шизонт делится и разрушает эпителий стенки кишечника. Освободившиеся мерозоиты вновь проникают в эпителиальные клетки кишечника, образуя шизонты II, III, а у отдельных видов - IV и пятой генераций. Таким образом, шизогония этого рода КОКЦИДИЙ повторяется много раз. Затем бесполое множественное деление сменяется половым процессом - гаметогонией.
Сущность гаметогонип заключается в том, что последующие генерации шизонтов формируют мерозоиты, которые проникают в клетку хозяина и превращаются в одноядерные трофозопты. В дальнейшем из одноядерных трофозоитов образуются макрогаметоциты и микрогаметоциты. Затем макрогаметоциты превращаются в макрогаметы. У микрогаметоцитов ядро делится, в результате образуются мелкие мужские клетки - микрогаметы.
Жизненный цикл кокцидий рода Jsospora ранее отождествлялся с кокцидиями рода Eimeria. Однако изучение биологии токсоплазм, а затем и саркоцист расширило знания о биологии кокцидий рода Jsospora. Так, если взять котят, свободных от кокцидий, и скормить им мозг мышей, который был поражен цистами токсоплазм, то через 5- 6 дней в стенке кишечника зараженных животных образуются шизонты и гамонты токсоплазм, а затем в фекалиях котят появляются н ооцисты.
Представленная (по Френкелю) схема жизненного цикла токсоплазм показывает, что у кокцидий рода Jsospora более сложный цикл развития, чем у рода Eimeria. В связи с этим целый ряд исследователей полагают, что токсоплазмоз - это ничто иное, как одна из стадий (пролиферативная) развития кишечной формы изоспороза кошек. Таким образом, кошки и, по-видимому, другие виды кошачьих являются дефинитивными хозяевами, в организме которых паразит проходит половой цикл развития. Кошки могут заражаться изоспорозом, поедая мышей, зараженных токсоплазмами, после чего выделяют ооцист, которые, попадая другим животным и человеку, заражают их пролиферативными формами токсоплазм. Следовательно, остальные животные и человек являются промежуточными хозяевами кокцидий Jsospora begimina.
Специфичность кокцидий. Кокцидий рода Eimeria относятся к специфическим паразитам только своих хозяев, хотя, паразитируя в кишечнике, многие из них морфологически могут быть похожими, однако паразитируют они только у одного хозяина, к которому приспособились в процессе эволюции.
Строгая специфичность кокцидий рода Eimeria проявляется пе только в отношении хозяина, но и места паразитирования в организме животного. Так, Е. tenella паразитирует только в эпителиальных клетках слепых кишок, тогда как Е. acervulina - в двенадцатиперстной кишке кур. Такая специфичность кокцидий к определенным органам и тканям или к определенному месту обитания явилась основным условием, обеспечивающим одновременное паразитирование многих видев кокцидий в одном хозяине.
Несколько по-другому следует рассматривать специфичность у кокцидий рода Jsospora особенно после того, как было установлено, что токсоплазма размножается в организме двух хозяев - дефинитивном и промежуточном.
Патогенез. Кокцидий, проникая в эпителиальные клетки кишечника, разрушают их и таким образом причиняют механические повреждения слизистой пищеварительного тракта. В такие пораженные участки кишечника проникает микрофлора, которая обостряет течение болезни, вызывая воспаление, а затем и обширные некрозы. В связи с этим целые участки кишечника выключаются из процесса пищеварения, что и приводит к хроническому голоданию организма животного. Воспалительные процессы на слизистой и ее некрозы увеличивают скопление экссудата в просвете кишечника, который затрудняет всасывание жидкости в организм животного.
Похожий материал по теме:
|
Отряд Кокцидии (Coccidia)
Царство Животные (Zoa). Подцарство Простейшие, или Одноклеточные (Protozoa), Тип Споровики (Sporozoa), Отряд Кокцидии (Coccidia)
Так же как и грегарины, коцидии представляют собой обширную группу паразитических простейших, включающую свыше 400 видов. Паразитируют они в самых различных группах беспозвоночных и позвоночных животных: кольчатых червях, моллюсках, членистоногих, позвоночных. Для кокцидий характерен внутриклеточный паразитизм в различных органах и тканях.
Размножение кокцидий — эндогенная часть цикла
Жизненный цикл кокцидии слагается (за единичными исключениями) из закономерного чередования бесполого размножения, полового процесса и спорогонии. У одних видов спорогония совершается вне организма хозяина, в наружной среде; у других, при наличии смены хозяев, бесполое размножение и спорогония происходят в организме разных хозяев.
У одних видов спорогония совершается вне организма хозяина, в наружной среде; у других, при наличии смены хозяев, бесполое размножение и спорогония происходят в организме разных хозяев.
Типичный кокцидийный жизненный цикл рассмотрим на примере представителей рода эймерия (Eimeria). В кроликах паразитирует несколько видов эймерий. Большая часть их — паразиты кишечника, один вид локализуется в печени. Эймерии — кокцидии, развитие которых не сопровождается сменой хозяев. В их жизненном цикле имеется два основных этапа. Первый этап цикла протекает в кишечнике кролика. Это эндогенная часть цпкла. Второй этап проходит вне тела хозяина во внешней среде — экзогенная часть цикла.
Eimeria magna — один из наиболее широко распространённых видов кокцидий кролика. На рисупке схематически представлены основные этапы жизненного цикла этого паразита.
Начнём рассмотрение жизненного цикла Eimeria magna с момента, когда паразит проникает в кишечник хозяина. Первой стадией эндогенной части цикла является спорозоит, выходящий из заглоченной кроликом ооцисты (строение и развитие ооцист будет рассмотрено ниже). Спорозоиты — это очень маленькие клетки (длиной около 8 мкм, шириной 2—3 мкм), веретеновидной формы с одним ядром.
Первой стадией эндогенной части цикла является спорозоит, выходящий из заглоченной кроликом ооцисты (строение и развитие ооцист будет рассмотрено ниже). Спорозоиты — это очень маленькие клетки (длиной около 8 мкм, шириной 2—3 мкм), веретеновидной формы с одним ядром.
Спорозоиты, так же как и другие расселительные стадии кокцидий — мерозоиты (см. ниже), несмотря на небольшие размеры, имеют сложную структуру. На рисунке изображена составленная на основе электронно-микроскопических исследований обобщённая картина строения зоита. От окружающей среды тело зоита отграничено трёхмембранной пелликулой. Наружная мембрана непрерывна. Две внутренние мембраны на переднем и заднем концах прерываются. Здесь располагаются так называемые полярные кольца. На самом переднем конце зоита располагается коноид — особый органоид, представляющий собой полый конус, слагающийся из спиральных фибриллярных компонентов. Считают, что коноид способствует проникновению зоита в клетку хозяина. Под пелликулой вдоль зоита проходят многочисленные микротрубочки, выполняющие, вероятно, опорно-двигательную функцию. Характерная черта организации зоита — особые органеллы роптрии. Это плотные, сужающиеся к переднему концу структуры, открывающиеся, по-видимому, наружу в области коноида. Предполагают, что роптрии — это своеобразные внутриклеточные «железы проникновения», выделяющие протеолитические вещества, способствующие проникновению зоита в клетку хозяина. Зоит имеет ещё несколько микропор, образующихся благодаря втягиванию наружной мембраны в толщу цитоплазмы. Считают, что микропоры выполняют функции цитостома — «клеточного рта», через который поступает пища. Кроме перечисленных специальных органоидов у зоитов имеются клеточное ядро и основные общие всем эукариотическим клеткам органоиды — митохондрии, аппарат Гольджи, эндоплазматическая сеть с рибосомами.
Под пелликулой вдоль зоита проходят многочисленные микротрубочки, выполняющие, вероятно, опорно-двигательную функцию. Характерная черта организации зоита — особые органеллы роптрии. Это плотные, сужающиеся к переднему концу структуры, открывающиеся, по-видимому, наружу в области коноида. Предполагают, что роптрии — это своеобразные внутриклеточные «железы проникновения», выделяющие протеолитические вещества, способствующие проникновению зоита в клетку хозяина. Зоит имеет ещё несколько микропор, образующихся благодаря втягиванию наружной мембраны в толщу цитоплазмы. Считают, что микропоры выполняют функции цитостома — «клеточного рта», через который поступает пища. Кроме перечисленных специальных органоидов у зоитов имеются клеточное ядро и основные общие всем эукариотическим клеткам органоиды — митохондрии, аппарат Гольджи, эндоплазматическая сеть с рибосомами.
За внедрением кокцидии в клетку хозяина следует активный рост — паразит увеличивается в массе. На этой стадии развития паразит носит название шизонта, в соответствии с тем способом размножения, к которому он приступает.
На этой стадии развития паразит носит название шизонта, в соответствии с тем способом размножения, к которому он приступает.
По мере роста паразита начинается деление ядра, благодаря чему шизонт становится многоядерным. Число ядер варьирует в широких пределах — от 8 до 60. Растущий шизонт разрушает эпителиальную клетку и постепенно перемещается в субэпителиальный слой соединительной ткани. Развитие шизонта завершается бесполым размножением. Вокруг каждого из ядер обособляется участок цитоплазмы, в результате чего весь шизонт распадается на одноядерные мелкие клетки, каждая из которых имеет веретеновидную форму. На этом заканчивается процесс бесполого размножения шизонта. Такое размножение носит название множественного деления или шизогонии. Весь процесс от момента внедрения спорозоита в эпителиальную клетку до завершения шизогонии занимает 80—96 ч. Одноядерные веретеновидные клетки, образовавшиеся в результате шизогонии, называют мерозоитами.
Мерозоиты вновь внедряются в эпителиальные клетки кишечника и дают начало второму поколению шизонтов. Процесс развития шизонтов второго поколения занимает несколько больше времени, чем первого, — 110 — 132 ч.
Часть мерозоитов от второго поколения даёт начало третьему поколению шизонтов. Образующиеся в результате его мерозоиты, так же как и часть мерозоитов второго поколения, не образуют шизонтов. Внедряясь в эпителиальные клетки, они дают начало гаметам. Гаметы кокцидий резко дифференцированы на мужские микрогаметы и женские макрогаметы. Образование тех и других из мерозоитов протекает различно.
Стадии развития кокцидий, дающие начало микрогаметам, называют микрогаметоцитами. При развитии их, сопровождающемся энергичным ростом, деление ядер начинается на самых ранних стадиях роста, оно совершается гораздо чаще, чем при шизогонии.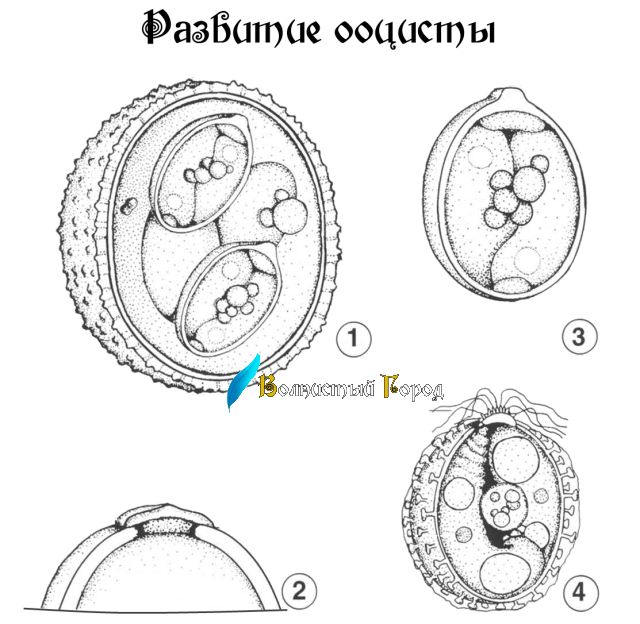 В результате в цитоплазме располагается несколько сот мелких ядер. Микрогаметы образуются путём вытягивания отдельных ядер. Тело их почти целиком состоит из веретеновидно вытянутого ядра с очень тонким периферическим слоем цитоплазмы. На переднем конце зрелой гаметы имеются два жгута. Длина их очень мала — 4—3 мкм. Гаметы подвижны. Большая часть цитоплазмы микрогаметоцита не идёт на образование гамет, а остается неиспользованной в виде большого так называемого остаточного тела.
В результате в цитоплазме располагается несколько сот мелких ядер. Микрогаметы образуются путём вытягивания отдельных ядер. Тело их почти целиком состоит из веретеновидно вытянутого ядра с очень тонким периферическим слоем цитоплазмы. На переднем конце зрелой гаметы имеются два жгута. Длина их очень мала — 4—3 мкм. Гаметы подвижны. Большая часть цитоплазмы микрогаметоцита не идёт на образование гамет, а остается неиспользованной в виде большого так называемого остаточного тела.
Совсем иначе осуществляется развитие женских половых клеток — макрогамет. Происходит рост цитоплазмы, не сопровождающийся делением ядра, размеры которого увеличиваются. Ядро приобретает пузыревидное строение, в центре его расположено крупное ядрышко. В цитоплазме по мере роста происходит накопление большого количества гранул. Макрогаметы сначала имеют сферическую форму, к концу развития они становятся овальными. Часть гранул цитоплазмы приближается к поверхности и располагается периферически в один слой. За счёт этих гранул в конце развития макрогаметы образуется оболочка. На одном из полюсов макрогаметы в оболочке остаётся отверстие (микропиле), через которое проникают микрогаметы.
За счёт этих гранул в конце развития макрогаметы образуется оболочка. На одном из полюсов макрогаметы в оболочке остаётся отверстие (микропиле), через которое проникают микрогаметы.
Следующий важный этап развития кокцидий — это процесс оплодотворения. Подвижные микрогаметы приближаются вплотную к макрогаметам. Одна микрогамета проникает через микропиле в макрогамету, причём ядра гамет сливаются, образуя характерную веретеновидную фигуру. В момент оплодотворения формируется вторая (внутренняя) оболочка, микропиле закрывается особой слизистой пробкой и зигота попадает в просвет кишечника. Обладающая двумя оболочками зигота получает название ооцисты.
На этом заканчивается эндогенная часть цикла, так как в кишечнике в отсутствие кислорода ооцисты эймерий кролика дальше развиваться не могут.
Размножение кокцидий — экзогенная часть цикла
Экзогенная часть цикла сводится к процессу спорогонии и осуществляется вне тела хозяина.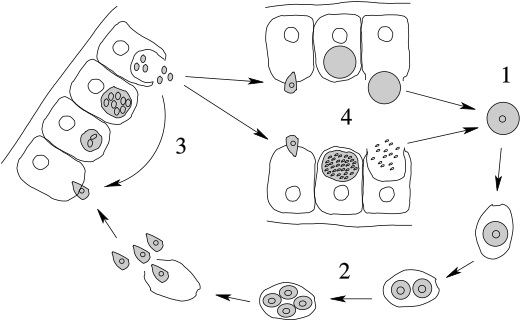 Из кишечника наружу ооцисты выходят вместе с фекальными массами. Только что вышедшие из кишечника ооцисты имеют овальную форму. Все протоплазматическое содержимое отделено от оболочки и занимает центральную часть ооцисты. Споруляция сводится к тому, что после двукратного деления ядра протоплазматическое содержимое ооцисты распадается на четыре одноядерных споробласта. Каждый из них выделяет оболочку, превращаясь в спору (спороцисту). Обычно не всё цитоплазматическое содержимое ооцисты идёт на образование споробластов, часть его остается неиспользованной в виде остаточного тела.
Из кишечника наружу ооцисты выходят вместе с фекальными массами. Только что вышедшие из кишечника ооцисты имеют овальную форму. Все протоплазматическое содержимое отделено от оболочки и занимает центральную часть ооцисты. Споруляция сводится к тому, что после двукратного деления ядра протоплазматическое содержимое ооцисты распадается на четыре одноядерных споробласта. Каждый из них выделяет оболочку, превращаясь в спору (спороцисту). Обычно не всё цитоплазматическое содержимое ооцисты идёт на образование споробластов, часть его остается неиспользованной в виде остаточного тела.
В каждой споре ядро делится ещё один раз, и образуются два червеобразных одноядерных спорозоита. На этом процесс спорообразования заканчивается. Размеры зрелых ооцист Eimeria magna: длина 25—40 мкм, ширина 18—30 мкм.
Таким образом, зрелая, способная к заражению ооциста содержит четыре спороцисты с двумя спорозоитами каждая.
При попадании зрелой ооцисты в кишечник кролика под воздействием кишечного сока пробка ооцисты разрушается, спорозоиты выходят из оболочки спор и проникают в клетки эпителия кишечникаа начиная новую, эндогенную, часть цикла.
Таким образом, в рассмотренном выше жизненном цикле кокцидий эймерий следует различать три основных этапа, из которых два первых относятся к эндогенной, а третий — к экзогенной части цикла.
Цикл начинается с нескольких поколений бесполого размножения — шизогонии. Это первый этап. Биологическое значение его очевидно: это увеличение числа особей паразита в данном экземпляре хозяина. Благодаря шизогонии количество паразитов возрастает в огромной степени. У кролика, проглотившего даже небольшое количество ооцист, вследствие шизогонии через короткий срок в кишечнике окажется огромное количество паразитов.
Второй этап — образование половых клеток и оплодотворение. Он завершается формированием тех стадий жизненного цикла паразита (в данном случае ооцист), при помощи которых паразит распространяется на новые особи хозяина, т. е. вид расселяется.
Он завершается формированием тех стадий жизненного цикла паразита (в данном случае ооцист), при помощи которых паразит распространяется на новые особи хозяина, т. е. вид расселяется.
Третий этап — спорогония. Он приводит к тому, что «расселительные» стадии жизненного цикла становятся способными к инвазированию (заражению) хозяина. Зрелые ооцисты кокцидий обладают большой стойкостью к действию различных неблагоприятных факторов среды, что очень затрудняет борьбу с ними.
Специфичность кокцидий
Кокцидии — паразиты с очень узкой специфичностью. Почти все виды их строго приурочены к одному виду хозяина и не могут паразитировать даже в близких видах. Например, кокцидии кролика не могут заражать зайцев, а кокцидии зайцев — развиваться в кроликах. В пределах организма хозяина кокцидии локализуются в строго определённых органах и даже частях органов. Например, Е. М. Хейсин доказал, что у кролика разные виды кокцидий локализуются в строго определённых отделах кишечника.
Следует отметить, что большинство кокцидиозов (заболеваний, вызываемых кокцидиями) поражает молодых птиц и млекопитающих, это главным образом «детские болезни», хотя и взрослые животные могут заражаться кокцидиями. Ряд видов кокцидий (Eimeria tenella, Eimeria ргаесох и др.) поражает кур (преимущественно цыплят), вызывая нередко гибель молодняка. Крупный рогатый скот также страдает от кокцндий (Eimeria zurni, Eimeria smithi, Isospora aksaica), причём заболевает преимущественно молодняк.
В рыбоводных хозяйствах (особенно на Украине) кокцидиозы неоднократно поражали карпов (Eimeria cyprini), что также часто приводило к гибели рыб.
Борьба с кокцидиозами — важная задача животноводства и ветеринарии. Она строится главным образом на профилактических мероприятиях, направленных на предохранение животных от заражения.
К кокцидиям относится также Toxoplasma gondii — возбудитель токсоплазмоза — тяжёлого заболевания человека.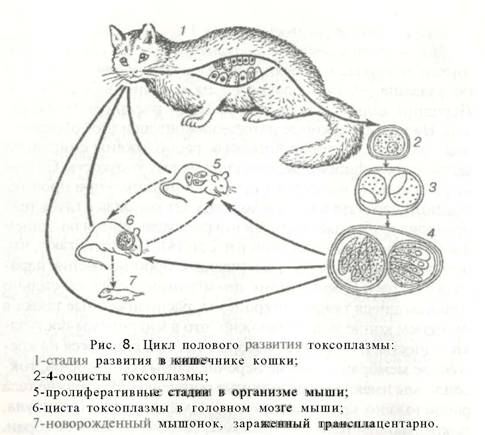 Этот возбудитель представляет собой типичную кокцидию. В отличие от видов рода Eimeria, у Toxoplasma gondii два хозяина. Шизогония, развитие гамет, половой процесс и образование ооцист протекают в кишечнике хищных млекопитающих, относящихся к семейству кошачьих (чаще всего это кошка). Вторым хозяином Toxoplasma служат многочисленные виды млекопитающих, в том числе и человек. В данном случае имеет место широкая специфичность паразита в отношении хозяина. Заключённые в спорах спорозоиты Toxoplasma, если будут проглочены промежуточным хозяином, проникают в самые различные внутренние органы, в том числе в мозг. Происходит энергичное размножение паразита бесполым путем (делением). Если лежащие в цисте одноклеточные паразиты — цистозоиты попадут в кишечник кошки (например, в случае, если кошка съест мышь, заражённую токсоплазмами), то они внедрятся в эпителий кишечника и проделают весь характерный для кокцидий цикл. Человек может заразиться токсоплазмозом от кошек, имеющих в кишечнике ооцисты и выделяющих их наружу.
Этот возбудитель представляет собой типичную кокцидию. В отличие от видов рода Eimeria, у Toxoplasma gondii два хозяина. Шизогония, развитие гамет, половой процесс и образование ооцист протекают в кишечнике хищных млекопитающих, относящихся к семейству кошачьих (чаще всего это кошка). Вторым хозяином Toxoplasma служат многочисленные виды млекопитающих, в том числе и человек. В данном случае имеет место широкая специфичность паразита в отношении хозяина. Заключённые в спорах спорозоиты Toxoplasma, если будут проглочены промежуточным хозяином, проникают в самые различные внутренние органы, в том числе в мозг. Происходит энергичное размножение паразита бесполым путем (делением). Если лежащие в цисте одноклеточные паразиты — цистозоиты попадут в кишечник кошки (например, в случае, если кошка съест мышь, заражённую токсоплазмами), то они внедрятся в эпителий кишечника и проделают весь характерный для кокцидий цикл. Человек может заразиться токсоплазмозом от кошек, имеющих в кишечнике ооцисты и выделяющих их наружу. Источником заражения может быть также мясо животных, заражённых токсоплазмой.
Источником заражения может быть также мясо животных, заражённых токсоплазмой.
ПОДЦАРСТВО ПРОСТЕЙШИЙЕ, ИЛИ ОДНОКЛЕТОЧНЫЕ
Тип Саркомастигофоры
Подтип Саркодовые
Подтип Жгутиконосцы
Тип Споровики
Тип Книдоспоридии
Тип Микроспоридии
Тип Инфузории
Эволюция простейших
В начало страницы
жизненный цикл развития, строение и фото
Чтобы проверить, есть ли у вас паразиты - добавьте в стакан воды всего 1 ложку...
Читать далееКокцидия – одноклеточный паразит, который, попав в организм более крупной особи, способен вызвать опасное заболевание – кокцидиоз. В природе насчитывается их множество видов, но лишь небольшая часть паразитирует в приближенных к человеку животных, и только 2 вида могут проникнуть в тело человека и причинить ему вред.
В природе насчитывается их множество видов, но лишь небольшая часть паразитирует в приближенных к человеку животных, и только 2 вида могут проникнуть в тело человека и причинить ему вред.
Общие сведения
Кокцидии насчитывают более 400 видов, 11 из них паразитируют в органах пищеварительного тракта и вызывают заболевание кокцидиоз.
Подкласс Кокцидии относится к группе эукариотов по типу споровиков, занимает место в классе Conoidasida. Это одноклеточные организмы, паразитирующие внутриклеточно в теле беспозвоночных и позвоночных представителей фауны.
Спровоцировать кокцидиоз у человека могут только два вида:
- Isospora bell – может жить и развиваться только в теле человека.
- Isospora hominis – мигрирует от крупного рогатого скота к людям.
Известны три отряда: Coelotrophiida, Adeleida, Eimeriida. Наиболее изученный отряд кокцидии – Eimeriida, в который входят представители рода саркоцисты, эймерии и токсоплазмы.
Размножение особей происходит половым и неполовым путем. Каждый этап развития может сопровождаться сменой хозяина. В большинстве случаев паразит проходит развитие в эпителии кишечника, печени, может локализоваться в кровяных и эндотелиальных клетках.
Каждый этап развития может сопровождаться сменой хозяина. В большинстве случаев паразит проходит развитие в эпителии кишечника, печени, может локализоваться в кровяных и эндотелиальных клетках.
Для своего обитания каждый из видов может выбрать только одного хозяина и не может проявить своих паразитических способностей даже в схожих по роду потенциальных носителях, что классифицирует как узкоспецифических паразитов.
Будьте осторожны
По данным ВОЗ в мире заражены какими либо паразитарными болезнями более 4,5 млрд человек. Около двух сотен различных видов паразитов могут находится в организме человека, считают учёные. Среди них: гельминты, аскариды, острицы, лямблии, токсоплазмы, хламидии… Человек может не подозревать о болезни много лет. Поэтому число заражённых паразитами гораздо больше выявленных больных.
Самый распространенный симптом указывающий на присутствие паразитов в организме — неприятный запах изо рта. Узнайте от своих близких, пахнет ли у вас изо рта утром (до того, как почистите зубы). Если да, то с вероятностью 99% вы заражены паразитами.
Если да, то с вероятностью 99% вы заражены паразитами.
80% всех существующих заболеваний либо напрямую вызваны паразитами, либо являются следствием жизнедеятельности паразитов в нашем организме!
Заражение паразитами приводит к неврозам, быстрой утомляемости, резкими перепадами настроениями, в дальнейшим начинаются и более серьезные заболевания.
У мужчин: паразиты вызывают: простатит, импотенцию, аденому, цистит, песок, камни в почках и мочевом пузыре.
У женщин: боли и воспаление яичников. Развиваются фиброма, миома, фиброзно-кистозная мастопатия, воспаление надпочечников, мочевого пузыря и почек.
Спокойно, не нужно бежать в аптеку и скупать дорогие лекарства, которые, по словам фармацевтов, вытравят всех паразитов. Большинство этих лекарств малоэффективны, Для полного избавления от паразитов придется принимать препараты купленные в аптеке, несколько раз, что нанесет вред организму..
Хотите знать что делать? Для начала советуем почитать статью
Строение кокцидии
Кокцидия имеет внешнюю трехмембранную оболочку пелликулу. Под ней размещаются субпелликулярные микротрубочки. Эти составляющие образуют каркас зоита. Крайняя мембрана пелликулы является цельной, две внутренние прерываются в области опорных колец. В первом кольце располагается конусообразный полый коноид, его стенки сложены из спиральных фибрил. Благодаря коноиду происходит более легкое проникновение особи в клетки носителя.
Под ней размещаются субпелликулярные микротрубочки. Эти составляющие образуют каркас зоита. Крайняя мембрана пелликулы является цельной, две внутренние прерываются в области опорных колец. В первом кольце располагается конусообразный полый коноид, его стенки сложены из спиральных фибрил. Благодаря коноиду происходит более легкое проникновение особи в клетки носителя.
Ближе к передней части зоита находятся роптрии, их число у разных видов может быть разным, максимальное количество достигает 14. Их концы пролегают через кольца коноида. Роптрии вмещают в себе вещество, предположительно влияющее на проникновение паразита в клетку.
В передней части кокцидии размещены плотные извивающиеся микронемы. Их функции до конца не изучены, но предположительно они связаны с роптриями и, возможно, влияют на легкий доступ внутрь клетки.
На всех стадиях развития тело кокцидий покрыто ультрамикроскопическими порами. Их особенность – они прорывают два внутренних слоя. В наружном, хоть и происходят выпячивания оболочки, целостность остается неизменной.
Предполагается, что появляющиеся микроворонки – это микроцистомы, которые пропускают сквозь себя питательные компоненты.
Кокцидии развиваются в пищеварительном тракте человека, обнаружить их помогает анализ крови.
Кокцидиям также присуще наличие в цитоплазме органоидов, характерных для многих клеток: эндоплазматическая сетка с рибосомами, аппарат Гольджи, митохондрии, отмечается наличие белковых, жировых зерен.
Жизненный цикл паразита
Независимо от вида, цикл развития кокцидий примерно одинаков. Отличием может быть отсутствие смены хозяина. Некоторые особи зарождаются и продолжают свою жизнь только в одном носителе.
Жизненный цикл начинается с проникновения спорозоита в клетку внутренних органов. После чего зоит преобразуется в шизонт – спороцист, в котором находится несколько ядер. Такое превращение дает старт бесполому размножению.
Шизонт замирает на месте. В этот период у него проходит интенсивное деление клеток на дольки, каждая из них имеет свое ядро. После завершения процесса шизогонии, дозревшие клетки, вновь образовавшиеся мерозоиты, выходят из оболочки и распространяются по организму носителя.
После завершения процесса шизогонии, дозревшие клетки, вновь образовавшиеся мерозоиты, выходят из оболочки и распространяются по организму носителя.
Выход мерозоитов переводит популяцию на новый этап развития – половое размножение. Пройдя несколько ступеней деления, мерозоиды преобразуются в гамонтов (половые клетки). Они бывают двух видов:
- Макрогамонты – это яйцеклетки паразита. Они не делятся, но увеличиваются в размерах посредством впитывания большого количества питательных веществ. Процесс заканчивается превращением их в макрогаметы.
- Микрогамонты – прототип сперматозоида. Внутри такого гамонта происходит процесс деления клеток, превращающихся в споровики. После завершения образовавшееся «яйцо» разрывается, из него выходят микрогаметы. Для более легкого их продвижения к макрогаметам споровики снабжены жгутиками.
Соединение макро и микрогаметы порождает образование зиготы, которую покрывают две защитные мембраны. Происходит зарождение ооцисты.
Далее, в зависимости от вида кокцидий, цикл развития может иметь два пути продолжения:
- Новые клетки Isospora belli не покидают организм хозяина, продолжая свое развитие, дорастая до спорозоитов и запуская следующий процесс деления и размножения.

- Цисты кокцидий вида Isospora hominis выходят с фекалиями из организма носителя, после чего с водой перемещаются в организмы животных. В процессе поедания мяса такого животного человек заражается кокцидиозом.
Далее цикл проходит повторный круг: деление ооцисты на спороцисты, образование зоитов. Этап развития шизонта и спорогония.
Процесс прекращается только после обнаружения паразитирующих особей и прохождения курса терапии.
Пример цикла развития эймерий в кишечнике кролика и вне его:
Заключение
Кокцидии – микроскопические особи, обладают свойством к стремительному размножению. Их не всегда можно выявить в организме носителя на начальной стадии заражения. Они обнаруживаются при детальном обследовании, когда человек начинает чувствовать недомогание, и чаще обнаруживаются на стадии шизогонии, когда шизонт «стоит» на месте и значительно увеличивается в размерах, что может показать аппарат УЗ-диагностики. Дополнительно о наличии паразитических особей расскажет анализ крови на наличие антител.
Чтобы кокцидиоз не распространялся, человеку следует проводить стандартную профилактику: мытье рук, тепловую обработку овощей и фруктов, длительную термообработку продуктов животного происхождения.
Для предупреждения заболевания у животных рекомендуется проводить вакцинацию. Чаще такие меры предусматривают защиту сразу от нескольких видов паразитов.
жизненный цикл, развитие и размножение, виды, способы заражения, проведение анализов и лечение
Многие пациенты полагают, что в кишечнике человека могут паразитировать только гельминты. Однако это ошибочное мнение. Нередко в ЖКТ обитают простейшие микроорганизмы, которые не видны невооруженным глазом. Они могут нанести здоровью человека не меньше вреда, чем паразитические черви. К таким простейшим относятся кокцидии. Они встречаются как у людей, так и у животных. Жизненный цикл кокцидий очень сложен, он проходит в несколько этапов. В процессе размножения паразитов выделяются вредные вещества, которые поражают кишечник.
К таким простейшим относятся кокцидии. Они встречаются как у людей, так и у животных. Жизненный цикл кокцидий очень сложен, он проходит в несколько этапов. В процессе размножения паразитов выделяются вредные вещества, которые поражают кишечник.
Что такое кокцидии?
Кокцидии - это одноклеточные простейшие. Они паразитируют в тонком кишечнике животных и человека. Микроорганизмы отряда Кокцидии являются специфичными паразитами. Каждая разновидность этого простейшего может паразитировать только в кишечнике определенного хозяина. Например, кокцидии, обитающие в организме зайца, не могут находиться в организме кролика.
Кокцидии могут размножаться как половым, так и неполовым способом. Они вызывают заболевание, которое называется кокцидиоз. У человека эта болезнь встречается довольно редко. Чаще этим паразитарным недугом страдают животные. Для людей представляют опасность всего два вида кокцидий:
- Isospora belli. Эта разновидность кокцидии может жить только в человеческом организме.

- Isospora hominis. Этот вид паразита является общим для человека и крупного рогатого скота. Также такой тип кокцидий встречается у свиней.
В России случаи кокцидиоза отмечаются в основном в южных регионах: на Кавказе и в Крыму.
Строение паразита
Паразит имеет микроскопические размеры и довольно сложное строение тела. В процессе жизненного цикла кокцидии могут существовать в следующих формах:
- Ооциста. В такой форме паразит проникает в организм человека или животного. Ооциста образуется при половом размножении данного микроорганизма. Эту форму кокцидий можно назвать защитной. Она помогает паразитам выживать, пока не созреют новые особи. Внутри каждой ооцисты находятся спорозоиты.
- Спорозоиты. Это подвижная форма кокцидий. Они освобождаются из ооцисты.
- Шизонт. Этот неподвижный микроорганизм состоит из нескольких долек - мерозоитов. В процессе размножения они превращаются в половые клетки, из которых образуется ооциста.
Рассмотрим более подробно строение спорозоита.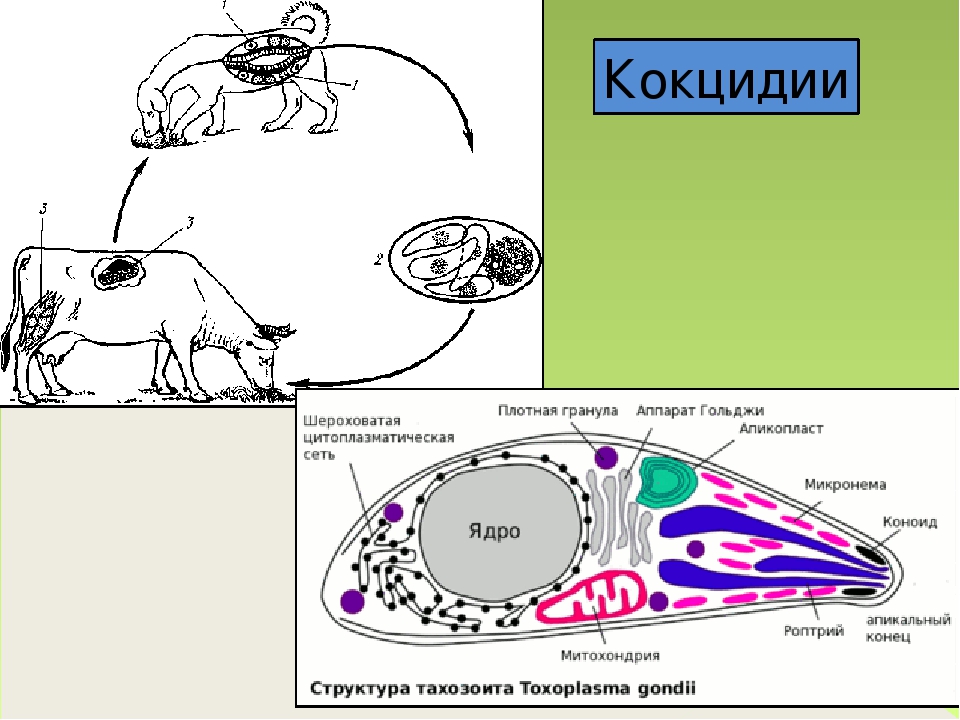 Этот микроорганизм по структуре похож на человеческую клетку. У спорозоитов имеется ядро, вокруг которого расположена цитоплазма. Также простейшие содержат органоиды: митохондрии и эндоплазму. Снаружи спорозоит покрыт оболочкой - пелликулой. Под ней расположены трубочки - фибриллы. Эти структуры позволяют микроорганизму сохранять форму. Ближе к переднему концу трубочки закручиваются и образуют коноид. С его помощью паразит крепится к стенкам кишечника. Также спорозоиты снабжены жгутиками для передвижения.
Этот микроорганизм по структуре похож на человеческую клетку. У спорозоитов имеется ядро, вокруг которого расположена цитоплазма. Также простейшие содержат органоиды: митохондрии и эндоплазму. Снаружи спорозоит покрыт оболочкой - пелликулой. Под ней расположены трубочки - фибриллы. Эти структуры позволяют микроорганизму сохранять форму. Ближе к переднему концу трубочки закручиваются и образуют коноид. С его помощью паразит крепится к стенкам кишечника. Также спорозоиты снабжены жгутиками для передвижения.
Фото кокцидии на разных стадиях жизненого цикла представлены в статье.
Жизненный цикл
Развитие паразита начинается сразу же после попадания в организм хозяина. Жизненный цикл кокцидий проходит в несколько этапов.
Сначала происходит бесполое размножение простейшего:
- После попадания в кишечник из ооцисты выходят спорозоиты.
- Вскоре спорозоиты превращаются в неподвижную форму - шизонт.
- У шизонта увеличивается количество ядер. Затем он распадается на мерозоиты, которые распространяются по тонкому кишечнику.

Через несколько таких циклов кокцидии начинают размножаться половым способом. Мерозоиты превращаются в половые клетки двух типов:
- Макрогамонты. Это своеобразные аналоги яйцеклеток. Они увеличиваются в размерах, накапливают питательные вещества и превращаются в макрогаметы.
- Микрогамонты. Эти клетки напоминают сперматозоиды. Они тоже увеличиваются в размерах, у них происходит активное деление ядер. Затем микрогамонты разрываются. Из них выходят микрогаметы, снабженные жгутиками для продвижения к макрогаметам.
Затем происходит процесс оплодотворения: микрогамета сливается с макрогаметой. Образуется зигота. Вокруг нее нарастают два защитных слоя. Так образуется новая ооциста. Затем жизненный цикл кокцидий повторяется заново.
Пути заражения
Пути инфицирования кокцидиями отличаются в зависимости от вида паразита. Isospora belli обитает только в кишечнике человека. Поэтому заразиться можно только от больного. Ооцисты выходят из организма вместе с фекалиями. Они очень устойчивы к внешней среде. Если человек не моет руки после посещения туалета, а затем прикасается к предметам, то кокцидии распространяются по всему дому. Это всегда является следствием плохой гигиены. Однако бывают случаи, когда пациент неосторожно смыл воду в туалете, и ооцисты вместе с капельками влаги остаются на всех окружающих предметах.
Они очень устойчивы к внешней среде. Если человек не моет руки после посещения туалета, а затем прикасается к предметам, то кокцидии распространяются по всему дому. Это всегда является следствием плохой гигиены. Однако бывают случаи, когда пациент неосторожно смыл воду в туалете, и ооцисты вместе с капельками влаги остаются на всех окружающих предметах.
Кокцидии Isospora hominis встречаются и у людей, и у животных. Инфицирование этим видом простейших происходит при поедании говядины или свинины, зараженных ооцистами. Особенно опасно непрожаренное или недоваренное мясо. Цикл развития кокцидий в теле животных проходит несколько иначе, чем у человека. Паразиты из кишечника могут попадать в мышцы животных.
Симптоматика
Инкубационный период кокцидиоза продолжается около 1 недели. В это время паразит прикрепляется к стенкам кишечника. Затем у больного возникают следующие симптомы:
- Ухудшается общее самочувствие, температура тела повышается до +39 градусов.
- Возникает сильная диарея.
 При этом каловые массы имеют водянистую консистенцию. В них может содержаться кровь и слизь.
При этом каловые массы имеют водянистую консистенцию. В них может содержаться кровь и слизь. - Периодически возникает рвота.
- Пациент ощущает озноб.
- У больного отмечается похудение из-за плохого аппетита.
Эти неприятные ощущения связаны с процессом размножения паразита. Когда из ооцисты выходят спорозоиты, в полость кишки выделяются едкие вещества. Они вызывают раздражение и воспаление слизистой.
Симптоматика патологии у разных больных выражена в различной степени. Это во многом зависит от вида кокцидий. При инфицировании Isospora hominis заболевание протекает в более тяжелой форме, чем при заражении Isospora belli.
Обычно симптомы болезни продолжаются не более двух недель. После этого все неприятные проявления исчезают самостоятельно, так как активное размножение паразитов длится около 14 дней. Однако это не означает, что не нужно принимать никаких мер при заражении кокцидиями. Лечение необходимо, так как воспалительный процесс в кишечнике может привести к серьезным осложнениям.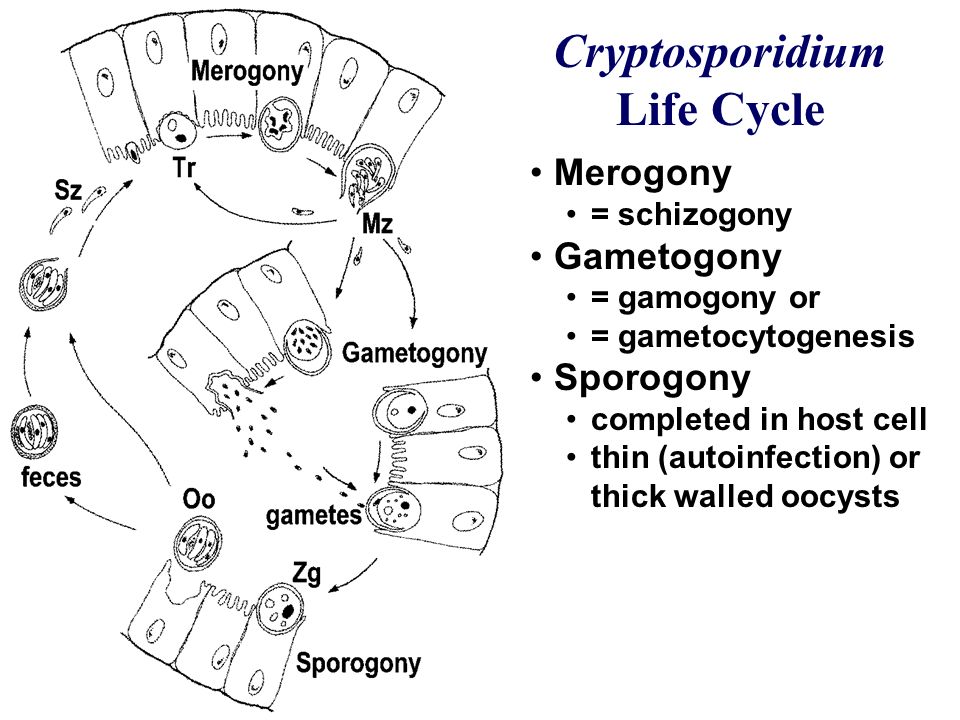
Летальные исходы при кокцидиозе не отмечались, заболевание имеет благоприятный прогноз. Повторно заразиться кокцидиозом невозможно, организм вырабатывает иммунитет к этим паразитам.
Диагностика
Пациенты очень часто принимают признаки кокцидиоза за пищевое отравление или бактериальную желудочно-кишечную инфекцию. Ведь многие болезни ЖКТ имеют схожую симптоматику. Нередко даже специалисты принимают это заболевание за дизентерию. Чтобы отличить эту патологию от других поражений ЖКТ назначают анализ кала на ооцисты.
Однако сложность диагностики кокцидиоза заключается в том, что ооцисты выявляются в кале во время выздоровления. Если паразиты не обнаружены в анализе, но у больного имеются признаки заболевания, применяют флотационные методы. В фекалии добавляют специальные растворы, и в результате паразиты всплывают в полученной жидкости.
Лечение
При легкой форме болезни назначают "Нитрат висмута". Этот препарат уменьшает раздражение кишечника и диарею.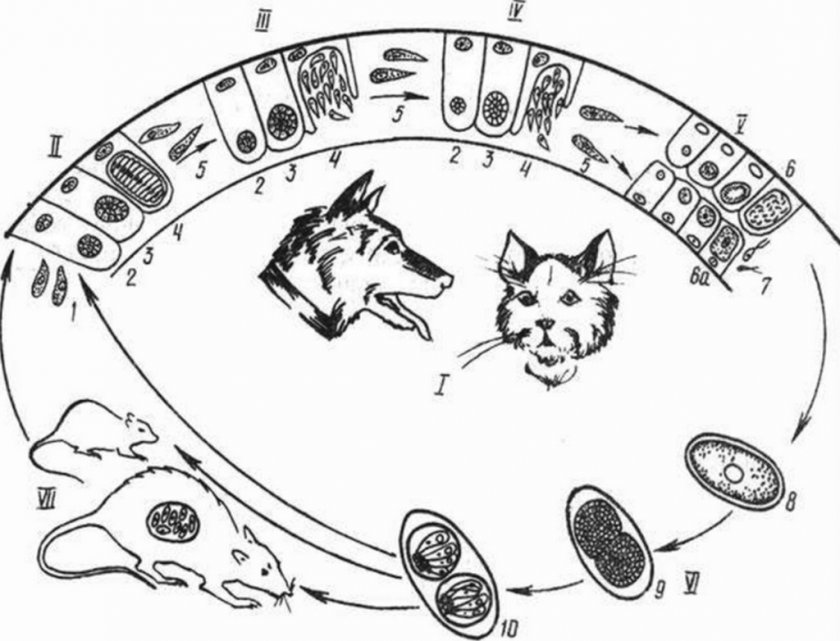 В более тяжелых случаях показано применение противопротозойных и сульфаниламидных лекарств:
В более тяжелых случаях показано применение противопротозойных и сульфаниламидных лекарств:
- "Бисептола";
- "Хлоридина";
- "Сульфазина";
- "Метронидазола".
Назначают также противовоспалительные препараты, которые предотвращают изъязвление стенок кишечника.
Во время лечения больному необходимо соблюдать диету. Следует избегать употребления острых, соленых, жареных и жирных блюд.
В качестве дополнения к медикаментозной терапии можно применять народные средства:
- Отвар из чистотела, ромашки и зверобоя. Травы нужно взять в равных пропорциях. Средство принимают утром натощак.
- Чеснок и семена льна. Их можно употреблять в чистом виде. Эти продукты обладают противопаразитарными свойствами.
- Зеленый чай. Нужно приготовить очень концентрированную заварку. Ее принимают по 1 чайной ложке трижды в сутки.
Профилактика
Кокцидиоз у человека встречается очень редко. Поэтому специфической профилактики не разработано. Однако, учитывая пути передачи паразитов, рекомендуется регулярно мыть руки и соблюдать личную гигиену. Говядину и свинину нужно подвергать тщательной термической обработке. Необходимо также приобретать мясо только у проверенных производителей. Эти меры помогут избежать неприятных проявлений кокцидиоза.
Однако, учитывая пути передачи паразитов, рекомендуется регулярно мыть руки и соблюдать личную гигиену. Говядину и свинину нужно подвергать тщательной термической обработке. Необходимо также приобретать мясо только у проверенных производителей. Эти меры помогут избежать неприятных проявлений кокцидиоза.
Жизненный цикл / Кокцидиоз / Иммукокс
В зависимости от вида Eimeria жизненный цикл кокцидий занимает от пяти до восьми дней.
Неспорулированные ооцисты выделяются с фекалиями в подстилке. Ооцисты спорулируют (становятся инфекционными) в присутствии достаточной влажности, кислорода и температуры. Ооцисты чрезвычайно устойчивы к окружающей среде и могут выжить до одного года в сухих прохладных условиях. | |
Спорулированные ооцисты, содержащие четыре спороцисты, каждая из которых содержит два инфекционных спорозоита, попадают в организм птиц при расклевывании земли и подстилки. | |
Спороцисты, а затем спорозоиты высвобождаются в кишечнике из спорулированной ооцисты путем эксцистации, процесса, которому способствует физическое измельчение и присутствие пищеварительных ферментов и солей желчных кислот. | |
Спорозоиты проникают в клетки кишечника, чтобы инициировать развитие бесполых внутриклеточных шизонтов.Шизонты производят большое количество второй инвазивной стадии, называемой мерозоитами, которые проникают в другие клетки кишечника, чтобы произвести следующее поколение шизонтов. | |
Число бесполых поколений колеблется от двух до четырех в зависимости от вида кокцидий. Бесполое размножение приводит к экспоненциальному увеличению числа паразитов. | |
После бесполого жизненного цикла начинается сексуальный жизненный цикл, во время которого формируются мужские и женские гаметы. | |
С каждым последующим циклом количество ооцист в окружающей среде увеличивается. Если не выработался иммунитет или не использовались антикокцидиальные препараты, когда условия окружающей среды благоприятны для споруляции, ведущей к нарастающей угрозе, наивные или полу-наивные птицы не смогут справиться с этим внезапным массовым воздействием из-за количества инфекционных заболеваний. спорулированные ооцисты. |
Профилактика жизненного цикла кокцидий и лечение кокцидиоза
Кокцидии (Eimeria bovis, E. zurnii)
Профиль паразита
Джо Дедриксон, DVM, Ph.D.
Введение
Кокцидиоз - это кишечное заболевание крупного рогатого скота, которое возникает в результате заражения
одноклеточные простейшие, называемые кокцидиями.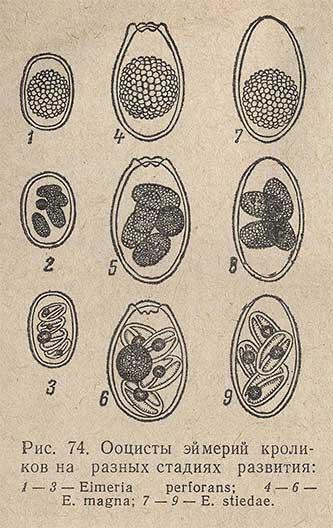 Считается, что кокцидиоз обходится американцам дорого.
производители говядины и молочных продуктов зарабатывают сотни миллионов долларов каждый год.Однако любой
оценка будет консервативной, потому что она не учитывает все причиненные убытки
на 95% 1 кокцидиальных
инфекции, которые носят субклинический характер и никогда не диагностируются как кокцидиоз.
Считается, что кокцидиоз обходится американцам дорого.
производители говядины и молочных продуктов зарабатывают сотни миллионов долларов каждый год.Однако любой
оценка будет консервативной, потому что она не учитывает все причиненные убытки
на 95% 1 кокцидиальных
инфекции, которые носят субклинический характер и никогда не диагностируются как кокцидиоз.
Кокцидиоз крупного рогатого скота:
Распространенное, сложное и дорогостоящее кишечное заболевание.
Этиология
Почти весь крупный рогатый скот подвергается воздействию кокцидий, особенно
высокопатогенный Eimeria bovis и Eimeria zurnii .Большинство
заражения крупного рогатого скота приводит только к субклиническим инфекциям, вызывающим легкую диарею
или отсутствие каких-либо клинических признаков. Однако этот скот выступает в роли переносчиков, которые распространяют
coccidia, когда они выделяют ооцисты с фекалиями.
Однако этот скот выступает в роли переносчиков, которые распространяют
coccidia, когда они выделяют ооцисты с фекалиями.
Инфекции могут оставаться на субклинических уровнях до тех пор, пока не снизится резистентность, вызванная стрессом такие факторы, как отлучение от груди, доставка, смешение, теснота, погода или даже изменения рациона, позволить популяциям кокцидий резко увеличиться.Всего за несколько дней миллионы условно-патогенных кокцидий поражают кишечник, вызывая такие клинические признаки, как геморрагическая диарея, потеря веса, снижение работоспособности и бодрости и даже смерть.
К моменту появления клинических признаков большая часть повреждений уже нанесена. 2 Крупный рогатый скот, переживший клиническую
инфекция может никогда не восстановиться после снижения производительности 3 и всегда может не иметь возможности эффективно
обрабатывать корм и жидкости. В гораздо меньшей степени можно наблюдать низкие темпы роста
у субклинически инфицированных животных.
В гораздо меньшей степени можно наблюдать низкие темпы роста
у субклинически инфицированных животных.
Щелкните здесь для интерактивного
демонстрация жизненного цикла Coccidia.
ВНЕШНЯЯ ФАЗА (трава, корм или вода загрязнены
с калом)
После споруляции ооциста способна противостоять коммерческому
чистящие и дезинфицирующие средства
и могут выжить и оставаться в окружающей среде в течение многих лет.
Шаг 1
Спорулированная ооциста - это зрелое яйцо, содержащее 4 спороцисты, каждая с 2 спорозоитами.
СУБКЛИНИЧЕСКАЯ ФАЗА (тонкий кишечник)
Субклинические кокцидиальные инфекции поражают ворсинки тонкого кишечника и могут
уменьшить усвоение питательных веществ.
Шаг 2
После проглатывания спорулированной ооцисты, воздействия углекислого газа и пищеварения
ферменты в пищеварительном тракте хозяина, он расщепляет (или эксцисты) и высвобождает
его 8 спорозоитов.
Шаг 3
Каждый высокоподвижный спорозоит плавает или скользит к тонкой кишке.
Шаг 4
Через 3-7 дней после проглатывания спорозоиты попадают в тонкий кишечник и воспроизводятся
бесполым путем в результате процесса зарождения, называемого шизогония (завершается с 5 по день
10). Каждый спорозоит может дать до 120000 мерозоитов первого поколения, которые
высвобождаются при взрыве клетки-хозяина. 4
Шаг 5
Эти мерозоиты претерпевают еще одно бесполое деление в нижней части тонкой кишки и
верхняя часть толстой кишки. Каждый мерозоит первого поколения может производить 30 человек второго поколения.
мерозоиты. 4
КЛИНИЧЕСКАЯ ФАЗА (толстый кишечник)
Клинические признаки кокцидиоза включают кровянистые выделения, окрашенные в кровь фекалии, обезвоживание,
анемия и общая потеря физического состояния.
Шаг 6
Мерозоиты второго поколения проникают в толстую кишку, дифференцируясь
как самец (микрогамета), так и самка (макрогамета) и начинают половую стадию
жизненного цикла.
Шаг 7
Микрогамета оплодотворяет макрогамету с образованием зиготы. Зигота образует защитный
стенка и становится ооцистой, которая вызывает разрыв клеток-хозяев.
ВНЕШНЯЯ ФАЗА (фекалии, зараженная трава, корм или
вода)
После споруляции ооциста может противостоять коммерческим чистящим и дезинфицирующим средствам.
и может выжить и оставаться в окружающей среде годами.
Шаг 8
Ооциста выходит вместе с тканью и жидкостями из разорванных клеток в
кал. На этой стадии ооциста не имеет споров (незрелая) и не является инфекционной.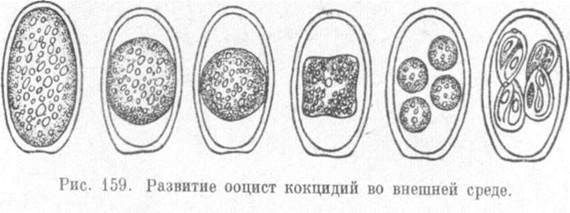
Step 9 В присутствии кислорода ооциста подвергается процессу, называемому споруляцией. Ооциста требуется от 2 до 4 дней, чтобы стать спорулированной ооцистой, способной инфицировать крупный рогатый скот. Одна ооциста может произвести до 23 миллионов ооцист 4 в течение следующего жизненного цикла.
Глоссарий
Следовательно, не все термины относятся к
к кокцидиям в целом, но конкретно относятся к кокцидиозам крупного рогатого скота.
Excystation The выброс инфекционных спорозоитов.
Gametogony После во второй шизогонии мерозоиты проникают в клетки и становятся либо макрогаметами, либо сбор микрогамет до полового размножения.
Гамон Первый
стадия после слияния микро- и макрогамет.
Макрогамет А одиночная большая клетка, по поведению «женская».
Мерозоит вторая незрелая стадия, произведенная бесполым путем, которая является наиболее разрушительной для хозяина клетки, образующиеся путем непрерывной репликации и расщепления второго поколения спорозоит внутри шизонта.
Microgamete Small жгутиковые подвижные клетки, «мужские» по поведению.
Ооциста Половой продуцируемая стадия кокцидий, когда она покидает корову-хозяина (яйцо), подвергая опасности недифференцированный эмбрион в упругой защитной оболочке.
Шизогония
процесс, посредством которого каждый спорозоит превращается в сотни или тысячи второго поколения
спорозоитов или мерозоитов внутри стеночной вакуоли в клетках-хозяевах и генерирует
следующий этап жизненного цикла паразита кокцидий.
Шизонт Сцена достигаются спорозоитами первого и второго поколений после того, как они вошли в новую клетка-хозяин и реплицировалась.
Спороциста ооциста, когда эмбрион развился и произвел первые инфекционные стадии, все еще в защитной оболочке ооцисты.
Споронт А одноклеточный зигота в стенке ооцисты до того, как она подвергнется делению, спорогония - это процесс (споруляция), посредством которой одноклеточный «споронт» (зигота) в стенке ооцисты подвергается серия делений с образованием спорозоитов, содержащихся в спороцистах.
Спорозоит
первая инфекционная стадия, развивается в ооцисте и высвобождается при поедании кисты
хозяином и подвергается повышенным концентрациям CO2, солей желчных кислот и трипсина.
ПРИМЕЧАНИЕ: Для крупного рогатого скота это было бы более правильным и помогло бы в понимании крупного рогатого скота. кокцидиоз, если их относить к спорозоитам первого и второго поколения.
Спорозоит первого поколения, выделяющийся из спорулированной ооцисты после эксцистации.В то время как спорозоит второго поколения происходит от шизонтовой шизогонии
спорозоит первого поколения.
кокцидиоз, если их относить к спорозоитам первого и второго поколения.
Спорозоит первого поколения, выделяющийся из спорулированной ооцисты после эксцистации.В то время как спорозоит второго поколения происходит от шизонтовой шизогонии
спорозоит первого поколения.
Размножение кокцидий
Одна спорулированная ооциста может превратиться в 23 миллиона ооцист после
всего 21 день внутри животного-хозяина. Во время бесполого деления одна спорулированная ооциста
делится на 8 спорозоитов, каждый из которых может разделиться на 120000 первого поколения
мерозоитов (всего до 960 000).
Каждый из этих мерозоитов может снова бесполым путем делиться на 30 мерозоитов второго поколения.
В результате получилось 48 миллионов мерозоитов второго поколения (микрогаметы «самец» и
macrogametes the female ») объединяются для полового размножения, чтобы произвести как можно больше
23 миллиона ооцист.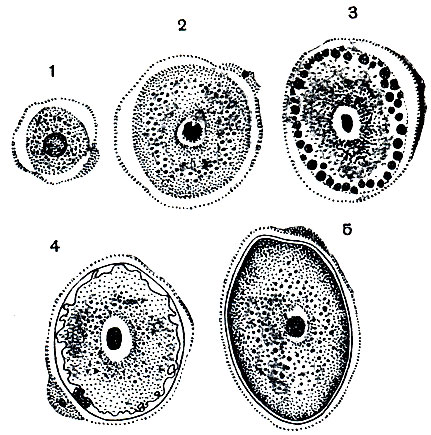
Факты о кокцидиях
- Кокцидии являются облигатными внутриклеточными паразитами и должны вернуться к хозяину для продолжения их жизненный цикл.
- Жизненный цикл кокцидий - это непрерывный процесс с ежедневным повторным заражением.
- Крупный рогатый скот регулярно поглощает тысячи ооцист каждый день с фекалиями, зараженными кормить и поить, чистить свою шерсть или лизать шерсть другого животного.
- Всего 50 тысяч ооцист могут вызвать тяжелое заболевание у теленка.
- У крупного рогатого скота может развиться иммунитет к кокцидиям после продолжительной субклинической инфекции.
- Самый эффективный способ лечения кокцидиозных инфекций - сочетание профилактических и лечебные мероприятия.
Рекомендации
1. Куигли
J. Calf Note # 17 - Обзор кокцидиоза у телят. Доступно по адресу: http://www.calfnotes.com/pdffiles/CN017.pdf.
По состоянию на 15 мая 2009 г.
Куигли
J. Calf Note # 17 - Обзор кокцидиоза у телят. Доступно по адресу: http://www.calfnotes.com/pdffiles/CN017.pdf.
По состоянию на 15 мая 2009 г.
2. Фицджеральд, Мэнсфилд, Мэн. Экономическое значение кокцидиоза у телят. J Parasitol 1969; 55: 39 (аннотация).
3. Фитцджеральд, Мэнсфилд, Мэн. Эффекты
кокцидиоз крупного рогатого скота на определенные компоненты крови, потребление корма и массу тела
изменения телят. Am J Vet Res 1972; 33 (7): 1391-1397.
4. Маас Дж. Дж. Факт
Лист № 10: Кокцидиоз крупного рогатого скота. Калифорнийский университет в Дэвисе; 1997.
Калифорнийский университет в Дэвисе; 1997.
Жизненный цикл и типы кокцидий - Управление кокцидиозом для натуральной и органической птицы
Жизненный цикл и типы кокцидий
Знание того, как развиваются кокцидии, помогает понять и контролировать болезнь.Кокцидиоз у домашней птицы вызывает одноклеточный паразит из рода Eimeria . Жизненный цикл Eimeria занимает от четырех до семи дней. Он начинается, когда птица захватывает и проглатывает активные «ооцисты». «Ооциста» - это капсула с толстой стенкой, защищающей паразитов. Они «образуют споры» или становятся инфекционными, если влага, температура и кислород становятся способствующими их росту. После того, как птица поедает ооцисты, кокцидии проникают в слизистую оболочку кишечника и многократно размножаются, повреждая ткани.
Кокцидиальная инфекция отличается от бактериальных и вирусных инфекций, поскольку кокцидии являются «самоограничивающимися» и обычно прекращают размножение до того, как птица погибнет.
Кокцидии - паразиты, поэтому питательные вещества они получают от курицы-хозяина. В конечном итоге размножение прекращается, обычно до того, как птица погибнет. Птица сбрасывает паразита в свой помет. Эти новые ооцисты могут инфицировать других птиц. См. Рамку «Размножение кокцидий» для получения дополнительной информации о сложном жизненном цикле кокцидий.
Кокцидии - очень плодовитые паразиты. Одна спорулированная ооциста может иметь большое влияние, когда ее ест курица. В каждой ооцисте четыре спороцисты, а в каждой спороцисте - по два спорозоита. Пищеварительный тракт высвобождает восемь спорозоитов из ооцисты, и они перемещаются в клеточную оболочку пищеварительного тракта. Внутри клетки паразит делится и вторгается в другие клетки. Может быть несколько поколений бесполого размножения; однако эта стадия самоограничивается и в конце концов прекращается.Наконец, наступает половой этап, на котором мужские и женские организмы объединяются и образуют новые ооцисты, защищенные толстой стенкой. Эти ооцисты выделяются с калом. См. Схему жизненного цикла кокцидий ниже.
Может быть несколько поколений бесполого размножения; однако эта стадия самоограничивается и в конце концов прекращается.Наконец, наступает половой этап, на котором мужские и женские организмы объединяются и образуют новые ооцисты, защищенные толстой стенкой. Эти ооцисты выделяются с калом. См. Схему жизненного цикла кокцидий ниже.
Кокцидиоз - это обычно болезнь молодых птиц, но птицы могут заразиться в любое время, если никогда ранее не подвергались заражению. Популяции кокцидий достигают опасного уровня со временем, поэтому вспышки обычно происходят в возрасте от 3 до 8 недель. Кокцидиоз идет рука об руку с заболеваниями кишечника, потому что он повреждает кишечник и позволяет бактериям проникать и вызывать вторичные инфекции.Кокцидии являются «видоспецифичными» - кокцидии, поражающие цыплят, не влияют на другой домашний скот, и наоборот (см. Вставку «Видовые паразиты»).
| Видовые паразиты Практически все домашние животные поражены различными видами кокцидий. | |
| Куриные кокцидии: Eimeria acervulina Eimeria maxima Eimeria tenella Eimeria necatrix Eimeria mitis Eimeria brunetti Eimeria praecox | Кокцидии индейки: Eimeria adenoeides Эймерия мелеагримит Eimeria gallopavonis Эймерия дисперса |
Типичный жизненный цикл кокцидий у птиц
Frontiers | Обзор жизненного цикла Eimeria домашней птицы и взаимодействий паразит-хозяин
Введение
Кокцидиоз - это термин, используемый для описания кишечного заболевания, вызванного инфицированием одним или несколькими видами Eimeria (1), и оказывает сильное экономическое влияние на птицеводство во всем мире (2, 3).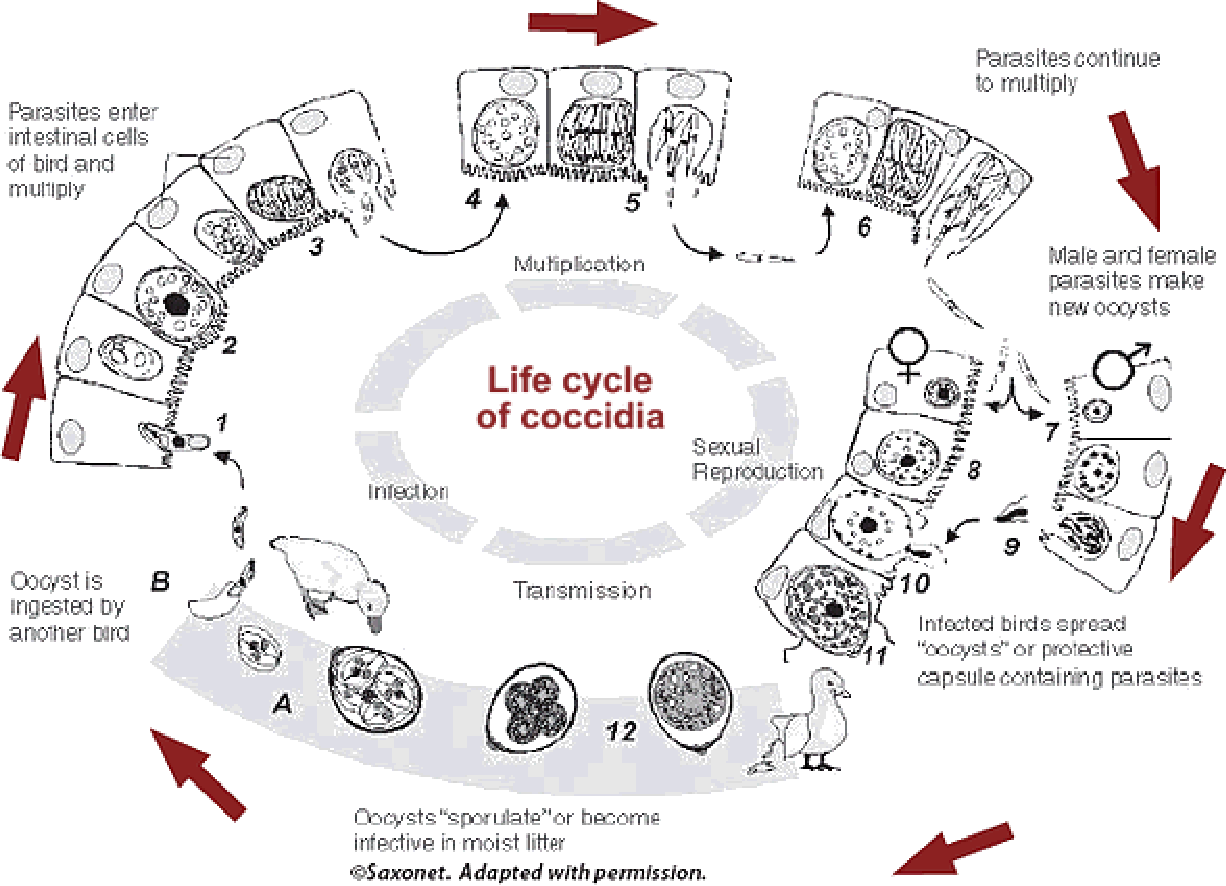 Этиологией этого кишечного заболевания являются патогенные видов Eimeria, , принадлежащих к филюму Apicomplexa, в частности Eimeria maxima, E. tenella и E. acervulina (1). В настоящее время известно семь видов Eimeria , которые заражают кур и различаются по патогенности. Однако описаны и другие виды (4). Различия между этими видами Eimeria включают инвазию в определенные участки кишечника, патогенность и тип образовавшегося поражения (Таблица 1) (6).
Этиологией этого кишечного заболевания являются патогенные видов Eimeria, , принадлежащих к филюму Apicomplexa, в частности Eimeria maxima, E. tenella и E. acervulina (1). В настоящее время известно семь видов Eimeria , которые заражают кур и различаются по патогенности. Однако описаны и другие виды (4). Различия между этими видами Eimeria включают инвазию в определенные участки кишечника, патогенность и тип образовавшегося поражения (Таблица 1) (6).
Таблица 1 . Поражения и патогенность Eimeria spp. у кур.
Клиническое заболевание у бройлеров включает диарею (от слизистой и водянистой до геморрагической), снижение привеса и проглатывания корма, а в тяжелых случаях - смертность (7). Большинство цыплят в какой-то момент своей жизни инфицированы кокцидиозами, но лишь у некоторых разовьются клинические проявления кокцидиоза. Клинические симптомы обычно возникают у молодых животных, но иногда возникают у взрослых (1, 8, 9). Заражение низкими уровнями Eimeria может стимулировать защитный иммунный ответ хозяина, и это является основой стратегий вакцинации (1, 10). Было заявлено, что заболевание возникает только в том случае, если животное подвергается воздействию высокой дозы инфекции или иммунитет хозяина довольно слаб (1). Из-за самоограничивающего характера жизненного цикла и повышенной устойчивости к повторному заражению кокцидиоз редко является проблемой в системах с интенсивным выращиванием, но становится важным в тесно замкнутых и высокоинтенсивных производственных системах.Стратегии борьбы с болезнью включают использование вакцинации и профилактических препаратов. Тем не менее, постоянное использование различных кокцидиостатов привело к лекарственной устойчивости Eimeria (11).
Заражение низкими уровнями Eimeria может стимулировать защитный иммунный ответ хозяина, и это является основой стратегий вакцинации (1, 10). Было заявлено, что заболевание возникает только в том случае, если животное подвергается воздействию высокой дозы инфекции или иммунитет хозяина довольно слаб (1). Из-за самоограничивающего характера жизненного цикла и повышенной устойчивости к повторному заражению кокцидиоз редко является проблемой в системах с интенсивным выращиванием, но становится важным в тесно замкнутых и высокоинтенсивных производственных системах.Стратегии борьбы с болезнью включают использование вакцинации и профилактических препаратов. Тем не менее, постоянное использование различных кокцидиостатов привело к лекарственной устойчивости Eimeria (11).
Eimeria spp. демонстрируют высокую степень специфичности хоста и сайта. Это объясняет, почему у любого животного может быть несколько видов Eimeria spp., Каждый из которых имеет свое собственное местоположение в кишечнике. Каждые Eimeria spp. вызывает различные взаимодействия между хозяином и паразитом, вызывая различную симптоматику кокцидиоза (12).Первой фазой паразитарного цикла является взаимодействие Eimeria с клеткой-хозяином, которое приводит к массивному разрушению кишечных клеток (11). Понимание этого взаимодействия и факторов окружающей среды является ключом к правильному контролю над болезнью (11). Цель этого обзора - изучить паразита домашней птицы Eimeria и обобщить имеющуюся информацию о его жизненном цикле и первоначальном взаимодействии клетки-хозяина и паразита.
Каждые Eimeria spp. вызывает различные взаимодействия между хозяином и паразитом, вызывая различную симптоматику кокцидиоза (12).Первой фазой паразитарного цикла является взаимодействие Eimeria с клеткой-хозяином, которое приводит к массивному разрушению кишечных клеток (11). Понимание этого взаимодействия и факторов окружающей среды является ключом к правильному контролю над болезнью (11). Цель этого обзора - изучить паразита домашней птицы Eimeria и обобщить имеющуюся информацию о его жизненном цикле и первоначальном взаимодействии клетки-хозяина и паразита.
Род
Eimeria Этот род состоит из ~ 1700 видов, поражающих как домашних млекопитающих, так и птиц.Все Eimeria spp. являются видоспецифичными и поэтому известны как моноксенные паразиты (13). Род Eimeria содержит виды, оказывающие наибольшее экономическое воздействие на кур. В общем, все свежеотпущенные ооцисты состоят из утолщенной внешней стенки и округлой массы с ядросодержащей зиготой; однако, как только происходит спороношение, отличительные характеристики каждого вида становятся более очевидными.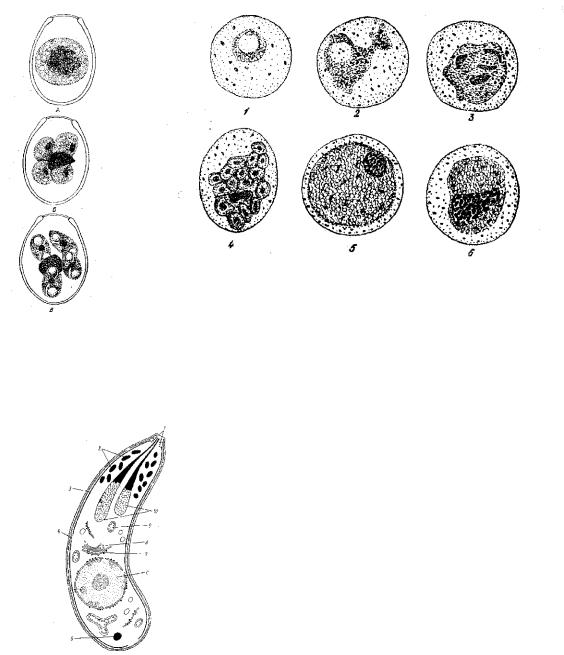 Для рода Eimeria внутри околоплазмы ооцисты развиваются четыре спороцисты, каждая из которых содержит два спорозоита в форме банана (рис. 1).Напротив, другой род Cystoisospora содержит две спороцисты, каждая из которых содержит четыре спорозоита (12).
Для рода Eimeria внутри околоплазмы ооцисты развиваются четыре спороцисты, каждая из которых содержит два спорозоита в форме банана (рис. 1).Напротив, другой род Cystoisospora содержит две спороцисты, каждая из которых содержит четыре спорозоита (12).
Рисунок 1 . Eimeria spp. Спорулированная ооциста. (А) E. máxima . (B) E. tenella . (C) E. acervulina .
Жизненный цикл
Жизненный цикл Eimeria в основном состоит из двух стадий: экзогенной фазы (спорогония) и эндогенной фазы (шизогония и гаметогония) (14).Начальная инфекционная единица всех Eimeria spp. стадия спорозоитов, представляющая собой подвижную клетку в форме банана. Спорозоит каждого апикомплексного паразита характеризуется уникальным комплексом структур, специализирующихся на инвазии клеток-хозяев (15). Спорозоит - это начало и конец жизненного цикла любого кокцидиана (16). Спорозоиты представляют собой инфекционные формы, обнаруживаемые в спорулированных ооцистах и являющиеся результатом сегментации протоплазмы (16). Протоплазма (споронт) окружена устойчивой стенкой ооцисты и выводится со стулом.Ооцисты имеют яйцевидную форму и различаются по размеру и форме в зависимости от вида (рис. 1).
Спорозоиты представляют собой инфекционные формы, обнаруживаемые в спорулированных ооцистах и являющиеся результатом сегментации протоплазмы (16). Протоплазма (споронт) окружена устойчивой стенкой ооцисты и выводится со стулом.Ооцисты имеют яйцевидную форму и различаются по размеру и форме в зависимости от вида (рис. 1).
После экзогенной фазы (спорогония) спорулированные ооцисты могут инициировать репликацию, как только они перорально попадают в организм восприимчивого хозяина, в данном случае курицы (1). Внутри кишечника хозяина спорозоиты высвобождаются из ооцист под действием пищеварительных ферментов и механического разрушения. Для появления спорозоитов должны присутствовать два отдельных стимула: во-первых, стресс углекислым газом (CO 2 ), который вызывает разрыв микропиле и увеличение проницаемости в ооцисте.Это приводит к коллапсу содержимого ооцисты в гипертоническом солевом растворе (17). Оптимальная концентрация CO 2 и время инкубации различаются в зависимости от вида (7).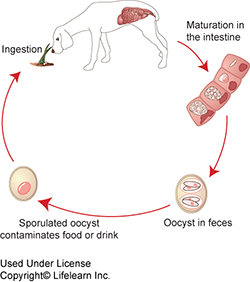 Температура также важна для высвобождения инфекционных спорозоитов (то есть температура тела) (18). Во-вторых, действие соединений, таких как трипсин и желчь (19), активирует спорозоиты внутри спороцисты и переваривает тело Stieda, образуя отверстие в мембране спороцисты. Желчь может либо способствовать проникновению пищеварительных ферментов через измененный микропиле в ооцисту, либо может изменять липопротеины тельца Stieda ооцист Eimeria (20).Хотя желчь не является строго необходимой для активации спорозоитов, было продемонстрировано, что недостаток желчи для многих видов Eimeria spp. приводит к более медленному высвобождению и более медленному высвобождению спорозоитов, подвергшихся воздействию (19, 21). Трипсин переваривает стенку спороцисты вместе с паразитоспецифическими ферментами, секретируемыми активированными спорозоитами. Из-за непрерывного движения спорозоитов тело Стиды разбухает, а затем исчезает, оставляя небольшое отверстие, через которое спорозоиты выходят (21).
Температура также важна для высвобождения инфекционных спорозоитов (то есть температура тела) (18). Во-вторых, действие соединений, таких как трипсин и желчь (19), активирует спорозоиты внутри спороцисты и переваривает тело Stieda, образуя отверстие в мембране спороцисты. Желчь может либо способствовать проникновению пищеварительных ферментов через измененный микропиле в ооцисту, либо может изменять липопротеины тельца Stieda ооцист Eimeria (20).Хотя желчь не является строго необходимой для активации спорозоитов, было продемонстрировано, что недостаток желчи для многих видов Eimeria spp. приводит к более медленному высвобождению и более медленному высвобождению спорозоитов, подвергшихся воздействию (19, 21). Трипсин переваривает стенку спороцисты вместе с паразитоспецифическими ферментами, секретируемыми активированными спорозоитами. Из-за непрерывного движения спорозоитов тело Стиды разбухает, а затем исчезает, оставляя небольшое отверстие, через которое спорозоиты выходят (21). Этот процесс очень быстрый и включает в себя сильное сжатие, вызванное быстрым движением и давлением спорозоита, чтобы пройти через отверстие (21-25).До этого момента хозяину не было нанесено никакого ущерба. Во время эксцистации и вторжения в клетку-хозяина спорозоит использует накопленный амилопектин для удовлетворения своих потребностей в энергии. Веттерлинг и Доран (1969) наблюдали, что в течение 30-минутного периода эксцистанции при 42,9 ° C уровни углеводных резервов снизились на 2/3 в активированных спорозоитах. Это также коррелирует с потреблением кислорода и липидных соединений (26, 27).
Этот процесс очень быстрый и включает в себя сильное сжатие, вызванное быстрым движением и давлением спорозоита, чтобы пройти через отверстие (21-25).До этого момента хозяину не было нанесено никакого ущерба. Во время эксцистации и вторжения в клетку-хозяина спорозоит использует накопленный амилопектин для удовлетворения своих потребностей в энергии. Веттерлинг и Доран (1969) наблюдали, что в течение 30-минутного периода эксцистанции при 42,9 ° C уровни углеводных резервов снизились на 2/3 в активированных спорозоитах. Это также коррелирует с потреблением кислорода и липидных соединений (26, 27).
Свободные спорозоиты инфицируют кишечные клетки кишечника и развиваются внутри паразитофорной вакуоли (ПВ) в округлый и растущий организм, называемый трофозоитом, который становится меронтом во время первого поколения мерогонии (12, 28, 29).По мере роста спорозоита эндотелиальная клетка становится гипертрофированной, а ее ядро претерпевает изменения, становясь больше с увеличенным ядрышком с разбросанным хроматином; его цитоплазма состоит из двух концентрических зон и не имеет вакуолизированного вида (30). Первоначально ядро клетки-хозяина имеет случайное распределение, но затем оно мигрирует на периферию, чтобы приспособиться к развитию меронтов (29).
Первоначально ядро клетки-хозяина имеет случайное распределение, но затем оно мигрирует на периферию, чтобы приспособиться к развитию меронтов (29).
Мерогония начинается с множественных делений ядра трофозоита Eimeria без разделения цитоплазмы, что приводит к образованию эллипсоидных структур, называемых бластофорами, с периферическим слоем ядер.Мерозоит образуется вокруг каждого ядра и растет в радиальном направлении. В конце фазы деление цитоплазмы приводит к образованию мононуклеарных веретеновидных подвижных дочерних клеток, известных как мерозоиты (12). Зрелые мерозоиты I разделены остаточным телом - остатком бластофора (26). Когда меронт созревает, мерозоиты I разрывают клетку и выходят в просвет тонкой кишки и, скорее всего, транспортируются кишечным потоком в толстую кишку, где мерозоиты I проникают в новые клетки.У мерозоитов I есть полярное кольцо, содержащее коноид с волокнами, сгруппированными в узкую спираль. От шишки до спины паразита проходят две раптрии с параллельной перемычкой на шее. Передняя область содержит множество микронем, 22 субпеликулярных трубочки, три из которых имеют гранулы гликогена, много рибосом, одну или две митохондрии, микропору и эндоплазматический ретикулум (26, 31). Эти мерозоиты I проникают в эпителиальные клетки и развиваются во вторую стадию меронтов, высвобождая лишь несколько мерозоитов II (31).
Передняя область содержит множество микронем, 22 субпеликулярных трубочки, три из которых имеют гранулы гликогена, много рибосом, одну или две митохондрии, микропору и эндоплазматический ретикулум (26, 31). Эти мерозоиты I проникают в эпителиальные клетки и развиваются во вторую стадию меронтов, высвобождая лишь несколько мерозоитов II (31).
После созревания вторых стадий меронтов высвободившиеся мерозоиты II проникают в соседние эпителиальные клетки, претерпевая половую гамогонию. Во время гамогонии большинство мерозоитов II развиваются в одну большую мононуклеарную сфероидную клетку - женскую макрогамету. Макрогаметы имеют характерные эозинофильные гранулы [внешний слой гранул, содержащий гликопротеины, и внутренний слой гранул, содержащий молекулы, богатые белком; оба широко известны как «стенки, формирующие тела» (WFB1, WFB2)]. Немногочисленные мерозоиты II развиваются в большие полинуклеарные клетки (мужские микрогамонты), которые образуют множество веретеновидных клеток с двумя жгутиками, микрогаметами (32).
Гамонты быстро вызывают изменения в клетке-хозяине, которая искажает и теряет свою столбчатую структуру (33). Патологические изменения и клинические признаки, связанные с Eimeria , вызваны в основном гамонтами (26), поскольку они вызывают разрушение слизистой оболочки тощей кишки, подвздошной и слепой кишки, вызывая дисбаланс всасывания (особенно воды и электролитов) и что приводит к диарее (12).
После этого свободно выпущенные микрогаметы оплодотворяют окружающие макрогаметы, образуя зиготы.Эозинофильные гранулы сходятся и образуют устойчивую стенку ооцисты, окружающую зиготу, которая уменьшается в размере и становится споронтом. Наконец, ооцисты высвобождаются из разорванных эпителиальных клеток и выводятся с калом в окружающую среду (9, 12).
Спорулированные Eimeria spp. Ооциста, выделяемая из организма хозяина, содержит стадию диплоидного споронта, которая развивается в дальнейшем путем мейоза. Сначала генерируются четыре гаплоидных споробласта, которые заключены в оболочку, тем самым становясь спороцистой. В каждой спороцисте вновь образуются по два спорозоита. Споронт также генерирует преломляющее полярное тело после мейоза (34). Этот процесс экзогенного спороношения (также известный как спорогония) требует оптимальных условий окружающей среды, включая достаточное количество кислорода, влаги и адекватную температуру (16%, 23 ° C) (35). Споруляция кажется строго аэробным процессом. Этот процесс занимает 1-2 дня. Как только споруляция заканчивается, метаболизм и дыхание ооцисты снижаются, однако она использует свои запасы полисахаридов и в конечном итоге становится неинфекционной, поскольку у паразита заканчивается энергия для осуществления процесса окончательной эндогенной эксцистации в просвете кишечника. (17).Спорулированные ооцисты могут долгое время выживать вне хозяина, в зависимости от факторов окружающей среды. Ооцисты устойчивы к некоторым дезинфицирующим средствам, обычно используемым в домашних условиях, но погибают при замораживании или высоких температурах окружающей среды.
В каждой спороцисте вновь образуются по два спорозоита. Споронт также генерирует преломляющее полярное тело после мейоза (34). Этот процесс экзогенного спороношения (также известный как спорогония) требует оптимальных условий окружающей среды, включая достаточное количество кислорода, влаги и адекватную температуру (16%, 23 ° C) (35). Споруляция кажется строго аэробным процессом. Этот процесс занимает 1-2 дня. Как только споруляция заканчивается, метаболизм и дыхание ооцисты снижаются, однако она использует свои запасы полисахаридов и в конечном итоге становится неинфекционной, поскольку у паразита заканчивается энергия для осуществления процесса окончательной эндогенной эксцистации в просвете кишечника. (17).Спорулированные ооцисты могут долгое время выживать вне хозяина, в зависимости от факторов окружающей среды. Ооцисты устойчивы к некоторым дезинфицирующим средствам, обычно используемым в домашних условиях, но погибают при замораживании или высоких температурах окружающей среды.
Механизм вторжения
Чтобы вызвать заболевание, апикомплексным паразитам сначала необходимо вторгнуться в чувствительные клетки-хозяева.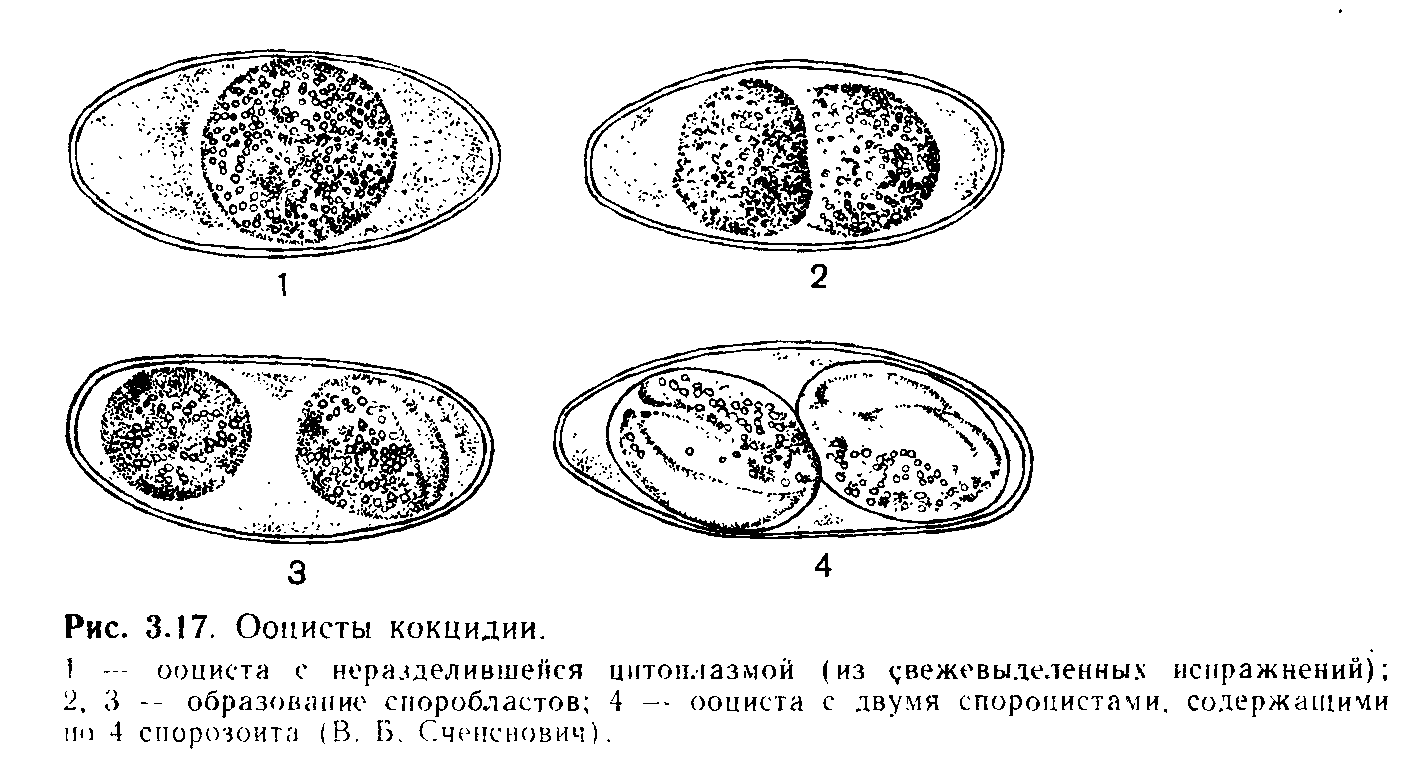 Чтобы достичь этого, процесс распознавания и инициация инфекции являются ключевыми моментами, которые могут использоваться в качестве целевых факторов для потенциального лечения.В настоящее время существует множество исследований этого процесса для паразитов, таких как Toxoplasma gondii и Plasmodium spp. (36–40). Однако информация о Eimeria spp. инвазия слабая, и все еще существуют пробелы в понимании того, как происходит инфекция (15). Последовательно мы можем разделить процесс инвазии клеток-мишеней на 5 основных шагов, что позволяет лучше понять это событие.
Чтобы достичь этого, процесс распознавания и инициация инфекции являются ключевыми моментами, которые могут использоваться в качестве целевых факторов для потенциального лечения.В настоящее время существует множество исследований этого процесса для паразитов, таких как Toxoplasma gondii и Plasmodium spp. (36–40). Однако информация о Eimeria spp. инвазия слабая, и все еще существуют пробелы в понимании того, как происходит инфекция (15). Последовательно мы можем разделить процесс инвазии клеток-мишеней на 5 основных шагов, что позволяет лучше понять это событие.
Распознавание клетки-мишени
Инвазия требует распознавания и взаимодействия спорозоитов с клеткой-хозяином. Eimeria spp. может только завершить свой жизненный цикл и производить ооцисты, выделяемые с фекалиями в конкретном хозяине; однако для этого специфического процесса паразиту требуется ряд стимулов (22, 41, 42). Между 1929 и 1954 годами было проведено большое количество исследований с целью заражения различных видов хозяев несколькими типами Eimeria , однако большинство экспериментов были безуспешными, и только экспериментальные инфекции цыплят видами индейки ( E. gallopavonis) и E.meleagridis ) были успешно получены (43). Эти наблюдения предполагают, что некоторые узнающие молекулы, вероятно, необходимы для того, чтобы спорозоиты проникли в определенные клетки-хозяева.
gallopavonis) и E.meleagridis ) были успешно получены (43). Эти наблюдения предполагают, что некоторые узнающие молекулы, вероятно, необходимы для того, чтобы спорозоиты проникли в определенные клетки-хозяева.
Хотя клетки-хозяева не играют активной роли в физическом процессе, способствующем проникновению паразита в клетку, они обеспечивают соответствующие поверхностные молекулы и рецепторы или секретируют метаболиты, которые, как полагают, инициируют привлечение или активацию паразитов апикомлексана, а затем инициируют их признание (15). In vivo, Eimeria spp. показывают высокую степень специфичности хозяйских клеток для своего развития. Eimeria spp. обычно инфицируют ограниченное количество клеток-хозяев и, в частности, часть органа или системы (44, 45). Эта специфичность может быть связана с уникальными условиями просвета кишечника, такими как pH, ферменты, слизистые, метаболиты, концентрация питательных веществ, микробов и т. Д. (46).
Подвижность, структура и секреция спорозоитов позволяют им проникать в клетку, однако есть свидетельства того, что клетка-хозяин также обладает характеристиками, которые являются ключевыми для инфицирования клетки-хозяина (47–49). Среди них есть некоторые молекулы клеточной поверхности кишечного эпителия, которые действуют как рецепторы или сайты узнавания для спорозоитов. Последнее было продемонстрировано исследованиями in vitro и , в которых инвазия паразита подавлялась с помощью различных соединений, которые изменяли мембрану клетки-хозяина. Некоторыми примерами этих соединений являются катионные молекулы, ферменты и ингибиторы протеаз (44, 50–56).
Среди них есть некоторые молекулы клеточной поверхности кишечного эпителия, которые действуют как рецепторы или сайты узнавания для спорозоитов. Последнее было продемонстрировано исследованиями in vitro и , в которых инвазия паразита подавлялась с помощью различных соединений, которые изменяли мембрану клетки-хозяина. Некоторыми примерами этих соединений являются катионные молекулы, ферменты и ингибиторы протеаз (44, 50–56).
Более конкретные данные показали присутствие паразитарных антигенов, которые связываются с молекулами, присутствующими на поверхности клетки-хозяина.Антигены 22, 31 и 37 кДа, мембранные гликоконъюгаты, эпитопы клетки-хозяина и спорозоиты, были идентифицированы как рецепторы и лиганды. Однако их ингибирование не полностью нарушает процесс инвазии паразитов, поэтому необходимо задействовать другие механизмы (15). Некоторые исследования показали, что спорозоитных антигенов E. adenoeides связываются со специфическими компонентами клетки-хозяина. Августин (1989) разработал моноклональное антитело, направленное к 40 кДа антигену спорозоитов, которое заметно уменьшило клеточную инвазию, тем самым проверив гипотезу по крайней мере об одном специфическом рецепторе инвазии (57).
Августин (1989) разработал моноклональное антитело, направленное к 40 кДа антигену спорозоитов, которое заметно уменьшило клеточную инвазию, тем самым проверив гипотезу по крайней мере об одном специфическом рецепторе инвазии (57).
На сегодняшний день считается, что механизмы инвазии сходны для всех паразитов апикомплексного типа, однако лиганды / рецепторы могут меняться у разных видов. Распознавание гликозилированных групп, таких как гепарансульфат и хондроитинсульфат на клетках-хозяевах, по-видимому, является правилом и может быть ответственным за различия в специфичности клеток-мишеней (58–60).
Соответственно, некоторые мембранные гликопротеины также были идентифицированы как потенциальные клеточные рецепторы для инвазии.Для нескольких простейших было предложено, что адгезия опосредуется связыванием с рецепторами лектина, поскольку наблюдается, что распределение углеводных остатков на просветной поверхности кишечника различается в зависимости от региона (61, 62). Что касается отбора клеток-хозяев и инвазии клеток in vitro , однако, нет никакой специфичности ни к хозяину, ни к типу клеток, поскольку многие типы клеток могут быть инфицированы спорозоитами. О таком поведении в принципе сообщали ранее некоторые авторы (63, 64).
Что касается отбора клеток-хозяев и инвазии клеток in vitro , однако, нет никакой специфичности ни к хозяину, ни к типу клеток, поскольку многие типы клеток могут быть инфицированы спорозоитами. О таком поведении в принципе сообщали ранее некоторые авторы (63, 64).
Механизм
Инвазивные стадии апикомплексных паразитов имеют комплекс специализированных структур (например, коноид, полярное кольцо, апикопласт) и органелл, прикрепленных к их мембранам (65). Этот комплекс расположен на переднем конце паразита, и выделяемые из него вещества необходимы для распознавания, адгезии и вторжения в клетку-хозяин. Ранее считалось, что интернализация паразитов происходит путем пассивного фагоцитоза, однако было продемонстрировано активное участие паразита в этом процессе (47, 48, 66).
Хотя спорозоиты могут двигаться, скользя, изгибаясь и вращаясь, у них нет видимых органов передвижения, таких как реснички, жгутики или ложноножки. Функция апикального комплекса связана с проникновением в клетку-хозяин и созданием внутриклеточной среды, подходящей для роста паразита (47, 67).
Апикальный комплекс состоит из уникальных секреторных элементов (микронемы и рооптрии) и структурных элементов (полярные кольца и коноид) (68).Во время активного процесса клеточной инвазии содержимое секреторных органелл высвобождается, образуя подвижный союз, который позволяет образовывать паразитофорную вакуоль. Коноид окружен полярными кольцами, состоящими из микротрубочек и, как полагают, является механической поддержкой инвазии клеток-хозяев (69-74). Кроме того, содержание роттрий вместе с плотными гранулами перепрограммирует клеточные функции, такие как клеточный иммунный ответ (75).
Спорозоиты распознают, контактируют и входят в клетку посредством кругового скользящего движения (скольжения) (76).Это движение важно для инвазии как in vivo , так и in vitro . В условиях in vivo спорозоиты выходят из ооцисты в кишечнике хозяина, а затем мигрируют в просвет кишечника, где они контактируют с эпителиальными клетками хозяина, где происходит инвазия (77).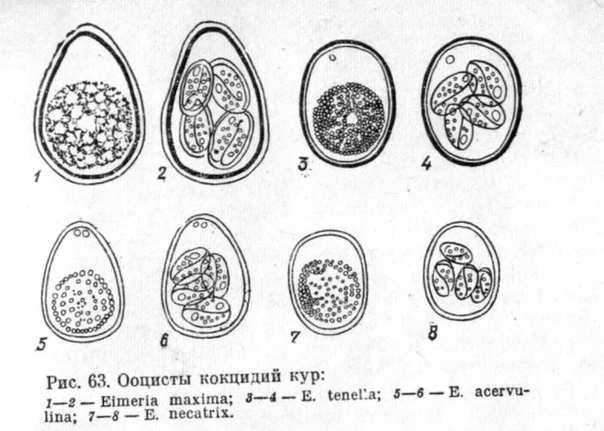 Как только происходит этот первый контакт, спорозоит проникает в клетку с помощью своего апикального сложного механизма. В модели in vitro гравитация помогает спорозоитам достичь контакта с клетками-хозяевами, поскольку они обычно растут как монослои, тем не менее известно, что скользящая подвижность важна для инвазии (40).Паразиты могут регулировать свой скользящий мотор, чтобы активировать миграцию по различным тканям, чтобы заставить клетки вторгаться и, при определенных обстоятельствах, активно выходить из инфицированной клетки-хозяина. Это движение регулируется внутренними и внешними факторами, причем кальциевый сигнальный каскад играет центральную роль в этом процессе (67, 78–82). Детальные исследования скользящей подвижности показывают, что и актин, и миозин участвуют в этом процессе (весь комплекс белков известен как глиидеома) (83–86).Основные компоненты этого аппарата были охарактеризованы с использованием биохимических и молекулярных методов, а также иммуногистохимии и ультраструктурных тестов (87).
Как только происходит этот первый контакт, спорозоит проникает в клетку с помощью своего апикального сложного механизма. В модели in vitro гравитация помогает спорозоитам достичь контакта с клетками-хозяевами, поскольку они обычно растут как монослои, тем не менее известно, что скользящая подвижность важна для инвазии (40).Паразиты могут регулировать свой скользящий мотор, чтобы активировать миграцию по различным тканям, чтобы заставить клетки вторгаться и, при определенных обстоятельствах, активно выходить из инфицированной клетки-хозяина. Это движение регулируется внутренними и внешними факторами, причем кальциевый сигнальный каскад играет центральную роль в этом процессе (67, 78–82). Детальные исследования скользящей подвижности показывают, что и актин, и миозин участвуют в этом процессе (весь комплекс белков известен как глиидеома) (83–86).Основные компоненты этого аппарата были охарактеризованы с использованием биохимических и молекулярных методов, а также иммуногистохимии и ультраструктурных тестов (87).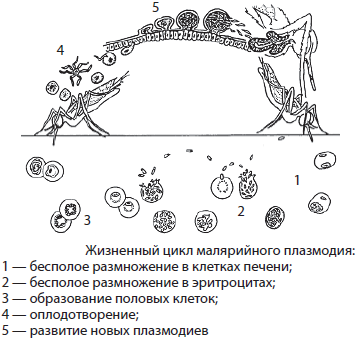
Связывание паразита с клеткой-хозяином
Конечная цель скользящей подвижности паразита состоит в том, чтобы установить временную адгезию, чтобы создать достаточную тягу, чтобы продвинуться внутрь клетки-хозяина. Этот первоначальный контакт опосредуется молекулами адгезии, которые высвобождаются из микронем по направлению к мембране ( pellicula ) паразита.Из этих белков наиболее охарактеризован AMA1 и члены анонимных белков, связанных с тромбоспондином, которые связываются непосредственно с моторным комплексом в месте адгезии (88–90).
Вторжение в клетку-хозяин
Как только спорозоит прикрепляется к клетке, происходит инвагинация клеточной мембраны перед продвигающимся паразитом, что вызывает изменения в клеточной мембране. Имеются данные о том, что Eimeria spp. секретируют материалы, которые способствуют инвагинации мембраны (91).Исследования на T. gondii показали, что инвазия - это организованный процесс, сопровождающийся последовательным высвобождением микронем, рооптрий и плотных гранул (83, 92).
Белки Microneme богаты адгезивными доменами, аналогичными тем, которые обнаруживаются у млекопитающих, хотя между белками имеется небольшая гомология. Секретируемые адгезины микронем, такие как TgMIC2, перемещаются с поверхности паразита актин-миозиновым двигателем во время их проникновения в клетку (83, 92). Содержимое роттрий секретируется во время инвазии и способствует образованию паразитофорной вакуоли.Предполагается, что для T. gondii содержимое роттрий отвечает за предотвращение слияния ЛВ с лизосомами. Кроме того, эти белки привлекают митохондрии и эндоплазматический ретикулум из клетки-хозяина (93–95).
Создание внутриклеточной ниши
Исследования in vitro показали, что PV-мембрана действует как молекулярное сито, проницаемое для молекул размером от 1300 до 1900 Да. Он также содержит трансмембранные белки, полученные из инфицированных клеток-хозяев.Кроме того, PV не связывается с лизосомами и быстро связывается с органеллами и клеточными компонентами.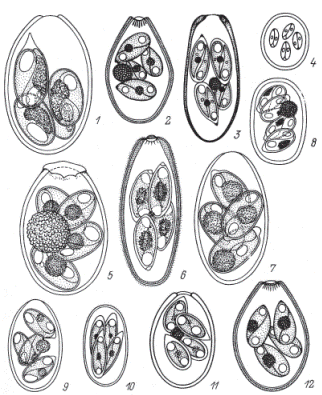 Было показано, что микротрубочки и промежуточные филаменты виметина окружают ЛВ в течение нескольких минут после инвазии и что к нему прикрепляются некоторые органеллы. Последнее важно для предотвращения объединения PV-лизосомы (93, 96, 97). Для некоторых апикомплексных паразитов описаны 2 пути доступа к содержимому клеточных органелл: во-первых, тесная ассоциация с органеллами, поддерживаемыми паразитическими белками ЛВ, и, во-вторых, манипуляции с цитоскелетом для рекрутирования пузырьков в ЛВ.Через 4 ч. я. от 20 до 50% ПВ покрывается митохондриями клетки-хозяина и ER клетки-хозяина (98, 99).
Было показано, что микротрубочки и промежуточные филаменты виметина окружают ЛВ в течение нескольких минут после инвазии и что к нему прикрепляются некоторые органеллы. Последнее важно для предотвращения объединения PV-лизосомы (93, 96, 97). Для некоторых апикомплексных паразитов описаны 2 пути доступа к содержимому клеточных органелл: во-первых, тесная ассоциация с органеллами, поддерживаемыми паразитическими белками ЛВ, и, во-вторых, манипуляции с цитоскелетом для рекрутирования пузырьков в ЛВ.Через 4 ч. я. от 20 до 50% ПВ покрывается митохондриями клетки-хозяина и ER клетки-хозяина (98, 99).
Кроме того, было высказано предположение, что митохондрии связаны с PV за счет белков, происходящих от rhoptry, таких как ROP2. ROP2 прикрепляется к мембране PV за счет гидрофобных взаимодействий и ионных взаимодействий с N-концом белка (100). ROP2 содержит два домена, которые нацелены на митохондриальный матрикс, и домены ER, экспонированные в цитозоле. Тесный контакт между органеллами и ЛВ способствует передаче некоторых продуктов паразитам через каналы, расположенные в мембране. Однако эти каналы еще не охарактеризованы (101).
Однако эти каналы еще не охарактеризованы (101).
После описанных ранее взаимодействий паразит начинает массовую модуляцию транскриптома хозяина (102). Транскрипция генов, влияющих на защиту хозяина и развитие паразита, регулируется активацией факторов транскрипции. Внутри этих факторов находится семейство NF-κB, которое включает p50 (NF-κB1), p52 (NF-κB2) и субъединицы RelA, RelB и c-Rel. Эти факторы обычно связаны с нейтрализацией молекулы ингибитора IκBs путем фосфорилирования сериновых остатков, что приводит к деградации протеасомами.Активный гетеродимер перемещается в ядро, где начинается транскрипция генов, участвующих в росте клеток, апоптозе и иммунном ответе (103). NF-κB активируется во время инфицирования клетки-хозяина различными патогенами, и его активация способствует облигатным внутриклеточным апикомплексам. Для T. gondii активация этого фактора в фибробластах увеличивала его выживаемость. Об антиапоптотическом механизме NF-κB также сообщалось у C. parvum .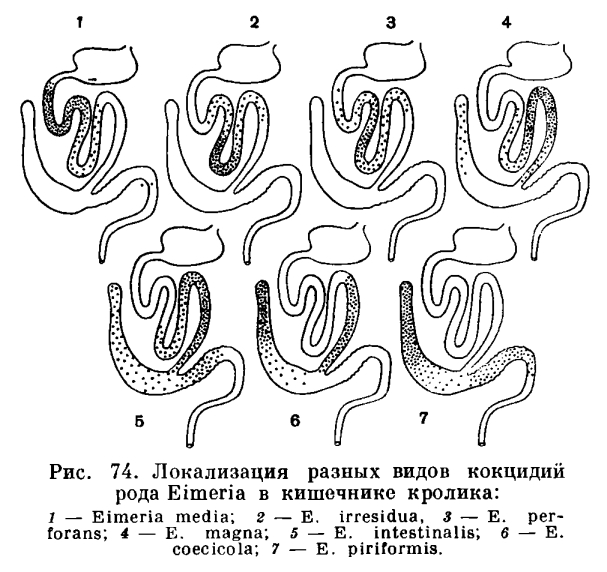 Однако паразит также может блокировать транслокацию фактора в ядро, уменьшая таким образом воспалительную реакцию (104–107).С другой стороны, для P. falciparum фактор также активируется в эндотелиальных клетках, вызывая увеличение экспрессии ICAM-I, что связано с секвестрацией красных кровяных телец на эндотелии, чтобы избежать фагоцитоза селезенки ( 108). Помимо NF-κB, белки семейства STAT (STAT1-4, STAT5a, STAT5b и STAT6) активируются в ответ на апикомплексаны, что приводит к продукции цитокинов. Это семейство регулирует транскрипцию генов, связанных с дифференцировкой, ростом и выживанием клеток, а также с иммунным ответом.Фосфорилирование белков STAT опосредуется цитозин-активируемой киназой Janus, которая вызывает димеризацию и транслокацию ядер. Активность STAT1 важна для механизмов клеточной защиты, тогда как STAT3 / 6 способствует внутриклеточному развитию T.gondii (109–113).
Однако паразит также может блокировать транслокацию фактора в ядро, уменьшая таким образом воспалительную реакцию (104–107).С другой стороны, для P. falciparum фактор также активируется в эндотелиальных клетках, вызывая увеличение экспрессии ICAM-I, что связано с секвестрацией красных кровяных телец на эндотелии, чтобы избежать фагоцитоза селезенки ( 108). Помимо NF-κB, белки семейства STAT (STAT1-4, STAT5a, STAT5b и STAT6) активируются в ответ на апикомплексаны, что приводит к продукции цитокинов. Это семейство регулирует транскрипцию генов, связанных с дифференцировкой, ростом и выживанием клеток, а также с иммунным ответом.Фосфорилирование белков STAT опосредуется цитозин-активируемой киназой Janus, которая вызывает димеризацию и транслокацию ядер. Активность STAT1 важна для механизмов клеточной защиты, тогда как STAT3 / 6 способствует внутриклеточному развитию T.gondii (109–113).
Заключение и перспективы
По-прежнему отсутствует информация о поведении Eimeria spp. внутри клетки-хозяина. Большая часть доступной информации экстраполирована от других апикомлексных паразитов.На очень упрощенном уровне эти взаимодействия должны быть похожими, потому что они принадлежат к одному семейству, тем не менее, как мы знаем, патогенез и поведение кокцидий различаются, поэтому должны быть существенные различия, которые необходимо выяснить с помощью in vitro исследования. Кроме того, транскриптомные исследования помогут идентифицировать белки, присутствующие на разных фазах цикла, и помогут лучше понять поведение и возможные цели для разработки новых лекарств.
внутри клетки-хозяина. Большая часть доступной информации экстраполирована от других апикомлексных паразитов.На очень упрощенном уровне эти взаимодействия должны быть похожими, потому что они принадлежат к одному семейству, тем не менее, как мы знаем, патогенез и поведение кокцидий различаются, поэтому должны быть существенные различия, которые необходимо выяснить с помощью in vitro исследования. Кроме того, транскриптомные исследования помогут идентифицировать белки, присутствующие на разных фазах цикла, и помогут лучше понять поведение и возможные цели для разработки новых лекарств.
Взносы авторов
Все перечисленные авторы внесли существенный, прямой и интеллектуальный вклад в работу и одобрили ее к публикации.
Конфликт интересов
LG-O использовался компанией Alura Animal Health and Nutrition.
Остальные авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Исследовательская группа CIBAV благодарит Университет Антиокии, Медельин, Колумбия (Стратегия объединения исследовательских групп CODI 2018-2019).
Список литературы
3.Haug A, Gjevre AG, Skjerve E, Kaldhusdal M. Обзор экономического воздействия субклинических инфекций эймерией у цыплят-бройлеров в Норвегии. Avian Pathol. (2008) 37: 333–41. DOI: 10.1080 / 03079450802050705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
4. Конвей Д.П., Маккензи Мэн. Методика диагностики и тестирования кокцидиоза домашней птицы. Blackwell Publishing (2007). DOI: 10.1002 / 9780470344620
CrossRef Полный текст | Google Scholar
7.Lang M, Kann M, Zahner H, Taubert A, Hermosilla C. Ингибирование апоптоза клеток-хозяев спорозоитами eimeria bovis. Vet Parasitol. (2009) 160: 25–33. DOI: 10.1016 / j.vetpar.2008.10.100
PubMed Аннотация | CrossRef Полный текст | Google Scholar
8. Кендалл DJ. Видовые свойства кокцидий домашних животных. В: Жизненные циклы кокцидий домашних животных . Оксфорд, Великобритания: Баттерворт-Хайнеманн; Эльзевир (1972). п. 197–237. DOI: 10.1016 / B978-0-8391-0066-9.50011-6
Кендалл DJ. Видовые свойства кокцидий домашних животных. В: Жизненные циклы кокцидий домашних животных . Оксфорд, Великобритания: Баттерворт-Хайнеманн; Эльзевир (1972). п. 197–237. DOI: 10.1016 / B978-0-8391-0066-9.50011-6
CrossRef Полный текст | Google Scholar
9. Chartier C, Paraud C. Кокцидиоз, вызванный Eimeria у овец и коз, обзор. Small Rumin Res. (2012) 103: 84–92. DOI: 10.1016 / j.smallrumres.2011.10.022
CrossRef Полный текст | Google Scholar
10. Цена кр. Использование живых вакцин для борьбы с кокцидиозом молодок ремонтного несушки. J Appl Poult Res. (2012) 21: 679–92. DOI: 10.3382 / japr.2011-00486
CrossRef Полный текст | Google Scholar
11.Хазанди М. Название Взаимодействие эимерии и клетки-хозяина у цыплят-бройлеров . Розуорти, SA: Университет Аделаиды (2006).
Google Scholar
12. Деплаз П., Экерт Дж., Матис А., Самсон-Химмельстьерна Г., фон Захнер Х. Паразитология в ветеринарной медицине . Вагенинген: Академические издательства Вагенингена (2016). DOI: 10.3920 / 978-90-8686-274-0
Паразитология в ветеринарной медицине . Вагенинген: Академические издательства Вагенингена (2016). DOI: 10.3920 / 978-90-8686-274-0
CrossRef Полный текст | Google Scholar
14. Allen PC, Fetterer RH. Последние достижения в биологии и иммунобиологии видов эимерии, а также в диагностике и борьбе с инфекциями, вызываемыми кокцидийными паразитами домашней птицы. Clin Microbiol Rev. (2002) 15: 58–65. DOI: 10.1128 / CMR.15.1.58-65.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
16. Боумен Д. Паразитология Джорджиса для ветеринаров . Сент-Луис, Миссури: Elsevier (2014).
Google Scholar
17. Райли Дж. Ф. Биохимия кокцидий. Comp Biochem Parasites. Нью-Йорк, штат Нью-Йорк; Лондон: Academic Press (1972) 359–81. DOI: 10.1016 / B978-0-12-711050-9.50030-0
CrossRef Полный текст | Google Scholar
18.Пизиел AM, Демяшкевич AW. Наблюдения за споруляцией eimeria bovis (Apicomplexa: Eimeriidae) из европейского зубра bison bonasus: влияние температуры и раствора дихромата калия. Folia Parasitol. (2015) 62: 1–3. DOI: 10.14411 / fp.2015.020
Folia Parasitol. (2015) 62: 1–3. DOI: 10.14411 / fp.2015.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
21. Лопес-Осорио С., Сильва Л.М.Р., Чапарро-Гутьеррес Дж. Дж., Веласкес З. Д., Тауберт А., Эрмосилья С. и др. Оптимизированный протокол эксцистации для ооцист, спорулированных eimeria bovis и eimeria arloingi, и первый трехмерный голотомографический микроскопический анализ различного выхода спорозоитов. Parasitol Int. (2020) 76: 102068. DOI: 10.1016 / j.parint.2020.102068
PubMed Аннотация | CrossRef Полный текст | Google Scholar
24. Woodmansee DB. Выделение, эксцистация in vitro и развитие Cryptosporidium sp. In vitro. от телят (докторская диссертация), Университет штата Айова, Эймс, штат Айова, США (1986).
Google Scholar
25. Хибберт Л., Хаммонд Д., Симмонс Дж. Влияние pH, буферов, желчных и желчных кислот на эксцистанцию спорозоитов различных видов эимерий. J Protozool. (1968) 16: 441–4. DOI: 10.1111 / j.1550-7408.1969.tb02297.x
(1968) 16: 441–4. DOI: 10.1111 / j.1550-7408.1969.tb02297.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
26. Левин Д.Н. Простейшие паразиты домашних животных и человека. Mineapolis, MN: Burguess Publishing Company (1973).
Google Scholar
27. Левин Д.Н. Apicomplexa: Собственные кокцидии. Простейшие паразиты домашних животных и человека . Издательская компания Burgress (1973).
Google Scholar
29.Бедрник П. Культивирование eimeria tenella в культуре тканей. дальнейшее развитие мерозоитов второго поколения в тканевых культурах. Acta protozool. (1969) 7: 87–98.
Google Scholar
31. Hammond DM, Long PL. Кокцидии. Eimeria, Isospora, Toxoplasma и родственные роды . Балтимор, Лондон: University Park Press (1973).
Google Scholar
35. Вальденштедт Л., Элвингер К., Лунден А., Тибо П., Уггла А. Спороношение ооцист eimeria maxima в подстилке с различным содержанием влаги.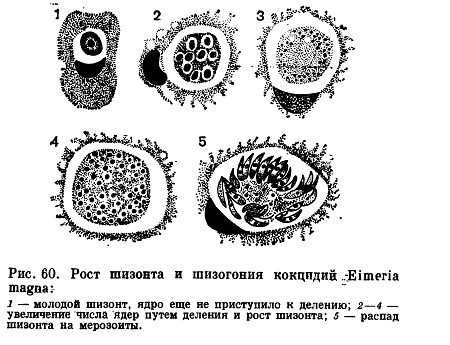 Poult Sci. (2001) 80: 1412–5. DOI: 10.1093 / пс / 80.10.1412
Poult Sci. (2001) 80: 1412–5. DOI: 10.1093 / пс / 80.10.1412
PubMed Аннотация | CrossRef Полный текст | Google Scholar
36. Kim K, Weiss LM. Toxoplasma gondii : модель апикомплексана. Int J Parasitol. (2004) 34: 423–32. DOI: 10.1016 / j.ijpara.2003.12.009
CrossRef Полный текст | Google Scholar
37. Фокет Л., Хермсен С.С., Верхой Л., ван Гемерт Г.Дж., Кортезе Р., Никосия А. и др. Анти-CD81, но не анти-SR-BI, блокирует инфекцию печени плазмодием falciparum на гуманизированной модели мыши. J Antimicrob Chemother. (2014) 70: 1784–7. DOI: 10.1093 / jac / dkv019
PubMed Аннотация | CrossRef Полный текст | Google Scholar
39. Фридрих Н., Мэтьюз С., Солдати-Фавр Д. Сиаловые кислоты: ключевые детерминанты инвазии апикомплексов. Int J Parasitol. (2010) 40: 1145–54. DOI: 10.1016 / j.ijpara.2010.04.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
42. Khazandi M, Tivey D.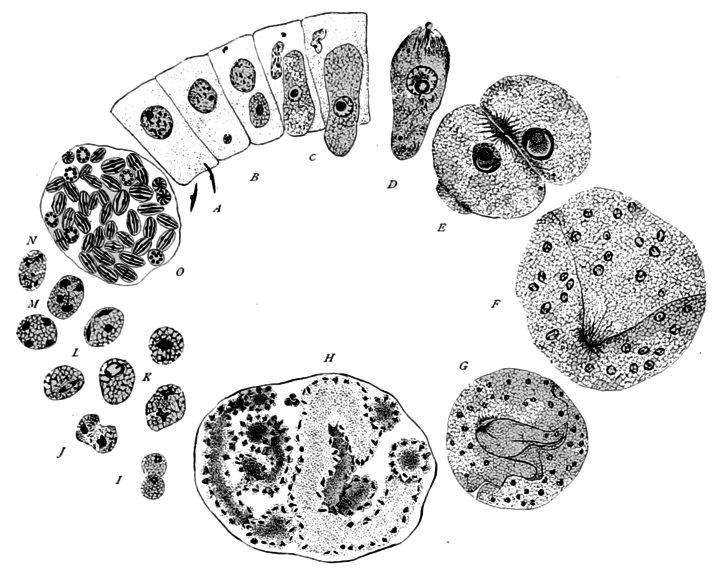 Разработка in vitro метода для прикрепления eimeria tenella к предпочтительным и нежелательным участкам кишечника. Exp Parasitol. (2010) 125: 137–40. DOI: 10.1016 / j.exppara.2010.01.007
Разработка in vitro метода для прикрепления eimeria tenella к предпочтительным и нежелательным участкам кишечника. Exp Parasitol. (2010) 125: 137–40. DOI: 10.1016 / j.exppara.2010.01.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
43. Hammond DM, Long PL. Кокцидии . Балтиморский университет (1973). п. 481.
Google Scholar
44. Августин П. Исследование инвазии клеток спорозоитами эимерии с использованием моноклональных антител, генерируемых против спорозоитов и клеток-хозяев. В: Макдугалд Л., Лонг П., редакторы. Материалы конференции по кокцидиозу в Джорджии .(1986). п. 602–8.
Google Scholar
45. Джойнер Л. Специфика хоста и сайта. В: Лонг П., редактор. Биология кокцидий , University Park Press: Балтимор, Мэриленд. 35–62. (1982).
Google Scholar
46. Бамстед Дж., Томли Ф. Использование культуры in vitro для изучения роли белков микронем в инвазии клеток-хозяев eimeria tenella. В: Ширли М., Томли Ф., Фриман Б., редакторы. Борьба с кокцидиозом в следующем тысячелетии. Berks, Великобритания: Институт здоровья животных (1997). п. 77.
В: Ширли М., Томли Ф., Фриман Б., редакторы. Борьба с кокцидиозом в следующем тысячелетии. Berks, Великобритания: Институт здоровья животных (1997). п. 77.
Google Scholar
47. Николс Б., Чиаппино М., О'Коннер Г. Секреция из стеблей toxoplasma gondii во время вторжения клеток-хозяев. J Ultrastruct Res. (1983) 83: 85–98. DOI: 10.1016 / S0022-5320 (83)
-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
48. Долбровольски Дж., Сибли Л. Инвазия токсоплазмой в клетки млекопитающих обеспечивается актиновым цитоскелетом паразита. Cell. (1996) 84: 933–9. DOI: 10.1016 / S0092-8674 (00) 81071-5
PubMed Аннотация | CrossRef Полный текст | Google Scholar
51. Августин П. Взаимодействия паразита и хозяина на поверхности клетки. В: St John J, Berlin E, editors. Границы мембранных исследований в сельском хозяйстве. Белтсвилл, Мэриленд: Роуман и Алленхельд (1985). п. 461–6.
Google Scholar
54.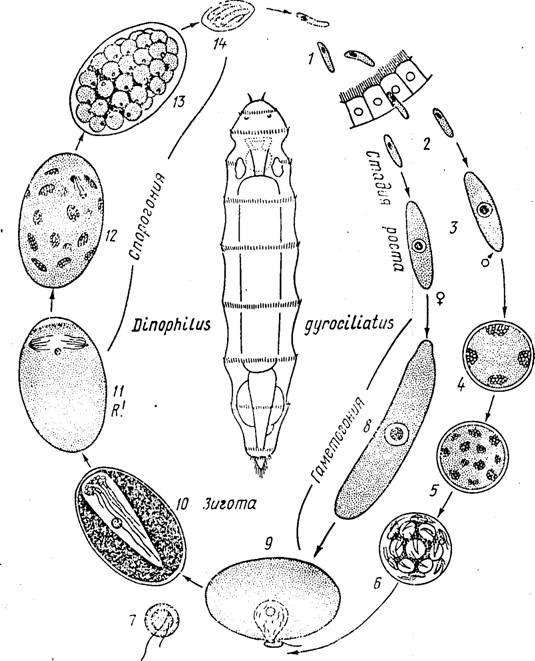 Августин П., Данфорт Х. Использование моноклональных антител для изучения поверхностных антигенов спорозоитов Eimeria .В: Proc. Шлем. Soc. Вашингтон, округ Колумбия (1987). п. 207–211.
Августин П., Данфорт Х. Использование моноклональных антител для изучения поверхностных антигенов спорозоитов Eimeria .В: Proc. Шлем. Soc. Вашингтон, округ Колумбия (1987). п. 207–211.
Google Scholar
55. Фуллер А.Л., Макдугалд Л.Р. Снижение проникновения в клетки спорозоитов eimeria tenella (Coccidia) с помощью ингибиторов протеаз и частичная характеристика протеолитической активности, связанной с интактными спорозоитами и мерозоитами. J Parasitol. (1990) 76: 464–7. DOI: 10.2307 / 3282822
PubMed Аннотация | CrossRef Полный текст | Google Scholar
56. Крейн М., МакГейли К. Eimeria tenella: ингибирование инвазии клеток-хозяев путем обработки спорозоитов фосфолипазой. Exp Parasitol. (1991) 72: 219–22. DOI: 10.1016 / 0014-4894 (91)
-R
PubMed Аннотация | CrossRef Полный текст | Google Scholar
57. Августин П. Молекулярные взаимодействия культивируемых клеток почек индейки со специфическими антигенами спорозоитов Adenoeides Eimeria . Proc Exp Biol Med. (1989) 191: 30–6. DOI: 10.3181 / 00379727-191-42885
Proc Exp Biol Med. (1989) 191: 30–6. DOI: 10.3181 / 00379727-191-42885
PubMed Аннотация | CrossRef Полный текст | Google Scholar
58.Каррутерс В., Хаканссон С., Гиддингс О., Сибли Л. Toxoplasma gondii использует сульфатированные протеогликаны для прикрепления субстрата и клетки-хозяина. Infect Immun. (2000) 68: 4005–11. DOI: 10.1128 / IAI.68.7.4005-4011.2000
PubMed Аннотация | CrossRef Полный текст | Google Scholar
59. Нагулесваран А., Мюллер Н., Хемфилл А. Neospora caninum и toxoplasma gondii: новый анализ адгезии / инвазии выявляет явные различия во взаимодействиях тахизоитов и клеток-хозяев. Exp Parasitol. (2003) 104: 149–58. DOI: 10.1016 / S0014-4894 (03) 00137-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
60. Фонлауфен Н., Гетг Н., Нагулесваран А., Мюллер Н., Бьёркман С., Шарес Г. и др. In vitro индукция брадизоитов neospora caninum в клетках vero выявляет дифференциальную экспрессию антигена, локализацию и распознавание клетками-хозяевами тахизоитов и брадизоитов.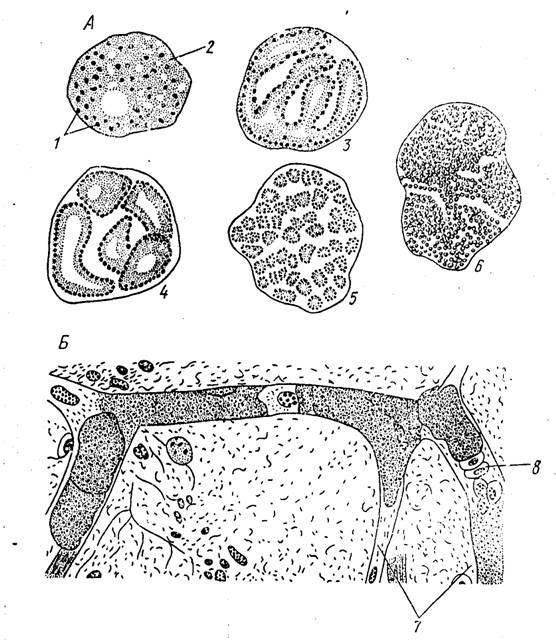 Infect Immun. (2004) 72: 576–83. DOI: 10.1128 / IAI.72.1.576-583.2004
Infect Immun. (2004) 72: 576–83. DOI: 10.1128 / IAI.72.1.576-583.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
61.Алрой Дж., Гойал В., Лукач Н.В., Тейлор Р.Л., Страут Р.Г., Уорд HD и др. Гликоконъюгаты эпителия кишечника домашней птицы (gallus domesticus): исследование гистохимии лектинов. Histochem J. (1989) 21: 187–93. DOI: 10.1007 / BF01747519
PubMed Аннотация | CrossRef Полный текст | Google Scholar
62. Suprasert A, Fujioka T. Лектин и ультраструктурная биохимия гликоконъюгатов в эпителии слепой кишки цыплят. Acta Histochem. (1988) 83: 141–51.DOI: 10.1016 / S0065-1281 (88) 80047-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
63. Файер Р., Хаммонд Д. Развитие шизонтов первого поколения eimeria bovis в культивируемых бычьих клетках. J Protozool. (1967) 14: 1104–5. DOI: 10.1111 / j.1550-7408.1967.tb02076.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
64. Hermosilla C, Barbisch B, Heise A, Kowalik S, Zahner H. Развитие eimeria bovis in vitro : пригодность нескольких бычьих, фетальных желудочно-кишечных, мадин-дарбовых бычьих почек (MDBK) и африканских зеленых мартышек (VERO ) клетки. Parasitol Res . (2002) 88: 301–7. DOI: 10.1007 / s00436-001-0531-1
Hermosilla C, Barbisch B, Heise A, Kowalik S, Zahner H. Развитие eimeria bovis in vitro : пригодность нескольких бычьих, фетальных желудочно-кишечных, мадин-дарбовых бычьих почек (MDBK) и африканских зеленых мартышек (VERO ) клетки. Parasitol Res . (2002) 88: 301–7. DOI: 10.1007 / s00436-001-0531-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
65. Бамстед Дж., Томли Ф. Индукция секреции и поверхностного кэппирования белков микронем в eimeria tenella. Mol Biochem Parasitol. (2000) 110: 311–21. DOI: 10.1016 / S0166-6851 (00) 00280-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
66. Рассел Д., Синден Р. Роль цитоскелета в подвижности спорозоитов кокцидий. J Cell Sci. (1981) 50: 345–59.
PubMed Аннотация | Google Scholar
68. Доран Д. Поведение кокцидий in vitro кокцидий. Балтимор, Мэриленд; Лондон: University Park Press (1982).
Google Scholar
69. Каррутерс В., Сибли Л. Последовательная секреция белка из трех отдельных органелл toxoplasma gondii сопровождает инвазию фибробластов человека. евро J Cell Biol. (1997) 73: 114–23.
Каррутерс В., Сибли Л. Последовательная секреция белка из трех отдельных органелл toxoplasma gondii сопровождает инвазию фибробластов человека. евро J Cell Biol. (1997) 73: 114–23.
PubMed Аннотация | Google Scholar
70.Mordue D, Desai N, Dustin M, Sibley L. Инвазия toxoplasma gondii создает подвижное соединение, которое выборочно исключает белки плазматической мембраны клетки-хозяина на основе их прикрепления к мембране. J Exp Med. (1999) 190: 1783–92. DOI: 10.1084 / jem.190.12.1783
PubMed Аннотация | CrossRef Полный текст | Google Scholar
72. Николс Б., О'Коннор Г. Проникновение перитонеальных макрофагов мыши простейшими toxoplasma gondii. Новые доказательства активной инвазии и фагоцитоза. Lab Invest. (1981) 44: 324–35.
PubMed Аннотация | Google Scholar
76. Кили А., Солдати Д. Глидезом: молекулярная машина, приводящая в движение подвижность и вторжение клеток-хозяев Apicomplexa. Trends Cell Biol. (2004) 14: 528–32. DOI: 10.1016 / j.tcb.2004.08.002
(2004) 14: 528–32. DOI: 10.1016 / j.tcb.2004.08.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
77. Мейсснер М., Фергюсон Д. Д., Фришкнехт Ф. Факторы инвазии апикомплексных паразитов: существенные или избыточные? Curr Opin Microbiol. (2013) 16: 438–44. DOI: 10.1016 / j.mib.2013.05.002
CrossRef Полный текст | Google Scholar
78. Lourido S, Moreno SNJ. Кальциевый сигнальный такселкит апикомплексных паразитов toxoplasma gondii и Plasmodium spp. Cell Calcium. (2015) 57: 186–93. DOI: 10.1016 / j.ceca.2014.12.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
79. Лавин, доктор медицины, Аррисабалага Г. Выход из клеток-хозяев патогенного паразита toxoplasma gondii не требует подвижности. Eukaryot Cell. (2008) 7: 131–40. DOI: 10.1128 / EC.00301-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
81. Блэкман MJ, Carruthers VB. Недавние исследования выхода апикомплексных паразитов открывают новые взгляды на убийство. Curr Opin Microbiol. (2013) 16: 459–64. DOI: 10.1016 / j.mib.2013.04.008
Curr Opin Microbiol. (2013) 16: 459–64. DOI: 10.1016 / j.mib.2013.04.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
82. Тардье И., Менар Р. Миграция Apicomplexa через биологические барьеры: пути токсоплазмы и плазмодия. Трафик. (2008) 9: 627–35. DOI: 10.1111 / j.1600-0854.2008.00703.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
83. Опиц К., Солдати Д. Глидезома: динамический комплекс, обеспечивающий скольжение и инвазию клеток-хозяев токсоплазмой гонди. Mol Microbiol. (2002) 45: 597–604. DOI: 10.1046 / j.1365-2958.2002.03056.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
85. Пиндер Дж. К., Фаулер Р. Э., Длужевски А. Р., Баннистер Л. Х., Лавин Ф. М., Митчелл Г. Х. и др.Актомиозиновый мотор в мерозоите малярийного паразита. Plasmodium falciparum: последствия для инвазии эритроцитов. J Cell Sci. (1998) 111: 1831–9.
PubMed Аннотация | Google Scholar
86.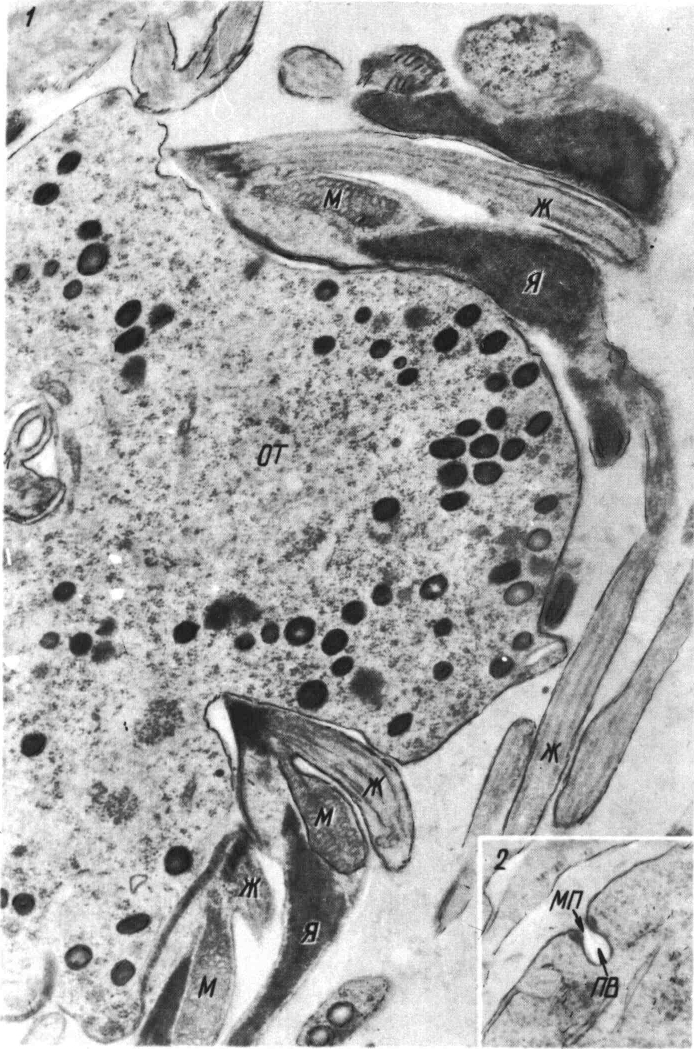 Schwartzman JD, Pfefferkorn ER. Иммунофлуоресцентная локализация миозина на переднем полюсе кокцидия, toxoplasma gondii. J Protozool. (1983) 30: 657–61. DOI: 10.1111 / j.1550-7408.1983.tb05339.x
Schwartzman JD, Pfefferkorn ER. Иммунофлуоресцентная локализация миозина на переднем полюсе кокцидия, toxoplasma gondii. J Protozool. (1983) 30: 657–61. DOI: 10.1111 / j.1550-7408.1983.tb05339.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
88.Тайлер Дж. С., Трик М., Бутройд Дж. С.. Сосредоточьтесь на главном: роль AMA1 в апикомплексной инвазии и репликации. Trends Parasitol. (2011) 27: 410–20. DOI: 10.1016 / j.pt.2011.04.002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
91. Sheetz M, Painter R, Singer S. Биологические мембраны как двухслойные пары III. индуцированные компенсаторные изменения формы мембран. J. Cell Biol. (1976) 70: 193–206. DOI: 10.1083 / jcb.70.1.193
PubMed Аннотация | CrossRef Полный текст | Google Scholar
93.Синай А., Вебстер П., Джойнер К. Ассоциация эндоплазматического ретикулума и митохондрий клетки-хозяина с мембраной паразитофорной вакуоли Toxoplasma gondii : взаимодействие с высоким сродством. J Cell Sci. (1997) 110: 2117–28.
J Cell Sci. (1997) 110: 2117–28.
PubMed Аннотация | Google Scholar
94. Hakansson S, Charron A, Sibley L. Эвакуоли токсоплазмы: двухэтапный процесс секреции и слияния образует паразитофорную вакуоль. Herm-Gotz. Eur Mol Biol Org J. (2001) 20: 3132–44.DOI: 10.1093 / emboj / 20.12.3132
PubMed Аннотация | CrossRef Полный текст | Google Scholar
95. Синай А.П., Столяр К.А. Белок ROP2 toxoplasma gondii опосредует ассоциацию органелл хозяина с мембраной паразитофорной вакуоли. J. Cell Biol. (2001) 154: 95–108. DOI: 10.1083 / jcb.200101073
PubMed Аннотация | CrossRef Полный текст | Google Scholar
96. Мело Э.Дж., Карвалью TM, Де Соуза В. Поведение микротрубочек в клетках, инфицированных Toxoplasma gondii . Biocell. (2001) 25: 53–9.
PubMed Аннотация | Google Scholar
97. Джонс Т.К., Хирш Дж. Г.. Взаимодействие между toxoplasma gondii и клетками млекопитающих: II. Отсутствие слияния лизосом с фагоцитарными вакуолями, содержащими живых паразитов. J Exp Med. (1972) 136: 1173–94. DOI: 10.1084 / jem.136.5.1173
J Exp Med. (1972) 136: 1173–94. DOI: 10.1084 / jem.136.5.1173
PubMed Аннотация | CrossRef Полный текст | Google Scholar
98. Коппенс И., Данн Дж. Д., Романо Дж. Д., Пипаерт М., Чжан Х., Бутройд Дж. К. и др. Toxoplasma gondii изолирует лизосомы млекопитающих-хозяев в вакуолярном пространстве. Cell. (2006) 125: 261–74. DOI: 10.1016 / j.cell.2006.01.056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
99. de Melo EJ, de Carvalho TU, de Souza W. Проникновение toxoplasma gondii в клетки-хозяева вызывает изменения в распределении митохондрий и эндоплазматического ретикулума. Cell Struct Funct. (1992) 17: 311–17. DOI: 10.1247 / csf.17.311
PubMed Аннотация | CrossRef Полный текст | Google Scholar
100. Лабесс Дж., Гелин М., Бессин Ю., Лебрен М., Папоин Дж., Сердан Р. и др. ROP2 из toxoplasma gondii: фактор вирулентности с протеинкиназной складкой и без ферментативной активности. Eukaryot Cell.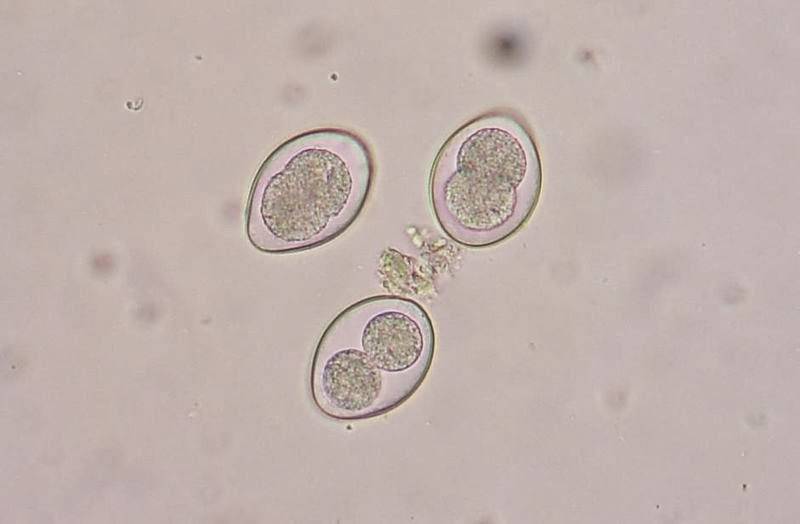 (2009) 10: 483–93. DOI: 10.1016 / j.str.2008.11.005
(2009) 10: 483–93. DOI: 10.1016 / j.str.2008.11.005
PubMed Аннотация | CrossRef Полный текст | Google Scholar
103. Каамано Дж., Хантер С. Семейство факторов транскрипции NF-κB: центральные регуляторы врожденных и адаптивных иммунных функций. Clin Microbiol Rev. (2002) 15: 414–29. DOI: 10.1128 / CMR.15.3.414-429.2002
PubMed Аннотация | CrossRef Полный текст | Google Scholar
104. Мясник Б., Ким Л., Джонсон П., Денкерс Э. Toxoplasma gondii тахизоиты ингибируют индукцию провоспалительных цитокинов в инфицированных макрофагах, предотвращая ядерную транслокацию фактора транскрипции NF-каппа 65. B J Immunol. (2001) 167: 2193–201. DOI: 10.4049 / jimmunol.167.4.2193
CrossRef Полный текст | Google Scholar
105.Chen X. Cryptosporidium parvum активирует ядерный фактор kappaB в желчном эпителии, предотвращая апоптоз эпителиальных клеток. Гастроэнтерология . (2001) 120: 1774–83. DOI: 10.1053 / gast.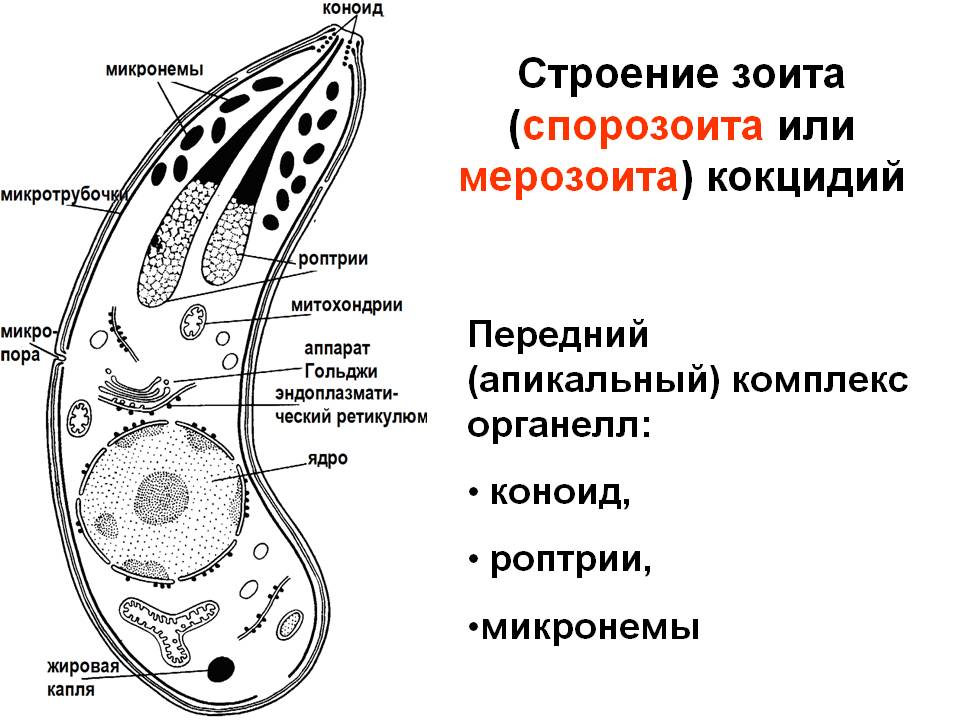 2001.24850
2001.24850
PubMed Аннотация | CrossRef Полный текст | Google Scholar
106. Molestina R, Payne T, Coppens I, Sinai A. Активация NF-kappaB с помощью toxoplasma gondii коррелирует с повышенной экспрессией антиапоптотических генов и локализацией фосфорилированного IkappaB на мембране паразитофорной вакуоли. J Cell Sci. (2003) 116: 4359–71. DOI: 10.1242 / jcs.00683
PubMed Аннотация | CrossRef Полный текст | Google Scholar
107. Caamano J. Идентификация роли NF-каппа B2 в регуляции апоптоза и в поддержании Т-клеточного иммунитета к toxoplasma gondii. J Immunol. (2000) 165: 5720–28. DOI: 10.4049 / jimmunol.165.10.5720
PubMed Аннотация | CrossRef Полный текст | Google Scholar
108. Трипати А., Салливан Д., Стинс М.Эритроциты, инфицированные Plasmodium falciparum, увеличивают экспрессию молекулы 1 межклеточной адгезии на эндотелии мозга через NF-κB. Infect Immun. (2006) 74: 3262–70. DOI: 10.1128 / IAI.01625-05
PubMed Аннотация | CrossRef Полный текст | Google Scholar
109. Онг И., Риз М., Бутройд Дж. Белок 16 Toxoplasma rhoptry (ROP16) подрывает функцию хозяина путем прямого фосфорилирования тирозина STAT6. J Biol Chem. (2010) 285: 28731–40. DOI: 10.1074 / jbc.M110.112359
Онг И., Риз М., Бутройд Дж. Белок 16 Toxoplasma rhoptry (ROP16) подрывает функцию хозяина путем прямого фосфорилирования тирозина STAT6. J Biol Chem. (2010) 285: 28731–40. DOI: 10.1074 / jbc.M110.112359
PubMed Аннотация | CrossRef Полный текст | Google Scholar
110. Либерман Л., Баника М., Райнер С., Хантер С. STAT1 играет критическую роль в регуляции антимикробных эффекторных механизмов, но не в развитии ответов типа Th2 во время токсоплазмоза. J Immunol. (2004) 172: 457–63. DOI: 10.4049 / jimmunol.172.1.457
PubMed Аннотация | CrossRef Полный текст | Google Scholar
111. Гаврилеску Л.С., Батчер Б.А., Дель Рио Л., Тейлор Г.А., Денкерс Е.Ю.STAT1 необходим для противомикробной эффекторной функции, но незаменим для выработки гамма-интерферона во время инфекции toxoplasma gondii. Infect Immun. (2004) 72: 1257–64. DOI: 10.1128 / IAI.72.3.1257-1264.2004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
113. Фелпс Э., Суини К., Блейдер И. Toxoplasma gondii rhoptry разряд коррелирует с активацией фактора транскрипции клетки-хозяина ранней реакции роста 2. Infect Immun. (2008) 76: 4703–12. DOI: 10.1128 / IAI.01447-07
Фелпс Э., Суини К., Блейдер И. Toxoplasma gondii rhoptry разряд коррелирует с активацией фактора транскрипции клетки-хозяина ранней реакции роста 2. Infect Immun. (2008) 76: 4703–12. DOI: 10.1128 / IAI.01447-07
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Классификация: Обзор таксономических рангов (см. Illustrated Guide to Protozoa, 2000. Аллен Пресс) Protista (одноклеточные эукариоты) Семейство: Eimeriidae Паразит
морфология: Паразиты кокцидий образуют три стадии развития: шизонты, гамонты.
и ооцисты.Размер шизонтов варьируется в зависимости от вида паразита. Хост
диапазон: Инфекции
были зарегистрированы во всем мире у большинства видов позвоночных,
включая эвтерианских и метатериальных млекопитающих, птиц, рептилий и рыб.Считается, что большинство видов кокцидий сильно зависят от хозяина и
паразитируют только на одиночных видах хозяев (масличных), хотя некоторые виды
у птиц и рептилий могут паразитировать на близкородственных хозяевах (стеноксенные)
и некоторые виды рыб могут паразитировать на неродственных хозяевах (эвриксены). Участок
заражения: Большинство
виды претерпевают эндогенное развитие в слизистой оболочке кишечника (мелкие
и / или толстый кишечник), тогда как некоторые виды развиваются в печени,
желчный пузырь или почки.Обычно они проявляют тропизм к жестким тканям,
инфицирование клеток-хозяев в определенных местах. Паразиты подвергаются
несколько циклов шизогонии, завершающихся лизисом хозяйских клеток
высвободить мерозоиты. В конечном итоге образуются гамонты, которые созревают до
производят микро- и макро-гаметы, которые подвергаются оплодотворению
неподвижная зигота (ооциста), которая выделяется с фекалиями хозяина. Патогенез: Большинство видов не являются серьезными патогенами и вызывают незначительные заболевания или не вызывают их вовсе.Однако некоторые виды высокопатогенны и вызывают катаральный
или геморрагический энтерит в результате сильной эрозии слизистых оболочек через
лизис клеток, приводящий к обильному водянистому или кровянистому поносу. Клиническое заболевание
обычно не проявляется до тех пор, пока кумулятивное повреждение тканей, связанное с
шизогония второго или третьего поколения. Умеренно пораженные животные могут
проявлять прогрессирующие признаки, такие как плохая прибавка или потеря веса, слабость
и истощение, в то время как сильно пораженные люди могут вскоре умереть
появление болезни.Патогенность зависит от многих факторов; такой
как вид паразита, жизнеспособность, инфекционность, вирулентность, тропизм, хозяин
возраст, статус питания, иммунологическая компетентность, а также преобладающие
условия окружающей среды (температура, влажность) и методы управления. Режим трансмиссии: Ооцисты, выделяемые с фекалиями хозяина, загрязняют внешнюю среду, но они должны пройти внутреннее спороношение (образование спорозоитов) перед они становятся заразными.Новые хозяева заражаются при проглатывании спорулированных ооцисты, загрязняющие пищу или воду (фекально-оральная передача). После проглатывания ооцисты и спороцисты выделяются в кишечнике, высвобождая в них содержатся спорозоиты, которые проникают в клетки-хозяева и начинают мерогонию. Стимулы эксцистации включают соответствующие физико-химические реакции после желудочного сока. условия, такие как уровень кислорода, pH, соли желчных кислот, ферменты поджелудочной железы, пр. Дифференциал
диагноз: Клинические признаки обычно
совпадают с проходимостью паразита (период патента = период, в течение которого ооцисты
производятся). Лечение
и контроль: Прогрессирование болезни
обычно настолько быстро, что любое терапевтическое (лечебное) лечение может просто
опоздать. По этой причине постоянное употребление лекарств с пищей или водой.
часто используется для профилактического (профилактического) лечения во многих интенсивных
животноводство.Доступен широкий спектр препаратов, в том числе
с кокцидиостатической (обратимой супрессивной) активностью или кокцидио-цидной
(необратимая летальная) активность. К основным группам препаратов относятся сульфаниламиды.
(сульфаниламид, триметоприм, этопабат), пиридинолы (клопидол, декоквинат),
нитробензамиды (зоален), органические мышьяки (роксарсон), нитрофураны
(фуразолидон, ампролиум), хиназолиноны (галофугинон), полиэфир-ионофор
антибиотики (монензин, лазлоцид, салиномицин, наразин), асимметричные (диклазурил)
и симметричные (толтразурил) триазины.К сожалению, есть монтаж
проблемы, связанные с лекарственной устойчивостью многих кокцидий
виды, особенно против синтетических наркотиков, которые имеют тенденцию к сохранению
внутри популяций паразитов. Многие отрасли рекомендуют периодическую ротацию
между разными группами лекарств и применением комбинированных (коктейльных) препаратов
чтобы свести к минимуму возникновение сопротивления. Большинство кокцидиальных инфекций стимулируют
развитие сильных защитных иммунных ответов, хотя и преходящих
за исключением премуитивных (недолговечных, если не сохраняются паразиты).Был
значительный успех в контроле с помощью иммунопрофилактики с использованием ослабленных
или преждевременные штаммы паразитов, особенно в птицеводстве.
В настоящее время исследователи пытаются разработать рекомбинантные субклеточные вакцины.
Вспышки обычно можно контролировать с помощью методов управления, основанных на
улучшение гигиены, уменьшение скопления людей, удаление загрязненного мусора и
изоляция инфицированных лиц. Химическая дезинфекция обычно нецелесообразна
поскольку ооцисты устойчивы ко многим обычным дезинфицирующим средствам.
|
Текст жизненного цикла кокцидий (Eimeria spp.)
Текст жизненного цикла кокцидий (Eimeria spp.)Жизненный цикл кокцидий
Кокцидии сильно специфичный для хозяина (может инфицировать только один вид хозяина или дополнительный промежуточный хосты). Итак, если ваша курица заболела кокцидиями - ваше здоровье беспокоить не буду!НО - есть всегда «НО» - ветеринарная медицина использует слово «кокцидии» как совокупность очень разные виды - так как лечат их в основном одним и тем же лекарством (антибиотики-кокцидиостатики). Поэтому - иногда - ваш ветеринар говорит вам диагноз "кокцидия", которым он / она не является. в состоянии сказать вам вид, который он / она нашел, то есть в кишечнике ваших щенков. Попытаться найти узнать больше о кокцидиях!
Заражение кокцидиями животных является результатом употребления воды или зараженной пищи по инфекционной стадии - спорулированных ооцист .В большинстве случаев это вопрос гигиены. Ооцисты wall механически (или / и ферментативно) разрушается в желудке / кишечнике.
спороцисты (A) освобождены и открыты к ферментам (трипсину и желчи). В результате спорозоиты (захватчики) становятся выпущен (B) . Для них характерны типичные органеллы (см. Спорозоит , ). Спорозоиты активно перемещаются и проникают в эпителиальные клетки для своего дальнейшего развития. (1) .
А как насчет Вторжения!
Однажды внутриклеточный (в его паразитофорная вакуоль ), спорозоит округляется и превращается в так называемого шизонта первого поколения (шизонт син. меронт) (2) (3) . Мерозоит формирование происходит внутри шизонтов. В зависимости от вида сотни или образуются тысячи мерозоитов.
Автор разрушая хозяйскую клетку, высвободившиеся мерозоиты могут вторгаться в новые эпителиальные клетки (4) и развиваются до шизонтов II (второе поколение) (5) .Мерозоиты поколений различаются размерами и количеством.
Выпущено мерозоиты II могут дать начало еще одному третьему поколению шизонтов (6) (около видов Eimeria даже развился четвертый ступень мерогонии) или переход к стадиям полового развития (п. гамонты). Мы до сих пор не знаем триггера «мужского» или «женского» развития. Даже если вы заразите курицу одним спорозоитом - так называемой самкой макрогамет и мужские микрогеймы.Кстати все спорозоиты и мерозоиты являются «гальпоидными» сперматозоидами.
(7 - самец микрогамонт)
(8 - самка макрогамонт) .процесс оплодотворения (9 + 10 - микрогаметы активно вводят макрогамет) приводит к образованию внутриклеточного зигота (с сильно непроницаемой стенкой ооцисты). Зигота становится молодой ооцистой тем самым разрушая клетку-хозяин (11) .Ооцисты (без споров) тип см. 11) выделяются с фекалиями.
Споруляция (12) имеет место в теплой и влажной почве (подстилке). Зонды полученные непосредственно из фекалий инфицированных животных, в основном содержат непористые ооцисты. Зонды из помета покажут спорулированных ооцисты с 4 спороцистами, содержащие по 2 спорозоита ( Eimeria тип).
Кокцидиоз в птицеводстве
Время считывания: 10 минут
Кокцидиоз имеет универсальное значение в птицеводстве, вызывая огромные потери из-за большого количества птиц в стаде и высокой плотности поголовья.Экономические последствия кокцидиоза: снижение прибыли, вызванное более высокой конверсией корма, замедлением роста, повышенной смертностью и затратами на профилактику или лечение. Ежегодные убытки от кокцидиоза для коммерческой птицы во всем мире оцениваются в 2 миллиарда евро.
Традиционная борьба с кокцидиозом в основном основана на химиопрофилактике, которая оказалась эффективной в последние десятилетия. Однако рост устойчивости ко всем антикокцидиозным препаратам и возможный предстоящий запрет, ограничивающий их использование, поставили перед птицеводческой отраслью новую задачу предотвращения кокцидиоза и борьбы с ним с помощью альтернативных стратегий.
Причины и жизненный цикл
Кокцидиальные паразиты - это простейшие, принадлежащие к типу Apicomplexa. Кокцидиоз цыплят вызывают семь видов, все из рода Eimeria : E. acervulina, E. brunetti, E, maxima, E. mitis, E. necatrix, E. praecox и / или E. tenella.
Настоящим Рис. 1. Жизненный цикл Eimeria :
Иммунитет
Восприимчивы птицы всех возрастов. У цыплят может развиться иммунитет после заражения, однако иммунитет является видоспецифичным, что подвергает птиц риску по сравнению с другими видами Eimeria .Иммунитет к видам Eimeria приобретается постепенно и не является полным до достижения птицами 7-недельного возраста - эти 42 дня являются периодом критического риска.
Иммуносупрессивные заболевания, такие как болезнь Марека, инфекционная бурсальная болезнь (ВЗК) и другие, мешают развитию иммунитета, и инфицированные птицы могут быть более восприимчивыми к кокцидиозу.
Обследование повреждений и оценка поврежденийЖизненные циклы этих видов прямые (рис. 1). Курицы заглатывают спорулированные ооцисты («яйцо» паразита) из зараженного подстилки, и они попадают в кишечник, где паразиты проникают в клетки кишечной стенки.Происходит несколько циклов репликации, которые приводят к образованию новых ооцист, которые выделяются с фекалиями. В зависимости от условий окружающей среды (включая температуру и влажность) ооцисты спорулируют и становятся инфекционными. Весь цикл занимает от 4 до 6 дней. Этот короткий, прямой жизненный цикл в сочетании с возможностью массового размножения во время внутриклеточной фазы делает эту группу паразитов серьезной проблемой в условиях интенсивного земледелия.
Характеристики поражений будут зависеть от вида Eimeria , поражающего кишечник. Оценка поражений - это метод, разработанный для численного ранжирования грубых поражений, вызванных кокцидиями (Johnson and Reid 1970). Узнайте больше о мониторинге здоровья кишечника на ферме в нашем блоге.
Поражения основных видов
Eimeria acervulina
Тяжесть инфекции может зависеть от изолята, количества проглоченных ооцист и иммунного статуса птицы. Снижение скорости набора веса также пропорционально дозе заражения.Водянистый и слизистый помет можно увидеть уже через 4 дня после заражения. Тяжелые инфекции часто вызывают поражения, а иногда и смерть.
Инфекции легкой и средней степени тяжести могут незначительно повлиять на привес и конверсию корма, однако могут вызвать потерю пигментов каротиноидов и ксантофиллов. Eimeria acervulina обычно поражает дуоденальную петлю кишечника, а при тяжелых инфекциях может распространяться и инфицировать нижние уровни тощей кишки и даже подвздошную кишку или нижнюю часть кишечника.Белые поражения E. acervulina отчетливо видны на поверхности слизистой оболочки дуоденальной петли. Белые полосы ориентированы поперек кишечника, и их расположение часто называют лестницей.
Eimeria maxima
Eimeria maxima Инфекции расположены в средней части кишечника по обе стороны от небольшого узла (рудиментарный дивертикул), оставленного желточным мешком. При тяжелых инфекциях поражения могут распространяться вверх на двенадцатиперстную кишку и вниз до илео-слепого перехода.В конце жизненного цикла на серозной поверхности кишечника может появиться несколько петехий.
Eimeria tenella
Eimeria tenella , хорошо известная причина слепой кишки или «кровянистого» кокцидиоза, которая поражает две слепые кишки и в тяжелых случаях может также паразитировать в кишечнике выше и ниже соединения слепой кишки. Eimeria tenella проникает глубоко в ткань кишечника, вызывая повреждение слизистой оболочки и мышечного слоя.Просвет слепой кишки заполнен свернувшейся кровью и некротическим мусором.
Эмерия Некатрикс
Eimeria necatrix также приживается в средней части кишечника. Вероятно, из-за низкой репродуктивной способности E. necatrix , он не может конкурировать с другими кокцидиями и диагностируется в основном у более старых птиц, таких как родительские молодки или молодки-несушки в возрасте 9–14 недель. E. Necatrix вместе с E.tenella являются наиболее патогенными из куриных кокцидий . Инфицирования 104–105 спорулированных ооцист достаточно, чтобы вызвать серьезную потерю веса, заболеваемость и смертность. Выжившие могут истощаться, страдать от вторичных инфекций и терять пигментацию. Помет инфицированных птиц часто содержит кровь, жидкость и слизь. Кишечник может быть раздутым, слизистая оболочка утолщена, а просвет заполнен жидкостью, кровью и остатками тканей. С серозной поверхности очаги инфекции можно увидеть в виде небольших белых бляшек или красных петехий.У мертвых птиц эти поражения выглядят белыми и черными, вызывая выражение «соль и перец».
Профилактика и контроль
Кокцидиальные ооцисты чрезвычайно устойчивы к условиям окружающей среды и дезинфицирующим средствам, поэтому искоренение кокцидиоза в птичниках путем удаления подстилки, очистки и дезинфекции невозможно; поэтому было использовано несколько противомикробных или противопротозойных средств.
Возможные методы профилактики или лечения кокцидиоза:
Антикокцидиальные препараты
Живые вакцины
Пробиотики
Иммунная поддержка
Комбинированные стратегии
Противококцидиальные препараты
Anticoccidials добавляются в корм для предотвращения болезней и экономических потерь, часто связанных с подострой инфекцией.Профилактическое использование предпочтительнее, так как большая часть повреждений возникает до того, как признаки становятся очевидными, и лекарства не могут полностью остановить вспышку. Непрерывное применение антикокцидиальных препаратов способствует появлению устойчивых к лекарствам штаммов кокцидий. Различные программы используются в попытках замедлить или остановить выбор сопротивления. к большинству лекарств широко распространена резистентность. Кокцидии можно проверить в лаборатории, чтобы определить, какие продукты наиболее эффективны. Действие антикокцидиальных препаратов может быть кокцидиостатическим, при котором рост внутриклеточных кокцидий останавливается, но развитие может продолжаться после отмены препарата, или кокцидиоцидным, при котором кокцидии погибают во время своего развития.
Устойчивость к противомикробным препаратам
В течение десятилетий не вводилось никаких новых химикатов, и была подтверждена резистентность ко всем лекарствам, одобренным для использования у кур, хотя появление резистентности можно замедлить, используя программы ротации с различными химикатами и / или ионофорами. Тем не менее устойчивость к доступным химическим веществам и ионофорам стала широко распространенной. Если в будущем станет возможным контроль кокцидиоза с помощью химиотерапии, потребуются препараты с новыми молекулярными механизмами действия и, следовательно, с беспрецедентными мишенями.
Живые вакцины
Видоспецифический иммунитет развивается после естественного заражения, степень которого во многом зависит от степени заражения и количества повторных инфекций или состояния иммунной системы. Защитный иммунитет - это прежде всего клеточная иммунная реакция; Т-клеточный ответ.
Коммерческие вакцины состоят из живых спорулированных ооцист различных кокцидиальных видов, вводимых в низких дозах. Современные антикокцидиальные вакцины следует вводить суточным цыплятам либо в инкубатории, либо на ферме.Поскольку вакцина служит только для занесения инфекции, цыплята повторно заражаются потомством вакцинного штамма на ферме. Большинство коммерческих вакцин содержат живые ооцисты кокцидий, которые не аттенуированы. Самоограничивающийся характер кокцидиоза используется как форма ослабления для некоторых вакцин, а не как биологическое ослабление. Некоторые вакцины, продаваемые в Европе и Южной Америке, включают ослабленные линии кокцидий.
Пробиотики
Инфекция кокцидиоза у домашней птицы часто приводит к некротическому энтериту, поскольку Clostridium perfringens, естественно присутствующая в кишечнике, получает пользу от поражения кишечника, вызванного Eimeria.Следовательно, важно управлять энтеритом и, что еще важнее, предупреждать его, чтобы снизить влияние на продуктивность и общее состояние здоровья птицы. Пробиотики, такие как Bacillus spp . может использоваться с пищей или с питьевой водой для профилактики или даже лечения некротического энтерита.
Иммунная поддержка
Поскольку цыплята способны вырабатывать защитный иммунитет после заражения кокками, важно ускорить этот процесс. Известно, что бета-глюканы обладают иммуномодулирующим действием и могут быть полезным средством профилактики кокцидиоза.Исследования показали, что бета-глюкан, полученный из водорослей, в качестве пищевой добавки усиливает клеточно-опосредованный иммунный ответ в кишечнике, уничтожая патоген до того, как возникнут серьезные поражения. Следовательно, меньше поражений, вызванных кокками, наблюдается у птиц, получавших добавку бета-глюкана, подвергшихся заражению Eimeria . Эта стратегия создает беспроигрышную ситуацию, поскольку она, во-первых, обеспечивает циркуляцию ооцитов (не влияет на количество OPG, в отличие от использования (химических) антикокцидиалов) в доме, что необходимо для создания иммунитета, а во-вторых, предлагает иммуномодулирующий эффект. ускорение иммунного ответа против Eimeria .
Узнайте больше о поддержке иммунитета, загрузив нашу рецензируемую статью!
Комбинированные стратегии
Не существует серебряной пули для борьбы с кокцидиозом и замены использования антикокцидиальных препаратов. Комбинированные стратегии - это путь вперед, и они не требуют времени на отказ!
Вакцинация является хорошей альтернативой антикокцидиальным препаратам, но не обеспечивает защиты от некротического энтерита. Чтобы предотвратить энтерит, важно использовать пробиотик в сочетании с вакцинацией.Вторым средством поддержки вакцинации, которым нельзя пренебрегать, является использование иммуномодулятора, такого как бета-глюкан, для ускорения реакции иммунной системы на вакцину.
Возможна замена антикокцидиалов питательными растворами. Опять же, необходима комбинированная стратегия, нацеленная на несколько аспектов проблемы кокцидиоза. Наилучшая защита наблюдается, когда раствор одновременно поддерживает иммунитет, предотвращает некротический энтерит и убивает кокцидии (частично), позволяя некоторым циркулирующим ооцитам укреплять иммунитет.Некоторые молекулы растительного происхождения обладают антипаразитарным действием и могут использоваться в качестве пищевого раствора в сочетании с пробиотиком и бета-глюканом.
Наша миссия - сотрудничать с вами в борьбе с кокцидиозом естественным и устойчивым способом!
.Преимущества альтернативных стратегий
Снижает использование / потребность в ионофорах
Время вывода не применяется
Снижает заболеваемость некротическим энтеритом
Поддерживает вакцинацию против кокков
Сокращает использование терапевтических средств
Предотвращает снижение работоспособности при субклиническом кокцидиозе
Натуральное решение для борьбы с кокками

 У птицы, пораженной кокцидиозом, снижается упитанность, масса и яйценоскость.
У птицы, пораженной кокцидиозом, снижается упитанность, масса и яйценоскость.
 После образования макрогамет и микрогамет они копулируют (сливаются), образуя копулу или зиготу. Зигота окружается оболочкой и превращается в ооцисту. Ооцисты в зависимости от видов могут иметь самую разнообразную форму и величину, у всех у них двуконтурная оболочка и зернистая цитоплазма. Такие ооцисты выходят во внешнюю среду и проходят стадию спорогонии. Во внешней среде при наличии тепла, влаги и кислорода в ооцисте формируются четыре споры и в каждой из них по два спорозоита. С образованием в ооцисте спор и спорозоитов заканчивается спорогония. Такие ооцисты становится зрелыми, при попадании в организм восприимчивых животных и заражают их.
После образования макрогамет и микрогамет они копулируют (сливаются), образуя копулу или зиготу. Зигота окружается оболочкой и превращается в ооцисту. Ооцисты в зависимости от видов могут иметь самую разнообразную форму и величину, у всех у них двуконтурная оболочка и зернистая цитоплазма. Такие ооцисты выходят во внешнюю среду и проходят стадию спорогонии. Во внешней среде при наличии тепла, влаги и кислорода в ооцисте формируются четыре споры и в каждой из них по два спорозоита. С образованием в ооцисте спор и спорозоитов заканчивается спорогония. Такие ооцисты становится зрелыми, при попадании в организм восприимчивых животных и заражают их.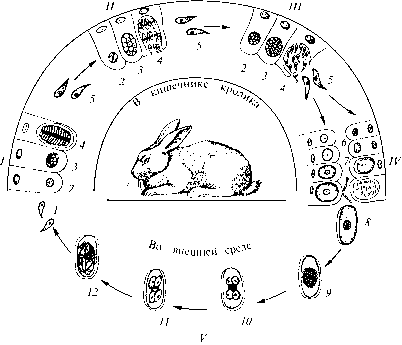 Во внешней среде в таких ооцистах образуются по две споры и в каждой споре по четыре спорозопта. Ооцисты, выделявшиеся из организма подопытных котят, морфологически похожи на ооцист Josospora bigemina.
Во внешней среде в таких ооцистах образуются по две споры и в каждой споре по четыре спорозопта. Ооцисты, выделявшиеся из организма подопытных котят, морфологически похожи на ооцист Josospora bigemina.
 В дефинитивном - кошке токсоплазма проходит половой цикл, в результате образуются ооцисты, похожие на J. bigemina. При скармливании этих ооцист животным развивается пролиферативная форма, которую ранее считали токсоплазмой; последней могут заразиться все животные и человек. Из этих новых данных вытекает, что кокцидий рода Jsospora на разных стадиях развития могут обладать и различной специфичностью.
В дефинитивном - кошке токсоплазма проходит половой цикл, в результате образуются ооцисты, похожие на J. bigemina. При скармливании этих ооцист животным развивается пролиферативная форма, которую ранее считали токсоплазмой; последней могут заразиться все животные и человек. Из этих новых данных вытекает, что кокцидий рода Jsospora на разных стадиях развития могут обладать и различной специфичностью. В результате всех этих процессов развиваются полосы, которые и создают условия отрицательного водного баланса в организме больных, увеличивают вязкость крови и осложняют работу сердца, являясь причиной гибели больных животных.
В результате всех этих процессов развиваются полосы, которые и создают условия отрицательного водного баланса в организме больных, увеличивают вязкость крови и осложняют работу сердца, являясь причиной гибели больных животных. ..
..

 При этом каловые массы имеют водянистую консистенцию. В них может содержаться кровь и слизь.
При этом каловые массы имеют водянистую консистенцию. В них может содержаться кровь и слизь.
 Мужские и женские гаметы сливаются, образуя зиготу, которая превращается в незрелую ооцисту без споров, которая попадает на подстилку с фекалиями.
Мужские и женские гаметы сливаются, образуя зиготу, которая превращается в незрелую ооцисту без споров, которая попадает на подстилку с фекалиями. Каждый вид кокцидий поражает только один вид домашнего скота, каждый из которых имеет «свой вид». Существует семь различных видов Eimeria, которые инфицируют цыплят, но только три вызывают наибольшие проблемы в США: Eimeria tenella, Eimeria maxima и Eimeria acervulina.Иммунитет к одному типу не обеспечивает иммунитет к другим типам. Индюки, утки, гуси и другие виды домашней птицы заражены различными видами кокцидий.
Каждый вид кокцидий поражает только один вид домашнего скота, каждый из которых имеет «свой вид». Существует семь различных видов Eimeria, которые инфицируют цыплят, но только три вызывают наибольшие проблемы в США: Eimeria tenella, Eimeria maxima и Eimeria acervulina.Иммунитет к одному типу не обеспечивает иммунитет к другим типам. Индюки, утки, гуси и другие виды домашней птицы заражены различными видами кокцидий. Паразиты образуют экологически устойчивые
ооцисты, которые передаются фекально-оральным путем между хозяевами. Там
три последовательных этапа жизненного цикла паразита: эндогенное размножение
асексуальной мерогонией (также известной как шизогония), за которой следует половая
гамогония (♂ микрогаметы удобряют ♀ макрогаметы производят
ооцисты), которые выделяются и подвергаются бесполой спорогонии (формируя спороцисты
содержащие инфекционные спорозоиты).Многие роды известны на
основу конфигурации ооцисты (количество спороцист в ооцисте,
и количество спорозоитов на спороцисту).
Паразиты образуют экологически устойчивые
ооцисты, которые передаются фекально-оральным путем между хозяевами. Там
три последовательных этапа жизненного цикла паразита: эндогенное размножение
асексуальной мерогонией (также известной как шизогония), за которой следует половая
гамогония (♂ микрогаметы удобряют ♀ макрогаметы производят
ооцисты), которые выделяются и подвергаются бесполой спорогонии (формируя спороцисты
содержащие инфекционные спорозоиты).Многие роды известны на
основу конфигурации ооцисты (количество спороцист в ооцисте,
и количество спорозоитов на спороцисту). расположение в хозяине и стадии зрелости. Они начинаются как небольшие базофильные
округлые клетки (материнские меронты), расположенные внутри клеток-хозяев.
Меронты образуют многочисленные дочерние мерозоиты путем эндогенного деления.
ядра с последующим цитокинезом. Зрелые шизонты выглядят как мембранные
грозди небольших базофильных тел (похожие на грозди винограда).
Отдельные шизонты обычно имеют диаметр от 10 до 100 мкм.
но некоторые виды образуют огромные мегалошизонты (до 1 мм в диаметре).Гамонты демонстрируют половую дифференциацию, с микрогамонтами (♂)
проявляется в виде многоядерных базофильных стадий, в конечном счете, с выделением небольших
двояковидные микрогаметы; и макрогамонты (♀) очевидны как одноядерные
эозинофильные клетки с одним яйцевидным ядром. Развивающиеся ооцисты содержат
многочисленные эозинофильные стенкообразующие тела, которые дают начало жестким
наружные стенки ооцисты.
расположение в хозяине и стадии зрелости. Они начинаются как небольшие базофильные
округлые клетки (материнские меронты), расположенные внутри клеток-хозяев.
Меронты образуют многочисленные дочерние мерозоиты путем эндогенного деления.
ядра с последующим цитокинезом. Зрелые шизонты выглядят как мембранные
грозди небольших базофильных тел (похожие на грозди винограда).
Отдельные шизонты обычно имеют диаметр от 10 до 100 мкм.
но некоторые виды образуют огромные мегалошизонты (до 1 мм в диаметре).Гамонты демонстрируют половую дифференциацию, с микрогамонтами (♂)
проявляется в виде многоядерных базофильных стадий, в конечном счете, с выделением небольших
двояковидные микрогаметы; и макрогамонты (♀) очевидны как одноядерные
эозинофильные клетки с одним яйцевидным ядром. Развивающиеся ооцисты содержат
многочисленные эозинофильные стенкообразующие тела, которые дают начало жестким
наружные стенки ооцисты. Беспорульные ооцисты содержат развивающиеся споробласты.
который в конечном итоге подвергается споруляции, образуя спороцисты, содержащие
инфекционные спорозоиты. Ооцисты Eimeria обладают характерным
Конфигурация 1: 4: 2, то есть каждая ооциста содержит по 4 спороцисты.
содержащий 2 спорозоитов. Ооцисты обычно имеют овальную или эллипсовидную форму.
форма, диапазон от 10-40 мкм
в длину на 10-30 мкм в
ширину и может содержать специализированные структуры, такие как полярные шапки, микропиле,
остаточные и кристаллические тела.
Беспорульные ооцисты содержат развивающиеся споробласты.
который в конечном итоге подвергается споруляции, образуя спороцисты, содержащие
инфекционные спорозоиты. Ооцисты Eimeria обладают характерным
Конфигурация 1: 4: 2, то есть каждая ооциста содержит по 4 спороцисты.
содержащий 2 спорозоитов. Ооцисты обычно имеют овальную или эллипсовидную форму.
форма, диапазон от 10-40 мкм
в длину на 10-30 мкм в
ширину и может содержать специализированные структуры, такие как полярные шапки, микропиле,
остаточные и кристаллические тела. Многие хозяева также являются носителями нескольких видов кокцидий, которые могут различаться.
значительно в морфологии, цикле развития, месте инфекции и
патогенность.Двенадцать Eimeria spp. были описаны из
крупного рогатого скота, 11 видов от овец, 9 от коз и 7 от кур. В
в целом, небольшие быстроразвивающиеся виды обычно являются наиболее
патогенный.
Многие хозяева также являются носителями нескольких видов кокцидий, которые могут различаться.
значительно в морфологии, цикле развития, месте инфекции и
патогенность.Двенадцать Eimeria spp. были описаны из
крупного рогатого скота, 11 видов от овец, 9 от коз и 7 от кур. В
в целом, небольшие быстроразвивающиеся виды обычно являются наиболее
патогенный.
 Молодые животные наиболее подвержены клиническим заболеваниям, хотя выживают
выработать сильный специфический защитный иммунитет против последующей инфекции
и болезнь.
Молодые животные наиболее подвержены клиническим заболеваниям, хотя выживают
выработать сильный специфический защитный иммунитет против последующей инфекции
и болезнь. Инфекции обычно диагностируются при копрологическом исследовании.
фекалий хозяина для кокцидиальных ооцист (концентрированных с использованием различных методов седиментации-флотации)
техники). Неокрашенные ооцисты лучше всего наблюдать с помощью световой микроскопии с использованием
неоптимальное проходящее освещение (конденсатор заводится, чтобы ввести
дифракция), фазово-контрастная или интерференционно-контрастная оптика. Свежие фекалии
образцы могут содержать только неспоровые ооцисты, поэтому
Иногда для диагностики может потребоваться кратковременное хранение для облегчения споруляции
(2% дихромат калия часто используется для подавления микрофлоры при хранении,
но не для рыб, и охлаждение может замедлить процесс
если это необходимо для полевых образцов).Недавно исследователи использовали диапазон
молекулярных методов для характеристики генетической изменчивости между и
среди видов паразитов, но немногие методы подходят для рутинной диагностики
использовать.
Инфекции обычно диагностируются при копрологическом исследовании.
фекалий хозяина для кокцидиальных ооцист (концентрированных с использованием различных методов седиментации-флотации)
техники). Неокрашенные ооцисты лучше всего наблюдать с помощью световой микроскопии с использованием
неоптимальное проходящее освещение (конденсатор заводится, чтобы ввести
дифракция), фазово-контрастная или интерференционно-контрастная оптика. Свежие фекалии
образцы могут содержать только неспоровые ооцисты, поэтому
Иногда для диагностики может потребоваться кратковременное хранение для облегчения споруляции
(2% дихромат калия часто используется для подавления микрофлоры при хранении,
но не для рыб, и охлаждение может замедлить процесс
если это необходимо для полевых образцов).Недавно исследователи использовали диапазон
молекулярных методов для характеристики генетической изменчивости между и
среди видов паразитов, но немногие методы подходят для рутинной диагностики
использовать.