Что такое пуллороз у цыплят и какие существуют методы его лечения?
При разведении цыплят на яйца и мясо – последнее особенно касается птенцов бройлеров – на пути к цели могут встать разнообразные инфекционные заболевания. Одним из них является пуллороз, возбудитель которого – микроорганизм Bacillus pullorum. Данная бактерия отличается высокой живучестью и способна длительное время сохраняться при различных температурах.
Пуллороз чаще встречается у цыплят, реже поражает взрослые особи. Наиболее восприимчивы к пуллорозу птенцы в возрасте до 20 дней. Как правило, инкубационный период пуллороза весьма короткий, поэтому при первых подозрительных симптомах больных птиц нужно изолировать от здоровых и как можно скорее начать лечение.
Содержание:Показать
Признаки
Инкубационный период пуллороза у цыплят короткий – от 1 до 6 дней. Заболевание может протекать в острой или подострой форме, переходящей в хроническую. Самого пристального внимания заслуживают цыплята в возрасте 3-7 дней.
Нужно принимать меры при следующих признаках:
- цыплята собираются группами;
- птенцы вялые, постоянно широко расставляют лапы, опускают крылья вниз, дышат с трудом;
- сильная жажда;
- жидкий стул белого или зеленого цвета со слизью;
- из-за поноса пушок сзади испачкан и склеен, часто возникает закупорка клоаки;
- птицы постоянно пищат;
- глаза чаще всего прикрыты.
Нередки случаи, когда пуллорозом заражены взрослые несушки, при этом заболевание может протекать бессимптомно. Взрослые курицы часто выступают лишь носителем заболевания и источником заразы. Пуллороз от заболевших несушек начинает развиваться непосредственно в яйце.
Среди таких яиц около 50-70% эмбрионов погибают на первых этапах развития. Оставшиеся птенцы рождаются зараженными.
Для цыплят, вылупившихся из инфицированных яиц, характерны:
- общая слабость, апатия, сонливость;
- отказ от корма;
- плохая оперенность;
- желток не до конца втянут в брюшную полость;
- жидкий стул белого цвета.
Гибель в таком случае наступает через 2-3 дня. При этом, при отсутствии эффективного лечения, из одного выводка может погибнуть до 90% птенцов.
Также пуллороз может возникнуть у цыплят в возрасте 2-3 недель. В таком случае заболевание протекает в подострой форме, которая затем переходит в хроническую. Заболевшие в этот период птицы, в том числе, птенцы бройлеров, иногда выздоравливают. При отсутствии лечения гибель может наступить через 15-20 дней. Данную форму пуллороза можно опознать по тому, что птенцы замедляются в росте и развитии. Птица периодически страдает расстройством пищеварительной системы, двигательная активность снижается.
С возраста 20 дней число инфицированных птенцов резко уменьшается, а с возраста 45 дней носит случайный характер.
При возникновении сальмонеллеза у кур мясо и яйца употреблять в пищу категорически запрещено!
Для чего на птицефабриках вызывают искусственную линьку у несушек? Ответ на этот вопрос вы найдете в нашей статье.
Опухшие глаза могут свидетельствуют о различных заболеваниях. Подробнее об этом читайте здесь.
Лечение
Лечение пуллороза у цыплят осуществляется медикаментозно. Чем быстрее хозяин подворья отреагирует на перемену в поведении птиц, заметит тревожные признаки, тем успешнее окажется лечение.
Для лечения пуллороза у цыплят используются следующие препараты:
- сульфадимезин – с кормом (в концентрации 0,05%) или с водой (в концентрации 0,1%) на протяжении 2 недель, после 3-дневного перерыва курс повторить;
- террамицин – 2 г на 1 кг корма на протяжении 10 дней, после 3-дневного перерыва курс повторить;
- фуразолидон – с кормом (в концентрации 0,04%) на протяжении 2 недель, после 3-дневного перерыва курс повторить;
- фуридин – с кормом (200 мг на 1 кг общей массы) на протяжении 10 дней.

В больших птицеводческих хозяйствах активно применяется полимиксин-М из расчета 100 мг на тысячу цыплят на протяжении 7 дней. Средство добавляется в корм.
Для профилактики рекомендуется дезинфицировать инкубационные яйца аэрозолем гексахлорафена.
Пуллороз цыплят и кур: описание, симптомы, лечение
1
2985
Рейтинг статьи
Кира Столетова
Инфекционная болезнь домашней птицы из отряда куриных пуллороз цыплят поражает довольно часто, приводя в итоге к гибели молодняка.
Пуллороз цыплят и кур
Справка о природе пуллороза
Инфекция, называемая Пуллороз птицы, относится к кишечным, поражающим паренхиматозные органы цыплят. Она вызывает у взрослой птицы воспалительные процессы в яичниках, приводя к желточному перитониту. Среди иных наименований инфекционного заболевания — дизентерия, бациллярный белый понос (диарея).
Отличительной особенностью пуллороза у цыплят является его бессимптомное протекание.
Первые случаи Пуллороза птиц массового характера наблюдались в 1889 году. Тогда английские ученые назвали это расстройство сальмонеллезом птиц. Возбудитель Пуллороза у домашней птицы выявили в 1900 году. Птичий тиф, пуллороз, на европейской территории бы зафиксирован в 1913-м, на российских птицефермах кишечная инфекция появилась в 1924-м, когда были импортированы цыплята и индюшата с признаками этой болезни.
В результате воздействия пуллороза на организм молодняка количество летальных исходов среди цыплят достигает 70%. При этом экономический ущерб от него связан еще и со снижением продуктивности взрослых кур, уменьшения их яйценоскости и выводимости нового поколения по причине проблемного эмбрионального развития плода. Молодые цыплята и индюшата при заболевании Пуллорозом начинают терять в весе, что напрямую влияет на племенные характеристики домашней птицы.
Этиологическая картина пуллороза
пуллороз птиц вызывается возбудителем, принадлежащим к отряду сальмонелл, представляющим собой неподвижную грамотрицательную палочку, не образующую ни спор, ни капсул. Микробиология относит возбудитель птичьего тифа к аэробам.
Для активности инфекционной палочки наиболее оптимальной температурой является 38°С при показателях щелочной среды pH 7,5.
В привычной питательной среде аэроб развивается достаточно быстро, легко образуя круглых форм полупрозрачные колонии с четкими очертаниями и слегка выступающей влажной поверхностью. пуллороз может размножаться в шероховатой форме, тогда он растет сухими колониями.
Возбудитель тифа птиц значительно устойчив к воздействию внешних факторов. Так, в птичьем помете пуллороз сохраняется на протяжении 100 суток, в условиях непроточной воды — до 200, в почвенном слое — до 400. При этом в условиях несменяемой на протяжении 10 суток птичьей подстилки возбудитель пуллороза птиц гибнет.
Ученые подметили, что попавший в садово-огородную культуру аэроб пуллороза при сохранении температуры в пределах 18-20°С в высушенном состоянии способен жить до 7 лет.
Длительный срок активности пуллорозной инфекции наблюдается в условиях заморозки до 180-190 суток. Инактивировать вирус пуллороза возможно при нагревании до 60°С на протяжении не менее получаса. При температуре кипения аэроб гибнет уже спустя минуту, когда варится зараженное куриное яйцо — спустя 7-8 минут.
Привести к гибели инфекции могут различные препараты и растворы:
- 1%-ый формалин способен уничтожить Пуллороз за 5 минут,
- для инактивации карболовой кислотой потребуется концентрация в 5% и полминуты времени,
- справятся за 15-20 минут с пуллорозным вирусом марганцовка, нафтазол, хлорная известь с активным хлором.
Ученые отмечают чувствительность пуллорозных бактерий к препаратам из ряда антибиотиков, однако наблюдается привыкание инфекции, когда лечение проводится при длительном применении одного и того же медикамента.
Эпизоотология
Помимо домашней птицы (индеек, индюшат, кур, цыплят, цесарок, фазанов и перепелок из куриного отряда) среди других животных, которые склонны к заболеванию пуллорозом, вылеляются кролики, декоративные свинки, мыши. Небольшая устойчивость против пуллороза птиц зафиксирована среди водоплавающих.
Среди бройлеров тифом заражаются преимущественно птицы мясного направления. Наименьшие случаи заболевания пуллорозом у цыплят отмечены у тех типов домашней птицы, которые выводятся для получения яиц.
Основным путем передачи заболевания является эмбриональный, когда заражение проходит через инфицированные яйца к новорожденному молодняку. Таких случаев отмечается до 50%.
Пуллороз отмечается у молодняка в зависимости о возрастной категории:
- 5-7-и дневные цыплята болеют пуллорозом чаще, болезнь прогрессирует у них на протяжении 20 суток,
- при достижении возраста 20 суток и далее количество случаев у цыплят сокращается, переходя в подострые формы протекания либо хроническое развитие.

Передача кишечной инфекции происходит разными путями:
- в качестве источника передачи возбудителя выступают заболевший молодняк и взрослые куры-носители бактерии, которые вместе с экскрементами выводят в окружающую среду большое скопление возбудителя пуллороза.
- проникновение пуллороза в куриные яйца происходит посредством содержимого кишечника болеющих особей через скорлупные поры,
- источниками бактерий могут стать оставшиеся после зараженного выводка пух, отходы, питьевая вода, корм,
- переносчиками болезни являются городские птицы (воробьи, голуби, галки).
Обычно из зараженных пуллорозом куриных яиц вылупляется лишь от 25 до 50% цыплят, остальные гибнут в процессе эмбрионального развития.
САМЫЕ ЧАСТЫЕ БОЛЕЗНИ У КУР: симптомы и лечение куриных заболеваний! (Ветеринар Павел Шкурманов)
Ньюкаслская болезнь - вакцинация кур.
Про болезни кур! (впечатлительным не смотреть и не слушать)
Патогенезная и клиническая картины птичьего тифа
Среди факторов, которые способствуют появлению и развитию пуллороза у цыплят и кур, многие связаны с условиями содержания домашней птицы и ее качеством питания:
- неполноценный рацион и несоблюдение графика кормления,
- скученное проживание птиц в птичнике,
- перегрев либо переохлаждение особей.
Патогенез инфекции
При попадании внутрь птичьего организма возбудитель в месте проникновения, например, слизистых кишки, желудка, легочной системы, начинает свое размножение и через кровеносную систему приступает к распространению по всем внутренним органам, приводя к патологии сердца, печенки, почек, яичников, селезенки.
В процессе размножения пуллороз выбрасывает в организм токсины, приводящие к гибели эмбриона.
Большинство цыплят при вылуплении уже являются носителями пуллороза, который проявляется с признаками острой интоксикации. В организме взрослой птицы возбудитель накаливается в яйцеобразующих органах и время от времени выделяется вместе с яйцекладкой.
В организме взрослой птицы возбудитель накаливается в яйцеобразующих органах и время от времени выделяется вместе с яйцекладкой.
Среди последствий перенесения пуллороза птицами, когда обеспечено надлежащее лечение, — вырабатываемый против кишечной инфекции иммунитет к вторичному заражению за счет образования антител у перенесших пуллороз кур. Эта особенность легла в основу селекционной работы при выведении куриных линий, устойчивых к птичьему тифу.
Клинические признаки
Скрытый период пуллороза птиц может длиться от суток до 20. При этом выделяют:
- конгенитальную форму, при которой уже больными цыплята вылупляются из зараженных яиц,
- постнатальную форму, когда здоровые особи заражаются от больных в процессе их совместного содержания.
При конгенитальной форме, развивающейся за 3-5 суток, заболевание проявляется у цыплят в виде общей слабости и сонливых состояний. Молодняк теряет аппетит и отказывается от кормов, перемещается с опущенными крыльями. Среди физиологических симптомов — белый жидкий понос. Аналогичные клинические признаки у зараженных постнатальным способом, который прогрессирует на протяжении от 2 до 5 суток.
Среди физиологических симптомов — белый жидкий понос. Аналогичные клинические признаки у зараженных постнатальным способом, который прогрессирует на протяжении от 2 до 5 суток.
Протекание инфекции и патологические изменения
Количество летальных случаев при пуллорозе птиц достигает 70% и зависит от формы развития болезни.
Острая форма развития
Она наблюдается спустя 3 дня-неделю и сопровождается затрудненным дыханием, отсутствием координированных движений цыплят, малоподвижностью птиц. Обычно заболевшие особи застывают в неподвижном состоянии с закрытыми глазами, широко расставив лапы, что нередко демонстрируют ветеринары в качестве наглядного примера клинической картины на фото. Отмечается повышение температуры до 44°С. Основной симптом острого развития пуллороза — профузный жидкий понос белого цвета. Исход острого протекания тифа в большинстве случаев летальный, через 10-15 суток.
Подострое и хроническое развитие
Такие формы протекания заболевания характерны для 2-3-х недельных птиц и взрослых кур. Цыплята начинают терять в привесе, становятся малоподвижными, отстают в развитии. Если лечить птиц при помощи антибиотиков, большинство цыплят от болезни выздоравливает.
Цыплята начинают терять в привесе, становятся малоподвижными, отстают в развитии. Если лечить птиц при помощи антибиотиков, большинство цыплят от болезни выздоравливает.
У взрослых бройлеров симптомов пуллороза не наблюдается, болезнь протекает без особенных клинических признаков. Лишь периодически можно отмечать изменение яйценоскости в сторону уменьшения. Некоторые особи отличаются вялыми состояниями, пониженным аппетитом. При обострении птичьего тифа фиксируются случаи жажды, одышка. У несушек развивается перитонит. При проявлении пуллороза у бройлеров отмечается хромота и появление артритов, у птиц опухают коленные суставы. Показатели смертности среди взрослых бройлеров составляют не более 5%, если вовремя их начать лечить.
Патологии
В результате развивающегося в организме пуллороза при вскрытии эмбрионов, молодняка и взрослых особей отмечаются патологические изменения внутренних органов:
- увеличение печенки, селезенки и желчного пузыря, заполненного темной зеленой желчью,
- накопление белых мочекислых солей в прямой кишке,
- присутствие очагов некроза в легочных тканях, сердце,
- воспалительные процессы в кишечнике,
- наличие фолликулярных воспалений.

В соответствии с полученными эпизоотологическими данным ветеринарные врачи ставят диагноз с учетом клинических признаков, возраста птицы, полученных патологоанатомических исследований. Окончательный диагноз ставится при наличии бактериологических исследований свежих птичьих трупов либо прижизненной диагностики взрослых особей по кровекапельной реакции.
Лечебные и профилактические мероприятия
Одним из наиболее эффективных средств для профилактики пуллороза является бактериофаг, применяемый перорально в дозировке по 2 мл. Вводится он двукратно с интервалом в 2 дня. На третий день этот препарат используется в виде инъекции подкожно в объеме 0,5 мл.
Лечение заболевших особей осуществляется с использованием препаратов группы антибиотиков, среди которых:
- фуразолидон, примешиваемый к корму по 0,04-0,06% на протяжении 15 суток с повторным лечением после 3-5 дней перерыва,
- менее токсичный фуридин с дозировкой 200 мг на 1 килограмм веса, добавляемый в корм в течение 10 суток,
- широко применяемый как добавка к кормам и питьевой воде сульфадимезин в объеме до 1% на протяжении 2-х недель с повтором через интервал в 2-3 суток,
- комплексные авидокс и колимицин.

При выявлении случаев заболевания пуллорозом-тифом и поставленном ветеринарной службой окончательном диагнозе постановлением исполнительной власти региона принимается решение об объявлении неблагополучной обстановки и приступают к ограничительным мероприятиям по разведению цыплят и индюшат, проводится комплексное лечение и убойная зачистка.
Пуллороз у цыплят: лечение
Вырастить поголовье кур из цыплят – это экономически выгодно, ведь можно получать мясо-яичную продукцию от хозяйства, не привлекая дополнительные инвестиции. К сожалению, много инфекционных заболеваний поражаю именно молодняк, к таким болезням относится пуллороз цыплят. А вот чем лечить пуллороз у цыплят и как его обнаружить? Попробуем разобраться.
[содержание]
Чем лечить пуллороз у цыплят
Содержание статьи:
Причина пуллороза
Пуллороз поражает молодняк из-за такой бактерии как Bacillus pullorum. Возбудитель успешно сохраняется при большом диапазоне температур, он устойчив почти в любой среде, поэтому хозяевам птичника достаточно сложно определить, что именно стало причиной болезни у цыплят, пуллороз у молодых взрослых кур сложно диагностировать.
Диагностировать болезнь достаточно тяжело, чем осложняется её лечение, но ряд симптомов присутствует. Как правило, инкубационный период при этой болезни достаточно короткий. Отмечают, что инфекция может развиваться уже в яйце, в этом случае падеж молодняка может составлять от половины яиц в инкубаторе, то трех четвертей – цыпленок просто не развивается внутри яйца.
Взрослые курицы болеют практически бессимптомно, в отличие от цыплят, выступая носителем бактерии и источником инфекции. Часто птенцы заражаются сразу после вывода – таких птиц легко заметить:
- Цыплята малоподвижные, подолгу стоят на одном месте;
- Глаза птиц практически постоянно закрыты;
- Дышат птенцы только клювом;
- Постоянно пищат;
- Страдают от поноса.
Уже через пару суток наступает гибель птиц, если не провести лечение своевременно, то может погибнуть от половины вывода до всех особей.
Если хозяева не уверены, что птенец инфицирован именно пуллорозом, то всегда можно обратиться в ветеринарную клинику для постановки диагноза – специалисты возьмут забор жидкостей организма для проведения анализа и назначения адекватного лечения.
Птицу, которая поражена пуллорозом, не стоит потреблять в пищу, яйца также опасны для здоровья человека – эти продукты вызывают тяжелую интоксикацию.
Лечение пуллороза
Если были зафиксированы случаи заболевания, которые подтверждены ветеринаром, то стадо считается неблагополучным по пуллорозу и практически каждая особь требует профилактического лечения. Как правило, для устранения бактерии эффективны антибиотики пеннициллинового ряда, биомицина — их можно применять уже с первых дней жизни птенца, они абсолютно безопасны для взрослых несушек и бройлеров. Такие методы позволяют снизить смертность в несколько раз.
Непосредственно больную птицу необходимо начинать лечить незамедлительно, так как промедление даже в несколько часов недопустимо. Часто несушек и бройлеров лечат:
- Фуридином;
- Колмик-Е;
- Фуразолидоном;
- Авидосом.
Лучше, если предварительно выполнен анализ на чувствительность бактерии к предложенному препарату – так лечение буде более эффективным. Если использовать препараты через некоторое время, то такое опоздание может привести к тому, что бактерия не будет ливкидирована и пуллороз будет распространяться дальше. После завершения лечения кур неплохо повторно провести анализ на возбудителя заболевания, чтобы подтвердить выздоровление.
Если использовать препараты через некоторое время, то такое опоздание может привести к тому, что бактерия не будет ливкидирована и пуллороз будет распространяться дальше. После завершения лечения кур неплохо повторно провести анализ на возбудителя заболевания, чтобы подтвердить выздоровление.
Профилактика пуллороза кур
При разведении куриц необходимо обращать внимание на пресечение распространения пуллороз в птичнике. Особенно важно обращать внимание на питание птиц – корм должен быть богатый витаминами, хорошо добавлять сенную муку, силос, красную морковь, тыкву. Такие простые продукты укрепят организм курочек и цыплят, они с успехом смогут бороться с инфекциями.
Нужно обратить внимание и на потребление несушками белковой пищи: если их очень много, особенно это относится к протеинам животного происхождения, а витаминов в корме мало, то эмбирионы страдают от дистрофии, процент вывода снижается, смертность цыплят при выращивании растет.
Стоит обращать внимание и на условия содержания птенцов – они очень важны для выращивания здорового поголовья. Особенно важно в этом вопросе – начать ранний прикорм, если задержать его хотя бы на сутки, то молодняк существенно ослабнет, а отход увеличится.
Особенно важно в этом вопросе – начать ранний прикорм, если задержать его хотя бы на сутки, то молодняк существенно ослабнет, а отход увеличится.
Если выявлено небольшое количество инфицированных особей, то иногда их целесообразно забить, чтобы пресечь распространение заболевания. Также в птичнике нужно провести необходимые мероприятия по санитарной обработке помещений, обеспечить улучшенное кормление для всего поголовья.
При выявлении эпизодов нужно не только начать незамедлительное лечение, а и обеспечить изоляцию больных птиц. Антибиотики целесообразно ввести всему поголовью. Павшую птицу лучше сжечь либо закопать, но при этом глубина должна быть значительной. Инкубаторы и вводные шкафы, в которых находились инфицированные цыплята обязательно нужно обработать дезинфицирующим средством: подходит 0,5 % раствор карбоната натрия, для лучшей эффективность стоит обработать помещение парами формальдегида.
Инкубаторы и вводные шкафы, в которых находились инфицированные цыплята обязательно нужно обработать дезинфицирующим средством: подходит 0,5 % раствор карбоната натрия, для лучшей эффективность стоит обработать помещение парами формальдегида.
Пуллороз цыплят – это инфекционное заболевание, наносящее серьезный экономический вред во всех хозяйствах, где оно встречается, так как значительно повышает риск гибели птенцов и молодняка. К сожалению, профилактика не дает 100% гарантию защиты от инфекции, поэтому о лечении знать необходимо.
Пуллороз-тиф у домашней птицы — описание, диагностика, лечение
Пуллороз-тиф у домашней птицы — описание, диагностика, лечение и профилактика.
Пуллороз-тиф у домашней птицы
Возбудитель заболевания весьма устойчив во внешней среде: в курином помете он сохраняется до 100 суток, в почве 420 суток, при нагревании до 60 градусов теряет свою заразительность в течение 30 минут.
Источники инфекции.
Основным источником инфекции являются больные и переболевшие куры, которые остаются пожизненными бактерионосителями. Источником инфекции могут быть воробьи и голуби, которые также болеют пуллороз-тифом. Даже домашние грызуны и некоторые клещи могут переносить эту болезнь. Заражение цыплят часто происходит в первые дни жизни, в таких случаях инкубационный период сокращается с 2-6 суток до 24-36 часов, и заболевание развивается молниеносно.
Распространять пуллороз-тиф может и ухаживающий персонал, пренебрегающий спецодеждой и соблюдением правил предосторожности в обращении с птицей. Возбудитель пуллороза может проникнуть в яйцо через скорлупу во время хранения или инкубации яиц. Кроме того, куры-бактерионосители несут зараженные пуллорозом яйца.
В случае, если яйца перед инкубацией были заражены пуллорозом, болезнь часто протекает сверхостро и цыплята погибают через несколько часов после вывода. Острое течение пуллороза обычно наблюдается у цыплят и индюшат до 10-дневного возраста.
Особенно часто такое течение бывает у цыплят-бройлеров. Они становятся вялыми, сидят больше под брудером, у них появляются признаки расстройства пищеварения, испражнения вначале кашицеобразные, а затем становятся жидкими и пенистыми, мелообразными, иногда с желтоватым оттенком. Вокруг клоаки пушок выпачкан испражнениями, а иногда они и заклеивают клоаку. Острое течение болезни длится 2-6 дней и часто заканчивается смертью.
При подостром течении наблюдаются те же признаки, но они менее выражены, и многие переболевшие цыплята остаются живыми. В дальнейшем они отстают в росте и развитии, но к 4-5-месячному возрасту догоняют неболевших. У взрослых кур-несушек заболевание протекает скрыто, но для опытного птицевода не проходят незамеченными такие признаки, как бледность гребня и сережек, задержка в гнезде при снесении яйца, поносы, отвислость живота и др.
Диагностика пуллороза-тифа у домашней птицы.
Диагноз на пуллороз-тиф ставят не только на основании клинических, эпизоотологических и патологоанатомических исследований, но и на основании бактериологического исследования с помощью реакции непрямой гемагглютинации на стекле с каплей крови (РИГА) или с помощью кровекапельной реакции агглютинации (ККРА).
Лечение и профилактика пуллороза-тифа у домашней птицы.
При установлении диагноза для предупреждения разноса инфекции всех больных птиц уничтожают, а если есть условия, то лечат биомицином и фуразолидоном. При применении биомицина 30-дневный период разделяют на два: с 1-го по 10-й день биомицин применяют из расчета 1 г препарата на 1000 голов цыплят, а с 11-го по 30-й день по 1,2 г. Фуразолидон скармливают с кормом ежедневно с 1-го по 5-й день в дозе 2 г на 1000 цыплят, а с 5-го по 15-й день в дозе 3 г.
В ряде стран его применяют в дозе 0,04% к массе корма и скармливают такой корм вволю.
Кроме лечебных-мероприятий, в хозяйстве проводят глубокие ветеринарно-санитарные процедуры, направленные на ликвидацию заболевания.И. Петрухин «Домашний ветеринар»
Если вам интересна тема про пуллороз-тиф у домашней птицы, то читайте также статью на портале Я-фермер: https://www.ya-fermer.ru/pulloroz-tif
Как лечить пуллороз цыплят?
Выращивание поголовья кур из цыплят – это, пожалуй, наиболее выгодный способ получения мяса и яиц, но не редко птицеводы сталкиваются с различными заболеваниями птиц, которые особенно рьяно поражают именно молодняк кур. Одним из таких заболеваний является пуллороз цыплят.
Одним из таких заболеваний является пуллороз цыплят.
Пуллороз цыплят – это инфекционное заболевание, возбудителем которого является микроорганизм Bacillus pullorum. Возбудитель пуллороза способен долгое время сохраняться в различных средах и температурах, поэтому не всегда есть возможность выявить, что именно послужило причиной заражения цыплят. Диагностировать заболевание можно по ряду характерных для него симптомов.
После того, как был подтвержден пуллороз цыплят, лечение необходимо начинать немедленно. Положительную динамику лечения можно наблюдать при применении антибиотиков, таких как Фуридин, Фуразолидон, Колмик-Е, коли-миницин, Авидос. Перед назначением препараты сначала проводится лабораторное исследование на чувствительность патогенной микрофлоры к отдельному препарату.
Заболевание начинает прогрессировать у цыплят после короткого инкубационного периода. В некоторых случаях, когда имеет место заболеваемость взрослых кур несушек, у которых, как правило, болезнь протекает бессимптомно, болезнь у птенцов может начать развиваться прямо в яйце. При заражении пуллорозом яиц, примерно 50-75% погибают на разных стадиях развития.
При заражении пуллорозом яиц, примерно 50-75% погибают на разных стадиях развития.
Кроме того, может произойти заражение птенцов сразу после вывода из яиц. При поражении цыплят после вывода, птенцы не слишком подвижны, стоят с закрытыми глазами, дышат клювом, жалобно пищат, также не редко наблюдается понос. Гибель птенцов наступает через двое суток. Если не провести правильное лечение из одного выводка погибает от 50 до 90% цыплят.
При вскрытии павшей птицы можно наблюдать некротические очаги поражения внутренних органов, сильное поражение печени, селезенки, а также отложение солей в мочеточнике и печени. Не редко источником болезни являются взрослые куры- несушки, которые болеют практически без клинических признаков.
При вскрытии взрослых птиц наблюдаются поражение слизистых оболочек печени, легких, сердца. Пуллороз у взрослых кур не вызывает летального исхода, но сильно снижает качество продукции. Если нет уверенности, что именно пуллороз вызвал симптоматику у цыплят необходимо обратиться ветклинику для проведения диагностики и проведения анализа жидкостей с целью выявления возбудителя заболевания.
Особое внимание нужно на дезинфекцию инкубаторов и выводных шкафов, в которых появилось больное поголовье. В качестве профилактики необходимо обработать все помещения 0,5% раствором карбоната натрия. Одной дезинфекции будет мало, поэтому необходимо обработать все поверхности парами формальдегида.
Пораженную пуллорозом птицу и яйца нельзя использовать в пищу, так как данное заболевание может передаваться человеку, вызывая тяжелую интоксикацию. При выявлении эпизодов пуллороза у кур, хозяйство необходимо изолировать на карантин и провести комплексное лечение всего поголовья молодняка и взрослых кур. Всех павших птиц необходимо утилизировать путем сжигания или закапывания на большую глубину.
Пуллороз цыплят – это заболевание, которое наносит большой экономических вред во всех хозяйствах, где оно встречается, так как процент гибели молодняка и эмбрионов яиц достаточно высок, а способы профилактики и лечения, к сожалению, пока не дают возможность полностью взять под контроль инфекцию.
Пуллороз — AgroXXI
Пуллороз, иначе называемый тифом птиц, представляет собой инфекционную болезнь, отличающуюся высокой контагиозностью, значительным ущербом для птицеводческого хозяйства и большой смертностью среди восприимчивого поголовья
Так летальность болезни может достигать 70% среди цыплят.
Этиология
Причиной возникновения пуллороза является микроорганизм из рода сальмонелл, относящихся к семейству энтеробактерий. А именно S. gallinarum-pullorum. Выделенные в конце позапрошлого столетия американцами Смитом и Сальмоном микроорганизмы, служившие причиной чумы свиней, позже были названы в честь Сальмона. На данный момент род сальмонелл насчитывает порядка 2 тысяч различных серологических вариантов.
Все представители рода имеют ряд общих особенностей:
- представляют собой подвижные, закругленные на концах, палочки;
- не образуют спор и капсул;
- в мазках располагаются хаотично;
- растут на обычных питательных средах;
- являются аэробами или факультативными анаэробами;
- хорошо окрашиваются анилиновыми красителями, грамотрицательны.

Кроме того, сальмонеллам присуща достаточно высокая устойчивость к действию факторов окружающей среды. В почве сальмонеллы сохраняются в активном состоянии больше года, в помете птицы не менее 100 суток, в воде сохраняют жизнеспособность от 120 до 200 дней. Способны переносить замораживание в тушках птицы при глубокой заморозке микроорганизм выживает в течение не менее 3 лет. Ультрафиолет и прямые солнечные лучи инактивируют сальмонелл в течение 5–9 часов, нагревание до 65°С около получаса. Кроме того, сальмонеллы выдерживают повышенные концентрации хлорида натрия и сохраняются в соленом мясе до 8 месяцев.
Вместе с тем сальмонеллы достаточно чувствительны к обычным дезинфицирующим средствам, антибиотикам тетрациклинового ряда и некоторым другим, в меньшей степени к сульфаниламидным и нитрофурановым препаратам.
Эпизоотология
К пуллорозу восприимчивы все курообразные, в наибольшей степени куры и индюки. Потенциальную опасность S. gallinarum-pullorum представляют и для человека. Возбудитель болезни выделяется с пометом больной птицы и бактерионосителей.
Возбудитель болезни выделяется с пометом больной птицы и бактерионосителей.
Факторами передачи служат:
- подстилка;
- загрязненные корма;
- инвентарь и прочее.
При горизонтальном пути распространения инфекции ведущую роль играет алиментарное заражение. Кроме того, проходя трансовариальный барьер, сальмонеллы приводят к развитию заболевания у цыплят, которые, в свою очередь, сразу же после рождения становятся источниками возбудителя пуллороза.
Для цыплят и индюшат характерно острое течение болезни, для взрослой птицы хроническое и бессимптомное течение болезни. Как и при многих других инфекционных заболеваниях, предрасполагающими к возникновению вспышки пуллороза факторами являются нарушения условий содержания и кормления птицы, переохлаждение и перегрев, скученное содержание, неполноценность рациона.
Патогенез и симптоматика
Попав в организм восприимчивой птицы алиментарным путем, сальмонеллы локализуются на слизистой оболочке кишечника, преимущественно в слепых отростках. В этот момент у больной птицы наблюдаются симптомы поражения желудочно-кишечного тракта. В дальнейшем сальмонеллы разносятся по организму гематогенным путем, вызывая воспаления и дистрофические изменения в тканях различных органов. Кроме того, в процессе жизнедеятельности микроорганизмы выделяют большое количество токсинов, оказывающих действие на весь организм.
В этот момент у больной птицы наблюдаются симптомы поражения желудочно-кишечного тракта. В дальнейшем сальмонеллы разносятся по организму гематогенным путем, вызывая воспаления и дистрофические изменения в тканях различных органов. Кроме того, в процессе жизнедеятельности микроорганизмы выделяют большое количество токсинов, оказывающих действие на весь организм.
Инкубационный период при пуллорозе достаточно непродолжителен и составляет от 1 до 7 суток. Первыми признаками заболевания служат:
- вялость;
- отказ от корма;
- повышение температуры тела;
- профузный понос.
Размягченные в самом начале болезни фекалии очень быстро становятся жидкими, белыми, с пузырьками газа. Иногда отмечается наличие в помете крови. Очень быстро нарастают симптомы обезвоживания и интоксикации. Без оказания медикаментозной помощи в течение 2–7 суток значительная часть больных цыплят погибает.
У взрослой птицы пуллороз чаще всего протекает в хронической форме, что не исключает однако возможности острого и подострого течения болезни. При острой и подострой формах клинические признаки пуллороза у взрослой птицы сходны с симптомами заболевания у цыплят. Хроническая форма характеризуется перемежающимися поносами и прогрессирующим истощением. Кроме того могут наблюдаться снижение продуктивности, жажда, признаки поражения респираторного тракта. В отличие от кур у индеек пуллороз чаще всего протекает в острой форме в независимости от возраста.
При острой и подострой формах клинические признаки пуллороза у взрослой птицы сходны с симптомами заболевания у цыплят. Хроническая форма характеризуется перемежающимися поносами и прогрессирующим истощением. Кроме того могут наблюдаться снижение продуктивности, жажда, признаки поражения респираторного тракта. В отличие от кур у индеек пуллороз чаще всего протекает в острой форме в независимости от возраста.
При патологоанатомическом вскрытии обнаруживают изменения, присущие для катарального либо катарально-геморрагического энтерита у птенцов, кровоизлияния оболочек желточного мешка и не полностью рассосавшийся желток. У птицы старшего возраста отмечают:
- перитонит;
- кровоизлияния, участки некроза в паренхиматозных органах и миокарде;
- дистрофические изменения в яичниках.
- Для индеек характерным признаком пуллороза является отек легких и признаки пневмонии.
Диагноз на пуллороз ставят комплексно, учитывая эпизоотологическию обстановку, симптомы болезни, результаты патвскрытия. Для уточнения диагноза проводят ряд лабораторных исследований, включающих бактериологический посев, выращивание чистой культуры возбудителя болезни и подтитровку на чувствительность к антибиотикам. Обязательным является исследование на пуллороз замерших эмбрионов.
Для уточнения диагноза проводят ряд лабораторных исследований, включающих бактериологический посев, выращивание чистой культуры возбудителя болезни и подтитровку на чувствительность к антибиотикам. Обязательным является исследование на пуллороз замерших эмбрионов.
Лечение и меры борьбы
Специфического лечения пуллороза не разработано. Вместе с тем, положительные результаты в подавлении возбудителя болезни достигаются применением антибиотиков (гентамицин, препараты тетрациклинового ряда) и нитрофуранов (фурадонин, фуразолидон) после предварительного изучения чувствительности к ним микроорганизмов.
Основной мерой борьбы с пуллорозом является профилактика и своевременное выявление случаев заболевания. С этой целью ежемесячно для лабораторного исследования направляют замершие при инкубации эмбрионы яиц, а также периодически проводят прижизненные исследования племенного поголовья, ремонтного и откормочного молодняка. Для прижизненной диагности чаще всего используют кровекапельную реакцию агглютинации и кровекапельную реакцию непрямой гемагглютинации.
Положительно реагирующую птицу отправляют на убой, серопозитивный молодняк направляют для выращивания на мясо и последующего убоя.
При возникновении в хозяйстве вспышки пуллороза накладывают карантинные ограничения, запрещающие вывоз живой птицы для комплектации стад и яиц за пределы хозяйства, инкубацию яиц для внутрихозяйственных целей. Больную и подозрительную по заболеванию птицу уничтожают, яйца, полученные от данной категории, направляют для технической переработки на меланж либо на пищевые производства, подразумевающие высокотемпературную обработку. Оставшейся птице с профилактической целью дают корма с добавлением в них антибиотиков, сульфаниламидов, нитрофуранов.
Ограничения с хозяйства снимают после прекращения выявления клинических признаков болезни, проведения заключительной дезинфекции птицеводческих помещений и инкубационного оборудования, а также после двукратного отрицательного результата серологических исследований, проведенных с двухнедельным интервалом.
Пуллороз у кур: симптомы и лечение
Инфекционные болезни наносят огромный ущерб птицеводческим хозяйствам. Пуллороз у кур – часто встречающееся заболевание, которое поражает кишечник и органы дыхательной системы пернатых. Его возбудителем является одна из разновидностей бактерии сальмонеллы. Чтобы предотвратить падёж поголовья, птицевод должен уметь распознавать симптомы опасной болезни у пернатых на начальной стадии.
Информация о возбудителе
Пуллороз вызывает грамотрицательная аэробная бактерия, принадлежащая к отряду сальмонелл. Она не образует спор или капсул и интенсивно размножается в кислой среде при повышенной температуре. Возбудитель устойчив к внешним условиям. Так, в почве он может сохранять жизнеспособность на протяжении 400 суток, в воде – до 200 дней, в птичьем помёте – более 3 месяцев. При замораживании анаэроб живёт около 6 месяцев.
Бактерия, вызывающая пуллороз, погибает при воздействии высокими температурами. Уничтожить её можно с помощью растворов:
- 1% формалина;
- 5% карболовой кислоты;
- марганцовки;
- хлорной извести.

После проникновения в организм птицы сальмонелла быстро размножается. У особей с сильным иммунитетом болезнь ограничивается поражением пищеварительной системы. У цыплят в возрасте до 3 недель и ослабленных кур бактерии по кровотоку распространяются в лёгкие и репродуктивные органы.
Пути передачи инфекции
Пуллороз чаще всего передаётся двумя способами – от несушки к цыплёнку через яйцо или алиментарным путём. Источниками передачи инфекции являются больные куры или дикие птицы, проникающие на территорию выгульного двора. Здоровые птицы могут заразиться пуллорозом через питьевую воду, обсеменённый патогенами корм, подстилку. Распространению инфекции способствуют грызуны.
Внимание! Куры, перенесшие болезнь, являются носителями бактерий и могут заразить своих соседей по курятнику.
Как протекает пуллороз: симптомы
Пуллороз поражает преимущественно кур мясных пород. В группе риска находится молодняк. Цыплята переносят болезнь в острой или подострой форме. У взрослых кур она протекает хронически. Фермеру важно научиться распознавать симптомы пуллороза у кур, ведь сальмонелла опасна и для человека.
У взрослых кур она протекает хронически. Фермеру важно научиться распознавать симптомы пуллороза у кур, ведь сальмонелла опасна и для человека.
Инкубационный период длится от 2 до 20 суток. Его продолжительность зависит от вирулентности бактерий, а также степени резистентности организма птицы.
Симптомы пуллороза в острой форме
Острая форма пуллороза развивается у птенцов в возрасте от рождения до 2 недель. Заражённые во время эмбрионального развития цыплята появляются на свет слабыми. Они сбиваются в группы и постоянно пищат. Птицы передвигаются на широко расставленных лапах с опущенными крыльями. К типичным проявлениям болезни относятся:
- Затруднённое дыхание, о чём свидетельствует приоткрытый клюв.
- Слабость, вялость. У больных особей снижается двигательная активность.
- Цыплята теряют интерес к корму, но много и часто пьют.
- Наблюдается расстройство кишечника. Помёт становится жидким и приобретает белый цвет. В кале присутствуют пузырьки воздуха и слизь.

- Клоака загрязнена, перья вокруг неё слипшиеся.
Внимание! Почти 80% птенцов, заражённых пуллорозом через яйцо, погибает в течение 7–10 дней.
Симптомы перманентного пуллороза
У цыплят старше 3 недель и взрослых кур болезнь протекает в подострой или хронической форме. Симптомы пуллороза при этом проявляются слабо, что сильно затрудняет диагностику. Для перманентной формы характерны следующие признаки:
- отставание в развитии;
- снижение привеса;
- малая активность;
- ухудшение аппетита;
- бледность гребешка;
- периодически возникает диарея;
- у несушек наблюдается резкое снижение продуктивности;
- хромота, воспаление суставов;
- отвисание живота;
- желточный перитонит.
Внимание! Обнаружить пуллороз у взрослых кур-несушек довольно сложно. Птицы ведут себя как обычно, разве что изредка страдают расстройством пищеварения. При этом они несут заражённые яйца.
Фермера должно насторожить резкое снижение яйценоскости.
Патологические изменения
Кур и цыплят, павших от болезни, отправляют на экспертизу. При вскрытии тушек оценивают состояние внутренних органов птиц. При пуллорозе обнаруживаются такие патологоанатомические изменения:
- У цыплят находят остатки желточного мешка. В норме он должен рассосаться к 5–7 дню жизни.
- В клоаке присутствует белый помёт.
- Стенки кишок испещрены кровоизлияниями.
- На сердце, печени и селезёнке обнаруживаются признаки некроза.
- В желчном пузыре содержится зелёная жидкость.
- У кур-несушек, павших от пуллороза, посмертно диагностируют воспалительный процесс в яйцеводе, спайки кишечника, а также желточный перитонит.
Диагностика заболевания
Важную роль при постановке диагноза в случае подозрения на пуллороз играют лабораторные исследования. Нельзя полагаться только на клиническую картину болезни, так как симптомы заражения сальмонеллой во многом схожи с проявлениями аспергиллёза, кокцидиоза, отравлений, а также некоторых видов авитаминозов.
Для подтверждения диагноза пуллороз в лаборатории исследуют от 5 до 10 тушек павших цыплят или несколько десятков эмбрионов, замерших во время инкубации. Идентифицировать бактерии помогают специальные сыворотки и растворы, на которых быстро размножается сальмонелла.
Взрослых несушек проверяют на наличие инфекции с помощью серологических тестов. За 4 суток до взятия проб из рациона птиц необходимо исключить животную и жирную пищу, а за 10 дней – лекарственные средства, если они применялись на тот момент.
Методы лечения пуллороза у кур
Для лечения пуллороза применяют антибиотики тетрациклинового ряда в комбинации с нитрофурановыми и сульфаниламидными препаратами:
- Фуразолидон добавляют в корм в течение 15 дней (0,04% от общего объёма). После трёхдневного перерыва курс повторяют.
- Полимиксин М или Колимицин растворяют в воде (0,4 мг на голову).
- Хлортетрациклин – 20–25 мг/кг веса.
- Байтрил или Энрофлоксацин добавляют в питьё.
 Продолжительность курса лечения составляет 6–7 дней.
Продолжительность курса лечения составляет 6–7 дней.
Важно! Ветеринар должен указать точные дозировки и схему применения препаратов. Важно чётко соблюдать его рекомендации. Нельзя самостоятельно прекращать лечение, так как сальмонелла может выработать резистентность к антибиотикам.
Наряду с противомикробными препаратами, больным цыплятам рекомендуется давать витамины и специальные добавки, улучшающие пищеварение и поддерживающие иммунитет.
Профилактика заболевания и меры борьбы
Если в хозяйстве подтвердился пуллороз, его объявляют неблагополучным. Больные особи подлежат убою, а условно здоровых с профилактической целью пропаивают сульфаниламидными и нитрофурановыми препаратами в сочетании с антибиотиками. Птичник обрабатывают раствором формальдегида или карбонатом натрия. Яйца, полученные от заражённых кур, отправляют на фабрики и предприятия, где предполагается их использование после тщательной термической обработки.
На фермах, которые занимаются продажей яиц и суточных цыплят, регулярно проводят серологическое исследование на предмет пуллороза.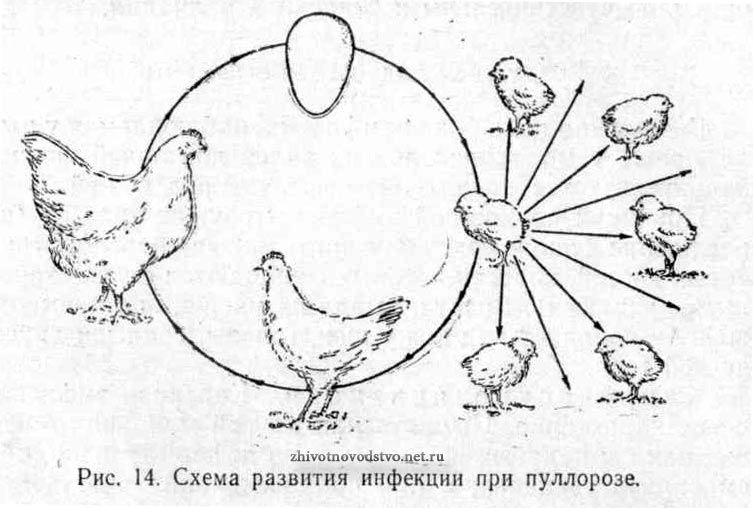 Птиц, оставленных для формирования стада, проверяют на пуллороз ежемесячно начиная с пятимесячного возраста. Карантин с фермы снимается, если при двукратном серологическом исследовании всех кур, проведённом с интервалом в 14 дней, были получены отрицательные результаты.
Птиц, оставленных для формирования стада, проверяют на пуллороз ежемесячно начиная с пятимесячного возраста. Карантин с фермы снимается, если при двукратном серологическом исследовании всех кур, проведённом с интервалом в 14 дней, были получены отрицательные результаты.
Птицеводы понимают, насколько важно уделять внимание профилактике пуллороза. Защитить поголовье от опасной болезни помогут следующие меры:
- поддержание чистоты в курятнике;
- проведение полной дезинфекции птичника и инвентаря дважды в год;
- раздельное содержание молодняка и взрослого поголовья;
- ограничение контакта домашних кур с дикими птицами;
- грамотное составление рациона пернатых, введение в него витаминных добавок;
- закупка инкубационных яиц и молодняка у проверенных поставщиков.
Пуллороз кур опасен для человека, поэтому очень важно принимать меры по защите пернатых от заражения сальмонеллой. Обнаружив признаки болезни у цыплят, следует немедленно сообщить об этом в ветслужбу, а в дальнейшем строго придерживаться рекомендаций ветеринара.
Salmonella Pullorum, Pullorum Disease, 'Bacillary White Diarrhea'
Введение
Заболевание, вызываемое одним из двух адаптированных к птице штаммов бактерий Salmonella , Salmonella Pullorum, обычно вызывает смертность только у птиц в возрасте до 3 недель. Иногда он может вызывать гибель взрослых птиц, обычно несушек с коричневой скорлупой. Чаще всего он поражает кур, но также поражает индеек, диких птиц, цесарок, воробьев, попугаев, кольчатых голубей, страусов и павлинов.Он по-прежнему встречается во всем мире в некоммерческом птицеводстве, но сейчас редко встречается в большинстве коммерческих систем.
Заболеваемость 10-80%; смертность повышается в стадах, подвергающихся стрессу или с ослабленным иммунитетом, и может достигать 100%. Путь заражения - оральный или через пупок / желток. Передача может быть трансовариальной или горизонтальной, в основном у молодых птиц, и иногда может быть связана с каннибализмом. Бактерия довольно устойчива к нормальному климату, живет несколько месяцев, но восприимчива к обычным дезинфицирующим средствам.
Знаки
- Непринятие.
- Депрессия.
- Перья с рюшами.
- Закрытые глаза.
- Громкое чириканье.
- Белый понос.
- Вентиляционная оклейка.
- Задыхаясь.
- Хромота.
Посмертные поражения
- Серые узелки в легких, печени, стенке желудка и сердце.
- Воспаление кишечника или слепой кишки.
- Спленомегалия.
- Сердцевины слепой кишки.
- Кристаллы уратов в мочеточниках.
Диагностика
Изоляция и идентификация. В клинических случаях рекомендуется прямой посев на Brilliant Green, McConkey и неселективный агар. Процедуры обогащения обычно основываются на селенитном бульоне с последующим посевом на селективную среду.
В клинических случаях рекомендуется прямой посев на Brilliant Green, McConkey и неселективный агар. Процедуры обогащения обычно основываются на селенитном бульоне с последующим посевом на селективную среду.
Отличить от брюшного тифа, паратифа, паракобактерий, других энтеробактерий, озноба и омфалита
Лечение
Амоксициллин, потенцированный сульфонамид, тетрацилины, фторхинолоны.
Профилактика
Искоренение от родительских стад. Как и другие сальмонеллы, выздоровевшие птицы устойчивы к воздействию инфекции, но могут оставаться носителями. Вакцины обычно не используются, поскольку они мешают серологическому тестированию и устранению носителей.
Влияние пробиотика на показатели роста, кишечную флору и иммунную функцию цыплят, инфицированных Salmonella pullorum
В этом исследовании изучались эффекты Lactobacillus paracasei KL1 и Lactobacillus plantarum subsp. plantarum Смешанный пробиотик Zhang-LL на Salmonella , вызванном пуллорозом у цыплят. Всего 120 однодневных карликовых птенцов Нонгда № 3 были случайным образом распределены для 4 обработок с 6 повторностями по 5 птиц в каждой. Обработка была пустой группой, Salmonella pullorum - инфицированной группой, пробиотической группой лечения и пробиотической профилактической группой ( PP ). Все птицы (n = 90), за исключением пустой группы, были инфицированы S. pullorum на 4-й день. На 14-й день BW, ADG, смертность, патология ткани, количество колоний слепой кишки, индексы иммунных органов, слизистая слепой кишки. секреторный IgA и цитокины.Результаты показали, что цыплята инфицированы S . pullorum были подавлены, и их BW уменьшилась. Группа PP имела самый высокий ADG и самый низкий уровень смертности (0%), тогда как группа, инфицированная S. pullorum , имела 37,50% смертность и самый низкий ADG. Патологические срезы показали, что в группе лечения пробиотиками были незначительные поражения, но в группе PP не было повреждений в подвздошной кишке, слепой кишке и печени.
Всего 120 однодневных карликовых птенцов Нонгда № 3 были случайным образом распределены для 4 обработок с 6 повторностями по 5 птиц в каждой. Обработка была пустой группой, Salmonella pullorum - инфицированной группой, пробиотической группой лечения и пробиотической профилактической группой ( PP ). Все птицы (n = 90), за исключением пустой группы, были инфицированы S. pullorum на 4-й день. На 14-й день BW, ADG, смертность, патология ткани, количество колоний слепой кишки, индексы иммунных органов, слизистая слепой кишки. секреторный IgA и цитокины.Результаты показали, что цыплята инфицированы S . pullorum были подавлены, и их BW уменьшилась. Группа PP имела самый высокий ADG и самый низкий уровень смертности (0%), тогда как группа, инфицированная S. pullorum , имела 37,50% смертность и самый низкий ADG. Патологические срезы показали, что в группе лечения пробиотиками были незначительные поражения, но в группе PP не было повреждений в подвздошной кишке, слепой кишке и печени. Cecal Количество Lactobacillus было самым высоким ( P <0.05) и Salmonella и Escherichia coli были самыми низкими ( P <0,05) в группе PP; По сравнению с группой, зараженной S. pullorum , индексы тимуса и селезенки в группе лечения пробиотиками увеличились ( P <0,05), но они не были затронуты ( P > 0,05) в бурсе Фабрициуса, тогда как в в группе PP все иммунные органы были увеличены ( P <0,05). Секреторные IgA слизистой оболочки и IL-4 были самыми высокими ( P <0.05), а также фактор некроза опухоли α и гамма-интерферон были самыми низкими ( P <0,05) в группе PP; Таким образом, смешанный пробиотик Lactobacillus KL1 и L. plantarum Zhang-LL эффективно снижал смертность от пуллороза у цыплят, способствовал их росту, регулировал баланс кишечной флоры, улучшал иммунную функцию, сопротивлялся пуллорозу, полностью предотвратил пуллороз цыплят после заражения и снизил экономические потери в птицеводстве.
Cecal Количество Lactobacillus было самым высоким ( P <0.05) и Salmonella и Escherichia coli были самыми низкими ( P <0,05) в группе PP; По сравнению с группой, зараженной S. pullorum , индексы тимуса и селезенки в группе лечения пробиотиками увеличились ( P <0,05), но они не были затронуты ( P > 0,05) в бурсе Фабрициуса, тогда как в в группе PP все иммунные органы были увеличены ( P <0,05). Секреторные IgA слизистой оболочки и IL-4 были самыми высокими ( P <0.05), а также фактор некроза опухоли α и гамма-интерферон были самыми низкими ( P <0,05) в группе PP; Таким образом, смешанный пробиотик Lactobacillus KL1 и L. plantarum Zhang-LL эффективно снижал смертность от пуллороза у цыплят, способствовал их росту, регулировал баланс кишечной флоры, улучшал иммунную функцию, сопротивлялся пуллорозу, полностью предотвратил пуллороз цыплят после заражения и снизил экономические потери в птицеводстве.
Узелки кишечника и суставов - Veterinaria Digital
Поиск
Контент
Все типыНовостиСтатьиБлогиСобытияКомпанииКартинка неделиКорпоративная культура
Категория
Все категорииАнтибиотикиАнтиоксидантыАквакультураДезодорантДижестивыРаспространениеФерментыСобытияУправление фермойЖирыКормлениеВкусИммуностимуляторыМикробиоцидМногофункциональныеМикотоксиныПитаниеПатологияФармакологияКартинкаПтицеводствоЗаготоводство
Тэг
Все TagsAbdominal FatAcidosisActinobacillus suisAdditivesadenoviridaeadenovirusAFIAAflatoxinAflatoxinsAfrica-enAfrican catfishAGP Антибиотик Рост PromotersAgrenaair sacsALAAlquerfeedAlquermold NaturalAlquernat NebsuiAlquernat YuccaAlquernat Zycoxalternative cerealsAmoniacoAMVECAJAnimal здоровье корма feedanimal additivesanimal healthanimal healthanimal и productionAnimal Husbandryanimal productionanimal welfareantibiotic рост promoterantibiotic свободной chickensantibioticsantibodiesAnticoccidial planantioxidantsAntiviotic свободной eggsAPASURAquacultureaquaculture lightingAquaculture productionAquaculture productionArterial hypertensionArtificial InseminationAscitesAsia-enAsociación De Productores Avícolas Sur UruguayAspergillus -enatlasatlas patology'sавтоматические шприцызаводские заболеваниявирусный гриппАвианский гепатитАвианский инфекционный бронхитАвианский инфекционный токсический гепатоэнтеритПтичий инфекционно-токсический гепатоэнтеритПавелийский гриппМикоплазмоз птичьего пулороза птичьего септицемияAw ardsbactericidalbactericidal и fungicidalbacteriostaticbacteriumbacteriumbalanced feedbangkokBangladeshBeef CattleBiogasBiomass и biogasBiosecurityBiotinBiovetBiovet AwardsBiovet SymposiaBirdsblackhead diseaseBone fracturesBovineBovineBovine mastitisBovine губчатой EncephalopathyBovine-enbreedersbreeding sowsBroiler managementBroilersBroilersbroilersbroilersbroodinessbroody hensBSEBursa из Fabriciusbutyratecaecal coccidiacage-freeCagescages для укладки hensCAHEcalciumcalves’ immuneCampylobacterCampylobacter jejuniCampylobacteriosiscandlingcapillariacaptadores де micotoxinascarbon dioxideCarl FluggecatfishCattle farmingCellsCentral Americachemical coccidiostatsChicken breedsChicken eggChickensChileChinaCimenol RingClostridiumClostridium perfringenscobayacobayoCoccidiacoccidicidescoccidiosiscoccidiosiscoccidiostatscochlosomiasisCollaborationColombiacolostrumcommercial утка productionconditioner pronutrientsConditioning свиньи barnconejillo де indiasConferencesCongreso Латиноамериканская о де AviculturaConjuntiva глазное -enControlled environmentcorn pricesCorneal слой gizzardcoronaviruscovid 19cuyeCyanosis earsCystsDairy CattleDecalcificationdeep постельные принадлежности systemDeinococcus radioduransDeodorizerdeoxynivalenolDermatitis синдром свиней nephropathyDermatitis-enDeviated киля услуги boneDiagnosticDiagnostic по imagesdiarrheadiarrhea в calvesdiarrhea в pigsDigestion в fishDigestivedigestive mycosisDigestive Systemdigestive tractdirty eggsdiseaseDisease preventiondisease vectorsdisinfectionDisseminationDuckDuck breedsDuck eggsduck managementDuck meatDUCKSDuodenal foamE. coliEar NecrosisEcuadoreditorialEggEgg DayEgg depigmentationegg layingegg productionegg qualityegg qualityeggs productioneggs transportEggsCargoSystemEggshellEggshell defectsEimeriaEimeria acervulinaEimeria tenellaencephalopathyEndocrine SystemEnergy savingEnteritis вызван жир acidityEnteritis-enEnterobacteriaEnzyme deficiencyEnzymesEP2 ReceptorEquineEscherichia палочка -enEuropeEurotierEuroTier международного lesionfacilities networkeventeventosEventsEvolutionExothermalExpositionEye для layingfairfairFami QSfarmfarm managementfarm ventilationfarmingfarmsFatty liverfeaturedfeedfeedFeedfeed additiveFeed для pigsFeed для poultryFeed для ruminantsfeedingFeverFishfish feedfish productionFishmealFlavoringFlavoringsflufood coloringsFood safetyFood safetyfoot-and Болезнь ротовой полости (ящур) Дерматит подушечек стопы ФормальдегидФормальдегидные ожоги Птичья оспа Рыхлая печеньфунгицидный грибокFusarium-enGangrenous dermatitisgarantía de calidadГаз в цекагастрокнемиусе gyGi-OvoGizzardGlobal LabGoatgoat качество milkgood ветеринара waterGreen yolkgregarine в shrimpGrow-finishgrowth promotersguinea pigguinea pigsGumborogut microbiotahatchabilityheat stresshelminthHemorrhages в основании живота в troutHemorrhages в репродуктивном systemHemorrhagic enteritisHemorrhagic жирных liverHemorrhagic syndromehen productivityHepatic disordersHepatitisHepatoregeneratorsHigh fiberhistomoniasisHydroelectric powerHydrosalpingitisHygiene и disinfectionhygienic-санитарная conditionshyperprolific sowsIBVIICAIleocecal valvesIleusimmune deficiencyImmune SystemImmune systemimmunityImmunoboostersImmunodeficiencyImmunostimulantimmunosuppressive pathogensimportance из цветаинкубацияINDIAN RUNNER DUCKИнфекционный бронхитИнфекционный бронхитИнфекционный бурсалИнфекционный синусит индейкигриппИнфраорбитальные пазухиInmunosupresiónМеждународный научный форум по птицеводствуИнтервью entsintestinal epitheliumIntestinal слизистой conditionersIntestinal слизистой optimizersintestinal noodlesIntestinal optimizerIntestinal Оптимизатор pronutrientsintestinal физиология в откладках яиц processIntestinal villiintestinal welfareIntestineIPPEIPPE 2021IPSFJoint nodulesKHAKI CAMPBELLkidneykidney urateslactationlarval feedingLatin AmericanLatin American Poultry AssociationLawsonia внутриклеточного-enLayerslayers increaselaying henlaying henLesions в kidneylevantelibre де jaulalighting в broilersLighting в домашней птице housesLive Poultry transportLiverliver conditionerLiver кондиционирование pronutrientsLiver regenerationLiver стеатозе в бройлерыМедицинская микологияметанМикробиоцидмикробиотаМикроорганизмыМиграционные птицыМикробиоцидмикробиотаМикроорганизмыМигрирующие птицыМилокмолочное качествоМилозисмозикелезные системы YMusculoskeletal SystemMyco-TalksMycoplasma synoviaeMycoplasma-enmycoplasma-enmycoses в poultrymycosisMycosis в gizzardmycotoxicosisMycotoxin binderMycotoxinsMyopathyNatural additivesNatural preservativenatural preservativesNecrotic enteritisneonatal diarrheanephritisnephropathynephropathy syndromeNewcastleNewcastle diseaseNewsNorth AmericaNutrientsNutritionOIEomphalitisOne HealthOnline Exhibitionoocystsorganic acidsOrganic Productsorganic wastesOrnithobacterium-enOvarian infectionOvaritis infecciosa -enOviductOvineovumOVUM 2024oxidative stressPakistanpalatabilitypandemicpapillomatosisParasite controlParasitesParasitosis-enparvoviruspathogenPathologyPCV 2PEDPEKIN DUCKPenelope albipennisPericarditis-enPeritonitis-enperúpesticidesPetechiaePetsPHOTOPERIODPigPig FarmingPig housingpig productionPiglet handlingpigletspigmentationPigmentspigsPleuritis -enПододерматит-ruПолисерозит Жиры низкого качестваспоросы эпидемический диареяпост после отъемаптицаптицаЭЛОГИЯ ПТИЦЫПтицефабрика FarmningPoultry дом disinfectionpoultry productionPoultryFarmPrebioticspreservativepreservative additivespreservative productsPreservativesprevent mycotoxicosispreventionprobioticsProduct qualityproductionproduction параметры в geeseproductive parametersproductive параметры в отлученных pigletsPromoters минеральных absorptionPronutrientspronutrients optimizersprotein excessProteus -enprotocolPseudomonasPULLETSQS certificateQuality из свинины meatR & DRabbitsRactopamineraw materialsRearing pulletsrecirculation systemsrecríaRenewable energyReproductive помощь techniquesreproductive techniqueResearchResearch и DevelopmentRespiratory SystemRevolving doorsRobert KochRuminantssalmónSalmonellaSalmonellaSalmonellicidesSalmonellosissalmonidssalpingitisSarcoptic scabiesSars-Cov-2sea licesea LicesemenSeminarSepticemia-enshedsheep в milkShigellashrimpshrimpshrimp farmingshrimp производствоСиликоглицидолКалькулятор силикоглицидолаСимпозиумСимпозиум БиоветсинацеСинусит-оспаЯйца с мягкой скорлупойТак лар energySouth АмерикаЮжная AsiaSoutheast AsiasowsstallionsteatosisStomachStress preventionSub Сахары Africasustainable aquacultureSwineswine feverswine синдром fluSwine influenzaSwine Productionswine reproductionSwine Salmonellosisswollen головы в poultrySymposiaTechnical conferenceTechnical visitstechnonewstendonitisthe liverThigh fattilapiatilapia farmingtilapia productiontoolToxicity от sorghumtoxicologyToxinsTraining sessiontransporttrichothecenesTurkeyTurkeysTyphlitisUnited StatesUrates в heartUSPOULTRYvaccinationVaccinationsvaccine immunityVaccinesvectamVegetablesventilationveterinarian magazineVeterinaryVeterinary equipmentVeterinary EthnologyVeterinary experiencesVIDEOCONFERENCIASviral diseaseViral энтерита де ducksViral гепатита от 2020water duckvirusVitaminsvitellusvivVIV QingdaoVIV Циндао качество отлученияБелая мышцаWilliam FarWind poweryolk color Желток без впитываниязараленон оксид цинказооноз
coliEar NecrosisEcuadoreditorialEggEgg DayEgg depigmentationegg layingegg productionegg qualityegg qualityeggs productioneggs transportEggsCargoSystemEggshellEggshell defectsEimeriaEimeria acervulinaEimeria tenellaencephalopathyEndocrine SystemEnergy savingEnteritis вызван жир acidityEnteritis-enEnterobacteriaEnzyme deficiencyEnzymesEP2 ReceptorEquineEscherichia палочка -enEuropeEurotierEuroTier международного lesionfacilities networkeventeventosEventsEvolutionExothermalExpositionEye для layingfairfairFami QSfarmfarm managementfarm ventilationfarmingfarmsFatty liverfeaturedfeedfeedFeedfeed additiveFeed для pigsFeed для poultryFeed для ruminantsfeedingFeverFishfish feedfish productionFishmealFlavoringFlavoringsflufood coloringsFood safetyFood safetyfoot-and Болезнь ротовой полости (ящур) Дерматит подушечек стопы ФормальдегидФормальдегидные ожоги Птичья оспа Рыхлая печеньфунгицидный грибокFusarium-enGangrenous dermatitisgarantía de calidadГаз в цекагастрокнемиусе gyGi-OvoGizzardGlobal LabGoatgoat качество milkgood ветеринара waterGreen yolkgregarine в shrimpGrow-finishgrowth promotersguinea pigguinea pigsGumborogut microbiotahatchabilityheat stresshelminthHemorrhages в основании живота в troutHemorrhages в репродуктивном systemHemorrhagic enteritisHemorrhagic жирных liverHemorrhagic syndromehen productivityHepatic disordersHepatitisHepatoregeneratorsHigh fiberhistomoniasisHydroelectric powerHydrosalpingitisHygiene и disinfectionhygienic-санитарная conditionshyperprolific sowsIBVIICAIleocecal valvesIleusimmune deficiencyImmune SystemImmune systemimmunityImmunoboostersImmunodeficiencyImmunostimulantimmunosuppressive pathogensimportance из цветаинкубацияINDIAN RUNNER DUCKИнфекционный бронхитИнфекционный бронхитИнфекционный бурсалИнфекционный синусит индейкигриппИнфраорбитальные пазухиInmunosupresiónМеждународный научный форум по птицеводствуИнтервью entsintestinal epitheliumIntestinal слизистой conditionersIntestinal слизистой optimizersintestinal noodlesIntestinal optimizerIntestinal Оптимизатор pronutrientsintestinal физиология в откладках яиц processIntestinal villiintestinal welfareIntestineIPPEIPPE 2021IPSFJoint nodulesKHAKI CAMPBELLkidneykidney urateslactationlarval feedingLatin AmericanLatin American Poultry AssociationLawsonia внутриклеточного-enLayerslayers increaselaying henlaying henLesions в kidneylevantelibre де jaulalighting в broilersLighting в домашней птице housesLive Poultry transportLiverliver conditionerLiver кондиционирование pronutrientsLiver regenerationLiver стеатозе в бройлерыМедицинская микологияметанМикробиоцидмикробиотаМикроорганизмыМиграционные птицыМикробиоцидмикробиотаМикроорганизмыМигрирующие птицыМилокмолочное качествоМилозисмозикелезные системы YMusculoskeletal SystemMyco-TalksMycoplasma synoviaeMycoplasma-enmycoplasma-enmycoses в poultrymycosisMycosis в gizzardmycotoxicosisMycotoxin binderMycotoxinsMyopathyNatural additivesNatural preservativenatural preservativesNecrotic enteritisneonatal diarrheanephritisnephropathynephropathy syndromeNewcastleNewcastle diseaseNewsNorth AmericaNutrientsNutritionOIEomphalitisOne HealthOnline Exhibitionoocystsorganic acidsOrganic Productsorganic wastesOrnithobacterium-enOvarian infectionOvaritis infecciosa -enOviductOvineovumOVUM 2024oxidative stressPakistanpalatabilitypandemicpapillomatosisParasite controlParasitesParasitosis-enparvoviruspathogenPathologyPCV 2PEDPEKIN DUCKPenelope albipennisPericarditis-enPeritonitis-enperúpesticidesPetechiaePetsPHOTOPERIODPigPig FarmingPig housingpig productionPiglet handlingpigletspigmentationPigmentspigsPleuritis -enПододерматит-ruПолисерозит Жиры низкого качестваспоросы эпидемический диареяпост после отъемаптицаптицаЭЛОГИЯ ПТИЦЫПтицефабрика FarmningPoultry дом disinfectionpoultry productionPoultryFarmPrebioticspreservativepreservative additivespreservative productsPreservativesprevent mycotoxicosispreventionprobioticsProduct qualityproductionproduction параметры в geeseproductive parametersproductive параметры в отлученных pigletsPromoters минеральных absorptionPronutrientspronutrients optimizersprotein excessProteus -enprotocolPseudomonasPULLETSQS certificateQuality из свинины meatR & DRabbitsRactopamineraw materialsRearing pulletsrecirculation systemsrecríaRenewable energyReproductive помощь techniquesreproductive techniqueResearchResearch и DevelopmentRespiratory SystemRevolving doorsRobert KochRuminantssalmónSalmonellaSalmonellaSalmonellicidesSalmonellosissalmonidssalpingitisSarcoptic scabiesSars-Cov-2sea licesea LicesemenSeminarSepticemia-enshedsheep в milkShigellashrimpshrimpshrimp farmingshrimp производствоСиликоглицидолКалькулятор силикоглицидолаСимпозиумСимпозиум БиоветсинацеСинусит-оспаЯйца с мягкой скорлупойТак лар energySouth АмерикаЮжная AsiaSoutheast AsiasowsstallionsteatosisStomachStress preventionSub Сахары Africasustainable aquacultureSwineswine feverswine синдром fluSwine influenzaSwine Productionswine reproductionSwine Salmonellosisswollen головы в poultrySymposiaTechnical conferenceTechnical visitstechnonewstendonitisthe liverThigh fattilapiatilapia farmingtilapia productiontoolToxicity от sorghumtoxicologyToxinsTraining sessiontransporttrichothecenesTurkeyTurkeysTyphlitisUnited StatesUrates в heartUSPOULTRYvaccinationVaccinationsvaccine immunityVaccinesvectamVegetablesventilationveterinarian magazineVeterinaryVeterinary equipmentVeterinary EthnologyVeterinary experiencesVIDEOCONFERENCIASviral diseaseViral энтерита де ducksViral гепатита от 2020water duckvirusVitaminsvitellusvivVIV QingdaoVIV Циндао качество отлученияБелая мышцаWilliam FarWind poweryolk color Желток без впитываниязараленон оксид цинказооноз
Дата начала
Дата окончания
Автор
Все авторыDr. Марко А. Эрнандес Экайц МагурегиДр. Оскар Ф. Уэртас АльваDr. Эстефания МесаДр. Мартин КероДр. Germán BertschDr. Антон Таллерольдо. Альберт КуртоДра. Мария СорианоДра. Джудит Плаза АльмольдаДра. Mª de Àngels Calvo TorrasAndritraIng. Херардо Майораль ГарсияDr. Христос Цадилас Колапо АджувонД-р. Lluis Pons AngladaScientiae Doctor Manuel RosembergLda. Marta DompabloDra. Эльвира КаноДр. Дэвид Диес АриасPronutrientesDra. Ноэми ЛоренцоПроф. Рафаэль Мухериего Дра. Кристина ЛатасаPlantas naturalesAromasDr.Хуан Сабатер Тобелла Дра. Адриана Сиурана МаринаЛдо. Фернандо Р. ФейхтерVDTechnonews VDDra Evangelina ZárateLda. Мария СабатеRedactorDe res Agricolae (Columel·la) TucídidesVeterinaria DigitalDr. Хайме Боррелл ВаллсМед. Вет. Лилиан Чеа СотоДр. Карлос КуэнкаДра. Лилиана РеволледоПроф. Энрике Эрнандес Амир Х. Нилипур, доктор философии Антонио Пратс ЭстевеDr. Франсеск Монне I OrgaDra. Сара Боррелл Энцо РодригесMVZ Габриэль Руис КастаньедаДра Ана Магдалена МаркулескуДра. Сиао Ву Хосе Диас Р., Исабель Кога Й, Даниэль Фернандес Т.
Марко А. Эрнандес Экайц МагурегиДр. Оскар Ф. Уэртас АльваDr. Эстефания МесаДр. Мартин КероДр. Germán BertschDr. Антон Таллерольдо. Альберт КуртоДра. Мария СорианоДра. Джудит Плаза АльмольдаДра. Mª de Àngels Calvo TorrasAndritraIng. Херардо Майораль ГарсияDr. Христос Цадилас Колапо АджувонД-р. Lluis Pons AngladaScientiae Doctor Manuel RosembergLda. Marta DompabloDra. Эльвира КаноДр. Дэвид Диес АриасPronutrientesDra. Ноэми ЛоренцоПроф. Рафаэль Мухериего Дра. Кристина ЛатасаPlantas naturalesAromasDr.Хуан Сабатер Тобелла Дра. Адриана Сиурана МаринаЛдо. Фернандо Р. ФейхтерVDTechnonews VDDra Evangelina ZárateLda. Мария СабатеRedactorDe res Agricolae (Columel·la) TucídidesVeterinaria DigitalDr. Хайме Боррелл ВаллсМед. Вет. Лилиан Чеа СотоДр. Карлос КуэнкаДра. Лилиана РеволледоПроф. Энрике Эрнандес Амир Х. Нилипур, доктор философии Антонио Пратс ЭстевеDr. Франсеск Монне I OrgaDra. Сара Боррелл Энцо РодригесMVZ Габриэль Руис КастаньедаДра Ана Магдалена МаркулескуДра. Сиао Ву Хосе Диас Р., Исабель Кога Й, Даниэль Фернандес Т. , Арнальдо Альварадо С., Роберт Тиноко Р. и Фернандо де ла Крус С. Мед. Вет. Хосеп СендраДр. Роберто Хименес Торрес, доктор Ренан Медина Доменсайн, доктор Габриэль Руис Кастаньеда, дра. Марта Эльба Гутьеррес Варгас Эдуард Торрес Josep Llupià i MasDr. Ермаков Вадим Васильевич Тенгиз Ф. Урушадзе Хоаким Бруфау и Де Барбера Альберт Сан Габриэль Питер С. Доэрти Артуро Анадон НаварроД-р. Джоан Ногареда i GifreDr. Даниэль БаботДр. Виктор Хьюго Санчо Варгас (Víctor Hugo Sancho VargasMateu Torrent i MollevíDr. Рикардо М. Алесон, Энрик Эстев-Гарсия и Ньевес КреспоХосе Марин Санчес Мурильо, доктор Франсиско Хосе Родригес-Армихо Шардоннер, доктор Хосе Мария Гомес-Ньевес Родригес дель Кастильо Эдгар Санчес ПухальсДра. Памела Пенья и Лилло ГаданДра. Анна ТесуроДр. Виктор Угуэ, Энцо Родригес Ортега, Дра Нурия Мартин Гайрал, Lda. Анна ФариньясДр. Spadoni, E .; Д-р Ван ден Бош, С .; Доктор Родригес, G .; Доктор Таккини, Ф .; Д-р Савьетто, M.MV. Júlia Pié OrpíNatia CheminavaDra. Альба Видаль-Лурдес де лас Эрас АлегретДра.
, Арнальдо Альварадо С., Роберт Тиноко Р. и Фернандо де ла Крус С. Мед. Вет. Хосеп СендраДр. Роберто Хименес Торрес, доктор Ренан Медина Доменсайн, доктор Габриэль Руис Кастаньеда, дра. Марта Эльба Гутьеррес Варгас Эдуард Торрес Josep Llupià i MasDr. Ермаков Вадим Васильевич Тенгиз Ф. Урушадзе Хоаким Бруфау и Де Барбера Альберт Сан Габриэль Питер С. Доэрти Артуро Анадон НаварроД-р. Джоан Ногареда i GifreDr. Даниэль БаботДр. Виктор Хьюго Санчо Варгас (Víctor Hugo Sancho VargasMateu Torrent i MollevíDr. Рикардо М. Алесон, Энрик Эстев-Гарсия и Ньевес КреспоХосе Марин Санчес Мурильо, доктор Франсиско Хосе Родригес-Армихо Шардоннер, доктор Хосе Мария Гомес-Ньевес Родригес дель Кастильо Эдгар Санчес ПухальсДра. Памела Пенья и Лилло ГаданДра. Анна ТесуроДр. Виктор Угуэ, Энцо Родригес Ортега, Дра Нурия Мартин Гайрал, Lda. Анна ФариньясДр. Spadoni, E .; Д-р Ван ден Бош, С .; Доктор Родригес, G .; Доктор Таккини, Ф .; Д-р Савьетто, M.MV. Júlia Pié OrpíNatia CheminavaDra. Альба Видаль-Лурдес де лас Эрас АлегретДра. Мария СорианоЭдди ОтаолаНеизвестноДра. Лаура Ройдж Франсиско ЛопоХосе Хавьер ЛатасаЛда. Marta DompabloDr. Альфонсо СобальварроДр. Дэвид Диес АриасМед. Вет. Evangelina ZarateDra. Эльвира КаноЛда. Нурия Алкобер Сантьяго ЯпураVeterinaria DigitalLda. Соня Марзодра. Natividad CasasMed. Вет. Лилиан Чеа СотоДр. Ферран Боррас Цао ХунвэйЛдо. Миндаль Марцо БалдовиноДра. Siao WuDr. Пебло ТигрисДр. Карлос Доменек Эдуард Торрес Мигель Анхель АльгомедаДра. Анна ТесуроДр. Хосеп СендраДра. Эстефания Ф. Ребулль Нарцис КсатрухД-р. Hugo PatiñoLda. Anna FariñasLda. Celia MosteiroDra.Сарка Колачкова де МендезЛдо. Эдгар СанчесЛда. Natia CheminavaLda. Мария СабатеДра. Эстефания МесаДр. Альфредо Родригес Хайме Боррелл ВаллсЛдо. Энцо РодригесДра. Сара Боррелл Владимир де ла Мора, Сун Цу, Ямамото Цунэтомо, Хилари Хинтон, Зиглар, Генри Чесбро, Шинмен Мусаси, Хуан Хосе Арета, Марк Хантер, Уоррен Беннис, Либре, "De los 7 Principios de Ayurveda" publicado el siglo XX ACPascal Tellier, Крис Чемберсли, Винсент Ван Гог, Дж.
Мария СорианоЭдди ОтаолаНеизвестноДра. Лаура Ройдж Франсиско ЛопоХосе Хавьер ЛатасаЛда. Marta DompabloDr. Альфонсо СобальварроДр. Дэвид Диес АриасМед. Вет. Evangelina ZarateDra. Эльвира КаноЛда. Нурия Алкобер Сантьяго ЯпураVeterinaria DigitalLda. Соня Марзодра. Natividad CasasMed. Вет. Лилиан Чеа СотоДр. Ферран Боррас Цао ХунвэйЛдо. Миндаль Марцо БалдовиноДра. Siao WuDr. Пебло ТигрисДр. Карлос Доменек Эдуард Торрес Мигель Анхель АльгомедаДра. Анна ТесуроДр. Хосеп СендраДра. Эстефания Ф. Ребулль Нарцис КсатрухД-р. Hugo PatiñoLda. Anna FariñasLda. Celia MosteiroDra.Сарка Колачкова де МендезЛдо. Эдгар СанчесЛда. Natia CheminavaLda. Мария СабатеДра. Эстефания МесаДр. Альфредо Родригес Хайме Боррелл ВаллсЛдо. Энцо РодригесДра. Сара Боррелл Владимир де ла Мора, Сун Цу, Ямамото Цунэтомо, Хилари Хинтон, Зиглар, Генри Чесбро, Шинмен Мусаси, Хуан Хосе Арета, Марк Хантер, Уоррен Беннис, Либре, "De los 7 Principios de Ayurveda" publicado el siglo XX ACPascal Tellier, Крис Чемберсли, Винсент Ван Гог, Дж. Эйзенхауэр, Ноэль Кларасо и Серрат, Эмиль-Август Шартье, Лео Бернет, Уистон Черчилль, Жан Жак Переннес (Бретанья, 1948-), Стивен Р. Кови (Солт-Лейк-Сити, 24 октября 1932 г. - Айдахо-Фолс, 16 июля 2012 г.), Джеймс Дональд Уолтерс (19 мая 1926 г., Азуга, Румыния, 2013 г. - Азуга, 21 апреля 2013 г.) Италия) Маттиас Гирке (Берлин, 1954-) Стив Бэкли (12 февраля 1969) Джеймс Хантер (Детройт, 1955) Лю Цун-Юань (773-819) Эстебан Ривера Ортис, Veterinaria Digital, Фридрих Ницше, Рабиндранат Тагор, Сальвадор Пэсприу (1913-1985), Сальвадор Эсприу (1913-1985) Xativa 1940) Миямото Мусаси Лао Цесун Бин (450-316 гг.ec) Marco Aurelio (Roma 121 - Vindobona 180) Marco Tullius CiceroArthur Conan Doyle (Edimburgo, 22 мая 1859 г. - Crowborough, 7 июля 1930 г.) Конрад Лоренц Люсио Корнелио Сила (Roma 616 - 676 ab urbe condita) Гектор Роберту "Атауальпа Юпанки" Арчи Эдмистон Рой, профессор Кристоф Редис, Университет Йены Анонимно Йибран Дж. Гибран Леонардо да Винчи Джон Бурдон Сандерсон Халдейн (Оксфорд 1892 - Бхубанесвар 1964) Демостенес Робертон Эндрюс, 1904 г.
Эйзенхауэр, Ноэль Кларасо и Серрат, Эмиль-Август Шартье, Лео Бернет, Уистон Черчилль, Жан Жак Переннес (Бретанья, 1948-), Стивен Р. Кови (Солт-Лейк-Сити, 24 октября 1932 г. - Айдахо-Фолс, 16 июля 2012 г.), Джеймс Дональд Уолтерс (19 мая 1926 г., Азуга, Румыния, 2013 г. - Азуга, 21 апреля 2013 г.) Италия) Маттиас Гирке (Берлин, 1954-) Стив Бэкли (12 февраля 1969) Джеймс Хантер (Детройт, 1955) Лю Цун-Юань (773-819) Эстебан Ривера Ортис, Veterinaria Digital, Фридрих Ницше, Рабиндранат Тагор, Сальвадор Пэсприу (1913-1985), Сальвадор Эсприу (1913-1985) Xativa 1940) Миямото Мусаси Лао Цесун Бин (450-316 гг.ec) Marco Aurelio (Roma 121 - Vindobona 180) Marco Tullius CiceroArthur Conan Doyle (Edimburgo, 22 мая 1859 г. - Crowborough, 7 июля 1930 г.) Конрад Лоренц Люсио Корнелио Сила (Roma 616 - 676 ab urbe condita) Гектор Роберту "Атауальпа Юпанки" Арчи Эдмистон Рой, профессор Кристоф Редис, Университет Йены Анонимно Йибран Дж. Гибран Леонардо да Винчи Джон Бурдон Сандерсон Халдейн (Оксфорд 1892 - Бхубанесвар 1964) Демостенес Робертон Эндрюс, 1904 г. , Мюлфориг, Сэрвэн-Йорк, Мартес, 1967, Мартес, Мартес, 16 (1547 - 1616) Артур Хелпс (Стритэм, 10 июля 1813 г. и Лондон, 7 марта 1875 г.) Клод Бернар (Сен-Жюльен-сюр-Рон 1813 г. - Париж 1878 г.) Мариано Хосе де Ларра (Мадрид, 24 марта 1809 г., Мадрид, 13 февраля 1837 г.) HesiodoJ .Р.Р. Толкин, Дональд Портер (1953) Пол ди Модика, Стивен Ричардс Кови (Солт-Лейк-Сити, 24.10.1932 - Айдахо-Фолс, 16.07.2012) Нанду Джубани (Монистроль де Колдерс, 19.01.1971) Северо-Очоа (Луарка, 24.09.1905) - Мадрид 01.11.1993) Видал Сасун (Лондон 17.01.1928 - Лос-Анджелес 05.09.2012) Рабиндранат Тагор (Калькута, 7 мая 1861 г. и расчет 7 августа 1941 г.) Питер Фердинанд Друкер (Вена, 19.11.1909 г.) Клермонт 11/11/2005) Ферри Джозефон (Кардифф 1940) ТЕРМИНОС Рене Декарт (Ла-Хэй 31.03.1596 г. Стокгольм 11.02.1650) Генри Форд (Гринфилд 30.06.1863 г. Фэйр-лейн 07.04.1947) Антуан де Сент-Экзюпери (Лион, 29 июня 1900 г., Исла-де-Рио, 31 июля 1944 г.) Энди Таршис Филип Котлер (Чикаго, 27 мая 1931 г.) Филип Котлер (Чикаго, 27 мая 1931 г.
, Мюлфориг, Сэрвэн-Йорк, Мартес, 1967, Мартес, Мартес, 16 (1547 - 1616) Артур Хелпс (Стритэм, 10 июля 1813 г. и Лондон, 7 марта 1875 г.) Клод Бернар (Сен-Жюльен-сюр-Рон 1813 г. - Париж 1878 г.) Мариано Хосе де Ларра (Мадрид, 24 марта 1809 г., Мадрид, 13 февраля 1837 г.) HesiodoJ .Р.Р. Толкин, Дональд Портер (1953) Пол ди Модика, Стивен Ричардс Кови (Солт-Лейк-Сити, 24.10.1932 - Айдахо-Фолс, 16.07.2012) Нанду Джубани (Монистроль де Колдерс, 19.01.1971) Северо-Очоа (Луарка, 24.09.1905) - Мадрид 01.11.1993) Видал Сасун (Лондон 17.01.1928 - Лос-Анджелес 05.09.2012) Рабиндранат Тагор (Калькута, 7 мая 1861 г. и расчет 7 августа 1941 г.) Питер Фердинанд Друкер (Вена, 19.11.1909 г.) Клермонт 11/11/2005) Ферри Джозефон (Кардифф 1940) ТЕРМИНОС Рене Декарт (Ла-Хэй 31.03.1596 г. Стокгольм 11.02.1650) Генри Форд (Гринфилд 30.06.1863 г. Фэйр-лейн 07.04.1947) Антуан де Сент-Экзюпери (Лион, 29 июня 1900 г., Исла-де-Рио, 31 июля 1944 г.) Энди Таршис Филип Котлер (Чикаго, 27 мая 1931 г.) Филип Котлер (Чикаго, 27 мая 1931 г. ) Марк МакКормак (Чикаго, 6 ноября / ноября 1930 г. - Нью-Йорк 16 мая / 2003) Филип Дуглас Джексон ((Deer Lodge, 17 сентября 1945 г.) Бенджамин Франклин (Бостон 17.01.1706 - Филадельфия 17.04.1790) Сэмюэл К.К. Тинг (Мичиган, 27 января 1936 г.) Премия Нобелевской премии в области медицины в 1976 г. Самуэль К. Тинг (Мичиган, 27 января 1936 г.) Премия Нобелевской премии в области экономики в 1976 г. Мануэль Мартин Ферран (Ла-Кору? 11 декабря 1940 г. - Мадрид 30 августа 2013 г.) Марк МакКормак (Иллинойс, 6 ноября 1930 г. - Нью-Йорк, 16 мая 2003 г.) Проф. . Д-р Диего Джордано (Кордова, 6 ноября 1918 г. - Кордова, 11 февраля 2002 г.) Альберт Сент-Дьордьи, Премия Нобелевской премии по физиологии 1937 г. (Будапешт, 16 сентября 1893 г. - Массачусетс, 22 октября 1986 г.) Марк МакКормак (Иллинойс, 6 ноября 1930 г. - Нью-Йорк, 16 мая 2003 г.) ) Алан Кертис Кей (Спрингфилд, 17 мая 1940)
) Марк МакКормак (Чикаго, 6 ноября / ноября 1930 г. - Нью-Йорк 16 мая / 2003) Филип Дуглас Джексон ((Deer Lodge, 17 сентября 1945 г.) Бенджамин Франклин (Бостон 17.01.1706 - Филадельфия 17.04.1790) Сэмюэл К.К. Тинг (Мичиган, 27 января 1936 г.) Премия Нобелевской премии в области медицины в 1976 г. Самуэль К. Тинг (Мичиган, 27 января 1936 г.) Премия Нобелевской премии в области экономики в 1976 г. Мануэль Мартин Ферран (Ла-Кору? 11 декабря 1940 г. - Мадрид 30 августа 2013 г.) Марк МакКормак (Иллинойс, 6 ноября 1930 г. - Нью-Йорк, 16 мая 2003 г.) Проф. . Д-р Диего Джордано (Кордова, 6 ноября 1918 г. - Кордова, 11 февраля 2002 г.) Альберт Сент-Дьордьи, Премия Нобелевской премии по физиологии 1937 г. (Будапешт, 16 сентября 1893 г. - Массачусетс, 22 октября 1986 г.) Марк МакКормак (Иллинойс, 6 ноября 1930 г. - Нью-Йорк, 16 мая 2003 г.) ) Алан Кертис Кей (Спрингфилд, 17 мая 1940)
Быстрое обнаружение Salmonella pullorum на месте на основе анализа нуклеиновых кислот в боковом потоке в сочетании с реакцией амплификации рекомбиназной полимеразы
Реферат
Вызываемый Salmonella pullorum , пуллороз является бактериальным заболеванием, угрожающим птицеводческой промышленности, и был внесен в список бактериальных заболеваний. болезнь должна быть устранена правительством.Однако лечение пуллороза антибиотиками становится все труднее, что серьезно влияет на устойчивое развитие птицеводства. Злоупотребление антибиотиками может вызвать глобальные проблемы лекарственной устойчивости. Следовательно, срочно необходима ранняя диагностика молодых цыплят и точное лечение больных цыплят. Традиционное серотипирование для обнаружения Salmonella является дорогостоящим и трудоемким, в то время как другие широко используемые методы тестирования агглютинации на чашках часто приводят к физическим повреждениям цыплят.Следовательно, метод быстрого и безопасного обнаружения имеет большое значение для ранней диагностики, что является ключевым шагом в точном лечении и устранении пуллороза. В этом исследовании мы предлагаем новую систему анализа нуклеиновых кислот с боковым потоком ( LFNAA ), сочетающую амплификацию рекомбиназной полимеразы ( RPA ) для обнаружения S. pullorum .
болезнь должна быть устранена правительством.Однако лечение пуллороза антибиотиками становится все труднее, что серьезно влияет на устойчивое развитие птицеводства. Злоупотребление антибиотиками может вызвать глобальные проблемы лекарственной устойчивости. Следовательно, срочно необходима ранняя диагностика молодых цыплят и точное лечение больных цыплят. Традиционное серотипирование для обнаружения Salmonella является дорогостоящим и трудоемким, в то время как другие широко используемые методы тестирования агглютинации на чашках часто приводят к физическим повреждениям цыплят.Следовательно, метод быстрого и безопасного обнаружения имеет большое значение для ранней диагностики, что является ключевым шагом в точном лечении и устранении пуллороза. В этом исследовании мы предлагаем новую систему анализа нуклеиновых кислот с боковым потоком ( LFNAA ), сочетающую амплификацию рекомбиназной полимеразы ( RPA ) для обнаружения S. pullorum . В этом методе ДНК штаммов S. pullorum быстро амплифицировали с помощью RPA при температуре 37 ° C, а затем продукты RPA добавляли на подушку для образца LFNAA до тех пор, пока конечные результаты не наблюдались невооруженным глазом в течение 3 минут.Предлагаемый анализ является быстрым и дает видимые невооруженным глазом результаты в полевых испытаниях. Предел обнаружения геномной ДНК составил 5 × 10 -3 нг / мкл, что указывает на высокую чувствительность. Кроме того, предлагаемая система LFNAA является рентабельной, эффективной и не причиняет вреда цыплятам во время полевых испытаний. Эта система обеспечивает техническую поддержку для ранней диагностики S. pullorum у домашней птицы и открывает путь для точной медицины будущего, позволяющей избежать глобальных проблем с лекарственной устойчивостью.
В этом методе ДНК штаммов S. pullorum быстро амплифицировали с помощью RPA при температуре 37 ° C, а затем продукты RPA добавляли на подушку для образца LFNAA до тех пор, пока конечные результаты не наблюдались невооруженным глазом в течение 3 минут.Предлагаемый анализ является быстрым и дает видимые невооруженным глазом результаты в полевых испытаниях. Предел обнаружения геномной ДНК составил 5 × 10 -3 нг / мкл, что указывает на высокую чувствительность. Кроме того, предлагаемая система LFNAA является рентабельной, эффективной и не причиняет вреда цыплятам во время полевых испытаний. Эта система обеспечивает техническую поддержку для ранней диагностики S. pullorum у домашней птицы и открывает путь для точной медицины будущего, позволяющей избежать глобальных проблем с лекарственной устойчивостью.
Ключевые слова
амплификация рекомбиназной полимеразы (RPA)
Анализ нуклеиновых кислот в боковом потоке (LFNAA)
Salmonella pullorum ( S. pullorum )
pullorum )
ранняя диагностика
Рекомендуемые статьи Цитирующие статьи (0)
© 2020 Опубликовано Elsevier Inc. от имени Poultry Science Association Inc.
Рекомендуемые статьи
Цитирующие статьи
(PDF) Влияние пробиотиков на показатели роста, кишечная флора и иммунная функция цыплят, инфицированных Salmonella pullorum
21
моделей и функций хелперных Т-клеток. Adv. Иммунол. 46: 111–147.
437
Маунтзурис, К. К., П. Цирцикос, Э. Каламара, С. Нитч, Г. Шацмайр и К.
438
Фегерос. 2007. Оценка эффективности пробиотика, содержащего штаммы Lactobacillus,
439
Bifidobacterium, Enterococcus и Pediococcus, в повышении производительности бройлеров
440
и модуляции состава и метаболической активности слепой кишки
441
441
441
441
441
441 слепой микрофлоры.Пульт. Sci. 86: 309–317.
442
Mookiah, S. , C.C.Sieo, K. Ramasamy, N. Abdullah, and Y. W. Ho. 2014. Влияние
, C.C.Sieo, K. Ramasamy, N. Abdullah, and Y. W. Ho. 2014. Влияние
443
диетических пребиотиков, пробиотиков и синбиотиков на продуктивность, бактерии слепой кишки
444
популяции и концентрации бройлеров в слепой кишке. J. Sci.
445
Продовольствие, сельское хозяйство. 94: 341–348.
446
Олнуд, К. Г., С. С. Бески, М. Чокт и П.А. Иджи. 2015. Использование Lactobacillus
447
johnsonii у бройлеров, зараженных Salmonella sofia. Anim. Nutr. 1: 203–212.
448
Пань, З. М., X. Q. Ван, X. М. Чжан, С. З. Гэн, X. Чен, В. Дж. Пан, К. X. Конг, X.
449
X. Лю, X. Н. Цзяо и X. Ф. Лю. 2009. Изменения устойчивости к противомикробным препаратам
450
среди изолятов Salmonella enterica подвидов enterica серовара Pullorum в
451
Китае с 1962 по 2007 год.Вет. Microbiol. 136: 387–392.
452
Пэн, К., Х. Ф. Цзэн, Дж. Л. Чжу, С. Ван, Х. Т. Лю, К. Л. Хоу, П. А. Такер и С. Ю.
А. Такер и С. Ю.
453
Цяо. 2016. Влияние диеты Lactobacillus plantarum B1 на рост
454
продуктивность, кишечную микробиоту и профили короткоцепочечных жирных кислот у цыплят-бройлеров
455
цыплят. Пульт. Sci. 95: 893–900.
456
Ривас, А. Л. и Дж. Фабрикант, 1988.Признаки иммунодепрессии у кур
457
инфицированных различными штаммами вируса болезни Марека. Птичий дис.1–8.
458
Границы | Безопасность, защитный иммунитет и способность DIVA вакцины-кандидата от грубого мутанта Salmonella Pullorum у бройлеров
Введение
Инфекционные бактерии домашней птицы Salmonella enterica subsp. enterica можно разделить на две широкие группы сероваров на основе патогенеза и биологии инфекции (EFSA, 2004).Одна группа, содержащая серовар Gallinarum biovars Pullorum и Gallinarum, вызывает тяжелое системное брюшноподобное заболевание у ограниченного круга хозяев (Barrow and Freitas Neto, 2011). Другая группа, содержащая серовар Enteritidis, вызывает желудочно-кишечные заболевания у широкого круга хозяев, включая человека. Salmonella Pullorum хорошо адаптирован к молодым цыплятам в возрасте до 3 недель и приводит к острым системным заболеваниям и высокой смертности. Во многих развивающихся странах инфекции Salmonella Pullorum среди домашней птицы являются обычным явлением, и пуллорум остается основной угрозой для птицеводства (Guo et al., 2016). Salmonella Enteritidis является причиной пандемии пищевого сальмонеллеза среди людей, отчасти потому, что он обладает уникальной способностью заражать продукты из птицы, не вызывая заметных заболеваний у инфицированных птиц (Guard-Petter, 2001). Следовательно, существует потребность в методах, которые защищают бройлеров от дня вылупления до убойного возраста от заражения Salmonella Pullorum, а также снижают заражение пищевым серотипом Salmonella Enteritidis.
Другая группа, содержащая серовар Enteritidis, вызывает желудочно-кишечные заболевания у широкого круга хозяев, включая человека. Salmonella Pullorum хорошо адаптирован к молодым цыплятам в возрасте до 3 недель и приводит к острым системным заболеваниям и высокой смертности. Во многих развивающихся странах инфекции Salmonella Pullorum среди домашней птицы являются обычным явлением, и пуллорум остается основной угрозой для птицеводства (Guo et al., 2016). Salmonella Enteritidis является причиной пандемии пищевого сальмонеллеза среди людей, отчасти потому, что он обладает уникальной способностью заражать продукты из птицы, не вызывая заметных заболеваний у инфицированных птиц (Guard-Petter, 2001). Следовательно, существует потребность в методах, которые защищают бройлеров от дня вылупления до убойного возраста от заражения Salmonella Pullorum, а также снижают заражение пищевым серотипом Salmonella Enteritidis.
Вакцинация цыплят открыла многообещающее будущее, и продолжается прогресс в разработке безопасной и эффективной вакцины против Salmonella , которая обеспечивает широкую перекрестную защиту для улучшения здоровья животных и безопасности пищевых продуктов (Heithoff et al. , 2015). Salmonella Pullorum, вероятно, удастся уничтожить у домашней птицы исключительно с помощью метода испытаний и убоя для борьбы с болезнями (Всемирная организация здравоохранения животных [OIE], 2008). Серодиагностика пуллороза обычно основана на обнаружении антител к липополисахаридам Salmonella (LPS) с помощью макроскопического теста агглютинации пробирки, теста быстрой агглютинации сыворотки (SPA), теста цельной крови на окрашенный антиген или микро- тест агглютинации (Шивапрасад, 2000).В связи с тем, что племенные стада проходят скрининг на специфические сывороточные антитела против Salmonella LPS с использованием теста SPA (Gast, 1997), антитела, вырабатываемые после вакцинации, неотличимы от антител, вырабатываемых в ответ на инфекцию Salmonella Pullorum дикого типа. Основная цель при разработке идеальной вакцины состоит в том, чтобы она не мешала программе мониторинга сальмонеллеза. Концепция вакцин DIVA, основанная на отсутствии в вакцине по крайней мере одного иммуногенного белка или антигена, но присутствующего в штамме дикого типа, уже была предложена для коммерческого использования в ветеринарии (Selke et al.
, 2015). Salmonella Pullorum, вероятно, удастся уничтожить у домашней птицы исключительно с помощью метода испытаний и убоя для борьбы с болезнями (Всемирная организация здравоохранения животных [OIE], 2008). Серодиагностика пуллороза обычно основана на обнаружении антител к липополисахаридам Salmonella (LPS) с помощью макроскопического теста агглютинации пробирки, теста быстрой агглютинации сыворотки (SPA), теста цельной крови на окрашенный антиген или микро- тест агглютинации (Шивапрасад, 2000).В связи с тем, что племенные стада проходят скрининг на специфические сывороточные антитела против Salmonella LPS с использованием теста SPA (Gast, 1997), антитела, вырабатываемые после вакцинации, неотличимы от антител, вырабатываемых в ответ на инфекцию Salmonella Pullorum дикого типа. Основная цель при разработке идеальной вакцины состоит в том, чтобы она не мешала программе мониторинга сальмонеллеза. Концепция вакцин DIVA, основанная на отсутствии в вакцине по крайней мере одного иммуногенного белка или антигена, но присутствующего в штамме дикого типа, уже была предложена для коммерческого использования в ветеринарии (Selke et al. , 2007; Leyman et al., 2011; Román et al., 2012). Более того, способность живой вакцины выделяться и сохраняться в окружающей среде должна быть проверена, чтобы предоставить информацию для оценки неприемлемой опасности длительного выживания для окружающей среды (Leyman et al., 2012).
, 2007; Leyman et al., 2011; Román et al., 2012). Более того, способность живой вакцины выделяться и сохраняться в окружающей среде должна быть проверена, чтобы предоставить информацию для оценки неприемлемой опасности длительного выживания для окружающей среды (Leyman et al., 2012).
Необходимость удаления генов дикого типа для того, чтобы отличить вакцинированные штаммы от штаммов дикого типа, открывает новые возможности. В связи с этим создание новых аттенуированных вакцинных штаммов Salmonella было сфокусировано как на делеции факторов вирулентности, так и на нарушении метаболических путей, в то же время балансируя безопасность и иммуногенность (Galen and Curtiss, 2014).ЛПС является основным фактором вирулентности, а O -антиген является иммунодоминантным антигеном в тестах серологической диагностики. Усечение O -антигена и предотвращение его синтеза - это две стратегии ослабления Salmonella для использования в качестве вакцины DIVA (Kong et al. , 2011). WaaL представляет собой мембранный фермент, участвующий в лигировании O -антигена с олигосахаридом липидного А-ядра. Наличие или отсутствие антигена О-цепи определяет, является ли ЛПС гладким или шероховатым соответственно.Мутации в гене waaL приводят к тому, что бактерии обладают грубым LPS (Pérez et al., 2008). Однако мутант с делецией waaL (такой как Salmonella Typhimurium Δ waaL ) оказался недостаточно аттенуированным (Nagy et al., 2008), и поэтому считалось, что требуется второй ген вирулентности. SpiC требуется для транслокации эффекторов SPI-2 ( Salmonella , остров патогенности 2) (Geng et al., 2014), поэтому spiC был выбран в качестве дополнительной ослабляющей делеции.
, 2011). WaaL представляет собой мембранный фермент, участвующий в лигировании O -антигена с олигосахаридом липидного А-ядра. Наличие или отсутствие антигена О-цепи определяет, является ли ЛПС гладким или шероховатым соответственно.Мутации в гене waaL приводят к тому, что бактерии обладают грубым LPS (Pérez et al., 2008). Однако мутант с делецией waaL (такой как Salmonella Typhimurium Δ waaL ) оказался недостаточно аттенуированным (Nagy et al., 2008), и поэтому считалось, что требуется второй ген вирулентности. SpiC требуется для транслокации эффекторов SPI-2 ( Salmonella , остров патогенности 2) (Geng et al., 2014), поэтому spiC был выбран в качестве дополнительной ослабляющей делеции.
Цели настоящего исследования заключались в оценке безопасности и защитной способности штамма с двойным мутантом Salmonella Pullorum Δ spiC Δ waaL после внутримышечной инокуляции суточных бройлеров и оценки полезности этого штамма в качестве Стратегия DIVA.
Материалы и методы
Куры
В лаборатории были выведены белые куриные эмбрионыHY-line, полученные от Института птицеводства Цзянсу (Китай).Цыплят проверяли на отсутствие инфекции Salmonella бактериологическим исследованием, как описано ниже, и на наличие каких-либо клинических признаков кишечного заболевания. Экспериментальные группы были размещены в отдельных проволочных клетках с достаточным количеством корма и воды при температуре окружающей среды. Все экспериментальные процедуры и процедуры содержания животных были разрешены комитетами по благополучию и этике животных Университета Янчжоу (SYXK [Su] 2012–0029) и соответствовали руководящим указаниям административного комитета учреждения и комитета по этике лабораторных животных.В ходе экспериментальной работы соблюдались все лабораторные процедуры по охране труда и технике безопасности.
Бактериальные штаммы и развитие
Salmonella Pullorum Mutant Strain Штамм Salmonella Pullorum S06004, первоначально выделенный от цыплят с пуллорум, является естественно устойчивым к налидиксовой кислоте (Nal) (Geng et al.![]() , 2014) и использовался в качестве контрольного штамма. Мутантный штамм с делецией spiC , S06004Δ spiC (Guo et al., 2016), был использован в качестве фонового штамма для конструирования мутанта LPS raw. Делецию гена waaL проводили с использованием метода одностадийной инактивации, как описано ранее (Datsenko and Wanner, 2000). Целевой ген был удален от начального до стоп-кодона, что подтверждено секвенированием. Для иммунизации цыплят использовали мутантный штамм Salmonella Pullorum S06004Δ spiC Δ waaL . В качестве контрольных штаммов использовали вирулентный штамм Salmonella Gallinarum SG9 Nal R , поставляемый Barrow (1990), и Salmonella Enteritidis F06 Nal R , выделенный от мертвых кур птицефабрик.
, 2014) и использовался в качестве контрольного штамма. Мутантный штамм с делецией spiC , S06004Δ spiC (Guo et al., 2016), был использован в качестве фонового штамма для конструирования мутанта LPS raw. Делецию гена waaL проводили с использованием метода одностадийной инактивации, как описано ранее (Datsenko and Wanner, 2000). Целевой ген был удален от начального до стоп-кодона, что подтверждено секвенированием. Для иммунизации цыплят использовали мутантный штамм Salmonella Pullorum S06004Δ spiC Δ waaL . В качестве контрольных штаммов использовали вирулентный штамм Salmonella Gallinarum SG9 Nal R , поставляемый Barrow (1990), и Salmonella Enteritidis F06 Nal R , выделенный от мертвых кур птицефабрик.
Экстракция LPS, окрашивание серебром и иммуноблот-анализ
Липополисахариды экстрагировали фенольным методом с использованием набора для экстракции LPS (iNtRON, Корея), процедура включала лизис, осаждение, очистку и ресуспендирование. Образцы ЛПС разделяли на 12% SDS-PAGE гелях (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и окрашивали с помощью набора для окрашивания серебром (Thermo Scientific, США). Вестерн-блоттинг выполняли с использованием моноклонального антитела против O9 и козьего антимышиного IgG HRP (1: 5000; Sigma-Aldrich, США).Для выявления грубого фенотипа колонии, характерного для мутантного штамма, был проведен тест на акрифлавин на слайдах (Cerdà-Cuéllar and Aragon, 2008). Вкратце, колонии 24-часовой культуры, приготовленные из вакцинного штамма на чашках с питательным агаром, смешивали с 30 микролитрами 0,2% акрифлавина на предметном стекле. Смеси вращали в течение 1 мин и наблюдали за макроскопическими признаками агглютинации.
Образцы ЛПС разделяли на 12% SDS-PAGE гелях (электрофорез в полиакриламидном геле с додецилсульфатом натрия) и окрашивали с помощью набора для окрашивания серебром (Thermo Scientific, США). Вестерн-блоттинг выполняли с использованием моноклонального антитела против O9 и козьего антимышиного IgG HRP (1: 5000; Sigma-Aldrich, США).Для выявления грубого фенотипа колонии, характерного для мутантного штамма, был проведен тест на акрифлавин на слайдах (Cerdà-Cuéllar and Aragon, 2008). Вкратце, колонии 24-часовой культуры, приготовленные из вакцинного штамма на чашках с питательным агаром, смешивали с 30 микролитрами 0,2% акрифлавина на предметном стекле. Смеси вращали в течение 1 мин и наблюдали за макроскопическими признаками агглютинации.
Оценка LD
50 и колонизации органов Для определения 50% летальной дозы (LD 50 ) группы 10-дневных цыплят инфицировали внутримышечно 10-кратными разведениями (от 10 5 до 10 10 КОЕ) S06004Δ spiC Δ waaL или S06004. За птицами наблюдали в течение 3 недель после заражения, и смертность регистрировалась ежедневно для расчета значений LD 50 .
За птицами наблюдали в течение 3 недель после заражения, и смертность регистрировалась ежедневно для расчета значений LD 50 .
Устойчивость бактерий и их клиренс анализировали для определения количества штамма живой вакцины путем подсчета Nal-резистентных Salmonella на грамм печени или селезенки. Сорок птенцов, полученных в день вылупления, случайным образом разделили на две равные группы. Вакцинированной группе внутримышечно вводили 1 × 10 7 КОЕ живой вакцины, тогда как контрольной группе вводили 100 мкл PBS.После этого через 2, 7, 14 и 21 день после вакцинации печень и селезенку получали от каждой группы из пяти птиц с использованием асептических методов, взвешивали и затем гомогенизировали. Разведения гомогената инкубировали на селективном агаре XLT4 (Difco, США), содержащем 100 мкг / мл Nal, при 37 ° C и подсчитывали полученные колоний Salmonella .
Эксперименты по вакцинации
Иммунизация и защита от
Salmonella Pullorum Challenge Сорокодневные цыплята были разделены на две группы ( n = 20 на группу), обозначенные как группа A (невакцинированный контроль) и группа B (вакцинированная), для оценки защитной эффективности мутанта Salmonella Pullorum. после однократной внутримышечной инъекции.Этим двум группам суточных цыплят вводили 100 мкл PBS (pH 7,2) или PBS, содержащего 1 × 10 7 КОЕ мутантного штамма S06004Δ spiC Δ waaL . Животным вводили внутримышечно 10 9 КОЕ вирулентной Salmonella Pullorum через 14 дней после иммунизации (dpi) (Guo et al., 2016). Смертельные случаи и клинические симптомы регистрировались ежедневно в течение следующих 2 недель. В конце этого периода всех выживших птенцов забивали. Клинические баллы определялись и записывались с использованием системы, описанной нами ранее Guo et al.(2016). Органы (печень, селезенка и слепая кишка) собирали у каждой группы из пяти птиц в асептических условиях, взвешивали и гомогенизировали для проверки наличия штамма контрольного заражения. Разведения гомогената готовили в стерильном PBS (pH 7,2) и высевали на селективный агар XLT4 (Difco, США), содержащий 100 мкг / мл Nal.
после однократной внутримышечной инъекции.Этим двум группам суточных цыплят вводили 100 мкл PBS (pH 7,2) или PBS, содержащего 1 × 10 7 КОЕ мутантного штамма S06004Δ spiC Δ waaL . Животным вводили внутримышечно 10 9 КОЕ вирулентной Salmonella Pullorum через 14 дней после иммунизации (dpi) (Guo et al., 2016). Смертельные случаи и клинические симптомы регистрировались ежедневно в течение следующих 2 недель. В конце этого периода всех выживших птенцов забивали. Клинические баллы определялись и записывались с использованием системы, описанной нами ранее Guo et al.(2016). Органы (печень, селезенка и слепая кишка) собирали у каждой группы из пяти птиц в асептических условиях, взвешивали и гомогенизировали для проверки наличия штамма контрольного заражения. Разведения гомогената готовили в стерильном PBS (pH 7,2) и высевали на селективный агар XLT4 (Difco, США), содержащий 100 мкг / мл Nal.
Перекрестная защита от гомологичного серотипа
Четыре группы 20-дневных цыплят вакцинировали S06004Δ spiC Δ waaL , как описано в разделе «Иммунизация и защита от заражения Salmonella Pullorum». В возрасте 50 дней цыплятам внутримышечно вводили 10 9 КОЕ вирулентного штамма Salmonella Gallinarum SG9 или 10 9 КОЕ Salmonella Enteritidis F06. Смертность регистрировалась в течение 2 недель.
В возрасте 50 дней цыплятам внутримышечно вводили 10 9 КОЕ вирулентного штамма Salmonella Gallinarum SG9 или 10 9 КОЕ Salmonella Enteritidis F06. Смертность регистрировалась в течение 2 недель.
Защита от Salmonella Enteritidis, индуцированная вакцинным штаммом, оценивалась путем анализа способности контрольного штамма колонизировать желудочно-кишечный тракт, печень и селезенку вакцинированных и контрольных цыплят.Через четырнадцать дней после заражения пять птиц из каждой группы были умерщвлены и приготовлены гомогенаты тканей. Соответствующие разведения гомогенатов высевали на чашки с агаром XLT4, содержащие 100 мкг / мл Nal, для подсчета Salmonella Enteritidis, присутствующих в каждой ткани.
Производство антител и анализ стимуляции лимфоцитов
Непрямой метод ELISA с использованием убитых нагреванием целых бактерий Salmonella Pullorum в качестве покрывающего антигена применяли для количественного определения IgG в сыворотке, как описано ранее (Guo et al. , 2016). Вкратце, бактериальный антиген наносили на 96-луночный планшет и инкубировали в течение ночи при 4 ° C. После блокировки образцы сыворотки, собранные на 7, 14, 21 и 28 день, разбавляли и добавляли в лунки. Лунки инкубировали с разведением 1: 5000 козьих вторичных антител против куриного IgG, конъюгированных с пероксидазой хрена (Sigma – Aldrich, США), в течение 1 часа. Поглощение при 405 нм измеряли с помощью автоматического ридера для микропланшетов (Synergy 2, BioTek, США) после остановки реакции с помощью 2 M H 2 SO 4 .Полученные значения оптической плотности (OD) использовали для расчета скорректированных значений E по следующей формуле: E -значение = [OD (образец) - OD (отрицательный контроль) / OD (положительный контроль) - OD ( отрицательный контроль)]. Чтобы оценить влияние вакцины-кандидата на клеточно-опосредованный иммунный (CMI) ответ после иммунизации, на 21 день проводили анализ пролиферации периферических лимфоцитов, как описано ранее (Rana and Kulshreshtha, 2006).
, 2016). Вкратце, бактериальный антиген наносили на 96-луночный планшет и инкубировали в течение ночи при 4 ° C. После блокировки образцы сыворотки, собранные на 7, 14, 21 и 28 день, разбавляли и добавляли в лунки. Лунки инкубировали с разведением 1: 5000 козьих вторичных антител против куриного IgG, конъюгированных с пероксидазой хрена (Sigma – Aldrich, США), в течение 1 часа. Поглощение при 405 нм измеряли с помощью автоматического ридера для микропланшетов (Synergy 2, BioTek, США) после остановки реакции с помощью 2 M H 2 SO 4 .Полученные значения оптической плотности (OD) использовали для расчета скорректированных значений E по следующей формуле: E -значение = [OD (образец) - OD (отрицательный контроль) / OD (положительный контроль) - OD ( отрицательный контроль)]. Чтобы оценить влияние вакцины-кандидата на клеточно-опосредованный иммунный (CMI) ответ после иммунизации, на 21 день проводили анализ пролиферации периферических лимфоцитов, как описано ранее (Rana and Kulshreshtha, 2006).
Возможность серодиагностики на основе DIVA
Тест SPA использовали для оценки способности DIVA вакцины-кандидата S06004Δ spiC Δ waaL (Gast, 1997; Lalsiamthara et al., 2015). Коммерчески доступный планшет-тест Антигены Salmonella Pullorum были получены от Zhonghai Biotech (Пекин, Китай). Суточных цыплят иммунизировали внутримышечно вакцинным штаммом или мутантом S06004Δ spiC (гладкий фенотип LPS). Сыворотку готовили на 7, 14, 21 и 28 дни путем сбора крови путем пункции сердца и предоставления ей возможности коагулировать в течение 3 часов при комнатной температуре перед сбором фракции сыворотки. Образцы сыворотки вакцинированных птиц (30 мкл) смешивали с равным объемом стандартного тестового антигена SPA и наблюдали реакцию агглютинации.
Оценка экологической безопасности
Чувствительность мутанта S06004Δ spiC Δ waaL к ультрафиолетовому свету и различным дезинфицирующим средствам оценивали, как описано (Leyman et al. , 2012; Han et al., 2014), с небольшими изменениями. Бактерии выращивали до OD 600 = 1,0 при 37 ° C при встряхивании и разбавляли в PBS до 10 9 КОЕ / мл. Затем один миллилитр суспензии переносили в стерильную чашку Петри и подвергали воздействию ультрафиолетового излучения (PHILIPS, UV-C: 254 нм, 30 Вт, расстояние: 45 см) в течение 1 мин.Для устойчивости к окислению и щелочам каждую суспензию инкубировали в присутствии стрессоров при комнатной температуре: 100 мкМ перекиси водорода в течение 5 минут или 12,5 мМ гидроксида натрия (NaOH) в течение 5 минут. Чувствительность штаммов к порошку пероксимоносульфата, который является активным ингредиентом в выбранном дезинфицирующем средстве (DuPont TM Virkon ® S, Шэньчжэнь, Китай), анализировали с помощью анализа микроразбавления с использованием серийных двукратных разведений. Наконец, 10-кратные разведения наносили на чашки LB для количественного определения жизнеспособных бактерий.Эксперимент проводился трижды.
, 2012; Han et al., 2014), с небольшими изменениями. Бактерии выращивали до OD 600 = 1,0 при 37 ° C при встряхивании и разбавляли в PBS до 10 9 КОЕ / мл. Затем один миллилитр суспензии переносили в стерильную чашку Петри и подвергали воздействию ультрафиолетового излучения (PHILIPS, UV-C: 254 нм, 30 Вт, расстояние: 45 см) в течение 1 мин.Для устойчивости к окислению и щелочам каждую суспензию инкубировали в присутствии стрессоров при комнатной температуре: 100 мкМ перекиси водорода в течение 5 минут или 12,5 мМ гидроксида натрия (NaOH) в течение 5 минут. Чувствительность штаммов к порошку пероксимоносульфата, который является активным ингредиентом в выбранном дезинфицирующем средстве (DuPont TM Virkon ® S, Шэньчжэнь, Китай), анализировали с помощью анализа микроразбавления с использованием серийных двукратных разведений. Наконец, 10-кратные разведения наносили на чашки LB для количественного определения жизнеспособных бактерий.Эксперимент проводился трижды.
Статистический анализ
Статистический анализ выполняли с помощью GraphPad Prism 5 (GraphPad Software, США). Для определения статистических различий между несколькими экспериментальными группами использовался односторонний дисперсионный анализ с последующими тестами множественного сравнения Даннета. P <0,05 считалось статистически значимым.
Результаты
Мутант
waaL демонстрирует усеченный ЛПС, лишенный O -Антигенной области Чтобы подтвердить, что биосинтез O -антигена был затронут, профили LPS дикого типа и мутантных штаммов сравнивали с использованием окрашивания серебром препаратов LPS.Как показано на рисунке 1А, ЛПС из штамма дикого типа демонстрировал лестничный узор с различной длиной O -полисахаридных повторов, тогда как мутант с геном waaL имел грубую структуру ЛПС типа A (Ra). Кроме того, вестерн-блоттинг подтвердил отсутствие реактивности мутантного ЛПС waaL с моноклональным антителом против O9, что указывает на отсутствие в ЛПС антигена O (фиг. 1В). Штамм дикого типа и мутантный штамм waaL можно было отличить друг от друга с помощью теста на слайде с акрифлавином.Мутантный штамм демонстрировал грубый фенотип, тогда как штамм дикого типа демонстрировал гладкий фенотип, поскольку не вызывал агглютинации (рис. 1С).
1В). Штамм дикого типа и мутантный штамм waaL можно было отличить друг от друга с помощью теста на слайде с акрифлавином.Мутантный штамм демонстрировал грубый фенотип, тогда как штамм дикого типа демонстрировал гладкий фенотип, поскольку не вызывал агглютинации (рис. 1С).
РИСУНОК 1. Фенотипическая характеристика ЛПС у мутантных штаммов и штаммов дикого типа. (A) SDS-PAGE ЛПС, проанализированного путем окрашивания серебром. (B) Вестерн-блоттинг-анализ ЛПС с использованием моноклонального антитела против O9. (C) Мутантный штамм имеет грубый внешний вид с использованием теста агглютинации акрифлавина. (D) Схематическое изображение молекулы ЛПС Salmonella Pullorum (липид А, полисахариды ядра и O -антиген).
Определение затухания Δ
spiC Δ waaL Деформация Чтобы подтвердить безопасность мутантного штамма в качестве кандидата на живую вакцину, вирулентность родительских и мутантных штаммов была оценена на однодневных белых цыплятах линии HY. LD 50 S06004Δ spiC Δ waaL была примерно в 400 раз выше, чем у родительского штамма при внутримышечной инфекции (Таблица 1).
LD 50 S06004Δ spiC Δ waaL была примерно в 400 раз выше, чем у родительского штамма при внутримышечной инфекции (Таблица 1).
ТАБЛИЦА 1. Характеристики Salmonella мутантов Pullorum.
Колонизация и постоянство органов
Результаты персистенции бактерий и их выведения в органах показаны на рисунке 2. Бактериологический анализ показал, что инокуляция мутантным штаммом привела к высокому уровню колонизации внутренних органов через 2 дня после вакцинации и персистенции в течение примерно 2 недель, что позволяет предположить наличие вакцинного штамма сохраняла способность вторгаться в хозяина и стимулировать иммунный ответ.В целом, однако, устойчивость напряжения постепенно снижалась в течение эксперимента. Все образцы, взятые через 21 день после инокуляции, были отрицательными, что указывает на то, что мутантный штамм эффективно очищен.
РИСУНОК 2. Колонизация и стойкость вакцинного штамма в печени и селезенке после инокуляции суточных цыплят бактериальными клетками 10 7 КОЕ. Значения представлены как log 10 КОЕ / г образца. Отрицательные образцы показаны как 0 КОЕ / г; все образцы из контрольной группы были отрицательными.
Значения представлены как log 10 КОЕ / г образца. Отрицательные образцы показаны как 0 КОЕ / г; все образцы из контрольной группы были отрицательными.
Защитная эффективность против вирулентных
Salmonella Pullorum ChallengeЦыплята, вакцинированные вакциной, показали значительно более высокую защиту от заражения Salmonella Pullorum по сравнению с неиммунизированными цыплятами. Смертности не наблюдалось в иммунизированной группе, тогда как 16 из 20 бройлеров погибли в невакцинированной группе (рис. 3А). После заражения средний балл патологии вакцинированной группы и контрольной группы составлял 1.10 ± 1,77 и 4,70 ± 0,66, соответственно, что указывает на то, что иммунизированные цыплята получили значительно более низкие средние оценки, чем контрольные. У вакцинированных птиц также наблюдалось значительное снижение количества контрольных бактерий в органах (таблица 2).
РИСУНОК 3. Защитная способность грубого мутанта против вирулентного Salmonella enterica серовара Gallinarum biovar Pullorum и Gallinarum. При 14 dpi цыплятам из каждой группы внутримышечно вводили 1 × 10 9 КОЕ дикого типа Salmonella Pullorum S06004 (A) или вирулентного Salmonella Gallinarum SG9 (B) .Защиту выражали в процентах выживаемости после заражения ( ∗∗∗ P <0,001).
При 14 dpi цыплятам из каждой группы внутримышечно вводили 1 × 10 9 КОЕ дикого типа Salmonella Pullorum S06004 (A) или вирулентного Salmonella Gallinarum SG9 (B) .Защиту выражали в процентах выживаемости после заражения ( ∗∗∗ P <0,001).
ТАБЛИЦА 2. Выделение Salmonella из различных органов цыплят, вакцинированных мутантным штаммом, или неиммунизированных контрольных цыплят, впоследствии зараженных вирулентной сальмонеллой .
Перекрестная защита против вирулентных
Salmonella Gallinarum или Salmonella Enteritidis Challenge Для оценки перекрестного защитного эффекта живой вакцины вакцинированных цыплят заражали вирулентным штаммом Salmonella Gallinarum SG9 или штаммом Salmonella Enteritidis F06.После заражения вирулентным SG9 ни один из цыплят не умер в вакцинированной группе, тогда как только два цыпленка выжили в невакцинированной группе (рис. 3B). Бактериологический анализ тканей вакцинированных птиц после заражения вирулентным вирусом Salmonella Enteritidis показал, что штамм дикого типа не может быть обнаружен ни в системных органах, ни в слепой кишке; этого не было в контрольной группе (таблица 2).
3B). Бактериологический анализ тканей вакцинированных птиц после заражения вирулентным вирусом Salmonella Enteritidis показал, что штамм дикого типа не может быть обнаружен ни в системных органах, ни в слепой кишке; этого не было в контрольной группе (таблица 2).
Гуморальный и клеточный иммунный ответ, вызванный вакциной-кандидатом
Статистический анализ показал значительную разницу в гуморальном и клеточном иммунном ответе у цыплят, иммунизированных вакциной, по сравнению с контрольными животными.Уровни сывороточного IgG были значительно выше в каждый момент времени после иммунизации в экспериментальной группе (рис. 4). У вакцинированных цыплят уровень пролиферативного ответа лимфоцитов, обозначенный индексом стимуляции (SI), был значительно выше по сравнению с контрольными цыплятами (Рисунок 4).
РИСУНОК 4. Уровни гуморального и клеточного иммунного ответа у вакцинированных цыплят по сравнению с контрольными цыплятами. Сывороточные ответы антител IgG против живого вакцинного штамма, измеренные с помощью непрямого ELISA.Звездочки указывают на значительную разницу между иммунизированной и контрольной группами с PBS ( ∗ P <0,05; ∗∗ P <0,01). Индекс стимуляции реакций стимуляции лимфоцитов с использованием растворимых антигенов у иммунизированных кур через 3 недели после вакцинации. Звездочки указывают на значительную разницу по сравнению с контрольной группой PBS ( * P <0,05).
Сывороточные ответы антител IgG против живого вакцинного штамма, измеренные с помощью непрямого ELISA.Звездочки указывают на значительную разницу между иммунизированной и контрольной группами с PBS ( ∗ P <0,05; ∗∗ P <0,01). Индекс стимуляции реакций стимуляции лимфоцитов с использованием растворимых антигенов у иммунизированных кур через 3 недели после вакцинации. Звездочки указывают на значительную разницу по сравнению с контрольной группой PBS ( * P <0,05).
Дифференциация сывороточных антител к
Salmonella Pullorum Антитела к Salmonella Pullorum часто обнаруживаются с помощью теста SPA с использованием стандартного антигена.Сыворотка, собранная у вакцинированных цыплят S06004Δ spiC Δ waaL в различные интервалы времени, была идентифицирована как SPA-отрицательная после прививки (фиг. 5). Однако цыплята были идентифицированы как положительные в группе, вакцинированной штаммом spiC . В целом живая вакцина продемонстрировала очевидную способность DIVA, которая может быть чрезвычайно полезной в программе борьбы с сальмонеллезом.
В целом живая вакцина продемонстрировала очевидную способность DIVA, которая может быть чрезвычайно полезной в программе борьбы с сальмонеллезом.
РИСУНОК 5. Способность DIVA на основе теста агглютинации плашки сыворотки. Сыворотка, собранная на 7, 14, 21 и 28 дни, была протестирована на реактивность к стандартному антигену Salmonella Pullorum. Цыплята контрольной группы S06004Δ spiC показали сильную реакцию агглютинации (+ / ++) на 21 и 28 дни после инокуляции.
Штамм-мутант демонстрирует повышенную чувствительность к стрессу окружающей среды
Высокая чувствительность к УФ-излучению была продемонстрирована как для штаммов вакцины дикого типа, так и для ослабленных вакцин, при этом ни в одном из них не было клеток, выживших после облучения УФ-С.Что касается окислительного стресса, процент выживания мутантного штамма упал примерно на 84,5%, и они продемонстрировали заметно более высокую чувствительность к перекиси водорода, чем клетки дикого типа (48,8%) (рис. 6). Штамм с дефицитом ЛПС был очень чувствителен к щелочной обработке по сравнению с соответствующим штаммом дикого типа (Фиг.6). Анализ минимальной бактерицидной концентрации показал, что грубый мутант был намного более чувствителен к убивающим эффектам порошка пероксимоносульфата соединения, чем штамм дикого типа, со значительным сокращением количества выживших клеток в некотором диапазоне концентраций (таблица 3).Следовательно, живая вакцина-кандидат не могла сохраняться в неблагоприятных условиях, что позволяет предположить, что ее можно легко удалить из окружающей среды.
6). Штамм с дефицитом ЛПС был очень чувствителен к щелочной обработке по сравнению с соответствующим штаммом дикого типа (Фиг.6). Анализ минимальной бактерицидной концентрации показал, что грубый мутант был намного более чувствителен к убивающим эффектам порошка пероксимоносульфата соединения, чем штамм дикого типа, со значительным сокращением количества выживших клеток в некотором диапазоне концентраций (таблица 3).Следовательно, живая вакцина-кандидат не могла сохраняться в неблагоприятных условиях, что позволяет предположить, что ее можно легко удалить из окружающей среды.
РИСУНОК 6. Показатели выживаемости мутантных штаммов при различных стрессах окружающей среды. Чувствительность мутантного штамма Salmonella Pullorum и его родительского штамма к перекиси водорода (100 мкМ в течение 5 минут) и 12,5 мМ NaOH в течение 5 минут. Данные представляют собой средние значения и стандартные отклонения трех экспериментов ( ∗∗∗ P <0. 001).
001).
ТАБЛИЦА 3. Чувствительность мутантного штамма Salmonella Pullorum к порошку пероксимоносульфата.
Обсуждение
Salmonella Pullorum вызывает вспышки среди домашних птиц, что приводит к высокой заболеваемости и смертности цыплят (Xiong et al., 2016). Вакцинация не является панацеей, но ее всегда следует использовать как часть комплексной программы контроля. Живые аттенуированные вакцины широко тестировались на домашней птице, а также на мышах, хотя только несколько штаммов Salmonella зарегистрированы и коммерчески доступны для использования у домашней птицы (Barrow, 2007).В идеале вакцина, используемая для борьбы с инфекцией Salmonella , должна быть безопасной, перекрестной защитой, четко определенным и способной вызывать клеточный иммунитет (Desin et al., 2013).
Генетическая модификация вакцинного штамма Salmonella направлена на снижение риска сохранения или распространения в тканях хозяина и в окружающей среде, в то же время вызывая эффективный иммунный ответ. Двойные мутации, введенные в бактерии, могут привести к созданию высокоаттенуированного и безопасного вакцинного штамма и, таким образом, снизить риск реверсии путем приобретения генов посредством горизонтального переноса (Van Immerseel et al., 2005). O -антиген обеспечивает важные элементы в серологическом различении и играет непосредственную роль в вирулентности, такой как инвазия, колонизация и устойчивость. Известно, что белок WaaL участвует в лигировании O -антигена с липидным олигосахаридом A-core (Kaniuk et al., 2004). Мутант waaL в нашем вакцинном штамме продуцирует грубый LPS, лишенный повторяющихся единиц O -антигена (рис. 1). SPI-2 T3SS (система секреции типа III) участвует в предотвращении или устойчивости к механизмам уничтожения макрофагов, SpiC является частью трехбелкового регуляторного комплекса, который функционирует в пределах Salmonella , чтобы опосредовать переключение с секреции белка транслокона на транслокацию эффектора. (Фигейра и Холден, 2012).
Двойные мутации, введенные в бактерии, могут привести к созданию высокоаттенуированного и безопасного вакцинного штамма и, таким образом, снизить риск реверсии путем приобретения генов посредством горизонтального переноса (Van Immerseel et al., 2005). O -антиген обеспечивает важные элементы в серологическом различении и играет непосредственную роль в вирулентности, такой как инвазия, колонизация и устойчивость. Известно, что белок WaaL участвует в лигировании O -антигена с липидным олигосахаридом A-core (Kaniuk et al., 2004). Мутант waaL в нашем вакцинном штамме продуцирует грубый LPS, лишенный повторяющихся единиц O -антигена (рис. 1). SPI-2 T3SS (система секреции типа III) участвует в предотвращении или устойчивости к механизмам уничтожения макрофагов, SpiC является частью трехбелкового регуляторного комплекса, который функционирует в пределах Salmonella , чтобы опосредовать переключение с секреции белка транслокона на транслокацию эффектора. (Фигейра и Холден, 2012). Из-за этой центральной роли одиночная делеция гена spiC приводит к значительному ослаблению у Salmonella Pullorum. Наши результаты демонстрируют, что двойной мутант S06004Δ spiC Δ waaL был высоко авирулентным у суточных цыплят, поскольку не мог вызывать смертность даже при высокой бактериальной нагрузке, использованной для вакцинации.
Из-за этой центральной роли одиночная делеция гена spiC приводит к значительному ослаблению у Salmonella Pullorum. Наши результаты демонстрируют, что двойной мутант S06004Δ spiC Δ waaL был высоко авирулентным у суточных цыплят, поскольку не мог вызывать смертность даже при высокой бактериальной нагрузке, использованной для вакцинации.
Чувствительность бактерий к различным дезинфицирующим средствам является важным показателем приспособленности вакцинного штамма к выживанию в окружающей среде (Leyman et al., 2012). ЛПС играет важную роль в механизмах защиты бактерий от антимикробных веществ (Liu et al., 2014). O -антиген - это характерный полисахарид самого внешнего компонента внешней мембраны клеточной стенки грамотрицательных бактерий. Присутствие O -полисахарида в молекулах LPS может препятствовать достижению антимикробными веществами их участков связывания в клеточной стенке, что приводит к повышению толерантности и выживаемости. Разработанный нами мутантный штамм очень чувствителен к различным стрессам окружающей среды, что указывает на то, что живая вакцина-кандидат, вероятно, не сможет сохраняться в неблагоприятных условиях и будет легко удалена из окружающей среды.В дополнение к этому, вакцинный штамм был исключен из бройлеров до убойного возраста, что показало хороший профиль безопасности. Эти результаты показывают, что вакцина-кандидат достаточно безопасна для цыплят.
Разработанный нами мутантный штамм очень чувствителен к различным стрессам окружающей среды, что указывает на то, что живая вакцина-кандидат, вероятно, не сможет сохраняться в неблагоприятных условиях и будет легко удалена из окружающей среды.В дополнение к этому, вакцинный штамм был исключен из бройлеров до убойного возраста, что показало хороший профиль безопасности. Эти результаты показывают, что вакцина-кандидат достаточно безопасна для цыплят.
Помимо безопасности, важна также эффективность вакцины. Гуморальные и клеточные иммунные ответы, индуцированные вакциной Salmonella , играют важную роль в предотвращении инфекции (Penha Filho et al., 2012). Измерение уровней специфических антител к Salmonella используется для мониторинга гуморальных иммунных ответов.У цыплят из иммунизированной группы уровень сывороточного IgG был значительно выше, чем у цыплят из контрольной группы. Было показано, что роль CMI в устойчивости Salmonella включает как приобретенный, так и врожденный иммунные ответы. Кроме того, усиленный CMI может оказаться полезным для защиты видов птиц от этих внутриклеточных бактериальных инфекций (Babu et al., 2003). Измерение CMI у вакцинированных птиц проводили для исследования воздействия вакцины на пролиферацию периферических лимфоцитов.В этом исследовании живая вакцина была эффективной в увеличении пролиферации периферических лимфоцитов в ответ на растворимый антиген Salmonella Pullorum. В целом вакцинный штамм вызывал стойкий гуморальный иммунный ответ, а также эффективный ответ CMI.
Кроме того, усиленный CMI может оказаться полезным для защиты видов птиц от этих внутриклеточных бактериальных инфекций (Babu et al., 2003). Измерение CMI у вакцинированных птиц проводили для исследования воздействия вакцины на пролиферацию периферических лимфоцитов.В этом исследовании живая вакцина была эффективной в увеличении пролиферации периферических лимфоцитов в ответ на растворимый антиген Salmonella Pullorum. В целом вакцинный штамм вызывал стойкий гуморальный иммунный ответ, а также эффективный ответ CMI.
Salmonella Pullorum, Salmonella Gallinarum и Salmonella Enteritidis все относятся к Salmonella серогруппы D, поэтому следует ожидать перекрестной защиты вакцины.Бактериальные мутанты с усеченным ЛПС, такие как мутант, используемый здесь, могут иметь потенциал для использования в качестве вакцины, которая генерирует перекрестный защитный иммунитет к другим сероварам (Nagy et al., 2008; Kong et al., 2011; Leyman et al. , 2011). Грубый штамм Salmonella Gallinarum 9R использовался в качестве вакцины для защиты цыплят от птичьего тифа. Помимо борьбы с брюшным тифом домашней птицы, вакцина SG 9R использовалась в нескольких странах в качестве дополнительного инструмента для борьбы с Salmonella Enteritidis в коммерческих стадах несушек (Wigley, 2017).Недавно было высказано предположение, что грубые мутанты обеспечивают лучшую доступность липида А и ядерных антигенов, в то же время они способствуют перефокусировке иммунного ответа на белки внешней мембраны (Bearson et al., 2016; Liu et al., 2016) . Поэтому было проведено исследование перекрестной защиты, чтобы изучить способность вакцины-кандидата от грубой вакцины Salmonella Pullorum к перекрестному иммунитету. Мутантный штамм был способен обеспечивать перекрестную защиту после заражения с Salmonella Gallinarum дикого типа за счет снижения смертности и с Salmonella Enteritidis дикого типа за счет предотвращения колонизации.Поскольку в сообществе домашней птицы имеется более одной серогруппы Salmonella , мы будем оценивать перекрестный защитный иммунитет и эффективность защиты от гетерологичного серотипа Salmonella , такого как Salmonella Typhimurium и Salmonella Infantis, в будущих работах.
Грубый штамм Salmonella Gallinarum 9R использовался в качестве вакцины для защиты цыплят от птичьего тифа. Помимо борьбы с брюшным тифом домашней птицы, вакцина SG 9R использовалась в нескольких странах в качестве дополнительного инструмента для борьбы с Salmonella Enteritidis в коммерческих стадах несушек (Wigley, 2017).Недавно было высказано предположение, что грубые мутанты обеспечивают лучшую доступность липида А и ядерных антигенов, в то же время они способствуют перефокусировке иммунного ответа на белки внешней мембраны (Bearson et al., 2016; Liu et al., 2016) . Поэтому было проведено исследование перекрестной защиты, чтобы изучить способность вакцины-кандидата от грубой вакцины Salmonella Pullorum к перекрестному иммунитету. Мутантный штамм был способен обеспечивать перекрестную защиту после заражения с Salmonella Gallinarum дикого типа за счет снижения смертности и с Salmonella Enteritidis дикого типа за счет предотвращения колонизации.Поскольку в сообществе домашней птицы имеется более одной серогруппы Salmonella , мы будем оценивать перекрестный защитный иммунитет и эффективность защиты от гетерологичного серотипа Salmonella , такого как Salmonella Typhimurium и Salmonella Infantis, в будущих работах.
Основой для успешной борьбы с инфекцией Salmonella Pullorum у домашней птицы являются надлежащие методы ведения сельского хозяйства и гигиены, а также тестирование и удаление положительных стад из популяций.Когда вакцинация используется в программах контроля Salmonella , возможные помехи стандартным серологическим методам обнаружения Salmonella считаются серьезным недостатком, поскольку иммунизированные животные вырабатывают антитела против вакцинного штамма, которые нельзя отличить серологическими тестами от животных, инфицированных вирусом. штаммы дикого типа (Adriaensen et al., 2007). Успех вакцины DIVA на основе ЛПС ( Salmonella Gallinarum 9R) в борьбе с брюшным тифом и паратифом у птиц показал, что живые аттенуированные, но различимые бактериальные штаммы являются свидетельством продвижения вперед (Silva et al., 1981). Salmonella Gallinarum 9R представляет собой мутацию в гене rfaJ и приводит к грубому фенотипу ЛПС из-за дефектной боковой цепи антигена O (Kwon and Cho, 2011). Одним из самых больших преимуществ использования вакцины 9R является то, что она дает хорошую защиту и не мешает тестам, используемым для борьбы с пуллорум-брюшным тифом. В настоящем исследовании мутант гена waaL показал усеченный ЛПС, лишенный основного поверхностного антигена, аналогичный Salmonella Gallinarum 9R.Серологические результаты, полученные от вакцинированных птиц, были отрицательными, однако образцы были положительными на животных, инфицированных диким типом. Наши результаты показывают, что мутантный штамм S06004Δ spiC Δ waaL был способен стимулировать гуморальный иммунный ответ DIVA у цыплят и показал удовлетворительные результаты в серологических тестах в контрольной программе Salmonella .
Одним из самых больших преимуществ использования вакцины 9R является то, что она дает хорошую защиту и не мешает тестам, используемым для борьбы с пуллорум-брюшным тифом. В настоящем исследовании мутант гена waaL показал усеченный ЛПС, лишенный основного поверхностного антигена, аналогичный Salmonella Gallinarum 9R.Серологические результаты, полученные от вакцинированных птиц, были отрицательными, однако образцы были положительными на животных, инфицированных диким типом. Наши результаты показывают, что мутантный штамм S06004Δ spiC Δ waaL был способен стимулировать гуморальный иммунный ответ DIVA у цыплят и показал удовлетворительные результаты в серологических тестах в контрольной программе Salmonella .
Таким образом, мы продемонстрировали, что приблизительный аттенуированный кандидат на вакцину против Salmonella Pullorum обладал свойствами, желательными для вакцины, включая аттенуацию, иммуногенность и свойство DIVA.Таким образом, этот мутантный штамм может быть эффективной вакциной для борьбы с инфекцией Salmonella у домашней птицы. Необходимы дальнейшие усилия для определения эффективности вакцины в полевых испытаниях и разработки эффективной стратегии борьбы с сальмонеллезом.
Необходимы дальнейшие усилия для определения эффективности вакцины в полевых испытаниях и разработки эффективной стратегии борьбы с сальмонеллезом.
Авторские взносы
XJ, SG и RG задумали и разработали исследование. ZP, XC и QL проводили эксперименты. XF провела сбор образцов. RG, YJ и SZ проводили эксперименты на животных. RG и YJ провели статистический анализ.РГ и З.Л. составили рукопись. XJ завершил рукопись. Все авторы прочитали и одобрили окончательную версию рукописи.
Заявление о конфликте интересов
Авторы заявляют, что исследование проводилось в отсутствие каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Эта работа была поддержана ключевыми проектами Национального фонда естественных наук Китая (31230070, 31320103907), Специального фонда агро-научных исследований в общественных интересах (201403054), Китайского научного фонда высоких технологий (программа 863, 2011AA10A212), а также фонд отличных докторских диссертаций Университета Янчжоу, программа, предоставленная для научных инновационных исследований выпускников колледжей в провинции Цзянсу (KYLX15_1384). Финансирующие органы не играли никакой роли в дизайне исследования, в сборе, анализе или интерпретации данных, в написании отчета или в решении представить статью для публикации.
Финансирующие органы не играли никакой роли в дизайне исследования, в сборе, анализе или интерпретации данных, в написании отчета или в решении представить статью для публикации.
Список литературы
Adriaensen, C., De Greve, H., Tian, J. Q., De Craeye, S., Gubbels, E., Eeckhaut, V., et al. (2007). Живая вакцина Salmonella enterica серовара Enteritidis позволяет проводить серологическое различие между вакцинированными и инфицированными животными. Заражение. Иммун. 75, 2461–2468.DOI: 10.1128 / IAI.01357-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бабу, У., Скотт, М., Майерс, М. Дж., Окамура, М., Гейнс, Д., Янси, Х. Ф. и др. (2003). Влияние живой аттенуированной и убитой вакцины Salmonella на Т-лимфоцитарный иммунитет кур-несушек. Вет. Иммунол. Immunopathol. 91, 39–44. DOI: 10.1016 / S0165-2427 (02) 00265-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барроу, П. А. (1990). Иммунитет к экспериментальному тифу птиц у кур, индуцированный вылеченным плазмидой вирулентностью производным Salmonella Gallinarum. Заражение. Иммун. 58, 2283–2288.
А. (1990). Иммунитет к экспериментальному тифу птиц у кур, индуцированный вылеченным плазмидой вирулентностью производным Salmonella Gallinarum. Заражение. Иммун. 58, 2283–2288.
PubMed Аннотация | Google Scholar
Барроу, П. А., Фрейтас Нето, О. К. (2011). Болезнь Pullorum и тиф домашней птицы - новые мысли о старых болезнях: обзор. Avian Pathol. 40, 1–13. DOI: 10.1080 / 03079457.2010.542575
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Серда-Куэльяр, М., и Арагон, В. (2008). Резистентность в сыворотке крови Haemophilus parasuis связана с системным заболеванием свиней. Вет. J. 175, 384–389. DOI: 10.1016 / j.tvjl.2007.01.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Даценко, К. А., Ваннер, Б. Л. (2000). Одностадийная инактивация хромосомных генов в Escherichia coli K-12 с использованием продуктов ПЦР. Proc. Natl. Акад. Sci. США 97, 6640–6645. DOI: 10.1073 / pnas.120163297
DOI: 10.1073 / pnas.120163297
PubMed Аннотация | CrossRef Полный текст | Google Scholar
EFSA (2004 г.).Заключение научной группы по биологическим опасностям на запрос комиссии, связанный с использованием вакцин для борьбы с Salmonella у домашней птицы. EFSA J. 114, 1–74.
Фигейра Р. и Холден Д. В. (2012). Функции эффекторов системы секреции типа III острова патогенности Salmonella (SPI-2). Микробиология 158, 1147–1161. DOI: 10.1099 / mic.0.058115-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гэн, С., Цзяо, X., Барроу, П., Пан, З., и Чен, X. (2014). Детерминанты вирулентности Salmonella Gallinarum biovar Pullorum, идентифицированные с помощью сигнатурно-меченого мутагенеза, и мутант spiC как кандидатная живая аттенуированная вакцина. Вет. Microbiol. 168, 388–394. DOI: 10.1016 / j.vetmic.2013.11.024
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Guard-Petter, J. (2001). Цыпленок, яйцо и Salmonella enteritidis. Environ. Microbiol. 3, 421–430. DOI: 10.1046 / j.1462-2920.2001.00213.x
(2001). Цыпленок, яйцо и Salmonella enteritidis. Environ. Microbiol. 3, 421–430. DOI: 10.1046 / j.1462-2920.2001.00213.x
CrossRef Полный текст | Google Scholar
Го, Р., Гэн, С., Цзяо, Х., Пан, З., Чен, X., и Цзяо, X. (2016). Оценка защитной эффективности новой инактивированной вакцины Salmonella Pullorum ghost против вирулентного заражения цыплят. Вет. Иммунол. Immunopathol. 173, 27–33. DOI: 10.1016 / j.vetimm.2016.03.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хан, Ю., Han, X., Wang, S., Meng, Q., Zhang, Y., Ding, C., et al. (2014). Ген waaL участвует в синтезе липополисахаридов и играет роль в бактериальном патогенезе птичьего патогена Escherichia coli. Вет. Microbiol. 172, 486–491. DOI: 10.1016 / j.vetmic.2014.05.029
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хейтофф, Д. М., Хаус, Дж. К., Томсон, П. К., Махан, М. Дж. (2015). Разработка вакцины перекрестной защиты Salmonella для систем животноводства. Вакцина 33, 100–107. DOI: 10.1016 / j.vaccine.2014.11.012
Вакцина 33, 100–107. DOI: 10.1016 / j.vaccine.2014.11.012
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Канюк, Н. А., Виноградов, Э., Уитфилд, К. (2004). Исследование структурных требований к коровому акцептору липополисахарида для лигирования O-антигенов в роде Salmonella : WaaL «лигаза» не является единственным фактором, определяющим акцепторную специфичность. J. Biol. Chem. 279, 36470–36480. DOI: 10.1074 / jbc.M401366200
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Kong, Q., Янг, Дж., Лю, К., Аламури, П., Роланд, К. Л., и Кертисс, Р. III (2011). Влияние делеции генов, участвующих в липополисахаридном ядре и синтезе О-антигена, на вирулентность и иммуногенность серовара Salmonella enterica Typhimurium. Заражение. Иммун. 79, 4227–4239. DOI: 10.1128 / IAI.05398-11
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лалсиамтхара, Дж., Гогиа, Н., Госвами, Т. К., Сингх, Р. К., и Чаудхури, П. (2015). Промежуточный грубый Brucella abortus S19Δ на мутант является активным DIVA, безопасным для беременных морских свинок и обеспечивает защиту мышей. Vaccine 33, 2577–2583. DOI: 10.1016 / j.vaccine.2015.04.004
К., Сингх, Р. К., и Чаудхури, П. (2015). Промежуточный грубый Brucella abortus S19Δ на мутант является активным DIVA, безопасным для беременных морских свинок и обеспечивает защиту мышей. Vaccine 33, 2577–2583. DOI: 10.1016 / j.vaccine.2015.04.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Leyman, B., Boyen, F., Van Parys, A., Verbrugghe, E., Haesebrouck, F., and Pasmans, F. (2011). Salmonella Мутации Typhimurium LPS для использования в вакцинах, позволяющие дифференцировать инфицированных и вакцинированных свиней. Vaccine 29, 3679–3685. DOI: 10.1016 / j.vaccine.2011.03.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лейман, Б., Boyen, F., Van Parys, A., Verbrugghe, E., Haesebrouck, F., and Pasmans, F. (2012). Решение проблемы экологической выживаемости живых вакцин против Salmonella Typhimurium: делеция гена lon . Res. Вет. Sci. 93, 1168–1172. DOI: 10.1016 / j. rvsc.2012.05.008
rvsc.2012.05.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю Б., Книрель Ю. А., Фенг Л., Перепелов А. В., Сенченкова С. Н., Ривз П. Р. и др. (2014). Структурное разнообразие антигенов Salmonella O и его генетические основы. FEMS Microbiol. Ред. 38, 56–89. DOI: 10.1111 / 1574-6976.12034
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, К., Лю, К., Чжао, X., Лю, Т., И, Дж., Лян, К. и др. (2016). Иммуногенность и эффективность перекрестной защиты, индуцированные белками внешней мембраны из мутантов Salmonella Typhimurium с усеченным ЛПС у мышей. Внутр. J. Mol. Sci. 17: 416. DOI: 10.3390 / ijms17030416
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Надь, Г., Palkovics, T., Otto, A., Kusch, H., Kocsis, B., Dobrindt, U., et al. (2008). «Мягко грубо»: вакцинный потенциал мутанта регулирующего липополисахарида Salmonella enterica . J. Infect. Dis. 198, 1699–1706. DOI: 10.1086 / 593069
198, 1699–1706. DOI: 10.1086 / 593069
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Пенья Филхо, Р. А., Моура, Б. С., де Алмейда, А. М., Монтасье, Х. Дж., Барроу, П. А., и Беркьери, А. мл. (2012). Гуморальный и клеточный иммунный ответ, вызванный различными программами вакцинации до и после заражения цыплятами Salmonella Enteritidis. Vaccine 30, 7637–7643. DOI: 10.1016 / j.vaccine.2012.10.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Перес, Дж. М., МакГарри, М. А., Марольда, К. Л., и Вальвано, М. А. (2008). Функциональный анализ большой периплазматической петли лигазы О-антигена Escherichia coli K-12 WaaL. Мол. Microbiol. 70, 1424–1440. DOI: 10.1111 / j.1365-2958.2008.06490.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Рана, Н.и Кулшрешта Р.С. (2006). Клеточно-опосредованный и гуморальный иммунный ответ на вирулентный мутантный штамм Salmonella enterica серотипа gallinarum, вылеченный плазмидой, у цыплят-бройлеров. Вет. Microbiol. 115, 156–162. DOI: 10.1016 / j.vetmic.2006.01.011
Вет. Microbiol. 115, 156–162. DOI: 10.1016 / j.vetmic.2006.01.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Роман Б. С., Гарридо В., Муньос П. М., Аррибильяга Л., Гарсия Б., Де Андрес X. и др. (2012). Экстрадомен а фибронектина повышает эффективность липополисахаридных дефектных бактеринов Salmonella в качестве вакцин для мышей. Вет. Res. 43:31. DOI: 10.1186 / 1297-9716-43-31
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сельке М., Минс Дж., Спрингер С., Франк Р. и Герлах Г. Ф. (2007). Иммунизация свиней для предотвращения заболеваний у людей: создание и защитная эффективность вакцины с сероваром Salmonella enterica Typhimurium с живой отрицательной маркерной вакциной. Заражение. Иммун. 75, 2476–2483. DOI: 10.1128 / IAI.01908-06
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Силва, Э.Н., Сноейенбос, Г. Х., Вейнак, О. М., и Смизер, К. Ф. (1981). Исследования по использованию штамма 9R Salmonella Gallinarum в качестве вакцины для кур. Avian Dis. 25, 38–52. DOI: 10.2307 / 1589825
Исследования по использованию штамма 9R Salmonella Gallinarum в качестве вакцины для кур. Avian Dis. 25, 38–52. DOI: 10.2307 / 1589825
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Иммерзил, Ф., Метнер, У., Рихлик, И., Надь, Б., Велдж, П., Мартин, Г. и др. (2005). Вакцинация и ранняя защита от неспецифических для хозяина серотипов Salmonella у домашней птицы: использование врожденного иммунитета и микробной активности. Epidemiol. Заразить. 133, 959–978. DOI: 10.1017 / S0950268805004711
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уигли, П. (2017). Salmonella enterica серовар Gallinarum: ответ на фундаментальные вопросы бактериологии через шестьдесят лет после введения вакцины 9R. Avian Pathol. 30, 1–6. DOI: 10.1080 / 03079457.2016.1240866
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Всемирная организация здравоохранения животных [МЭБ] (2008 г. ).«Брюшной тиф и пуллорум у птиц», в Руководстве по диагностическим тестам и вакцинам для наземных животных , изд. Office International des Épizooties (Париж: Office International des Épizooties), 538–548.
).«Брюшной тиф и пуллорум у птиц», в Руководстве по диагностическим тестам и вакцинам для наземных животных , изд. Office International des Épizooties (Париж: Office International des Épizooties), 538–548.
Xiong, D., Song, L., Geng, S., Tao, J., An, S., Pan, Z., et al. (2016). Одноэтапная ПЦР-детекция Salmonella Pullorum / Gallinarum с использованием новой мишени: гена биосинтеза жгутиков flhB. Фронт. Microbiol. 7: 1863. DOI: 10.3389 / fmicb.2016.01863
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Болезни и лечение домашней птицы
Болезни домашней птицы и их лечение должны быть вашей первоочередной задачей, если вы владеете птицефабрикой.Разведение домашних животных несложно, но болезни могут испортить бизнес. Одно зараженное животное может буквально убить других животных на ферме. Поэтому очень важно выявлять все болезни и своевременно их лечить.
Изображение: pexels. com
com
Источник: UGC
Некоторые фермеры думают, что домашние животные страдают очень немногими болезнями, если они не контактируют с другими животными или людьми. Фактически, многие болезни могут передаваться через пищу и даже через окружающую среду на ферме. Прочтите этот пост, чтобы узнать больше о профилактике заболеваний и гигиене.
Какие болезни птицы наиболее распространены?
Птицу и других домашних животных поражают многие болезни. Ниже вы найдете краткий перечень наиболее распространенных и распространенных болезней птицы, их особенности, симптомы, а также методы лечения и профилактики.
Изображение: flickr.com
Источник: UGC
ЧИТАЙТЕ ТАКЖЕ : Рентабельность птицеводства в Нигерии
Что нужно знать о маске коронавирусаКокцидиоз
Это одна из самых распространенных болезней птицы, потому что микробы, которые потому что он может жить в земле долгое время, безопасно перенося довольно тяжелые условия. Повышенная влажность - идеальная среда для этих микробов. Вы можете предотвратить заражение, поддерживая чистоту и сухость.
Повышенная влажность - идеальная среда для этих микробов. Вы можете предотвратить заражение, поддерживая чистоту и сухость.
Заболевание передается через плохо промытые овощи и другие продукты питания, питьевую воду, а также через крыс, зараженную домашнюю птицу и диких птиц. Куры подвержены этому заболеванию с 80-го дня после рождения.
Основной симптом этого заболевания - сильный понос с кровью и пеной. Птицы часто теряют способность двигаться и сидеть в одной позе с взъерошенными перьями.Состояние опасно тем, что оно практически незаметно на этапе, когда можно эффективно лечить. Вылечить его можно, добавив в корм птиц порошкообразную серу и проведя полную дезинфекцию фермы.
Болезнь Лайма: основные факты и правда об этой болезни в Великобритании. Изображение: pixabay.com
Источник: UGC
Коли
Эта инфекция - еще одна распространенная болезнь, которая может поражать вашу птицефабрику. Эффективно лечить это заболевание можно с помощью антибиотиков определенного типа, назначенных ветеринаром.
Болезнь Ньюкасла
Болезнь - одна из самых опасных для птицеводства. В группе риска куры всех возрастов. Они становятся сонливыми, теряют аппетит, у них поднимается температура и возникают проблемы с дыханием. К сожалению, после того, как болезнь уже проявилась, эффективного лечения не существует. Всю зараженную птицу необходимо уложить, чтобы предотвратить дальнейшее заражение. Единственный способ борьбы с этим заболеванием - специальная вакцина.
Оспа
Оспа обычно поражает молодых птиц. От этого заболевания нет лечения, и всех зараженных птиц следует изолировать от других.Если на вашей ферме вы заболели оспой, немедленно сообщите об этом местному ветеринару. Однако профилактическая вакцинация работает намного лучше.
Птичий грипп
Заболевание, широко известное как птичий грипп, и многие люди опасаются заразиться им от домашних или диких птиц. На самом деле эти опасения вполне обоснованы, потому что они могут повлиять на людей. Вам нужно быть очень внимательным к своему стаду, чтобы заметить первые признаки и как можно быстрее избавиться от больных.
Первые заметные признаки включают проблемы с дыханием, изменение цвета морды больной птицы (или они могут стать синеватыми) и появление красных пятен вокруг глаз. Как только вы заметите это, вам нужно положить конец заразным птицам, уничтожить их тела и как следует продезинфицировать территорию. Вы также должны быть очень осторожны, чтобы не заразиться вирусом. К сожалению, эффективной вакцины для защиты вашей фермы не существует.
Изображение: picjumbo.com
Источник: UGC
Холера
Животные тоже страдают холерой, и это заболевание поражает кур, уток и гусей. Состояние очень опасно и вызывает высокий уровень смертности. Особенно подвержены этому заболеванию молодые цыплята до 2 месяцев. Инфекция передается через зараженную пищу и воду, инструменты и контакты с инфицированными или выздоравливающими птицами.
При заражении домашняя птица становится слабой и у нее повышается температура. Их носы и клювы покрыты пенистой слизью, а их экскременты могут содержать кровь. Лечить таких птиц категорически запрещено. Всех заболевших нужно немедленно уложить, а местность тщательно продезинфицировать. Все внутренние органы больных птиц необходимо уничтожить. При обширном некрозе тела зараженных птиц также необходимо уничтожить. Яйца можно использовать только после дезинфекции.
Лечить таких птиц категорически запрещено. Всех заболевших нужно немедленно уложить, а местность тщательно продезинфицировать. Все внутренние органы больных птиц необходимо уничтожить. При обширном некрозе тела зараженных птиц также необходимо уничтожить. Яйца можно использовать только после дезинфекции.
Болезнь воздушного мешка
Это бактерия, которую могут занести в ваш район даже дикие птицы. Во-первых, вы заметите, что ваши куры практически не могут откладывать яйца и они слабые.Затем возникнут проблемы с дыханием: чихание, кашель и так далее. Со временем их суставы опухнут. Тогда многие из них, возможно, умрут.
Самая плохая новость об этой болезни заключается в том, что она может передаваться от курицы к курице внутри яйца. Лучшая новость обо всем этом заключается в том, что бактерии можно убить с помощью антибиотиков, назначенных ветеринаром. Здоровую птицу можно защитить с помощью вакцины.
Изображение: pixabay.com
Источник: UGC
Пуллороз
Это заболевание - опасная инфекция, поражающая кур и цыплят индейки в возрасте от нескольких дней до двух недель.Птицы становятся слабыми и испытывают жажду, теряют аппетит. Некоторые из них стоят, широко расставив ноги, с закрытыми глазами. Экскременты становятся водянистыми и пенистыми. Как правило, явно больных птиц убивают сразу, и только относительно здоровых лечат антибиотиками, прописанными ветеринаром.
Болезни сельскохозяйственных животных: виды, причины, профилактикаКаннибализм
Несмотря на то, что это не инфекция, это заболевание также часто рассматривается как разновидность болезни, поскольку оно может отрицательно сказаться на вашем хозяйстве.Это вызвано слишком большим количеством птиц в одном месте, сырым и душным птичьим двором, слишком большим количеством света, проблемами с обменом веществ. Птицы разного возраста и размера, содержащиеся на одной и той же небольшой территории, могут подвергаться атакам каннибализма. Птицу, однажды попробовавшую кровь, следует держать подальше от всех, чтобы не допустить дальнейших провокаций. Каннибализм быстро исчезает после кормления птиц.
Птицу, однажды попробовавшую кровь, следует держать подальше от всех, чтобы не допустить дальнейших провокаций. Каннибализм быстро исчезает после кормления птиц.
Жесткий зоб
Это состояние вызвано грубой, сухой и затхлой пищей. Ворона застревает в еде и очень сильно.Птица теряет аппетит и сидит с взъерошенными перьями. Состояние лечится путем введения в зоб от 30 до 50 мл растительного масла через зонд. Затем поверните птицу головой вниз и осторожно помассируйте зоб, пока он не станет пустым. На следующий день осторожно промойте зоба водой и только на второй день птице можно будет съесть жидкую молочную пищу.
9 болезней, связанных с водой, которые могут поразить любого. Изображение: pixabay.com
Источник: UGC
Рахит
Рахит - неинфекционное заболевание, которое возникает, если в рационе птицы недостаточно витамина D.Чтобы предотвратить различные формы дефицита витаминов, добавляйте в обычную пищу дрожжи, свежую зелень, пшеничные отруби и проростки.
Отравление
Пищевые или другие отравления также относятся к болезням домашней птицы. Иногда птицы заражаются из-за неосторожной дезинфекции помещения, плохо очищенной пищи, зараженной грибком, тухлыми овощами и т. Д.
Ботулизм
Это сложное заболевание, которое может закончиться параличом всего тела, включая органы дыхания.Ваша птица просто не сможет дышать, и это приведет к летальному исходу. Заболевание вызывается токсином, который вырабатывается бактериями. Заболевание можно остановить, а действие токсина нейтрализовать, если дать птицам порцию антитоксина, полученную у ветеринара.
Кроме того, вы можете предотвратить такое заболевание, контролируя качество корма, который вы даете своим птицам, и очень хорошо убирая их места. Как правило, куры заражаются от мертвых тел, лежащих в пределах досягаемости, или от зараженной воды (опять же, если в воде есть что-то мертвое).
Вакцинация несушек: график, принципы и важность Изображение: pixabay. com
com
Источник: UGC
Бронхит
Птица тоже может болеть бронхитом. Это легко заметить, когда цыплята начинают издавать звуки, такие как чихание или храп. Со временем их глаза и носы начинают обильно слезиться. Из-за этого состояния птицы сильно страдают, и их способность откладывать яйца также сильно страдает.
Болезнь распространяется по воздуху, и единственный способ предотвратить это - вакцинация.Если некоторые из ваших кур уже инфицированы, найдите для них теплое и сухое место, где они смогут поправиться. Некоторые свежие травы, используемые в пищу, могут помочь им восстановить здоровье.
Инфекционный ринит
Это опасное заболевание, вызываемое бактериями, и, к сожалению, нет вакцины, чтобы эффективно его остановить. Основные симптомы легко заметны. Головы цыплят опухают до тех пор, пока их глаза почти не закрываются. Взрослые куры перестают откладывать яйца, и из их глаз и носа текут выделения.Влага также появляется под их крыльями.
Как предотвратить инфекционное заболевание в Нигерии? Единственный способ защитить свое стадо - это предотвратить любые контакты вашей домашней птицы с другими животными. Поддержание чистоты воды и территории снизит риск заражения.
Поддержание чистоты воды и территории снизит риск заражения.
Болезнь Марека
Другая болезнь, которая может поразить вашу ферму, называется болезнью Марека. Вы заметите это сразу, потому что у инфицированной птицы по всему телу разовьются опухоли. Эффективного лечения не существует, и в большинстве случаев это пожизненное заболевание, при условии, что инфицированный цыпленок выживает.Вам нужно будет избавиться от всех зараженных, потому что вирус невероятно улавливает, и все стадо может быть поражено в кратчайшие сроки, просто вдыхая частички кожи больных птиц.
Самым эффективным средством профилактики является вакцинация, которая проводится всем цыплятам в возрасте одного дня.
Изображение: pixabay.com
Источник: UGC
Профилактические меры помогут вам сэкономить деньги, птицу и ферму. Просто держите птицу разного возраста отдельно, сражайтесь с паразитами, такими как клещи, жуки и крысы, и регулярно чистите и дезинфицируйте ферму.Вакцинация - эффективное средство предотвращения болезней домашней птицы и защиты от вирусов, которые также могут поражать людей.









 Фермера должно насторожить резкое снижение яйценоскости.
Фермера должно насторожить резкое снижение яйценоскости. Продолжительность курса лечения составляет 6–7 дней.
Продолжительность курса лечения составляет 6–7 дней.